Fenton法处理苯胺废水最佳条件的研究
2017-12-22罗丹程文婷郑婷
罗丹,程文婷,郑婷
(上饶师范学院 化学与环境科学学院,江西 上饶 334001)
Fenton法处理苯胺废水最佳条件的研究
罗丹,程文婷,郑婷
(上饶师范学院 化学与环境科学学院,江西 上饶 334001)
采用Fenton法处理苯胺模拟废水,通过正交试验和单因素实验考察了(H2O2)/(Fe2+)摩尔比值、苯胺初始浓度、FeSO4·7H2O加入量和初始pH对苯胺模拟废水处理效果的影响。在最佳实验条件下,分析Fenton氧化后苯胺浓度、COD等水质参数的变化。研究结果表明,在(H2O2)/(Fe2+)摩尔比值为10、苯胺初始浓度为100 mg/L、FeSO4·7 H2O加入量为5 mmol/L、初始pH为3、反应时间为120 min条件下,废水中苯胺和COD的去除率分别为99.9%、89.7%。Fenton氧化后,苯胺完全被去除,氧化后产生的小分子有机物可生化性得到较大提高,有利于后续的生化处理。
苯胺废水;Fenton; 羟基自由基
苯胺是一种重要的有机化工原料和精细化工中间体,不易生物降解且毒性大,广泛用于染料、农药、医药、军工、香料和橡胶硫化等行业[1]。苯胺类有机物具有致畸、致癌、致突变作用,其废水往往呈现浓度高、色度大、难降解、生物毒性大等特点,如未经有效处理将给人体健康和生态系统带来严重潜在危害。
苯胺是最重要的胺类物质之一,因其为有机物,对其主要采用生物法处理,然而苯胺是一类难降解有机物,故去除效果不佳[2]。Fenton法是以H2O2在Fe2+催化下生成具有强氧化能力的·OH(氧化还原电位E0=2.73 V),可使废水中的有机物结构发生碳链裂解,将难生物降解的大分子有机物氧化分解为可生物降解的小分子有机物,或者完全矿化为CO2和H2O[3]。Fenton法对于难生物降解的苯胺废水处理显示出独特的优势。为了研究Fenton法对苯胺的处理效果和降解规律,以苯胺模拟废水为研究对象,苯胺去除率和COD(化学需氧量,表示水中有机物含量指标)为考察指标,探究(H2O2)/(Fe2+)摩尔比值、苯胺初始浓度、FeSO4·7H2O加入量、初始pH对Fenton法降解苯胺的影响,确定最佳条件,为苯胺废水处理的工程应用提供参考。
1 材料与方法
1.1 仪器和药品
仪器:PHS-3E型pH计(上海精科雷磁仪器厂),HY-7012型COD恒温加热器(青岛恒远科技发展有限公司),梅颖浦94-2定时恒温磁力搅拌器(上海梅颖浦仪器仪表制造有限公司)。
药品:苯胺(市售分析纯,上海阿拉丁试剂有限公司,≥99.5%质量分数)。
1.2 Fenton实验
室温条件下取100 mL苯胺模拟废水置于250 mL烧杯中,在恒温磁力搅拌器连续搅拌下,用配制好的H2SO4(6 mol/L)溶液调节pH,加入一定量FeSO4·7 H2O固体,搅拌溶解2 min,待固体溶解后再加入一定量的H2O2(质量分数30%)溶液,搅拌反应120 min,反应结束后立即用NaOH(8 mol/L)溶液调节pH为8,静置沉淀3 h,取上清液测试分析。
1.3 分析方法
COD的测定采用重铬酸钾法,苯胺测定采用N-(1-萘基)乙二胺偶氮光度法。
2 结果与讨论
2.1 正交试验
Fenton氧化法处理苯胺废水反应过程中,影响处理效果的主要因素有:(H2O2)/(Fe2+) 摩尔比值、苯胺初始浓度、FeSO4·7H2O加入量、初始pH。由于不同工业生产厂家不同处理工艺产生的苯胺废水水质不尽相同,因此Fenton氧化处理的最佳操作条件也不相同。在初步分析模拟水样的基础上,设计了四因素三水平的正交试验,采用L9(34)正交试验表,以苯胺去除率为指标,对上述四个因素进行讨论,初步确定最佳操作条件。正交试验因素水平表如表1所示,试验结果如表2所示。采用极差分析法对正交结果进行分析,分析结果见表3。

表1 因素水平表
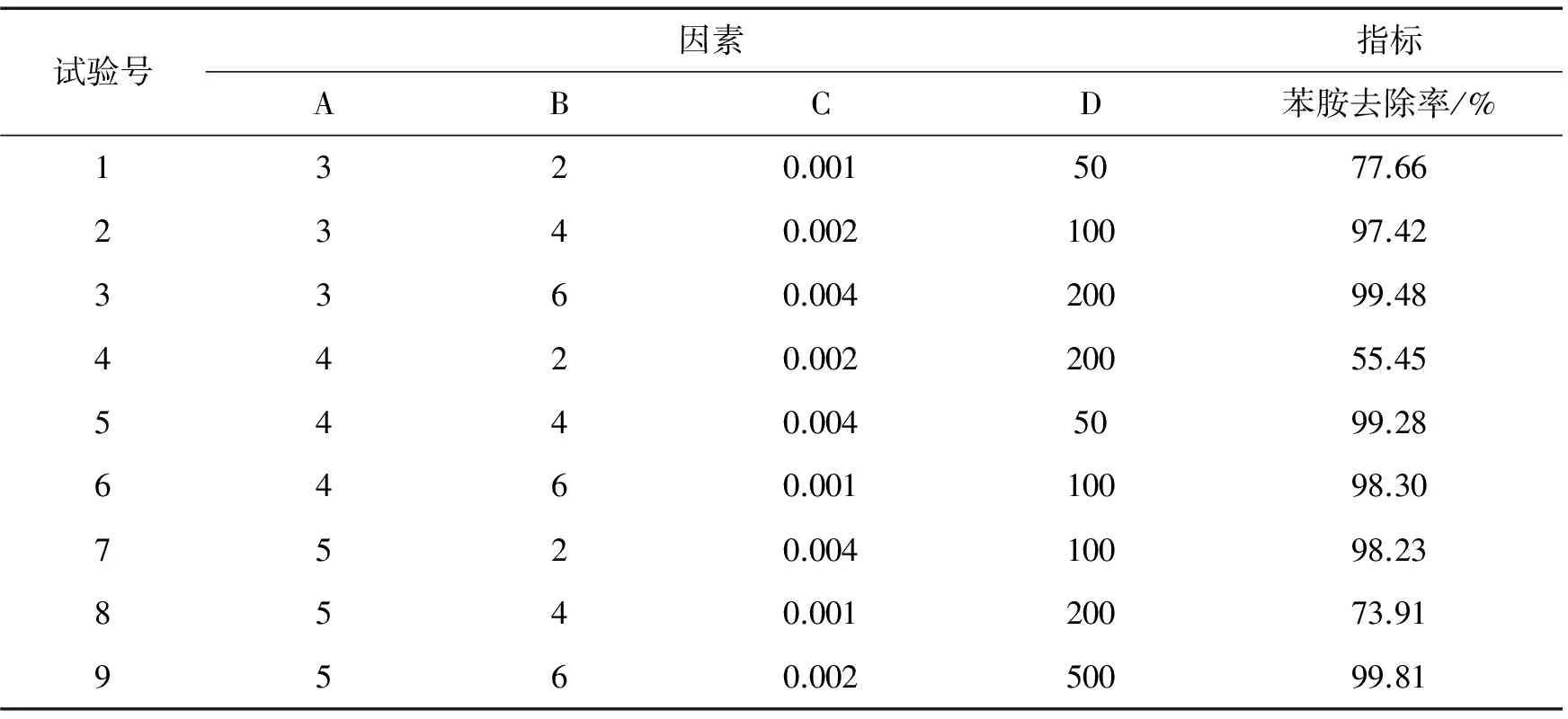
表2 正交试验结果
按照极差大小可排列出因素主次顺序,将各因素最好的水平进行组合,进而提出较优组合条件。从正交试验结果可知,Fenton法对苯胺去除率的影响因素主次顺序为:(H2O2)/(Fe2+)摩尔比值、苯胺初始浓度、FeSO4·7H2O加入量、初始pH。这与其他Fenton反应[4-7]影响因素次序稍有不同,尤其(H2O2)/(Fe2+)摩尔比值的影响,这可能与水质有关。
2.2 单因素实验
2.2.1 (H2O2)/(Fe2+)摩尔比值的影响
固定苯胺初始浓度为100 mg/L,FeSO4·7H2O加入量为1 mmol/L,调节模拟废水pH为4 ,变化(H2O2)/(Fe2+)摩尔比值为4、6、8、10、15和20,搅拌反应120 min,调节pH为8终止反应,静置沉淀3 h取上清液测定苯胺浓度及COD,实验结果如图1所示。

表3 极差分析结果
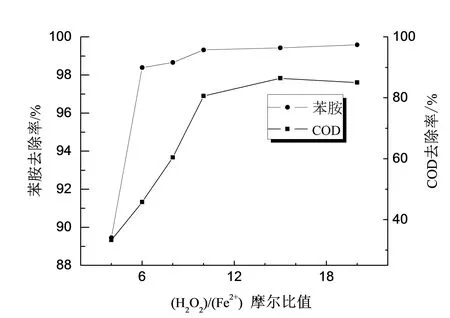
图1 (H2O2)/(Fe2+) 摩尔比值对苯胺及COD去除率的影响
从图1中可以看出,苯胺去除率随(H2O2)/(Fe2+)摩尔比值呈先明显升高而后小幅增大直至趋于平缓态势。当(H2O2)/(Fe2+)摩尔比值处于4~10区间时,随着(H2O2)/(Fe2+)摩尔比值的增大,苯胺去除率随之明显升高,由89.45%升高至99.32%,上清液苯胺浓度不足1mg/L;继续增加H2O2的加入量,苯胺去除率仅有小幅的增加。COD的去除率也呈现相似规律,由33.33%上升为86.45%,当(H2O2)/(Fe2+)摩尔比值增大至20时,COD去除率不再升高。COD去除率总体小于苯胺去除率源于Fenon体系产生的·OH能将苯胺氧化成苯二酚、氨基苯酚、丁烯二酸等小分子有机物[8],这部分小分子有机物仍可表现一定的COD值。(H2O2)/(Fe2+)摩尔比值过小时,即体系中H2O2量不足,Fe2+过量,因而产生的·OH量很少,而且一部分还会被过量的Fe2+消耗,致使有效的·OH量过低,氧化效果不明显。随着(H2O2)/(Fe2+)摩尔比值增大,H2O2的量不断增多,能提供的·OH量自然也多,Fe2+也由过量变为适量,被Fe2+消耗的·OH量也大为减少,更多的·OH与有机物分子充分反应将其氧化成小分子化合物甚至矿化成CO2和H2O,所以苯胺浓度和COD去除率均有一个明显的上升过程。伴随(H2O2)/(Fe2+)摩尔比值的进一步提高,苯胺浓度和COD去除率仅有小幅上升最后趋于稳定,这是因为此时H2O2已过量,虽然过量的H2O2能够提供更多的·OH,但Fe2+已经不足,不能够催化产生更多的·OH,而且过多的H2O2也会消耗一部分·OH,使·OH的量不增反减,而此时COD去除率相较于苯胺提高的幅度稍明显,这是因为过量的H2O2能氧化小分子有机物而对苯胺无效。此外,过量的H2O2本身也会不稳定分解成O2和H2O造成资源的浪费。因此,鉴于苯胺的去除考虑,确定10为最佳(H2O2)/(Fe2+)摩尔比值。
2.2.2 苯胺初始浓度影响
固定(H2O2)/(Fe2+)摩尔比值为10,FeSO4·7H2O加入量为1 mmol/L,调节初始pH为4,变化苯胺初始浓度为50、100、200、500、800和1000 mg/L,搅拌反应120 min,调节pH为8终止反应,静置沉淀3 h取上清液测定苯胺浓度及COD,实验结果如图2所示。随着苯胺浓度的升高,去除率先增加后急剧下降,最后趋于平缓。低浓度条件下Fenton体系产生的·OH相对而言处于过量状态,过量的·OH会与Fe2+反应被消耗,去除率不高。当苯胺浓度增大至100 mg/L时,Fenton体系产生的·OH处于适量状态,能与苯胺发生充分的反应,提高去除率;继续增大苯胺浓度,系统对苯胺的去除效果就越差,这是因为当体系内苯胺初始浓度较高时,体系内产生·OH已处于不足状态,没有足够的·OH与苯胺发生氧化反应,所以去除率呈下降趋势。而当苯胺浓度增大至1000 mg/L时,去除率趋于稳定,可能是因为苯胺浓度的增大使反应产生的Fe3+混凝效果提高从而弥补了去除率的下降。综上分析,苯胺最佳初始浓度是100 mg/L,在实际应用中,应注意Fenton法处理有机物最佳浓度的选择。

图2 苯胺初始浓度对苯胺及COD去除率的影响
2.2.3 FeSO4·7 H2O加入量的影响
固定(H2O2)/(Fe2+)摩尔比值为10,苯胺初始浓度为100 mg/L,调节初始pH为4,变化FeSO4·7H2O加入量为0.5、1、1.5、2、5和8 mmol/L,搅拌反应120 min,调节pH为8终止反应,静置沉淀取3h上清液测定苯胺浓度及COD,实验结果如图3所示。
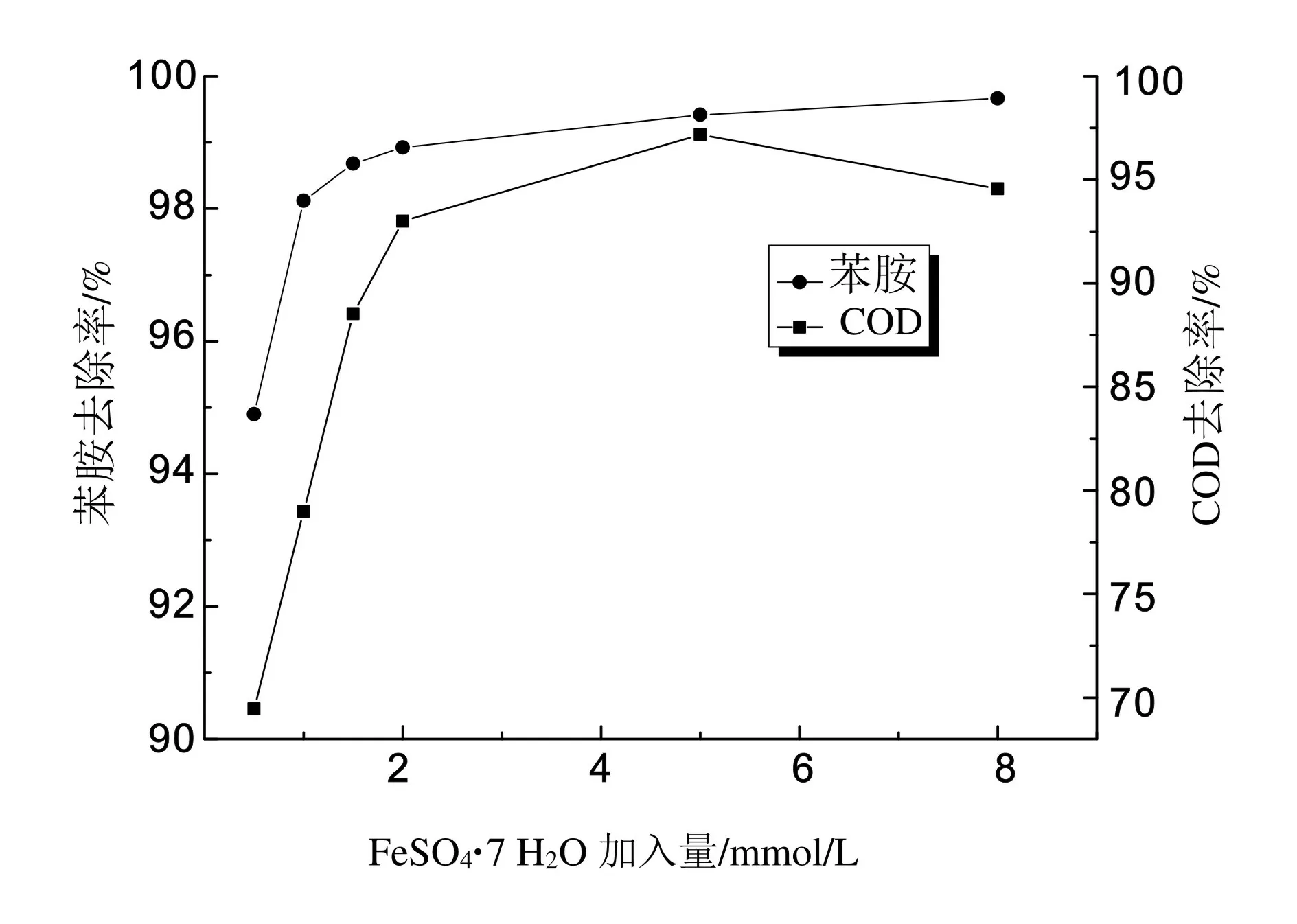
图3 FeSO4·7 H2O加入量对COD去除率的影响
Fenton反应体系由H2O2与Fe2+组成,在氧化过程中Fe2+是催化产生·OH的必要条件,而在混凝沉淀反应中,Fe2+为混凝沉淀作用提供了铁盐,因而FeSO4·7H2O的加入量是Fenton反应中一个非常重要的影响因素。从图3中可知,FeSO4·7H2O加入量对苯胺及COD去除率有较大的影响,总体呈先上升后下降的趋势。当FeSO4·7H2O加入量在5 mmol/L以前,随着加入量的增多,苯胺和COD去除率呈上升趋势,且上升速度先快后慢,并在加入量5 mmol/L时,苯胺去除率由94%升高至99.5%,COD去除率由69.46%增大到97.2%。Fe2+作为Fenton反应的催化剂,其加入量的多寡直接影响着·OH的产生量和产生速率[9],当Fe2+浓度过低时,·OH的产生量和产生速率都很小,体系中没有足够的·OH与有机物反应,加之·OH产生速率慢,反应不够剧烈,有机物降解过程受到抑制;随着Fe2+浓度的增大,·OH的产生量和产生速率均得到加强,Fe2+与H2O2充分反应产生大量的·OH,将水中有机物氧化降解,同时铁盐的增加也强化了混凝沉淀作用。继续加大FeSO4·7H2O加入量,苯胺去除率升高缓慢而COD去除率甚至下降,这是因为FeSO4·7H2O已过量,多余的Fe2+和H2O2反应产生的Fe3+较Fe2+催化效果减弱,同时过多的Fe2+还会和·OH反应消耗·OH的量,所以导致了COD去除率不升反降的结果。况且Fe2+加入量的增加会产生大量的化学污泥,给后续处理增加了难度,直接导致了处理成本的增加。此外,Fe3+还会对出水色度、总溶解性固体(TDS)和电导率带来不好的影响[10-11]。因此,最佳FeSO4·7H2O加入量为5 mmol/L。
2.2.4 初始pH的影响
固定(H2O2)/(Fe2+)摩尔比值为10,苯胺初始浓度为100 mg/L,FeSO4·7 H2O加入量为5 mmol/L,调节初始pH为2、3、4、5、6、6.78(原模拟废水),搅拌反应120 min,调节pH为8终止反应,静置沉淀3 h取上清液测定苯胺浓度及COD,如图4所示。由图4可知,初始pH对苯胺和COD的去除率影响较明显,总体而言随pH的增大去除率呈缓慢下降趋势。当初始pH处于2~4区域内,随着pH的升高,苯胺及COD去除率均现缓慢下降情况,但去除率仍维持较高水平,当pH为3时,苯胺及COD去除率分别达到99.9%和89.7%。Sedlak等[12]认为pH为2~4范围时会产生更多的·OH,产生的速率也会加快,提高有机物的去除率。大多数的研究[13-15]表明,Fenton反应的最佳pH为3左右,本实验在初始pH为3时,去除率最高为99.9%,与其研究结果一致。pH大于4之后,随着pH的增大,COD去除率下降明显,由89.7%下降至84%。其原因主要为pH的增大使体系中H+浓度减小,H+的不足会抑制H2O2分解产生·OH过程,同时H2O2的氧化电势降低,使处理效果降低[16]。与此同时,过高的初始pH值会促进H2O2的自身分解,减少·OH的生成量[17],溶液中的Fe2+容易以氢氧化物的形式沉淀而失去催化能力[18]。因此,最佳初始pH为3。
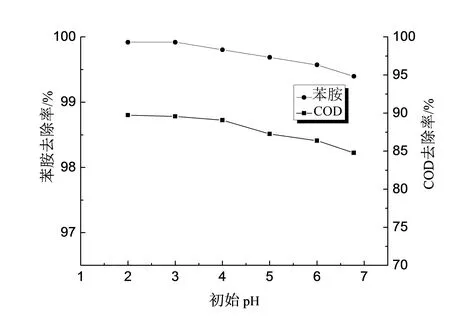
图4 初始pH对苯胺及COD去除率的影响
3 结论
Fenton法对苯胺去除率的影响因素主次顺序为:(H2O2)/(Fe2+)摩尔比值、苯胺初始浓度、FeSO4·7H2O加入量、初始pH;其最佳条件为:(H2O2)/(Fe2+)摩尔比值为10,苯胺初始浓度为100 mg/L ,FeSO4·7H2O加入量为5 mmol/L,初始pH为3,此时,苯胺及COD去除率分别为99.9%和89.7%。
[1] 山丹,马放,王金生,等.低温下生物强化SBR工艺处理苯胺废水的研究[J].中国环境科学,2009,29(8):844-845.
[2] 王哲,魏利,马放,等.苯胺废水SBR工艺生物强化处理效能[J].哈尔滨工业大学学报,2010,6(6):949-953.
[3] 郭劲松,陈鹏,方芳,等.Fenton试剂对垃圾渗滤液中有机物的去除特性研究[J].中国给水排水,2008,24(3):88-91.
[4] 陈芳艳,茅新华.Fenton试剂氧化处理印染废水[J].抚顺石油学院学报,2002,22(3):19-21.
[5] 李勇,吕松,朱素芳.Fenton试剂处理活性艳红印染废水的实验研究[J].环境科学与技术,2008,31(3):88-90.
[6] 刘诗燕,张艳,陈欣义,等.Fenton法处理印染废水的试验研究[J].广东化工,2009,36(8):166-167.
[7] 鲁璐,刘汉湖.Fenton试剂预处理实际印染废水的实验研究[J].环境科学与管理,2008,33(3):89-92.
[8] 余美维.Fenton氧化降解苯胺的条件优化及机理研究[D].北京:中国矿业大学,2015.
[9] KAVITHA V,PALANIVELU K.The role of ferrous ion in Fenton and photo-Fenton processes for the degradation of phenol[J].Chemosphere,2004,55(9):1235-1243.
[10] 陈传好,谢波.Fenton试剂处理废水中各影响因子的作用机制[J].环境科学,2000,21(3):93-96.
[11] DENG Y,ENGLEHARDT J D.Treatment of landfill leachate by the Fenton process[J].Water Research,2006,40(20):3683-3694.
[12] SEDLAK D L,ANDREN A W.Oxidation of chlorobenzene with Fenton reagent[J].Environmental Science and Technology,1991,25(4):777-782.
[13] SU C C,PUKDEE A M,RATANATAM S C,et al.Effect of operating parameters on the decolorization and oxidation of textile wastewater by the fluidized-bed Fenton process[J].Separation and Purifilation Technology,2011,83(15):100-105.
[14] SOUZA D R,DUARTE ETFM,SOUZA G G,et al.Study of kinetic parameters related to the degradation of an industrial effluent using Fenton-like reactions[J].Journal of Photochemistry and Photobiology A:Chemistry,2006,179(3):269-275.
[15] ARSLAN A I,GURSOY B H,SCHMIDT J E.Advanced oxidation of acid and reactive dyes:Effect of Fenton treatment on aerobic,anoxic and anaerobic processes[J].Dyes and Pigments,2008,78(2):117-130.
[16] 张萍,顾国维,扬海真.Fenton试剂处理垃圾渗滤液技术进展的研究[J].环境卫生工程,2004,12(1):28-31.
[17] LEIHG A G.Stabilization of hydrogen peroxide:U S Patent 4,304,762[P].198112-08.
[18] KARTHIKEYAN S,TITUS A,GNANAMANI A,et al.Treatment of textile wastewater by homogeneous and heterogeneous Fenton oxidation processes[J].Desalination,2011,281:438-445.
Optimum Conditions on Aniline Wastewater Treated by Fenton Process
LUO Dan,CHEN Wenting,ZHENG Ting
(School of Chemistry and Environmental Science,Shangrao Normal University,Shangrao Jiangxi 334001,China)
The pilot-scale experiments were conducted to investigate treatment performance of aniline simulation wastewater by Fenton process. The affecting factors of H2O2/ Fe2+ratio (molar basis) ,aniline concentration,dosage of FeSO4·7 H2O and initial pH value on removal efficiency were investigated by orthogonal and single factor experiments. Meanwhile,the changes of aniline,COD and other parameters in the concentrate during Fenton process were discussed under the optimal conditions. The results showed that the optimal operating conditions were as follows:n(H2O2)/n(Fe2+) ratio of 10,aniline concentration of 100 mg/L,dosage of FeSO4·7 H2O of 5 mmol/L,initial pH of 3 and reaction time of 120 minutes. Under these conditions,the removal efficiencies of aniline concentration and COD reached 99.9%,89.7% respectively. After Fenton process,the aniline was completely removed,much low molecule organic compounds was produced indicating its biodegradability significantly improved which were conducive to the subsequent biological treatment.
aniline wastewater;Fenton;hydroxyl radical
2017-10-16
上饶师范学院校级课题(201618)
罗丹(1989-),男,江西抚州人,助教,硕士,主要从事工业废水治理与资源化研究。E-mail:15907034228@163.com
X705
A
1004-2237(2017)06-0059-06
10.3969/j.issn.1004-2237.2017.06.014
