卵形鲳鲹仔稚鱼异速生长的研究
2017-12-18杨其彬马振华程大川江世贵李有宁陈明强
杨其彬,马振华,程大川,3,江世贵,李有宁,陈明强
( 1.中国水产科学研究院 南海水产研究所,广东 广州 510300;2.农业部南海渔业资源开发利用重点实验室,广东 广州 510300; 3.南京农业大学 无锡渔业学院,江苏 无锡 214081 )
卵形鲳鲹仔稚鱼异速生长的研究
杨其彬1,2,马振华1,2,程大川1,2,3,江世贵1,李有宁1,陈明强1
( 1.中国水产科学研究院 南海水产研究所,广东 广州 510300;2.农业部南海渔业资源开发利用重点实验室,广东 广州 510300; 3.南京农业大学 无锡渔业学院,江苏 无锡 214081 )
以传统的理论生物学研究方法,对孵化后卵形鲳鲹1~36日龄仔、稚鱼各器官测量和分析,研究其在早期环境适应上的异速生长及其生态学含义,以期为卵形鲳鲹的人工繁殖、育苗提供参考。试验结果表明,卵形鲳鲹仔、稚鱼的感觉、呼吸、摄食和游泳等器官快速分化,均存在异速生长现象。在头部器官中,吻长、口宽、眼径和头高在仔鱼期均为正异速生长,稚鱼期头高为等速生长,吻长、眼径和口宽为负异速生长。在身体各部位中,仔鱼期头长、体高和尾长为正异速生长,躯干长为负异速生长;稚鱼期各部分皆为等速生长;在游泳器官中,仔鱼期卵形鲳鲹胸鳍长、尾鳍高和臀鳍长为正异速生长,尾鳍长为等速生长,背鳍长为负异速生长;稚鱼期背鳍长和臀鳍长为正异速生长,胸鳍长、尾鳍长和尾鳍高为等速生长。卵形鲳鲹这些关键部位的快速发育,使外源性营养开始后以最小的代谢损耗获得了生存能力的显著提升,对适应复杂的生存压力具有重要的生态学意义。
卵形鲳鲹;早期发育;仔、稚鱼;异速生长
卵形鲳鲹(Trachinotusovatus)属鲈形目、鲈亚目、鲹科、鲳鲹属,俗称金鲳,我国主要分布于黄海渤海、东海、南海。卵形鲳鲹的肉白色细嫩、脂肪含量多、鲜美甜口。体呈卵形,人工养殖生长速度快,养殖半年多可达500 g,主要养殖区域为广州、福建和海南[1]。目前关于卵形鲳鲹的发育、繁殖及免疫等已有较多报道[2-11]。异速生长机制广泛存在于生物的生长模式中[12-13],它可以描述生物体某一部分的相对生长速率与另一部分的相对生长速率或不同属性之间的关联。研究发现鱼类的各个早期功能器官的生长发育普遍存在异速生长现象[14-17]。即某些对生存能力有显著提升的初生器官相对于整体而言表现为快速生长,当该器官协调身体各部分需要后,逐渐转变为等速生长或慢速生长[18-19],从而在特定环境中以最小的能量供应获得最优的生存能力[20]。因此,通过对卵形鲳鲹仔、稚鱼异速生长的研究,可以了解优先发育的器官所行使的功能对鱼类早期生长的重要性,探索不同生长阶段其特殊生活习性的改变和需求,对育苗工作具有重要的实践意义。
笔者对卵形鲳鲹仔、稚鱼异速生长发育进行了较为系统的研究,并探讨了该形态发育规律对卵形鲳鲹现实生存的意义,旨在完善卵形鲳鲹早期器官发育的基础数据,以期为卵形鲳鲹养殖产业的发展提供基础研究和实践指导。
1 材料与方法
1.1 试验材料
试验在中国水产科学研究院南海水产研究所深圳试验基地进行。卵形鲳鲹受精卵来自广东省深圳市龙岐庄,受精卵运达后,先在27.5 ℃水温中平衡20 min,然后投放至25 m2苗种培育池,平均水深1.5 m。育苗池从底部提供过滤水(5 μm 孔径纱网过滤),排水孔用导管通至水面附近,用300 μm孔径纱网拦截幼苗逃逸。调节进水阀门保证每日换水量75 m3。每日提供2000 lx的光照14 h以及黑暗环境10 h。盐度为33±0.8,水温为(27.0±1.0) ℃。提供10个气石,调节气泡成簇摇曳上升即可。
从卵形鲳鲹3日龄开始投喂圆型臂尾轮虫(Brachionusrotundiformis),水体中轮虫密度保持在10~20个/mL,直至13日龄停止投喂。9日龄投喂卤虫(Artemiasalina)无节幼体,至24日龄停止投喂,投喂密度为0.1个/mL,然后逐日递增至5 个/mL。轮虫和卤虫无节幼体需进行12 h营养强化,使用的强化剂为赛尔科—斯派索(泰国英伟公司)。育苗池水体中加入海水拟微球藻(Nannochloropsis)(青岛宏邦生物技术有限公司)以提供绿色环境和保证轮虫、卤虫存活。自第18日龄开始驯化卵形鲳鲹进食颗粒饲料,每日8:30—19:00每隔1 h投喂浮性颗粒饲料(250 μm,日清)。
育苗过程中,每日采取虹吸的方法除去育苗桶中剩余饵料、排泄物以及死去的仔、稚鱼。定时清理排水口过滤网,防止异物堵塞。
1.2 研究方法
使用 Olympus SZ40 型体视显微镜观察和Oneplus A2001相机拍照记录。从仔鱼孵化后第1日龄开始,每日8:00随机抽取10个样本,用适宜含量的麻醉剂麻醉后,在体视显微镜下观察其外部各个器官的形态变化并拍照。拍照时选择性剔除对影响测量准确性的畸形苗。用Auto CAD 2014测量如图1所示的头、躯干、尾部的各个指标,以平行或垂直于鱼体水平轴为基准,精确至每个像素,标尺精确至0.01 mm,用10%的中性福尔马林溶液固定全部样本,避光保存以备查用。

图1 卵形鲳鲹仔、稚鱼测量直观图1. 吻长;2. 眼径;3. 头高;4. 头长;5. 上颌长;6. 躯干长;7. 体高;8.背鳍长;9.胸鳍长;10.臀鳍长;11. 尾鳍长;12.尾鳍高;13. 全长.
1.3 数据处理
全长与日龄的函数关系使用数学模型:y=aebx来表达[17](x为日龄,y为相应日龄的全长,a为在y轴上的截距,b为生长速率)。鱼类异速生长模型以幂函数y=axb来构建[x为仔、稚鱼全长,y为与x相对应的各种器官的长度,a为在y轴上的截距,b为异速生长指数。当b=1时,表现出等速生长;当b>1时,表现出快速增长(正异速生长);当b<1时,表现出慢速增长(负异速生长)[16-17]]。功能胃的形成标志着仔鱼进入稚鱼期[21],卵形鲳鲹仔鱼在15日的胃腺开始发育,故以15日龄为卵形鲳鲹生长曲线节点,不同生长阶段可用不同生长方程表达:y=a1xb1,y=a2xb2。对b1、b2是否等于1做t检验,同时对b1、b2进行t检验,检测两个b值是否存在差异。应用SPSS 18.0统计软件对模型进行非线性回归参数拟合,并应用Excel 2016进行分段回归模型拟合,以决定系数r2最大和残差平方和最小为曲线拟合标准,用SPSS 18.0统计软件进行显著性检测。
2 结 果
2.1 卵形鲳鲹仔、稚鱼全长与日龄的关系
卵形鲳鲹仔、稚鱼全长与日龄的关系指数方程y=3.33e0.068x,r2=0.982,拟合可靠性较高(图2)。卵形鲳鲹初孵仔鱼全长为(3.33±0.24) mm,经过35 d生长,全长达到(37.60±2.610) mm,平均增长率为0.979 mm/d。
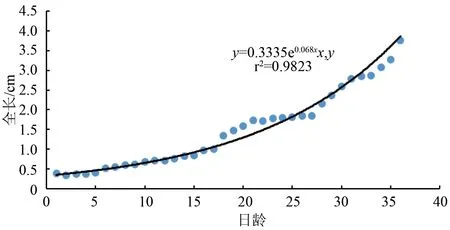
图2 卵形鲳鲹仔、稚鱼日龄与全长的关系
2.2 卵形鲳鲹仔、稚鱼发育过程中各器官的异速生长
2.2.1 卵形鲳鲹头部各器官异速生长
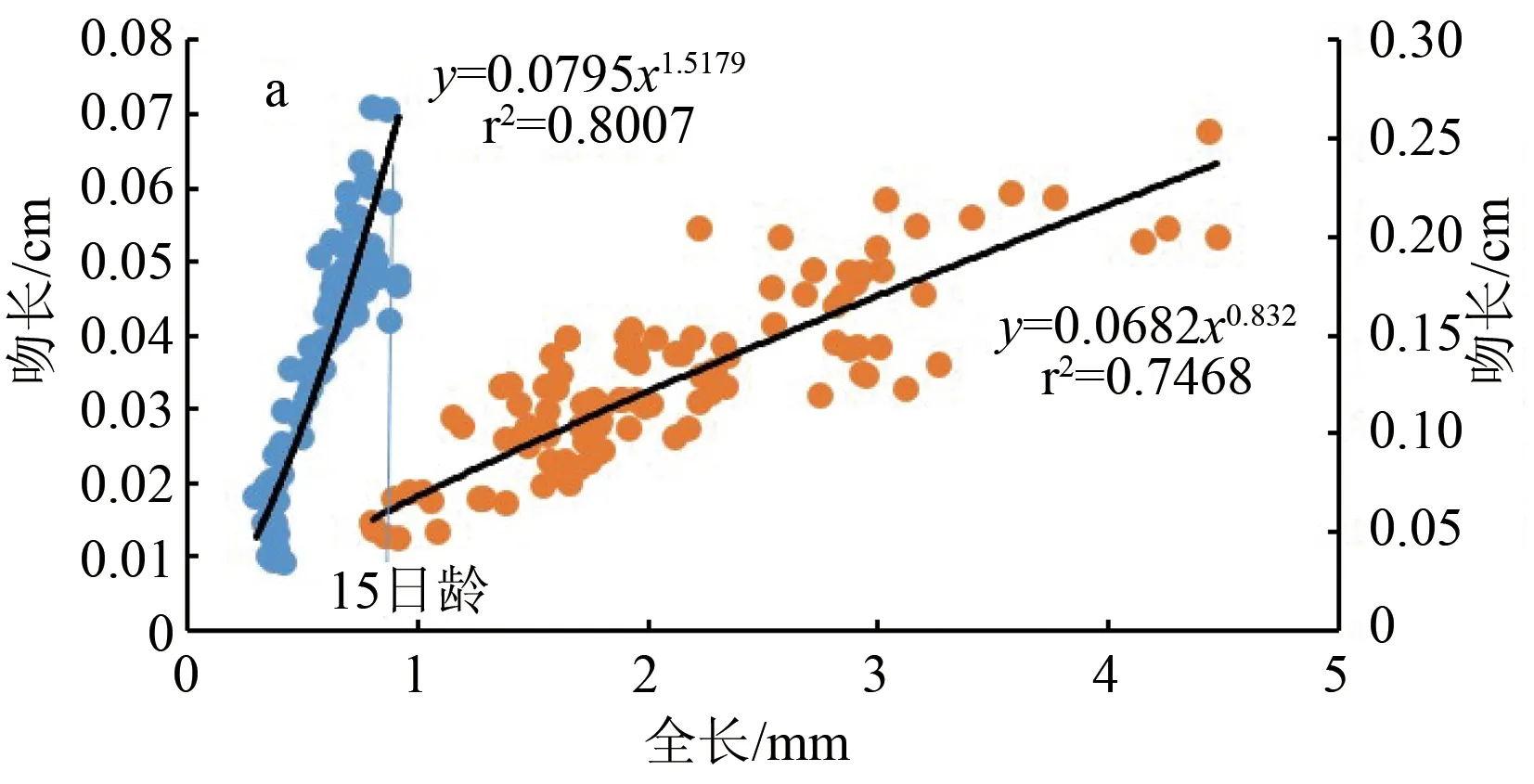
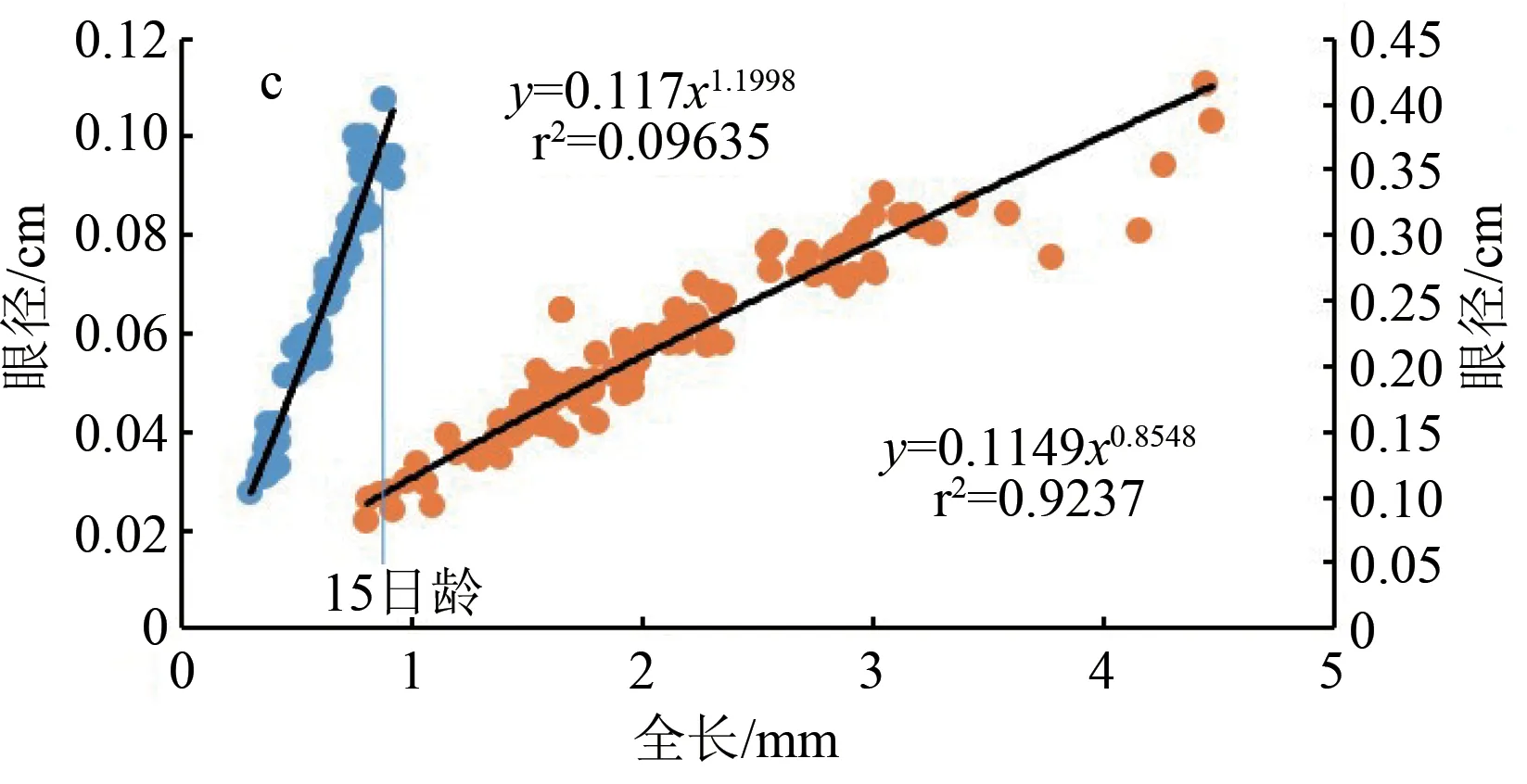
卵形鲳鲹仔、稚鱼期的吻长(图3a)、口宽(图3b)、眼径(图3c)和头高(图3d)与全长之间表现出了异速生长。15日龄前,它们的异速生长指数b1分别为1.518、1.207、1.200、1.406,4个异速生长指数与1均具有显著性差异(P<0.05),表现为正异速生长。15日龄后 b2分别为0.832、0.805、0.855、1.001,其中头高与1不具有显著性差异(P>0.05),表现为等速生长,其余3个生长指数均与1差异显著(P<0.05),表现为负异速生长。故在15日龄前,卵形鲳鲹仔鱼的头部器官均为快速生长,15日龄后吻长、口宽和眼径为慢速生长,头高为等速生长。15日龄时,卵形鲳鲹仔鱼全长为(8.51±0.07) mm,实际分析可得出吻长、口宽、眼径和头高在此时均存在生长拐点(P<0.05)。
2.2.2 卵形鲳鲹仔、稚鱼身体部分的异速生长
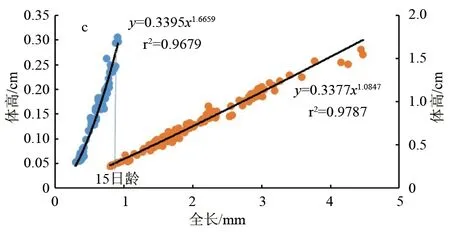
头长(图4a)、躯干长(图4b)、体高(图4c)和尾长(图4d)在仔鱼期和稚鱼期表现出了异速生长。其中头长、体高和尾长的异速生长指数b1分别为1.566、1.666和1.264,与1差异显著(P<0.05),表现为正异速生长。躯干长异速生长指数b1为0.327,与1差异显著(P<0.05),表现为负异速生长。稚鱼期头长、躯干长、体高和尾长的 b2分别为0.924、1.036、1.085和1.035,与1之间均无显著性差异(P>0.05),表现为等速生长。故说明卵形鲳鲹头长、体高和尾长在仔鱼期为快速生长,在稚鱼期为等速生长;躯干长在仔鱼期为慢速生长,稚鱼期为等速生长。分析 b1和 b2显著性差异与否,可得出头长、体高、躯干和尾长在此时均存在生长拐点(P<0.05)。

2.2.3 卵形鲳鲹仔、稚鱼游泳器官的异速生长
卵形鲳鲹仔、稚鱼的外部游泳器官主要为背鳍、腹鳍、胸鳍、尾鳍和臀鳍。由于卵形鲳鲹腹鳍在仔鱼期未见发育,稚鱼期开始发育后呈透明状,测量误差较大,这里不进行讨论。
卵形鲳鲹仔、稚鱼游泳器官异速生长曲线见图5。由图5可见,卵形鲳鲹仔鱼期的胸鳍长、臀鳍长和尾鳍高的异速生长指数b1分别为1.264、1.493和1.993,与1均差异显著(P<0.05),表现为正异速生长;尾鳍长的异速生长指数b1为1.025,与1无显著性差异(P>0.05),表现为等速生长;背鳍长的异速生长指数b1为0.677,与1差异显著(P<0.05),表现为慢速生长。
稚鱼期背鳍长和臀鳍长的异速生长指数b2分别为1.139和1.143,与1差异显著(P<0.05),表现为正异速生长。胸鳍长、尾鳍长和尾鳍高的异速生长指数 b2为0.992、0.99和1.01,与1差异不显著(P>0.05),表现为等速生长。
综上所述,卵形鲳鲹的游泳器官在仔、稚鱼发育阶段具有明显差异性。背鳍仔鱼期慢速增长,稚鱼期快速增长;胸鳍仔鱼期快速增长,稚鱼期等速增长;尾鳍长在仔、稚鱼期为等速增长,尾鳍高在仔鱼期快速生长,稚鱼期等速生长;臀鳍长仔、稚鱼期均快速增长。分析各器官b1和b2后,发现背鳍长、胸鳍长和尾鳍高在15日龄时存在生长拐点(P<0.05)。
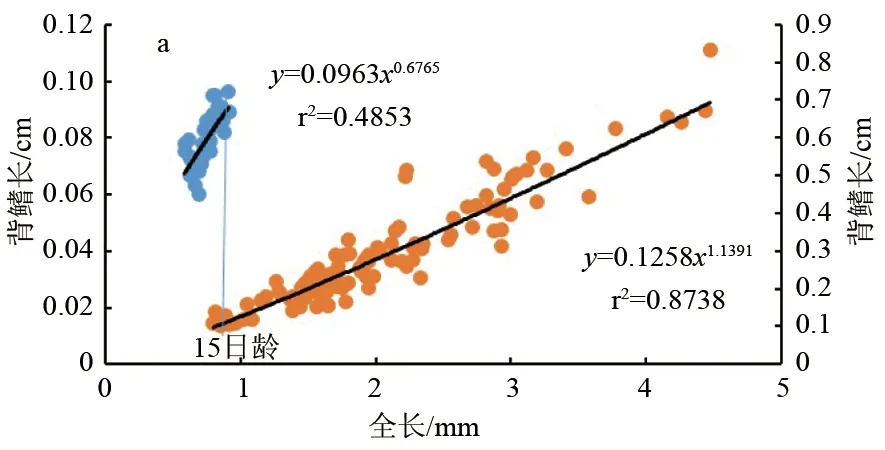

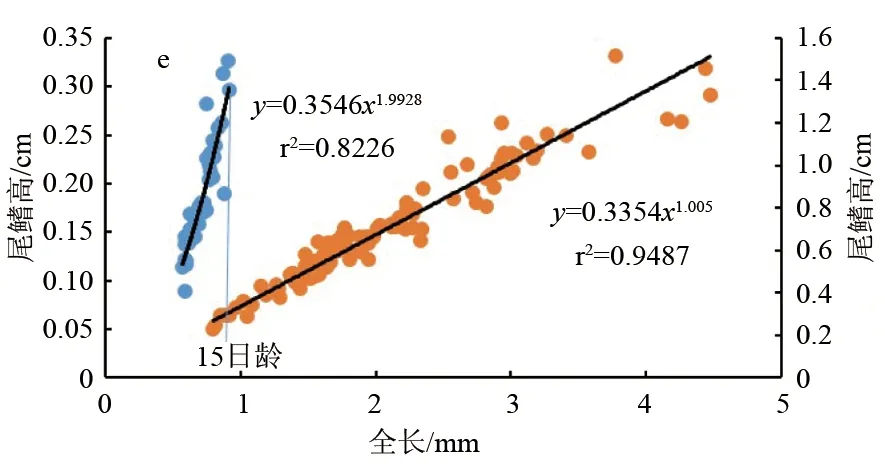
图5 卵形鲳鲹仔、稚鱼游泳器官异速生长曲线
3 讨 论
在人工水产养殖条件下,养殖环境中无自然水体中的敌害,养殖的成效依赖养殖品种自身的遗传因素和所提供的环境因素的适配[22-29]。仔鱼早期的生长发育对养殖业是极其重要而又十分繁琐的过程,这包括仔鱼形态特征、自身代谢和生活习性等变化[30-31]。捕食定位(如眼睛和表皮绒毛化学感受器)、摄食(如口、鳍和肌肉)、吸收和消化(如肝胰腺、胃和肠)等功能决定了仔鱼早期的生存[32]。鱼类的异速生长可以理解为,仔鱼在早期发育时期与环境互作过程中,特定功能为适应环境而优先被需求的现象。在历史的长河中,这种演化伴随着物竞天择适者生存的游戏规则。同时可以理解为是一种自我保护机制,体现为仔鱼孵化后,与营养摄取、躲避天敌的一些重要功能器官优先发育,表现出快速生长。这种现象久经证实,如大麻哈鱼(Oncorhynchusketa)[33]、美洲鲥(Alosasapidissima)[34]、粗唇龟鲻(Chelonlabrosus)[35]。卵形鲳鲹仔鱼优先发育特定时期所需功能的器官,以适应外部环境与协调自身内环境的稳态,以最小的时间和代谢资源为代价获得自身最大的生存优势,充分体现了表型可塑性和优胜劣汰的自然法则。
3.1 头部器官异速生长
近年来,鱼类头部器官的研究日益精进,使得对鱼类特定功能的获得有了更加深入的理解。通常认为鱼类早期是靠视觉进行捕食定位的,而水体振动以及化学感受器对侦测和攻击猎物也很重要。同时视力的完善与否与躲避被捕食的几率息息相关。不同鱼种头部的早期发育有所差异,有的在孵化过程中头骨结构和鳍已出现[36],有些则在孵化后才开始发育[37-39]。孵化后仔鱼通常出现未着色的眼睛和封闭的口器,而开口与眼睛着色时间相差不远[40-44]。开口后,下颌会着生游离神经丘及嗅觉相关的感受细胞[45-46]。施氏鲟(Acipenserschrenckii)[16]眼睛在2日龄完成了基本发育,西伯利亚鲟(A.baeri)[17]眼睛3~4日龄便完成了快速生长阶段。在本试验中,卵形鲳鲹仔鱼期眼睛发育为快速生长,稚鱼期相对于全长为慢速生长,和上述鱼类试验结果相似,说明在仔鱼期卵形鲳鲹的眼部功能已近基本完善。充分证明了眼部快速生长在早期生长阶段躲避敌害和提高摄食效率方面的重要性。
仔、稚鱼摄食能力的强弱与口宽、吻长的发育和完善程度密切相关。开口后仔鱼卵黄囊日益消耗,需要进行外源性营养以供同化作用之需,并迅速过渡至仔鱼期。卵形鲳鲹在2日龄末就开始张口,7日龄卵黄囊才消失[47]。为捕食体型更大、能量更高的食物,上、下颌需快速增长[48]。在本试验中,卵形鲳鲹仔、稚鱼的口宽、吻长及头高在15日龄时均出现拐点,仔鱼期的快速生长、稚鱼期的慢速生长或等速生长说明卵形鲳鲹口部器官功能于整体而言在15日龄左右已基本完善。这表明了吻长、口宽和头高的生长已完成了优先发育,过渡至次要发育阶段。
3.2 躯干部分的异速生长
在硬骨鱼的消化系统发育相关报道[44,48]中,仔鱼开口之前,消化道是位于卵黄囊上部的简单未分化的直管,然后随着日龄快速发育。胃腺的发育标志着仔鱼开始过渡到稚鱼期[21]。在本试验中,卵形鲳鲹功能胃的形成在15日龄左右。卵形鲳鲹躯干长的生长在仔鱼期表现为慢速生长,稚鱼期等速生长。体高在仔鱼期为快速生长,稚鱼期为等速生长。躯干的生长给予消化系统充足的发育空间,卵形鲳鲹仔鱼期体高的快速生长说明消化系统在该时期处于快速发育阶段,而稚鱼期躯干长和体高的等速生长说明消化系统已逐步发育完全,为接受饲料驯化做准备。
3.3 游泳器官的异速生长
鱼类游泳相关器官的早期发育已有相关报道[37,49-54],这些鱼类尾鳍最先发育并骨化完成,表明在鱼类早期发育中尾鳍最为重要,处于优先发育状态。试验观察发现,卵形鲳鲹尾鳍的发育在卵黄囊期为包裹在尾部中枢上下两侧的皮肤褶皱,仔鱼期逐渐有鳍条产生,辐射状呈椭圆形。稚鱼期尾鳍呈现扇形。稚鱼末期尾鳍的中间鳍条发育减缓并向上下两侧靠拢,逐步形成成鱼尾鳍的剪刀状。卵形鲳鲹仔、稚鱼尾鳍高在15日龄出现生长拐点,仔鱼期一直处于快速生长,稚鱼期与全长一起处于等速生长。这说明在仔鱼期卵形鲳鲹的尾鳍已经完成了快速生长,能够满足其快速游泳能力。稚鱼期的等速生长可保持身体增长所需同步的运动能力。
鱼类胸鳍主要具有辅助尾鳍前进或在进行中紧急制动的作用,胸鳍和背鳍、腹鳍和臀鳍一起具有协调鱼体平衡和辅助运动时的升降转弯。试验发现卵形鲳鲹胸鳍在仔鱼期的快速生长逐步转换成稚鱼期的等速生长,说明仔鱼期卵形鲳鲹胸鳍完成了快速增长。卵形鲳鲹背鳍和臀鳍在稚鱼期皆为快速生长,随着体宽的逐步拉伸,逐步呈现流线型。通过卵形鲳鲹主要游泳器官(背鳍、胸鳍、臀鳍和尾鳍)的全面分析发现,卵形鲳鲹在稚鱼末期的游泳器官已经基本完善,运动能力大幅度增加。这说明游泳器官在卵形鲳鲹早期发育中占据着重要的位置,同时也说明游泳器官的发育对捕食和躲避敌害的重要性。
4 结 论
本试验通过传统理论生物学的研究方法对卵形鲳鲹仔、稚鱼外部形态特征进行了较为详细的分析,研究表明,卵形鲳鲹仔、稚鱼关于信息捕获、运动能力以及同化作用相关的外部形态性状及器官皆表现出了异速生长现象,充分体现了卵形鲳鲹早期发育对生长环境的适应能力。因此,在卵形鲳鲹早期发育过程中,根据卵形鲳鲹自身的发育规律合理优化育苗环境,提供各个阶段所需营养,可降低死亡率,减少骨骼畸形率[52-53],为更好的推动卵形鲳鲹养殖业奠定基础。
[1] 蔡文超,区又君,李加儿,等.卵形鲳鲹免疫器官的早期发育[J].南方水产科学,2012,8(5):39-45.
[2] 区又君,罗奇,李加儿,等.卵形鲳鲹消化酶活性的研究Ⅰ.成鱼和幼鱼消化酶活性在不同消化器官中的分布及其比较[J].南方水产科学,2011,7(1):50-55.
[3] 刘兴旺,王华朗,张海涛,等. 卵形鲳鲹幼鱼饲料中适宜蛋白能量比的研究[J]. 水产科学,2011,30(3):136-139.
[4] 许晓娟,李加儿,区又君.盐度对卵形鲳鲹胚胎发育和早期仔鱼的影响[J].南方水产,2009,5(6):31-35.
[5] 蔡小辉,文雪,徐力文,等.卵形鲳鲹一例疑似神经性病毒病的初步分析[J]. 水产科学,2012,31(10):597-601.
[6] 王江勇,郭志勋,黄剑南,等.一起卵形鲳鲹幼鱼死亡原因的调查[J].南方水产,2006,2(3):54-56.
[7] 罗小燕,杨小立,黎祖福,等. 6种常见渔药对卵形鲳鲹的急性毒性[J]. 水产科学,2016,35(10):480-485.
[8] 区又君,李加儿.卵形鲳鲹的早期胚胎发育[J].中国水产科学,2005,12(6):786-789.
[9] 何永亮,区又君,李加儿.卵形鲳鲹早期发育的研究[J].上海海洋大学学报,2009,18(4):428-434.
[10] 陈伟洲,许鼎盛,王德强,等.卵形鲳鲹人工繁殖及育苗技术研究[J].台湾海峡,2007,26(3):435-441.
[11] 张邦杰,梁仁杰,王晓斌,等.卵形鲳鲹Trachinotusovatus(Linnaeus) 的引进,咸、海水池养与越冬[J].现代渔业信息,2001,16(3):16-20.
[12] Peters R H.The ecological implications of body size [M].2nd Ed.Cambridge:Cambridge University Press,1986:184-215.
[13] Niklas K J.Plant allometry:the scaling of form and process [M].Chicago:University of Chicago Press,1994:274-290.
[14] Osse J W M,Boogaart J G M,Snik G M J,et al.Priorities during early growth of fish larvae [J].Aquaculture,1997,155(1/4):249-258.
[15] Choo C K,Liew H C.Morphological development and allometric growth patterns in the juvenile seahorseHippocampuskudaBleeker [J].Journal of Fish Biology,2006,69(2):426-445.
[16] 马境,章龙珍,庄平,等.施氏鲟仔鱼发育及异速生长模型[J].应用生态学报,2007,18(12):2875-2882.
[17] 庄平,宋超,章龙珍,等.全人工繁殖西伯利亚鲟仔稚鱼发育的异速生长[J].生态学杂志,2009,28(4):681-687.
[18] Sink G M J,Boogaart J G M V D,Osse J W M.Larval growth patterns inCyprinuscarpioandClariasgariepinuswith attention to the fin fold [J].Journal of Fish Biology,1997,50(6):1339-1352.
[19] Herbing I H V.Development of feeding structures in larval fish with different life histories:winter flounder and Atlantic cod[J].Journal of Fish Biology,2001,59(4):767-782.
[20] Rodriguez A,Gisbert E.Eye development and the role of vision during Siberian sturgeon early ontogeny [J].Journal of Applied Ichthyology,2002,18(4/6):280-285.
[21] Stroband H W J,Kroon A G.The development of the stomach inClariaslazeraand the intestinal absorption of protein macromolecules [J].Cell and Tissue Research,1981,215(2):397-415.
[22] Bolla S,Holmefjord I.Effect of temperature and light on development of Atlantic halibut larvae [J].Aquaculture,1988,74(3/4):355-358.
[23] Polo A,Yufera M,Pascual E.Effects of temperature on egg and larval development ofSparusaurataL [J].Aquaculture,1991(92):367-375.
[24] Boglione C,Marino G,Bertolini B,et al.Larval and postlarval monitoring in sea bass:morphological approach to evaluate finfish seed quality [G]//Barnabé G,Kestemont P. Production, environment and quality: proceedings of the international conference bordeaux aquaculture ′92,Bordeaux:EAS Special Publication,1992:189-204.
[25] Andrades J A,Becerra J,Fernández-Llebrez P.Skeletal deformities in larval,juvenile and adult stages of cultured gilthead sea bream (SparusaurataL.) [J].Aquaculture,1996,141(1/2):1-11.
[26] Kihara M,Ogata S,Kawano N,et al.Lordosis induction in juvenile red sea bream,Pagrusmajor,by high swimming activity [J].Aquaculture, 2002,212(1/4):149-158.
[27] Cobcroft J M,Pankhurst P M,Poortenaar C,et al.Jaw malformation in cultured yellowtail kingfish (Seriolalalandi) larvae [J].New Zealand Journal of Marine and Freshwater Research,2004,38(1):67-71.
[28] Boglione C,Pulcini D,Scardi M,et al.Skeletal anomaly monitoring in rainbow trout (Oncorhynchusmykiss,Walbaum 1792) reared under different conditions [J].PLoS One,2014,9(5):e96983.
[29] Chen Q,Pan L,Xv Y,et al.Environmental conditioning of skeletal anomalies typology and frequency in gilthead seabream (SparusaurataL.,1758) juveniles [J].PloS One,2013,8(2):711-715.
[30] Osse J W M,Boogart G M J,Den V. Fish larvae,development,allometric growth and the aquatic environment [J].ICES Marine Science Symposia,1995(201):21-34.
[31] Nogueira L B,Godinho A L,Godinho H P.Early development and allometric growth in hatchery-reared characinBryconorbignyanus[J].Aquaculture Research,2014,45(6):1004-1011.
[32] Yúfera M,Pascual E,Polo A,et al.Effect of starvation on the feeding ability of gilthead seabream (SparusaurataL.) larvae at first feeding [J].Journal of Experimental Marine Biology and Ecology,1993,169(2):259-272.
[33] 宋洪建,刘伟,王继隆,等.大马哈鱼卵黄囊仔鱼异速生长及其生态学意义[J].水生生物学报,2013,37(2):329-335.
[34] 高小强,洪磊,刘志峰,等.美洲鲥仔稚鱼异速生长模式研究[J].水生生物学报,2015,39(3):638-644.
[35] Khemis I B,Gisber E,Alcaraz C,et al.Allometric growth patterns and development in larvae and juveniles of thick-lipped grey mulletChelonlabrosusreared in mesocosm conditions [J].Aquaculture Research,2013,44(12):1872-1888.
[36] Kendall A W.Early life history stages of fishes and their characters[G]//Ontogeny and Systematics of Fishes,Lawrence, USA: Allen Press,1984:11-22.
[37] Koumoundouros G,Gagliardi F,Divanach P,et al.Normal and abnormal osteological development of caudal fin inSparusaurataL. fry [J].Aquaculture,1997,149(3/4):215-226.
[38] Gluckmann I,Huriaux F,Focant B,et al.Postembryonic development of the cephalic skeleton inDicentrachuslabrax(Pisces,Perciformes,Serranidae)[J].Bulletin of Marine Science,1999,65(1):11-36.
[39] Koumoundouros G,Divanach P,Kentouri M.Development of the skull inDentexdentex(Osteichthyes,Sparidae) [J].Marine Biology,2000,136(1):175-184.
[40] Kjørsvik E,Meeren T,Kryvi H,et al.Early development of the digestive tract of cod larvae,GadusmorhuaL. during start-feeding and starvation [J].Journal of Fish Biology,1991,38(1):1-15.
[41] Boulhic M,Gabaudan J.Histological study of the organogenesis of the digestive system and swim bladder of the Dover sole,Soleasolea(Linnaeus 1758) [J].Aquaculture,1992,102(4):373-396.
[42] Bisbal G A,Bengtson D A.Description of the starving condition in summer flounder,Paralichthysdentatus,early life history stages [J].Fishery Bulletin,1995,93(2):217-230.
[43] Sarasquete M C,Polo A,Yúfera M.Histology and histochemistry of the development of the digestive system of larval gilthead seabreamSparusaurataL [J].Aquaculture,1995,130(1):79-92.
[44] Micale V,Garaffo M,Genovese L,et al.The ontogeny of the alimentary tract during larval development in common pandoraPagelluserythrinusL [J].Aquaculture,2006,251(2):354-365.
[45] Baglione C,Giganti M,Selmob C,et al.Morphoecology in larval fin-fish.A new candidate species for aquaculture,Diploduspuntazzo(Sparidae) [J].Aquaculture International,2002,11(1):17-41.
[46] Yin M C,Blaxter J H S.Feeding ability and survival during starvation of marine fish larvae reared in the laboratory [J].Journal of Experimental Marine Biology and Ecology,1987,105(1):73-83.
[47] Ma Z H,Qin J G,Hutchinson W,et al.Responses of digestive enzymes and body lipids to weaning times in yellowtail kingfishSeriolalalandi(Valenciennes,1833) larvae [J].Aquaculture Research,2014,45(6):973-982.
[49] Sfakianakis D G,Koumoundouros G,Divanach P,et al.Osteological development of the vertebral column and of the fins inPagelluserythrinus(L. 1758).Temperature effect on the developmental plasticity and morpho-anatomical abnormalities [J].Aquaculture,2004,232(1/4):407-424.
[50] Koumoundouros G,Sfakianakis D G.Osteological development of the vertebral column and of the fins inDiplodussargus(Teleostei:Perciformes:Sparidae) [J].Marine Biology,2001,139(5):853-862.
[51] Matsuoka M.Development of the skeletal tissues and skeletal muscles in the red sea bream [J].Bulletin of Seikai National Fisheries Research Institute,1987(65):1-114.
[52] Koumoundouros G,Divanach P,Kentouri M.Osteological development of the vertebral column and of the caudal complex inDentexdentex[J].Journal of Fish Biology,1999,54(2):424-436.
[53] Ma Z H,Guo H Y,Zheng P L,et al.Ontogenetic development of digestive functionality in golden pompanoTrachinotusovatus(Linnaeus 1758)[J].Fish Physiology & Biochemistry,2014,409(4):1157-1167.
[54] Zheng P L,Ma Z H,Guo H Y,et al.Osteological ontogeny and malformations in larval and juvenile golden pompanoTrachinotusovatus(Linnaeus 1758)[J].Aquaculture Research,2014,47(5):1421-1431.
AllometricGrowthinLarvaandJuvenileGoldenPompanoTrachinotusovatus
YANG Qibin1, 2, MA Zhenhua1,2, CHENG Dachuan1,2,3, JIANG Shigui1,LI Youning1, CHEN Mingqiang1
( 1. South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300,China; 2. Key Laboratory of South China Sea Fishery Resources Exploitation &Utilization, Ministry of Agriculture, Guangzhou 510300,China; 3.Wuxi Fisheries College, Nanjing Agriculture University, Wuxi 204081, China )
Traditional theoretical biology experiment was conducted to study the allometric growth in orangs of larval and juvenile golden pompanoTrachinotusovatusin adaptation to their early life stage (from 1th to 36th day post hatch),and aiming to provide fundamental data in artificial propagation of golden pompano. The results showed that during the larva and juvenile stages, the organs associated to feeling, breathing, and swimming were shown to develope and differentiate rapidly, and exhibite allometric patterns. The head organs, rostrum length, mouth width, orbital diameter and head region height exhibited positive allometric growth in larval stage. In juvenile stage, head height appeared isometric growth. Rostrum length, mouth width and orbital diameter exhibited negative allometric growth. In body region organs, in larval stage, head length, body height and tail region length exhibited positive allometric growth. Trunk length exhibited negative allometric growth. In juvenile stage, head length, body height, trunk region length and tail region length showed isometric growth. As for swimming organs, dorsal fin length, pectoral fin length, anal fin length and caudal fin height exhibited positive allometric growth; caudal fin height appeared isometric growth in larval stage. In juvenile stage, dorsal fin length and anal fin length exhibited positive allometric growth. Pectoral fin length, and caudal fin length and height appeared isometric growth. The rapid development of those key organs led to increase in larval survival ability at the early stage as soon as possible, and had important ecological significance to adapt the complex external environment.
golden pompanoTrachinotusovatus; early development; larval and juvenile fish; allometric growth
10.16378/j.cnki.1003-1111.2017.03.002
S965.328
A
1003-1111(2017)03-0259-08
2016-01-28;
2016-10-18.
国家自然科学基金青年科学基金资助项目(31502186);中国博士后科学基金资助项目(2014T70831,2013M542220);农业部南海渔业资源开发利用重点实验室开放基金资助项目(LSF2014-01);中国水产科学研究院南海水产研究所基本科研业务费资助项目(2014YJ01).
杨其彬(1972—),男,助理研究员;研究方向:水产动物繁育及发育. E-mail:yangqibin1208@163.com. 通讯作者:马振华(1981—),男,副研究员,博士;研究方向:海水鱼类繁育及发育.E-mail:zhenhua.ma@hotmail.com.
