大丽轮枝菌微菌核形成的影响因素研究
2017-12-13夏红飞陈志荣宾毅高峰黄家风
夏红飞,陈志荣,宾毅,高峰,黄家风*
(石河子大学农学院/新疆绿洲农业病虫害治理与植保资源利用自治区高校重点实验室,新疆 石河子 832003)
大丽轮枝菌微菌核形成的影响因素研究
夏红飞,陈志荣,宾毅,高峰,黄家风*
(石河子大学农学院/新疆绿洲农业病虫害治理与植保资源利用自治区高校重点实验室,新疆 石河子 832003)
为了研究大丽轮枝菌微菌核形成的影响因素及其与微菌核形成相关基因之间的关系,本研究通过微菌核形态观察、重量测定及形成相关基因的表达测定,对不同温度、光照、营养及寄主根系诱导条件下,棉花大丽轮枝菌V592菌株微菌核的形成进行了分析。结果表明:以PDA为基质,26℃比22℃更有利于微菌核形成;连续黑暗的条件比自然光及连续光照更有利于微菌核形成;营养丰富的全营养PDA培养基比半营养PDA及水琼脂平板更有利于微菌核形成;棉花根系及其提取物对微菌核的形成具有促进作用。通过qRT-PCR对7个微菌核形成相关基因的表达量进行测定,结果显示,温度、光照及营养条件改变后12 h,7个基因在26℃时的表达量明显高于22℃时的表达量,6个基因在黑暗中的表达量明显高于连续光照条件下的表达量,6个基因在全营养中的表达量明显高于营养缺乏的培养基中的表达量,表明大丽轮枝菌微菌核的产量与温度、光照和营养条件改变后12 h各基因的表达量密切相关。而寄主根系对微菌核形成相关基因的表达在12 h时有短暂的抑制作用,但是48 h后各基因不断被诱导表达。以上结果表明大丽轮枝菌微菌核的产量与微菌核形成相关基因的诱导表达密切相关。
大丽轮枝菌;微菌核;影响因素;基因表达
大丽轮枝菌(Verticillium dahliaeKleb.)是一种土壤传播的植物病原真菌,通过根部侵染宿主微管组织引发植物黄萎病。其寄主范围广泛,危害200多种经济作物,成为世界性的严重植物病害[1]。大丽轮枝菌侵染寄主时,在植物体内会形成由许多厚壁细胞组成的黑色近球形、长条形或不规则形的微菌核。依赖于这种休眠体结构,大丽轮枝菌能够在土壤或者宿主残体中存活10年以上[2],土壤中微菌核的数量直接决定寄主的发病程度[3]。因此,了解大丽轮枝菌微菌核形成的影响因素及分子调控机理对深入研究黄萎病防治策略具有重要意义。
对于大丽轮枝菌微菌核形成的分子调控机理研究,目前已鉴定了多个基因与微菌核形成有关。VDH1基因编码一个疏水蛋白,当VDH1基因敲除严重影响微菌核的形成[4-6]。VMK1和VdSNF1基因分别编码细胞丝裂原活化蛋白(MAP)激酶和蔗糖非发酵蛋白激酶,VMK1突变导致大丽轮枝菌微菌核形成明显减少[7],VdSNF1基因敲除导致大丽轮枝菌微菌核形成明显减少[8]。VdGARP1基因编码1个富含谷氨酸的蛋白,该基因突变后引起大丽轮枝菌微菌核形成延迟、致病力下降;在营养缺乏的条件下,该基因表达促进大丽轮枝菌从腐生阶段进入微菌核形式的休眠阶段[9]。而VdPR3基因敲除造成大丽轮枝菌微菌核形成完全受阻[6]。与上述4个基因不同的是,VdPKAC1和VGB分别是cAMP依赖信号途径和G蛋白介导的信号途径中的2个关键基因,分别敲除后能使大丽轮枝菌产生更多的微菌核[10-11]。综上所述,微菌核形成可能是一个复杂的受很多基因交叉调控的过程,在这个基因网络中,基因之间通过相互作用,显著影响微菌核的形成。
黄萎病的发生主要是由土壤中的微菌核萌发所引起,大量研究表明,土壤中的温度、湿度、pH和有机质含量影响大丽轮枝菌微菌核的存活力和萌发率[12-15],但对于微菌核形成因素研究的报道较少。Tjamos等[16]发现,棉花大丽轮枝菌18-30℃下2-5 d可形成微菌核;5℃下30 d才形成;32℃以上不形成微菌核,白应文等[17]研究表明,在基础改良培养基(BMM)上,pH值为 9.5-11.5、温度为 20℃时最有利于棉花黄萎病菌产生微菌核。对于不同的营养条件以及光照等因素是否对大丽轮枝菌微菌核形成有影响,以及不同条件下与微菌核形成相关基因的表达情况如何,目前尚不明确。为此,本研究以棉花黄萎病落叶型强致病力菌株V592为研究对象,通过从基因水平分析营养条件和环境条件对微菌核相关基因表达及微菌核形成进行研究,以期从微菌核形成的角度探索黄萎病防治的奠定理论基础。
1 材料与方法
1.1 供试材料
供试菌株棉花黄萎病落叶型强致病力菌株V592由本实验室分离、纯化、鉴定和保存。供试棉花根系所用的棉花品种为军棉一号(cv.Junmian No.1),由本实验室保存。
1.2 方法
1.2.1 温度对微菌核形成的影响
将 200 μL(1×107cfu/mL)V592 孢子悬浮液均匀涂布在铺有玻璃纸的PDA平板上,置于26℃培养箱培养48 h,待孢子长出菌丝后,再分别转至4、22、26、30、37℃的培养箱,每个温度处理设 3个重复。在温度条件改变后的第5天,拍照记录微菌核形成情况,然后将玻璃纸上的微菌核刮至称量纸上称重,室温过夜后,称其晾干后的重量。
1.2.2 光照对微菌核形成的影响
将 200 μL(1×107cfu/mL)V592 孢子悬浮液均匀涂布在铺有玻璃纸的PDA平板上,置于26℃培养箱培养48 h,待孢子长出菌丝后,再分别置于连续光照、连续黑暗以及自然光条件下培养,在光照条件改变后的第5天,拍照记录微菌核的形态。每个处理3个重复。
1.2.3 营养条件对微菌核形成的影响
将 200 μL(1×107cfu/mL)V592 孢子悬浮液分别均匀涂布在铺有玻璃纸的PDA平板上,在26℃培养箱培养48 h,待孢子萌发长出菌丝后,再将玻璃纸分别转至全营养PDA(常规PDA培养基)平板上、半营养 PDA平板(无菌水1 L,琼脂 15 g,马铃薯100 g,葡萄糖7.5 g)上和水琼脂平板(无菌水1 L,琼脂15 g)上。于26℃培养箱继续培养,在营养条件改变后的第5天,拍照记录微菌核的形态,并测定微菌核的湿重和干重。每个处理3个重复。
1.2.4 寄主对微菌核形成的影响
1.2.4.1 根提取物的制备
取棉花根15 g,用粉碎机粉碎,再用液氮磨碎,加入70 mL去离子水混匀,将混合物置于25℃摇床 150 r/min 振荡 1 h,6000 r/min离心 10 min,然后将上清液用定性滤纸进行过滤。为保证根系提取物中的活性成分不被破坏,滤出液采用0.22 μm的无菌滤膜进行过滤除菌,碎根残体121℃灭菌20 min,将除菌后的滤液及碎根残体保存于-20℃冰箱备用[18]。
1.2.4.2 菌株的诱导培养
将上述植物碎根以20 g/L的比例加入PDA培养基中,高压灭菌,温度冷却至55℃时加入100 mL上述无菌根系滤液,制备添加了棉花根系及提取物的 PDA(CPDA)平板。先将 200 μL(1×107cfu/mL)V592孢子悬浮液均匀涂布在铺有玻璃纸的PDA平板上,置于26℃培养48 h,待孢子萌发长出菌丝后,再将玻璃纸转至CPDA平板上继续培养,在培养条件改变后第5天,拍照记录微菌核形成情况,测定微菌核的湿重和干重。每个处理3个重复。
1.2.5 与微菌核形成相关基因表达量的测定
将上述各条件下培养的菌株,分别在培养条件改变后的12、48 h和第5天用Trizol法分别提取菌株总 RNA;cDNA第一条链的合成按照 M-MLV First Strand Kit系统进行,然后用作qRT-PCR模板。在目标基因外显子区域设计引物(表1)进行qRT-PCR。
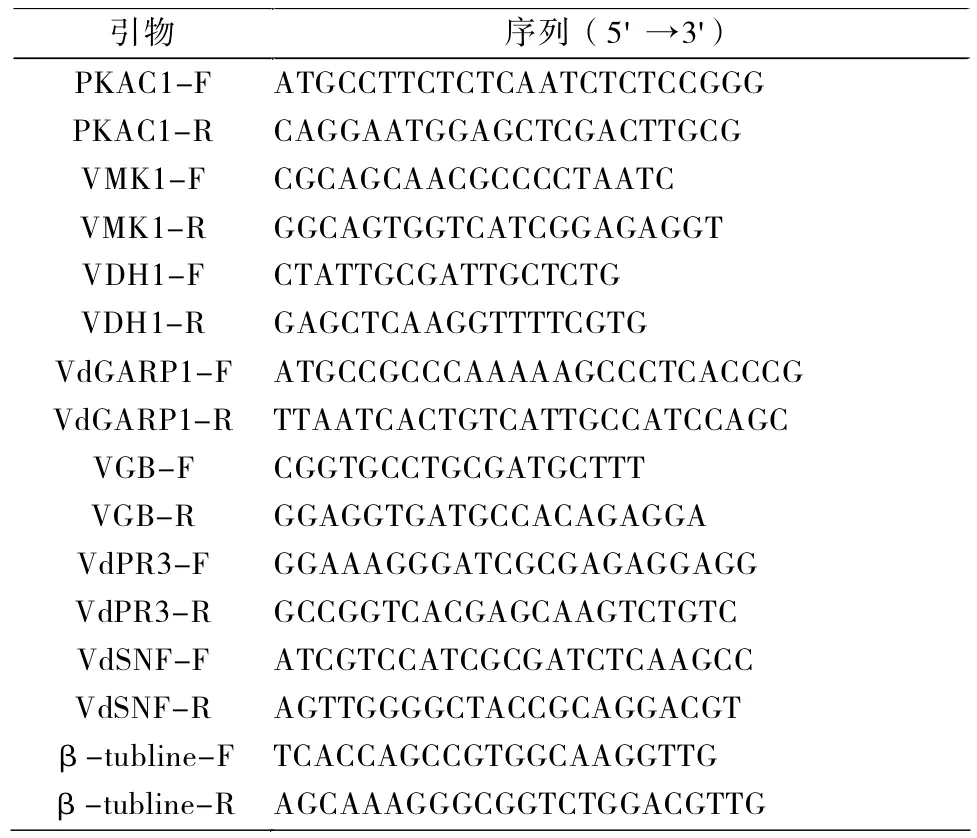
表1 qT-PCR所用引物Tab.1 Primers used for qT-PCR
反应程序为94℃ 30 s,60℃ 30 s,72 ℃15 s,45个循环。以β-tubline基因(DQ266153)作为内参基因。根据相对表达法计算不同条件下与微菌核形成相关基因的表达水平。引物设计使用 Primer premier 5进行,由华大基因公司合成。
2 结果与分析
2.1 温度对微菌核形成的影响
由图1A可见,在22和26℃条件下,棉花黄萎病菌均产生大量黑色微菌核,4和30℃条件下仅有极少量微菌核产生,而在37℃的条件下无微菌核产生。26℃条件下微菌核的湿重和干重均明显高于比22℃条件下的微菌核(图1B),表明26℃更有利于微菌核形成。由图1C可知,温度条件改变12 h时,7个基因在26℃时的表达量均比在22℃时高,其中VDH1、VdPR3和VdGARP1基因在26℃时的表达量分别是22℃时的100、50和25倍,VGB和VMK1基因在26℃时的表达量是22℃时的12.5倍。温度条件改变48 h时,7个基因26与22℃的表达量比值均明显下降,其中VdPKAC1、VGB和VdPR3基因在22℃的表达量反而高于26℃时的表达量。温度条件改变后的第5天,7个基因26与22℃的表达量比值更小,为0.36-2.78,表明7个基因在26℃的表达量与22℃的表达量差异减小。
以上结果说明,26℃的温度条件更有利于微菌核形成及相关基因的表达,其表达量主要取决于温度条件改变后12 h的表达量。

图1 不同温度条件对大丽轮枝菌V592微菌核形成的影响Fig.1 Effect of different temperature condition onV.dahliaemicrosclerotial development
2.2 光照对微菌核形成的影响
由图2可见,连续黑暗的条件更有利于大丽轮枝菌产生黑色微菌核,自然光照的条件只能产生极少量的微菌核,连续光照的条件不能促使大丽轮枝菌产生微菌核。
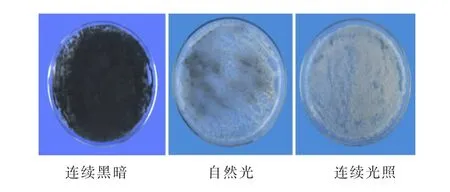
图2 不同光照条件下V592菌株形成的微菌核形态图Fig.2 Microsclerotial morphology of V592 strain under different illumination
对大丽轮枝菌中7个微菌核形成相关基因在连续黑暗与连续光照条件下的相对表达量进行比较,结果(表2)显示,光照条件改变后的12 h,除了VdPR3基因外,其他6个基因在黑暗中的表达量均比在连续光照条件下的表达量高,其表达量比值范围为1.3-11.0,其中VdGARP1和VGB基因在黑暗中的表达量分别是光照条件下的11和7.7倍。光照条件改变后的48 h,除了VdSNF1和VdPR3基因依然保持原有的表达趋势外,其它5个基因的表达都发生了剧烈变化,逆转为光照下的表达量高于黑暗中的表达量,其中变化最大的是VdGARP1和VGB基因,连续光照下的表达量分别是黑暗中的10.2和7.0倍。在光照条件改变后的第5天,只有VdPKAC1和VGB基因的表达回复为黑暗条件下的表达量高于光照条件。

表2 V592菌株7个基因在连续黑暗与连续光照下相对表达量的比值Tab.2 Fold changes in relative transcript abundance of seven genes involved in microsclerotial development in V592 strain under different illumination
以上结果说明,光照明显影响微菌核的形成及相关基因的表达,微菌核的产量可能与光照条件改变后12 h微菌核形成相关基因的表达量密切相关。连续光照48 h微菌核形成相关基因即使表达量剧增也不能促使大丽轮枝菌产生更多的微菌核。
2.3 营养条件对微菌核形成的影响
由图3A可见,3种营养条件均可使大丽轮枝菌产生微菌核。微菌核称重结果(图3B)显示,全营养培养基上微菌核产生最多,其次为半营养培养基,水琼脂平板上形成的微菌核最少,说明营养丰富更有利于微菌核形成。对7个基因在全营养条件与半营养条件下的相对表达量进行比较,由图3C可见,营养条件改变12 h时,除了VdPR3基因外,其他6个基因在全营养中的表达量均比在半营养中的表达量高,其中VDH1基因全营养/半营养的比值高达50倍;营养条件改变后的48 h,除VMK1基因外,其它6个基因的表达均发生明显变化,其中VdPKAC1、VGB和 VdSNF1基因在半营养 PDA上的表达量反而高于在全营养PDA上的表达量;营养条件改变后的第5天,从全营养/半营养的比值来看,VdPR3基因表达发生逆转,VdPKAC1、VGB和VdSNF1基因表达回复到全营养中的表达量高于半营养中的表达,7个基因在全营养中的表达量均比在半营养中的表达量高。
对7个基因在全营养条件与水琼脂作为营养条件的相对表达量进行比较,结果(图3D)显示,营养条件改变12 h时,除了VdPKAC1基因外,其他6个基因在全营养中的表达量均比在水琼脂中的表达量高,其中VdGARP1基因在全营养中的表达量是水琼脂中的20倍,VMK1和VGB基因在全营养中的表达量均是水琼脂中的11倍;营养条件改变48 h时,除了VDH1基因的表达变化不大外,其他5个基因的表达均发生明显变化,其中VGB、VdSNF1和VdPR3基因在水琼脂中的表达量反而高于在全营养PDA上的表达量;营养条件改变后的第5天,从全营养 /水琼脂的比值来看,VGB、VdSNF1和 VdPR3基因表达回复到在全营养中的表达量高于在水琼脂中的表达,除了VDH1基因外,其他6个基因在全营养中的表达量均比在水琼脂中的表达量高。
以上结果说明,营养丰富的培养条件更有利于微菌核的形成,微菌核的产量与营养条件改变后12 h微菌核形成相关基因的表达量密切相关,营养条件改变后的48 h,虽然营养缺乏的培养条件诱导了微菌核形成相关基因的表达,但并不影响大丽轮枝菌最终的菌核量。
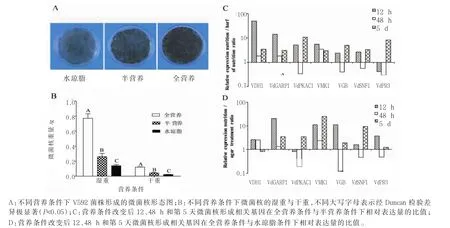
图3 不同营养条件对大丽轮枝菌V592微菌核形成的影响Fig.3 Effect of different nutrient condition onV.dahliaemicrosclerotial development
2.4 寄主根系对微菌核形成的影响
由图4A可见,在PDA和CPDA平板上均能产生大量的黑色微菌核,湿重和干重的称重结果(图4B)显示,棉花根系诱导产生的微菌核比对照产生的微菌核多,由此说明棉花根系能促进大丽轮枝菌微菌核的形成。7个基因的相对表达量的比较结果(图4)显示,棉花根系诱导培养12 h(图4C),从PDA/CPDA的比值来看,除了VdPR3基因外,其它6个基因在PDA上的表达量均比在CPDA上的表达量高,其中VDH1、VMK1和VdGARP1基因在PDA上的表达量分别是CPDA上的14.3、25和25倍。诱导培养48 h(图4D),除了VMK1和VdGARP1基因外,其它5个基因(VDH1、VdPKAC1、VGB、VdSNF1 和 VdPR3)的表达发生逆转,在CPDA上的表达量高于在PDA上的表达量,并且这种状况一直持续到诱导培养的第5天,大部分基因 (VDH1、VGB、VdPR3、VMK1 和 VdGARP1)在CPDA上的表达量依然高于在PDA上的表达量。该结果表明,寄主根系对微菌核形成相关基因的表达在最初的12 h有短暂的抑制作用,但是随着培养时间的延长,与微菌核形成相关基因不断被诱导表达。

图4 寄主根系对大丽轮枝菌V592微菌核形成的影响Fig.4 Effect of cotton root induction condition onV.dahliaemicrosclerotial development
3 讨论与结论
(1)本研究通过分析温度对棉花大丽轮枝菌微菌核形成的影响,结果表明26℃最有利于微菌核形成,22℃次之,4和30℃条件下仅有极少量微菌核产生,37℃的条件下无微菌核产生。这与Tjamos等[16]的研究结果一致,棉花大丽轮枝菌18-30℃下2-5 d可形成微菌核;5℃下30 d才形成;32℃以上不形成微菌核。本研究通过qRT-PCR对7个微菌核形成相关基因的相对表达量进行测定,结果显示,大丽轮枝菌在改变温度条件培养12 h时,7个基因在26℃时的表达量明显高于22℃时的表达量;48 h及5 d后,7个基因在26℃的表达量与22℃的表达量差异减少。这表明改变温度条件培养12 h时,26℃的温度条件更有利于微菌核形成相关基因的表达,这与26℃条件下产生了更多的微菌核的结果一致。
(2)通过分析光照对棉花大丽轮枝菌微菌核形成的影响,结果表明,连续黑暗的条件有利于大丽轮枝菌产生黑色微菌核,自然光只能产生极少量的微菌核,连续光照的条件不能使大丽轮枝菌产生微菌核。Tjamos等[16]的研究表明,白光和紫外光抑制或延迟微菌核形成[16],与本研究结果一致。Gao等[9]的研究表明,在近紫外光下VdGARP1基因随着时间的延长表达量逐渐增加,14 d后表达量明显高于黑暗条件下的表达量,但是明显延迟和抑制微菌核的产生。本研究发现,棉花大丽轮枝菌在连续光照12 h时,包括VdGARP1基因在内的6个微菌核形成相关基因的相对表达量明显低于连续黑暗条件下的表达量;连续光照48 h及5 d后,大部分基因(包括VdGARP1基因)的表达量逆转为光照下的表达量高于黑暗中的表达量,表现出随着光照时间的延长表达量逐渐增加的趋势,与Gao等[9]研究结果一致,但是光照抑制微菌核产生与微菌核形成相关基因表达量之间的互作机制还需进行深入解析。
(3)通过分析营养条件对棉花大丽轮枝菌微菌核形成的影响,结果表明,营养丰富的全营养PDA培养基更有利于微菌核形成,其次为半营养PDA培养基,水琼脂平板上形成的微菌核最少。白英文等[16]的研究表明,BM培养基中葡萄糖的用量减半,可使大丽轮枝菌的微菌核产生量提高3.7倍。本研究将马铃薯及葡萄糖含量减半却不能提高微菌核产量,其原因可能与BM和PDA两种基本培养基所含的碳源种类不同有关。Klimes等[5]的研究表明,VDH1基因分别在缺葡萄糖和缺硝酸钠的培养基上培养24 h,其表达量均明显高于对照[5]。本研究发现营养条件改变后的第5天,VDH1基因在水琼脂上的表达量比在全营养PDA上表达量高,表现出营养缺乏更促进其表达的趋势,与Klimes等[5]的研究结果一致。
(4)通过分析寄主根系对棉花大丽轮枝菌微菌核形成的影响,结果表明,寄主根系能促进大丽轮枝菌微菌核的形成。棉花根系及其提取物对大丽轮枝菌微菌核形成相关基因的表达在最初的12 h具有短暂的抑制作用,但是在48 h至第5天,大多数微菌核形成相关基因不断被诱导表达。Gao等[9]研究表明,VdGARP1基因受寄主根系诱导后,其表达量是随着诱导时间延长而不断增加,与本研究结果一致。
[1]Klosterman S J,Atallah Z K,Vallad G E,et al.Diversity,pathogenicity,and management of verticillium species[J].Annual Review of Phytopathology,2009,47(1):39-62.
[2]Garas N A,Wilhem S,Sagen J E.Relationship to cultivar resistance to distribution ofVerticillium dahliaein inoculated cotton plants and to growth to single conidia on excised stem segments[J].Phytopathology,1986,76(10):1005-1010.
[3]Pullman G S,Devay J E.Effect of soil flooding and paddy rice culture on the survival ofVerticillium dahliaeand incidence ofVerticillium wiltin cotton[J].Phytopathology,1982,12(12):1285-1289.
[4]Klimes A,Dobinson K F.A hydrophobin gene,VDH1,is involved in microsclerotial development and spore viability in the plant pathogenVerticillium dahliae[J].Fungal Genetics&Biology,2006,43(4):283-294.
[5]Klimes A,Amyotte S G,Grant S,et al.Microsclerotia development inVerticillium dahliae:Regulation and differential expression of the hydrophobin gene VDH1[J].Fungal Genetics and Biology,2008,45(12):1525-1532.
[6]Zhang T,Jian-Hua,Zhao,et al.Host-induced gene silencing of the target gene in fungal cells confers effective resistaance to the cotton wiltdisease pathogenVerticillium dahliae[J].Molecular Plant,2016,9(6):939-942.
[7]Rauyaree P,Ospinagiraldo M D,Kang S,et al.Mutations in VMK1,a mitogen-activated protein kinase gene,affect microsclerotia formation and pathogenicity inVerticillium dahliae[J].Current Genetics,2005,48(2):109-116.
[8]Tzima A K,Paplomatas E J,Rauyaree P,et al.VdSNF1,the sucrose nonfermenting protein kinase gene ofVerticillium dahliae,is required for virulence and expression of genes involved in cell-wall degradation[J].Molecular Plant-Microbe Interactions,2011,24(1),129-142.
[9]Gao F,Zhou B J,Li G Y,et al.A glutamic acidrich protein identified inVerticillium dahliaefrom an insertional mutagenesis affects microsclerotial formation and pathogenicity[J].PLoS One,2010,5(12):15319.
[10]Tzima A,Paplomatas E J,Rauyaree P,et al.Roles of the catalytic subunit of cAMP-dependent protein kinase A in virulence and development of the soilborne plant pathogenVerticillium dahliae[J].Fungal Genetics&Biology Fg&B,2010,47(5):406-15.
[11]Tzima A K,Paplomatas E J,Tsitsigiannis D I,et al.The G protein β subunit controls virulence and multiple growth and development-related traits inVerticillium dahliae[J].Fungal Genetics&Biology,2012,49(4):271-283.
[12]Ben-Yephet Y,Pinkas Y.Germination of individual microsclerotia ofVerticillium dahliae[J].Phytoparasitica,1977,5(3):159-166.
[13]Paplomatas E J,Bassett D M,Broome J C,et al.Incidence of Verticillium wilt and yield losses of cotton cultivars based on soil inoculum density ofVerticillium dahliae[J].Phytopathology,1993,82(12):1417-1420.
[14]DeVay J E,Pullman G S.Epidemiology and ecology of diseases caused by Verticillium species,with emphosis on Verticillium wilt of cotton[J].Phytopathologia Mediterranea,1984,23(2-3):95-108.
[15]杨家荣,商鸿生,高立强.土壤环境因素对棉花黄萎病菌微菌核存活的影响[J].植物病理学报,2004,34(2):180-183.Yang J R,Shang H S,Gao L Q.The effect of soil habitat factors of microsclerotia ofVerticillium dahliaeof cotton[J].Acta Phytophathologica Sinica,2004,34(2):180-183.
[16]Tjamos E C,Fravel D R.Detrimental effects of sublethal heating andTalaromyces flavuson microsclerotia ofVerticillium dahliae[J].Phytopathology,1995,85(4):388-392.
[17]白应文,胡东芳,胡小平,等.大丽轮枝孢微菌核的形成条件[J].菌物学报,2011,30(5):695-701.Bai Y W,Hu D F,Hu X P,et al.Formation conditions for microsclerotia ofVerticillium dahliae[J].Mycosystema,2011,30(5):695-701.
[18]张婷,张博森,刘启,等.不同致病力棉花黄萎病菌乙烯含量及相关基因表达量的测定[J].石河子大学学报(自然科学版),2016,34(5):632-637.Zhang T,Zhang B S,Liu Q,et al.Measurement of ethylene and transcript levels of genes involved in ethylene production by different virulentVerticillim dahliaefrom cotton[J].Journal of Shihezi University(Natural Science),2016,34(5):632-637.
Influence factors on microsclerotial formation inVerticillium dahliae
Xia Hongfei,Chen Zhirong,Bin Yi,Gao Feng,Huang Jiafeng*
(College of Agriculture,Shihezi University/Key Laboratory at Universities of Xinjiang Uygur Autonomous Region for Oasis Agricultural Pest Management and Plant Protection Resource Utilization,Shihezi,Xinjiang 832003,China)
This research aimed to analyze influence factors on microsclerotial development inVerticillium dahliaeand the correlation between influence factors and the transcript levels of seven genes involved in microsclerotial formation.Effects of different temperature,illumination and nutrient condition on microsclerotial development inV.dahliaeisolate V592 from infected cotton were measured by morphologic observation and weight of microsclerotia.The results showed that V592 produced more microsclerotia under 26℃ than under 22℃,more microsclerotia under continuous dark than under natural light and continuous illumination,and more microsclerotia on full nutrition PDA medium than on half of nutrition PDA medium and on agar medium.V592 produced more microsclerotia on PDA medium with cotton root extract than on PDA medium,indicating that microsclerotial production by V592 was stimulated by cotton root.The transcript levels of seven genes involved in microsclerotial formation in V592 were determined by qRT-PCR.When the temperature,illumination and nutrition conditions were changed,the transcript levels of seven genes were higher under 26℃than under 22℃during the first 12 hours;the transcript levels of six genes were higher under continuous dark than under continuous illumination,and the transcript levels of six genes were higher on full nutrition PDA medium than on half of nutrition PDA medium and on agar medium,indicating that microsclerotial production by V592 was associated with transcript levels of genes involved in microsclerotial formation within 12 hours.The transcript of six genes within 12 hours were suppressed transiently by cotton root extract,but transcript of genes involved in microsclerotial formation after 48 hours were induced continuously by cotton root extract.In conclusion,microsclerotial production byV.dahliaewas associated with inducible expression of genes involved in microsclerotial formation.
Verticillim dahliae;microsclerotium;influence factor;gene expression
S435.62
A
10.13880/j.cnki.65-1174/n.2017.05.016
1007-7383(2017)05-0618-07
2017-04-13
国家自然科学基金项目(31160351、31560494、31460451)
夏红飞(1992-),女,硕士研究生,专业方向为植物病理学,e-mail:1519447477@qq.com。
*通信作者:黄家风(1970-),女,教授,从事分子植物病理学研究,e-mail:jiafeng_huang@163.com。
