α-1酸性糖蛋白对多西他赛相关血液毒性的预测价值
2017-12-07余维纳王芳李林朱明智熊有毅陈卓谷元廷
余维纳 王芳 李林 朱明智 熊有毅 陈卓 谷元廷
(郑州大学第一附属医院 乳腺外二科 河南 郑州 450052)
·论著·
α-1酸性糖蛋白对多西他赛相关血液毒性的预测价值
余维纳 王芳 李林 朱明智 熊有毅 陈卓 谷元廷
(郑州大学第一附属医院 乳腺外二科 河南 郑州 450052)
目的探究早期乳腺癌患者的基线α-1酸性糖蛋白对多西他赛相关血液毒性的预测价值。方法选取97例接受多西他赛化疗的乳腺癌患者,每3周接受1次多西他赛注射(75 mg/m2,注射时间≥1 h),用药前当日清晨抽取血样测定基线AAG水平,在化疗第6天清晨抽取血样测定初始白细胞(WBC)及中性粒细胞绝对值(ANC)水平,观察患者基线AAG水平与多西他赛血液毒性之间的关系。结果34例(35.1%)患者发生3~4级白细胞减少,36例(37.1%)患者发生中性粒细胞减少。0~2级白细胞减少组AAG水平高于3~4级白细胞减少组,差异有统计学意义(P<0.05);0~2级中性粒细胞减少组AAG水平高于3~4级中性粒细胞减少组,差异有统计学意义(P<0.05)。0~2级血液毒性组AAG水平高于3~4级血液毒性组,差异有统计学意义(P<0.05)。结论早期乳腺癌患者的基线AAG水平可以预测多西他赛相关血液毒性,基线AAG水平较低者更可能发生3~4级血液毒性。
乳腺癌;多西他赛;α-1酸性糖蛋白;血液毒性
多西他赛是紫杉烷类抗肿瘤药物,临床应用于多种肿瘤的治疗,例如乳腺癌和非小细胞肺癌等[1-3]。多西他赛与环磷酰胺联合,多西他赛与铂类联合及环磷酰胺+表柔比星/多柔比星序贯多西他赛已经成为中国早期乳腺癌化疗的一线方案。多西他赛的骨髓抑制是其在临床应用中一个重要的剂量限制性因素,包括严重的白细胞减少和中性粒细胞减少[3-4]。化疗导致的中性粒细胞减少常常会导致发热性中性粒细胞减少症(febrile neutropenia,FN),是一种需要住院治疗的临床急症,一般情况下需要给予粒细胞集落刺激因子(G-CSF)和(或)抗生素[4-5]。多西他赛的药物代谢动力学存在较大的个体间差异,药物代谢酶及转运蛋白被认为是影响个体间差异的主要因素[6]。多西他赛在血浆中的主要载体为α-1酸性糖蛋白(AAG)和白蛋白,由于AAG是一种急性期蛋白,具有高度的个体间差异,因此,有研究认为AAG应该是多西他赛血浆结合的主要影响因素[7]。研究表明,多西他赛在血液中的未结合部分与其血液毒性有关[8]。因此,AAG的浓度可能是造成多西他赛血液毒性个体间差异的因素之一。本研究通过测定应用多西他赛的早期乳腺癌患者用药前的基线AAG水平及化疗第6天外周血白细胞及中性粒细胞的值来观察基线AAG水平与3~4级血液毒性之间的关系。
1 资料与方法
1.1一般资料选取郑州大学第一附属医院2016年7月至2017年3月收治的97例接受包含多西他赛化疗的乳腺癌患者。纳入标准:病理学确诊为浸润性乳腺癌;生存预期≥12周;年龄≥18岁;骨髓功能正常(ANC>1.5×109/L;血小板计数>100×109/L);肾脏功能正常[血肌酐≤2×正常值上限(ULN),总胆红素水平<1.5×ULN]并且肝脏功能正常[谷丙转氨酶(ALT)和/或谷草转氨酶(AST)水平<1.5×ULN,碱性磷酸酶水平<2.5×ULN];化疗期间未使用任何已知的抑制或促进CYP3A的药物及食物。所有患者同意参加本研究且均签署知情同意书。
1.2治疗方法所有患者接受多西他赛治疗75 mg/m2,注射时间≥1 h,每3周1次。其中45例患者在多西他赛使用前1 d接受环磷酰胺500 mg/m2注射;25例患者在多西他赛使用前1 d接受卡铂350 mg/m2注射;27例患者已接受多柔比星/表柔比星+环磷酰胺治疗,每3周1次,共4疗程,之后序贯使用多西他赛。在化疗过程中根据促白细胞生长因子(G-CSF)说明书的推荐剂量进行治疗。
1.3观察指标①采用免疫比浊法检测α-1酸性糖蛋白。患者开始使用多西他赛当日清晨空腹采集血样3 ml,以3 000 rpm转速离心10 min,取上清液,样本检测在迪瑞CS-600B全自动生化分析仪上完成,应用α-1酸性糖蛋白检测试剂盒。②化疗第6天测定患者外周血中的白细胞及中性粒细胞计数。清晨空腹抽取血样2 ml,加入EDTA-K2抗凝剂,2 h内进行血常规分析,所用仪器为Beckman-Coulter LH750全自动血液分析仪。根据Common Terminology Criteria for Adverse Event(CTCAE) 4.0 评价患者血液毒性程度:白细胞计数(2.0~4.0)×109/L为0~2级白细胞减少,白细胞计数<1.9×109/L为3~4级白细胞减少。中性粒细胞计数(1.0~2.0)×109/L为0~2级中性粒细胞减少,中性粒细胞计数<0.9×109/L为3~4中性粒细胞减少。
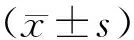
2 结果
2.1基本情况97例患者中,34例(35.1%)患者发生3~4级白细胞减少,36例(37.1%)患者发生中性粒细胞减少。AAG平均值为(1.005±0.227)mg/L,范围为(0.6~1.7)mg/L。见图1。

图197例患者的AAG水平
2.2AAG水平差异性分析0~2级白细胞减少组AAG水平[(1.056±0.215)mg/L]高于3~4级白细胞减少组[(0.912±0.220)mg/L],差异有统计学意义(P<0.05);0~2级中性粒细胞减少组AAG水平[(1.062±0.222)mg/L]高于3~4级中性粒细胞减少组[(0.908±0.202)mg/L],差异有统计学意义(P<0.05)。0~2级血液毒性组AAG水平高于3~4级血液毒性组,差异有统计学意义(P<0.05)。见图2、3。

图2 不同白细胞减少分级的AAG分布及平均值

图3 不同中性粒细胞减少分级的AAG分布及平均值
3 讨论
多西他赛自1996年开始就已经成为恶性肿瘤治疗中最重要的化疗药物之一[9]。目前中国多西他赛的使用剂量为75 mg/m2,每3周1次。国外已有多个Ⅰ期[10-14]、Ⅱ期[15-18]临床试验对其药物代谢动力学(PK)和药物代谢效力学(PD)进行研究。根据BSA计算剂量,多西他赛PK具有显著的个体间差异,导致在临床应用中无法得到最佳剂量,即达到可接受毒性下的最佳效果的剂量。血液毒性是接受多西他赛治疗乳腺癌患者中的主要剂量限制性毒性反应,主要表现为外周血白细胞计数及中性粒细胞计数的下降。该毒性反应可能会威胁生命,并且延缓后续治疗。研究指出,与非亚洲人群相比,多西他赛引起的3~4级白细胞减少更易发生在亚洲人群中[19]。
多西他赛血浆总浓度与血液毒性之间的关系并不明显,因为药效学研究表明多西他赛的效果主要与血浆中的未结合多西他赛(free drag concentration in plasma,fu)的水平有关[20],fu越高,越易发生3~4 级血液毒性。多西他赛在血液中主要与白蛋白、脂蛋白及AAG结合。AAG作为一种急性期反应蛋白,在血浆中的浓度受众多因素影响,在乳腺癌患者中具有高度个体间差异,而该差异可能影响多西他赛蛋白与fu结合,导致药物代谢动力学的个体间差异[21-22]。因此,AAG水平可能是多西他赛PK的一个预测因子。Bruno等[23]已经证实AAG在人群PK模型中是总多西他赛清除率的一个显著影响因素,AAG水平越高,CL越低。研究表明,用药前AAG水平与fu间存在负相关,用药前AAG水平越高,fu水平越低[24]。AAG水平增高,使得多西他赛的蛋白结合率增高,血液中未结合蛋白质的多西他赛减少,骨髓抑制作用下降。这就解释了为什么在两个多西他赛血浆总浓度相等的患者中,因AAG水平低而fu高的患者更容易出现3~4级血液毒性。
本研究结果显示,0~2级白细胞减少组AAG水平高于3~4级白细胞减少组,0~2级中性粒细胞减少组AAG水平高于3~4级中性粒细胞减少组,0~2级血液毒性组AAG水平高于与3~4级血液毒性组,差异有统计学意义(P<0.05)。该结果说明基线AAG水平越低,多西他赛相关血液毒性越高。该效应可能导致血液中高AAG水平的患者体内自由药的分布受到限制。此药动学效应可能是安全性终点的一个重要预测指标,特别是对于多西他赛的血液毒性。基线AAG水平可在应用多西他赛之前对患者发生3~4级血液毒性进行初步的预估,从而保证患者化疗过程中的安全。
综上所述,早期乳腺癌患者的基线AAG水平可以预测多西他赛相关血液毒性,基线AAG水平较低者更可能发生3~4级血液毒性。基线AAG水平与血液毒性之间的具体关系及AAG对多西他赛药动学/药效学的具体影响还有待进一步深入研究。
[1] Ringel I,Horwitz S B.Studies with RP 56976 (taxotere): a semisynthetic analogue of taxol[J].J Natl Cancer Inst,1991,83(4):288-291.
[2] Nieuweboer A J,de Morrée E S,de Graan A J,et al.Inter-patient variability in docetaxel pharmacokinetics: a review[J].Cancer Treat Rev,2015,41(7):605-613.
[3] Kenmotsu H,Tanigawara Y.Pharmacokinetics,dynamics and toxicity of docetaxel: why the Japanese dose differs from the Western dose[J].Cancer Sci,2015,106(5):497-504.
[4] Crawford J,Dale D C,Lyman G H.Chemotherapy-induced neutropenia: risks,consequences,and new directions for its management[J].Cancer,2004,100(2):228-237.
[5] Fontanella C,Bolzonello S,Lederer B,et al.Management of breast cancer patients with chemotherapy-induced neutropenia or febrile neutropenia[J].Breast Care(Basel),2014,9(4):239-245.
[6] Franke R M,Carducci M A,Rudek M A,et al.Castration-dependent pharmacokinetics of docetaxel in patients with prostate cancer[J].J Clin Oncol,2010,28(30):4562-4567.
[7] Urien S,Barré J,Morin C,et al.Docetaxel serum protein binding with high affinity to alpha-1-acid glycoprotein[J].Invest New Drugs,1996,14(2):147-151.
[8] Mathijssen R H,Sparreboom A,Verweij J.Determining the optimal dose in the development of anticancer agents[J].Nat Rev Clin Oncol,2014,11(5):272-281.
[9] Minami H,Kawada K,Saski Y,et al.Pharmacokinetics and pharmacodynamics of protein-unbound docetaxel in cancer patients[J].Cancer Sci,2006,97(3):235-241.
[10] Bissett D,Setanoians A,Cassidy J,et al.Phase Ⅰ and pharmacokinetic study of Taxotere (RP 56976) administered as a 24 hour infusion[J].Cancer Res,1993,53(3):523-527.
[11] Burris H,Irvin R,Kuhn J,et al.Phase Ⅰ clinical trail of Taxotere administered as either a 2 hour or 6 hour intravenous infusion[J].J Clin Oncol,1993,11(5):950-958.
[12] Extra J M,Rousseau F,Bruno R,et al.Phase Ⅰ and pharmacokinetic study of Taxotere (RP 56976; NSC 628503) given as a short intravenous infusion[J].Cancer Res,1993,53(5): 1037-1042.
[13] Launay-Iliadis M C,Bruno R,Cosson V,et al.Population pharmacokinetics of docetaxel during phase I studies using nonlinear mixed-effects modeling and nonpharametric maximum-likelihood estimation[J].Cancer Chemother Pharmacol,1995,37(1-2):47-54.
[14] Pazdur R,Newman R A,Newman B M,et al.Phase Ⅰ trial of Taxotere: five-day schedule.Journal of the National Cancer Institute[J].J Natl Cancer Inst,1992,84(23): 1781-1788.
[15] Tannock I F,de Wit R,Berry W R,et al.Docetaxel plus prenisone or mitoxantrone plus prednisone for advanced prostate cancer[J].N Engl J Med,2004,351(15):1502-1512.
[16] Petrylak D P,Tangen C M,Hussain M H,et al.Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer[J].N Engl J Med,2004,351(15):1513-1520.
[17] Shepherd F A,Dancdy J,Ramlau R,et al.Prospective randomized trial of docetaxel versus best supportive care in patients with non-samll-cell lung cancer previously treated with platinum-based chemotherapy[J].J Clin Oncol,2000,18(10): 2095-2103.
[18] Fossella F V,Devore R,Kerr R N,et al.Randomized phase Ⅲ trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small-cell lung cancer previously treated with platinum-containing chemotherapy regimens. The TAX 320 Non-Small Cell Lung Cancer Study Group[J].J Clin Oncol,2000,18(12): 2354-2362.
[19] Yano R,Konno A,Watanabe K,et al.Pharmacoethnicity of docetaxel-induced severe neutropenia: integrated analysis of published phase Ⅱ and Ⅲ trials[J].Int J Clin Oncol,2013,18(1):96-104.
[20] Sparreboom A,Nooter K,Loos W J,et al.The (ir)relevance of plasma protein binding of anticancer drugs[J].Neth J Med,2001,59(4):196-207.
[21] Israili Z H,Dayton P G.Human alpha-1-glycoprotein and its interactions with drugs[J].Drug Metab Rev,2001,33(2):161-235.
[22] Schmidt S,Gonzaleaz D,Derendorf H.Significance of protein binding in pharmacokinetics and pharmacodynamics[J].J Pharm Sci,2010,99(3):1107-1122.
[23] Bruno R,Vivier N,Vergniol J C,et al.A population pharmacokinetic model for decetaxel(Taxotere):model building and validation[J].J Pharma Biopharm,1996,24(3):153-172.
[24] Urien S,Barre J,Morin C,et al.Docetaxel serum protein binding with high affinity to alpha-1-acid glycoprotein[J].Invest New Drugs,1996,14(7):147-151.
Alpha-1-acidglycoproteinasapredictorinforecastinghematologicaltoxicityofdocetaxel
Yu Weina, Wang Fang, Li Lin, Zhu Mingzhi, Xiong Youyi, Chen Zhuo, Gu Yuanting
(DepartmentofBreastSurgery2,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China)
ObjectiveTo investigate the relationship between the baseline alpha-1-acid glycoprotein (AAG) and hematological toxicity of docetaxel in early stage breast cancer patients.Methods97 patients
docetaxel infusion (75 mg/m2over 1 h) once every 3 weeks. At the first cycle, the baseline AAG was determined at the day before docetaxel infusion. White blood cell (WBC) and absolute neutrophil count (ANC) was determined at the sixth morning. The relationship of baseline AAG and the degree of hematological toxicity was analyzed.ResultsGrade 3~4 neutropenia occurred in 34(35.1%) patients, and grade 3~4 leukopenia occurred in 36 (37.1%) patients. The average AAG in grade 0~2 neutropenia and 3~4 neutropenia was(1.056±0.215)mg/L and (0.912±0.220)mg/L(P<0.05), respectively. The average AAG in grade 0~2 leukopenia and 3~4 leukopenia was (1.062±0.222)mg/L and (0.908±0.202)mg/L(P<0.01), respectively. AAG of grade 0~2 hematological toxicity and grade 3~4 hematological toxicity had a significantly statistical difference(P<0.05).ConclusionThe baseline AAG level is correlated with high grade hematological toxicity and can act as a predictor in forecasting serious hematological toxicity in early stage breast cancer patients treated with docetaxel.
breast cancer; docetaxel; alpha-1-acid glcoprotein; hematological toxicity
谷元廷,E-mail:rxwkgyt@163.com。
R 969.1
10.3969/j.issn.1004-437X.2017.21.001
2017-04-02)
