无机磷降解菌株的分离、鉴定及解磷能力
2017-11-30吕睿贾凤安刘晨胡婷甄丽莎
吕睿+贾凤安+刘晨+胡婷+甄丽莎


摘要:为了开发高效微生物解磷肥,利用解磷菌选择培养基,从陕西省西安市周至县猕猴桃园农田土壤中分离出具有降解无机磷能力的菌株共计9株,通过纯化培养,筛选出1株高效无机磷降解菌JWP3。利用16S rDNA基因序列分析方法对该菌株的分类信息进行鉴定,鉴定结果表明该菌株为胶质芽孢杆菌 (Paenibacillus mucilaginosus)。并通过试验确定了该菌株的最适培养条件:初始接种量4%,摇床转速200 r/min,培养温度30 ℃,初始pH值为7。试验结果可为无机磷降解菌JWP3的大规模工业化生产提供数据支持。
关键词:无机磷降解菌;筛选;鉴定;解磷能力;最适培养条件
中图分类号: S182 文献标志码: A 文章编号:1002-1302(2017)20-0295-04
磷元素是植物生长所必需的三大营养要素之一,我国有75%的土壤缺磷[1],特别是北方石灰性土壤,虽然全磷含量很高,均在0. 57~0. 79 g/kg之间,但由于土壤中存在大量的游离碳酸钙,大部分磷形成难溶性的磷酸钙盐,能被作物吸收利用的有效磷含量很低[2],土壤中95%的磷为无效形式[3],大部分与土壤中Ca2+、Fe2+、Fe3+、Al3+结合形成难溶性磷酸盐。因此,如何开发和有效利用这部分被土壤固定的磷是目前我国农业生产中急需要解决的问题。
而土壤中存在着一些微生物能够将难溶性的磷酸盐转化为可利用形态,这些微生物称为解磷微生物 (phosphate solubilizing micro-organisms,PSM ),能够将难溶性的磷酸盐如矿磷粉转化为水溶性磷,提高土壤中的可溶性磷含量,从而改善植物磷素营养,提高作物产量[4-6]。因此,对解磷微生物菌剂及其应用的研究,成为了土壤微生物修复研究的热点,对提高土壤肥力和促进农作物增产具有重要的意义。
由于不同种类的解磷菌或菌株之间的解磷能力和接种效果差异悬殊,所以高效解磷菌株的筛选显得尤为重要[7]。本试验以磷酸钙为唯一磷源,通过选择性培养,从陕西省西安市周至县猕猴桃园大田土壤中分离筛选出9株解磷菌株,并通过分离、纯化、复筛,得到1株解磷能力较强的细菌 JWP3,研究该菌株的生理生化特征及对磷矿石的降解特性,确定菌株的最适接种量,最适pH值、最适生长温度及摇床转速对解磷能力的影响,确定该菌株的生长情况及解磷能力,为开发新的成本低、效果好且不污染环境的解磷菌肥提供科学依据,对发展绿色农业具有十分重要的意义。
1 材料与方法
1.1 材料
1.1.1 土样 采集陕西省西安市周至县猕猴桃园土壤,土样釆集方法为五点采样法,去除表层土壤,用土钻取深度为0~20 cm 的土壤,将5个不同点的土样混合为1份,装入无菌样品采集袋,标签注明采样信息,放入4 ℃冰箱保存。
1.1.2 培养基 无机磷液体培养基:蔗糖 10.0 g,(NH4)2SO4 0.5 g,MgSO4·7H2O 0.3 g,NaCl 0.3 g,KCl 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·7H2O 0.03 g,Ca3(PO4)2 5.0 g,,蒸馏水 1.0 L,pH值 7.2~7.5,121 ℃灭菌20 min。
无机磷固体培养基:无机磷液体培养基中加入20 g琼脂。
LB液体培养基[8]:蛋白胨 10 g,酵母粉 5 g,氯化钠 5 g,加蒸馏水至 1 L,pH值 7.0。
1.2 方法
1.2.1 解磷菌的富集 取1只250 mL锥形瓶,加入无机磷液体培养基100 mL,向锥形瓶中加入1 g土壤样品,摇床培养2 d(温度30 ℃,转速180 r/min),吸取锥形瓶底部菌液进行转接,富集解磷菌,每次转接前将菌液涂布到平板上计数。重复上述步骤,对不同样品进行处理。
1.2.2 解磷菌的初筛 将富集培养基中的菌种转接到含磷酸钙无机盐培养基的平板上,置于30 ℃恒温培养箱中,出现菌落后,挑取单菌落转接至新的固体培养基上,重复上述操作3次,将单菌落放入冰箱保存备用。
1.2.3 解磷菌的复筛 将初筛出的菌株转接到装有50 mL磷酸钙液体培养基中,摇床培养5 d,涂布,记录菌数,同时检测磷酸钙的降解,将菌液以8 000 r/min离心5 min,取上清10 mL,加5 mL钼锑抗显色剂,加蒸馏水定容至50 mL,以不接菌处理为对照,用分光光度计测量吸光度,计算磷含量,筛选出1株生长旺盛、降解能力强的菌株。
1.2.4 菌株形态学特征 将分离纯化得到的菌株在固体平板上进行划线培养,在温度为30 ℃的条件下培养2 d,观察菌株生长状况及菌落特征。
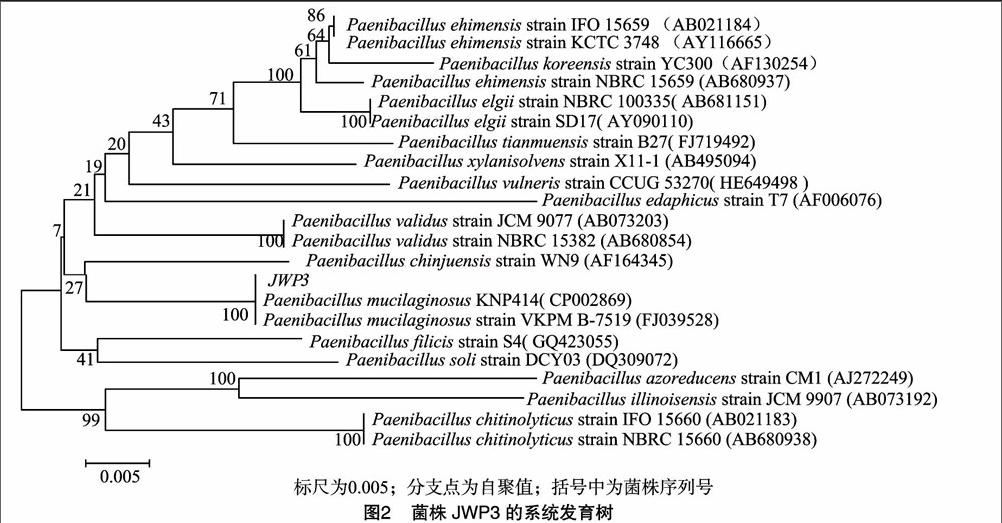
1.2.5 菌株16S rDNA序列分析及比对 选用细菌16S rDNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)建立 PCR扩增体系进行扩增。PCR 反应体系(50 μL):5×One Taq Standard Reaction Buffer 10 μL,10 mmol/L dNTPs 1 μL,10 μmol/L Forward Primer 1 μL,10 μmol/L Reverse Primer 1 μL,One Taq DNA Polymerase 1 μL,Template DNA 2.0 μL,Nuclease-Free water 34 μL。擴增程序:94 ℃预变性10 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min。产物经纯化后测定基因序列,利用 Blast将菌株的基因序列与 GenBank数据库中的序列进行比较,选取相似性较高的模式菌株序列,用MEGA 5.1中Neighbor-Joining法比较同源性,构建系统发育树。endprint
1.2.6 菌株解磷能力测定 配制解磷培养基(不加磷源)按50 mL每瓶分装于250 mL锥形瓶中,分别加入0.1 g准确称取的磷酸钙,在121 ℃条件下灭菌20 min,每個锥形瓶接入2%待测菌悬液,28 ℃ 180 r/min条件下摇床培养5 d,菌液 8 000 r/min 离心10 min,取上清10 mL,加5 mL钼锑抗显色剂,加水定容至50 mL,利用分光光度计测定并计算上清液中磷含量。
1.2.6.1 最适初始接种量测定 配制液体培养基,按1%、2%、3%、4%和5%等5个接种量接入到解磷培养基中,在 28 ℃ 条件下摇瓶培养5 d,菌液8 000 r/min离心10 min,取上清10 mL,加5 mL钼锑抗显色剂,加水定容至50 mL,利用分光光度计测定并计算上清液中磷含量。
1.2.6.2 最适初始pH值测定 配制磷酸钙液体培养基,分组调节pH值为5、6、7、8、9,按4%接种量接种,在28 ℃条件下摇瓶培养5 d,菌液8 000 r/min离心10 min,取上清10 mL,加5 mL钼锑抗显色剂,加水定容至50 mL,利用分光光度计测定并计算上清液中磷含量。
1.2.6.3 最适生长温度测定 按4%接种量将菌株接入培养液中,调节pH值为7,将菌种接于磷酸钙液体培养基中,分别置于温度为24、26、28、30、32 ℃的摇床中培养5 d,菌液 8 000 r/min 离心10 min,取上清10 mL,加5 mL钼锑抗显色剂,加水定容至50 mL,利用分光光度计测定并计算上清液中磷含量。
1.2.6.4 最适生长转速测定 按4%接种量将菌株接入培养液中,调节pH值为7,温度设置为30 ℃,调节摇床转速分别为140、180、200、220 r/min,培养5 d后,菌液8 000 r/min离心10 min,取上清10 mL,加5 mL钼锑抗显色剂,加水定容至50 mL,利用分光光度计测定并计算上清液中磷含量。
1.2.7 数据处理 数据采用 Excel 2010和 SPSS 19统计软件进行方差分析和多重比较。
2 结果与分析
2.1 解磷菌的筛选
对土壤样品进行涂布处理,初步得到菌株 21株,经复筛,得到具有高效解磷能力的菌株9株,通过钼蓝比色法测量解磷量。由表1可知,9株解磷菌的解磷能力相比于对照都有明显增加。其中,JWP 2解磷效果最弱,菌液中速效磷含量为10.47 mg/L,比空白对照增加了3.72 mg/L,而菌株JWP3培养液中速效磷含量最高,达到73.22 mg/L,比空白对照增加了66.47 mg/L,其解磷能力最强,本试验以 JWP3菌株为研究对象,对其菌落特征和解磷特性做进一步研究。
2.2 菌落形态特征
采用平板划线法将JWP3菌株进行纯化,并涂布至固体培养基上,培养2 d后,观察菌株形态。如图1所示,菌株单菌落呈水滴状,菌落无色透明,边缘光滑,表面湿润且黏稠,菌落直径约为0.5 cm。
2.3 16S rDNA测序分析
菌株JWP3经16S rDNA测序获得1 400 bp的基因片段,将序列信息提交到GenBank 数据库中,利用Blast将菌株的基因序列进行相似性比较,结果表明,菌株JWP3与胶质芽孢杆菌属同源性很高,从16S rDNA序列相似性比较结果看,菌株JWP3与胶质芽孢杆菌(Paenibacillus mucilaginosus)相似性达到100%,选取21株同源性较高的胶质芽孢杆菌菌株序列与待测菌株序列构建系统发育树(图2),从系统发育树可以看出,菌株JWP3与胶质芽孢杆菌相似性达到100%且处于同一分支,距离最近,鉴定菌株JWP3为胶质芽孢杆菌。
2.4 菌株解磷能力研究
2.4.1 最适初始接种量 由图3可以看出,从接种量1%开始,随接种量的增加,速效磷含量呈逐渐上升的趋势,当接种量为4%时,菌液中速效磷含量达到最大(96.56 mg/L),比接种量为3.0%时高了17.6 mg/L,有显著性差异,而当接种量达到5%时,解磷量为96.55 mg/L,与4%时无显著性差异,从经济角度考虑,选取4%为最适接种量。
2.4.2 最适初始pH值 不同pH值对菌株生长及解磷能力有显著影响,由图4可看出,当pH值达到7时解磷量达到最大,菌液中的速效磷含量达到97.28 mg/L,与其他pH值时有显著差异,当pH值达到6时解磷能力为74.90 mg/L,比pH值 9时高了2.5 mg/L,而比pH值 8时低了13 mg/L,有显著差异。因此确定,菌株JWP3的最适生长pH值为7,且菌株适合生长于中性或偏碱性的环境中,这对于菌株的大规模生产有重要指导意义。
2.4.3 最适培养温度 温度的变化对菌株的降解作用有显著影响,由图5可看出,随着温度的升高,菌株解磷能力逐渐增强,当温度达到30 ℃时,解磷量达到最高,菌液中的速效磷含量达到112.6 mg/L,比28 ℃时增加了14.6 mg/L,而温度为32 ℃时,解磷量为89.05 mg/L,与28 ℃时相比,显著降低,可能是温度升高导致菌株生长受到抑制,使解磷能力降低,因此确定菌株JWP3的最适生长温度为30 ℃。
2.4.4 最适摇床转速 由图6可看出,不同摇床转速对菌株解磷作用有明显影响,当摇床转速增加时,菌株解磷能力逐渐增加,当转速达到200 r/min时,菌液中速效磷含量最高(114.5 mg/L),当转速达到220 r/min时,解磷能力降低,菌液中速效磷含量为96.77 mg/L,比 200 r/min 时明显减少,二者有显著差异,其原因可能是转速过高,产生的剪切力对菌体造成机械损伤,降低了菌株的解磷能力[15],结果表明菌株JWP3的最适培养转速为200 r/min。endprint
3 讨论
解磷微生物在土壤中磷循环相关的生物学系统中担任着重要的角色,它可以将难溶磷素转化为可溶性磷,提高磷肥利用率。解磷微生物分布十分广泛,但是,在自然條件下,这些解磷微生物在土壤中的数量不足,难以发挥其活性,仅仅依靠自然条件的作用不足以释放满足植物生长发育所需的磷素。因此,人们便设想从自然条件下或生物体内筛选解磷菌株,制成菌剂后回接到土壤中以转化足够的有效磷[9-10]。本试验从周至猕猴桃园根际土壤中筛选出9株具有解磷作用的菌株,采用难溶性磷酸盐Ca3(PO4)2为磷源,对解磷菌株的降解能力进行测定,国内外已有许多关于解磷菌筛选的报道,解磷菌株多为芽孢杆菌和假单胞菌[11],其解磷能力一般在 31.5~519.7 mg/L 范围内[12-13],本试验筛选的菌株JWP3解磷能力为114.5 mg/L,处于中等水平。通过菌株形态特征分析,及16S rDNA测序,并对序列进行比对确定菌株JWP3为胶质芽孢杆菌(Paenibacillus mucilaginosu)。
虽然微生物的溶磷能力取决于自身特征,如分泌质子、有机酸和其他物质的数量和种类[14],但培养条件的不同也影响了菌株的生长情况和降解特性,从陕西周至县猕猴桃园土壤中筛选得到的高效解磷菌株JWP3在最适培养条件下,其解磷能力达到114.5 mg/L。试验表明,菌株JWP3在初始pH值为7,转速200 r/min,培养温度30 ℃的条件下解磷能力最强。接种量的选择,综合了菌株解磷能力及经济效益等因素,接种量为4%时解磷能力达到96.55 mg/L,与5%接种量时的9656 mg/L无显著差异,故确定最适接种量为4%。
目前,大多数研究者认为解磷菌溶解无机磷是因为解磷微生物在新陈代谢过程中产生的各种有机酸[15-17],这些有机酸既能降低土壤pH值,又可通过螯合作用结合土壤中的铁铝钙镁等离子,从而使磷酸铁、磷酸钙、磷酸镁、磷酸铝等难溶性的磷酸盐溶解[18]。Illmer等[10]研究认为假单孢菌属的解磷机制主要是产生质子,降低了培养基的pH值,从而使磷酸盐溶解。解磷菌的解磷机制是很复杂的,一种解磷菌可能有多个解磷机制[19],目前对解磷微生物的解磷机制还不是特别清楚,从猕猴桃园土壤中筛选得到的这株解磷菌株JWP3,其解磷机制还需作进一步深入研究。
4 结论
本研究从周至猕猴桃园采集土样,筛选到129株高效解磷菌,通过复筛和解磷能力的测定,得到1株降解无机磷能力最强的菌株,利用16S rDNA基因序列分析方法对该菌株的分类信息进行鉴定,鉴定结果表明该菌株为胶质芽孢杆菌(Paenibacillus mucilaginosus),命名为菌株JWP3,其解磷量达到了114.5 mg/L,具有较高的解磷能力。通过试验确定了该菌株的最适培养条件:初始接种量4%,摇床转速200 r/min,培养温度30 ℃,初始pH值为7,为菌株的开发利用提供了数据支持和理论基础。
参考文献:
[1]郝 晶,洪坚平,刘 冰,等. 石灰性土壤中高效解磷细菌菌株的分离、筛选及组合[J]. 应用与环境生物学报,2006,12(3):404-408.
[2]Kucey R. Effect of Penicillium bilaji on the solubility and uptake of P and micronutrients from soil by wheat[J]. Canadian Journal of Soil Science,1988,68(2):261-270.
[3]赵小蓉,林启美. 微生物解磷的研究进展[J]. 土壤肥料,2001(3):7-11.
[4]Vassileva M,Azcon R,Barea J M,et al. Effect of encapsulated cells of Enterobacter sp. on plant growth and phosphate uptake[J]. Bioresource Technology,1999,67(3):229-232.
[5]Peix A,Rivas-Boyero A A,Mateos P F,et al. Growth promotion of chickpea and barley by a phosphate solubilizing strain of Mesorhizobium mediterraneum under growth chamber conditions[J]. Soil Biology and Biochemistry,2001,33(1):103-110.
[6]Zaidi A,Khan M S,Amil M. Interactive effect of rhizotrophic microorganisms on yield and nutrient uptake of chickpea(Cicer arietinum L.)[J]. European Journal of Agronomy,2003,19(1):15-21.
[7]Bingquan F,Jiyun J,Cheng G. Isolation of Penicillium oxalicum and its effect on solubilization of insoluble phosphate under different conditions[J]. Scientia Agricultural Sinica,2002,35 (5):525-530.
[8]史国英,莫燕梅,岑贞陆,等. 一株高效解无机磷细菌BS06的鉴定及其解磷能力分析[J]. 微生物学通报,2015,42(7):1271-1278.endprint
[9]Molla M,Chowdhury A A,Islam A,et al. Microbial mineralization of organic phosphate in soil[J]. Plant and Soil,1984,78(3):393-399.
[10]Illmer P,Schinner F. Solubilization of inorganic calcium phosphates-solubilization mechanisms[J]. Soil Biology and Biochemistry,1995,27(3):257-263.
[11]银婷婷,王敬敬,柳 影,等. 高效解磷菌的筛选及其促生机制的初步研究[J]. 生物技术通报,2015,31(12):234-242.
[12]Chen Y P,Rekha P D,Arun A B,et al. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities[J]. Applied Soil Ecology,2006,34(1):33-41.
[13]Park J H,Bolan N,Megharaj M,et al. Isolation of phosphate solubilizing bacteria and their potential for lead immobilization in soil[J]. Journal of Hazardous Materials,2011,185(2/3):829-836.
[14]赵 越,赵 霞,侯佳奇,等. 耐高温解无机磷菌的解磷特性及生长动态研究[J]. 东北农业大学学报,2013,44(8):64-69.
[15]Kpomblekou A K,Tabatabai M. Effect of organic acids on the release of phosphorus from phosphate rocks[J]. Soil Science,1994,158(6):442-448.
[16]Kim K Y,Jordan D,Krishnan H B. Rahnella aquatilis,a bacterium isolated from soybean rhizosphere,can solubilize hydroxyapatite[J]. FEMS Microbiology Letters,1997,153(2):273-277.
[17]楊 芳,何园球,李成亮,等. 不同施肥条件下红壤旱地磷素形态及有效性分析[J]. 土壤学报,2006,43(5):793-799.
[18]刘文干,何园球,张 坤,等. 一株红壤溶磷菌的分离、鉴定及溶磷特性[J]. 微生物学报,2012,52(3):326-333.
[19]闫小梅,虞 丽,叶成龙,等. 一株灰潮土解磷菌的解磷特性及其对花生的促生作用[J]. 中国农学通报,2015,31(26):150-155.endprint
