甘肃牧区风干牦牛肉加工过程中的品质变化
2017-11-21,,,,,,
,, , ,,,
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
甘肃牧区风干牦牛肉加工过程中的品质变化
张丽,马纪兵,王妍,董超,崔文兵,余群力,韩玲
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
为研究甘肃牧区牦牛肉在自然冷冻风干加工过程中品质变化,取甘肃甘南公牦牛半膜肌,在自然风干60 d中采集样本并分析其理化、营养及食用品质变化。结果显示,牦牛肉在风干加工过程中,pH升高,30 d后变化不显著(p>0.05),水分活度(Aw)和水分含量均显著降低(p<0.05),在30 d Aw降至0.46,蛋白、脂肪含量则显著升高(p<0.05)。其必需氨基酸苏氨酸、赖氨酸、亮氨酸和非必需氨基酸甘氨酸、精氨酸、脯氨酸、丝氨酸、谷氨酸和组氨酸含量均高于原料肉,必需氨基酸/氨基酸总量(EAA/TAA)和必需氨基酸/非必需氨基酸(EAA/NEAA)分别为41.17%、69.64%。多不饱和脂肪酸/饱和脂肪酸(P/S)为0.36,稍低于理想值,n-6/n-3为1.95,处于理想值范围。风干加工过程中牦牛肉硬度、内聚性、胶着性和咀嚼性显著升高(p<0.05),弹性及恢复力显著降低(p<0.05)。表明风干牦牛肉基本保留了原料肉的营养成分,是一种高蛋白,耐咀嚼和储藏的半干肉制品。
甘肃牧区,风干牦牛肉,加工,品质变化
牦牛(Bosgrunniens)是高寒地区特有的牛种,主要产于青藏高原海拔3000 m以上的地区,生活在无污染的天然环境中,牦牛肉属于“高蛋白、低脂肪肉类”[1]。风干牦牛肉是以新鲜牦牛肉为原料在低温通风处阴干(多在冬季)而成的肉制品,其水分含量低、体积小、质量轻携带方便,是牧区一种传统的牦牛肉保藏方法。目前,此类产品多在西藏自治区、甘肃省、青海省和四川省等牦牛主产地生产销售,是当地牧民最主要的畜产消费品及招待贵宾和亲朋好友的上等佳肴[2]。肉品在加工过程中增加了肉与氧的接触表面积,与肉中的活性成分(如不饱和脂肪酸、铁离子)作用,使肌肉易于发生蛋白和脂肪氧化,导致其品质下降[3]。如变味、变色、营养成分破坏、产生一些毒性物质是其品质发生劣变的主要特征[4]。
目前针对风干肉加工过程中的品质变化国内已做了大量研究。曾瑜静[5]对内蒙古地区吉尔利阁牛肉在自然冷冻风干8周的研究发现,随水分含量的降低,水分活度在第6周降至0.367,其pH由第1周的5.41升至第8周的5.70。高媛[2]模拟青藏高原地区冬季风干环境(白天温度为0~4 ℃,湿度为70%±5%,晚间温度为-16~-12 ℃,湿度为50%±5%),将甘肃甘南州牦牛原料肉和风干25 d牦牛肉进行了氨基酸与脂肪酸评价对比,结果显示,风干牦牛肉的氨基酸和脂肪酸总量分别高于原料肉,EAA/TAA为39.45%,EAA/NEAA为65.15%,脂肪酸P:S为0.32(接近理想模式),n-6∶n-3为1.4(处于理想范围)。饶伟丽等[6]研究热风干燥温度对风干肉品质的影响,选取内蒙古小尾寒羊米龙在不同干燥温度进行风干,结果表明,风干肉硬度、弹性、内聚性和咀嚼性均随风干温度的升高而呈上升趋势。国外对传统腌制牛肉等加工中的研究发现pH也呈现上升趋势[6],但国外针对风干肉研究鲜有报道。目前围绕甘肃牧区风干牦牛肉,在为期60 d的风干加工过程中,从理化指标、营养品质以及食用品质角度分析其品质变化规律的研究目前未见报道。
本研究以甘肃省甘南州牦牛半膜肌为研究对象,利用甘南冬季低温低压的特殊自然气候条件自然风干0~60 d,分析风干牦牛肉加工过程中理化指标、营养品质和食用品质变化,明确其品质形成规律,旨在为传统风干牦牛肉加工过程中标准化生产和品质控制提供理论依据。
1 材料与方法
1.1材料与设备
选取甘肃省甘南州自然放牧下健康、无病的3~4岁公牦牛半膜肌,剔除表面的筋膜、脂肪,切成截面为2 cm×2 cm的条状,在甘肃省甘南州夏河县选择避光、能够自然通风的冻干室(室内温度-10~-15 ℃,相对湿度50%~75%),将肉吊挂于铁丝上,相邻两条肉之间保持1~2 cm的距离,在风干加工第0、2、4、6、8、10、15、20、25、30、40、50、60 d时采集样品;甲醇(色谱纯) 购自美国Sigma公司;硫酸铜、硫酸钾、浓硫酸、盐酸、硼酸、甲基红、次甲基蓝、石油醚、正己烷、三氟化硼甲醇 均为分析纯,购自国药集团化学试剂有限公司。
BS200S-WEI分析天平 北京赛多利斯天平有限公司;DHG-9123A型电热恒温鼓风干燥箱 上海精宏实验设备有限公;1765半微量定氮蒸馏器 天长市长城玻璃仪器制造厂;索氏抽提器 天长市长城玻璃仪器制造厂;HD-3A型智能水分测量仪 无锡市华科仪器仪表有限公司电子天平;PHB-4型便携式酸度计 南京科环分析仪器有限公司;HHS-4电子数显恒温水浴锅 北京科伟永兴仪器公司;L-8900高速氨基酸分析仪 株式会社-日立高新技术;Agilent 7890A-5975C气-质联用仪、色谱柱 美国安捷伦科技有限公司;TA.XT Express质构仪 英国Stable Micro Systems公司。
1.2实验方法
1.2.1 实验设计 以甘肃省甘南州公牦牛半膜肌为研究对象,利用甘肃省甘南州夏河县冬季(2016年1月至3月)低温低压的特殊自然气候条件自然风干0、2、4、6、8、10、15、20、25、30、40、50、60 d,分别测定其pH、水分活度、水分含量、蛋白含量、脂肪含量、氨基酸、脂肪酸以及质构特性,并分析传统风干牦牛肉在加工过程中品质变化规律。
1.2.2 测定方法
1.2.2.1 pH测定 参照GB/T 9695.5-2008[8],将风干肉充分绞碎并恢复至室温,称取10 g左右的样品于150 mL烧杯,加入100 mL 0.1 mo1/L的氯化钾溶液,混合均匀后,用已校正的pH计插入混合样品中央,待读数稳定后,记下读数。
1.2.2.2 水分活度测定 按照GB/T 23490-2009水分活度仪扩散法测定[9]。
1.2.2.3 水分含量测定 参考GB/T 5009.3-2010《食品安全国家标准 食品中水分的测定》中的直接干燥法进行测定[10]。
1.2.2.4 蛋白质测定 按照GB/T 5009.5-2010《食品中蛋白质的测定》半微量凯氏定氮法测定[11]。
1.2.2.5 粗脂肪测定 参考GB/T 5009.6-2003《食品中粗脂肪的测定》索氏抽提法进行测定[12]。
1.2.2.6 氨基酸测定 参考GB/T 18654.11-2008《肌肉中主要氨基酸含量的测定》的方法测定[13]。
1.2.2.7 脂肪酸含量测定 参考GB/T 22223-2008[14],应用脂肪酸甲酯的气相色谱分析法,采用气-质联用仪对样品进行脂肪酸测定。色谱条件:以氦气为载气,起始柱温100 ℃,持续 5 min,以5 ℃/min的速度升至170 ℃,持续5 min;以5 ℃/min的速度升至 200 ℃,持续 20 min;以 5 ℃/min的速度升至230 ℃,持续8 min。进样器温度 250 ℃,检测器温度260 ℃。分流进样10∶1,进样量为1 μL。质谱条件:EI 离子源,电子能量 70 eV,质量扫描范围 33~450 u,四级杆温度140 ℃,离子源温度 240 ℃,GC(gas chromatography)/MS(mass spectrum)接口温度250 ℃。
1.2.2.8 TPA测定 参考李真等[15]的方法略作修改,将风干牦牛肉沿着垂直纤维的方向1 cm×1 cm×1 cm的肉样,采用TA.XT Express质构特性仪进行测定,以“二次压缩”模式进行质地剖面分析。测定参数:测试前速率:2.0 mm/s;测试速率:2.0 mm/s;测试后速率:10.0 mm/s;二次下压间隔时间5 s;感应力10 g。
1.3数据处理
采用Excel 2007软件对数据进行平均值和标准偏差的统计分析并作图,用SPSS 19.0软件Duncan法进行数据的显著性分析(p<0.05)。
2 结果与分析
2.1pH变化
肉品加工过程中pH变化与肉制品的品质密切相关,可间接反映微生物的生长状态[16],风干牦牛肉加工过程中pH变化如图1所示。

图1 风干牦牛肉加工过程中pH变化Fig.1 The change of pH during processing of dried yak meat注:图中小写字母不同表示差异显著(p<0.05),图2~图6同。
由图1可知,牦牛肉在自然冷冻风干过程中pH由5.41升高到5.71,从风干第0~30 d变化差异显著(p<0.05),这与Vilar[7]对西班牙传统腌制牛肉加工过程中pH变化规律基本一致。这可能是由于在微生物作用下,肌间的蛋白质分解产生了一些碱性物质导致牦牛肉的pH升高[16],也可能是由于加工过程中牛肉中脂肪的氧化,脂肪酸分解生成醛、酮等小分子物质,使游离脂肪酸总量下降导致pH升高[5]。
2.2水分活度变化
水分活度是影响食品中微生物生长和产品货架期的重要因素,水分活度越低,微生物越不易生长,产品货架期越长[17]。风干牦牛肉在加工过程中水分活度变化如图2所示。
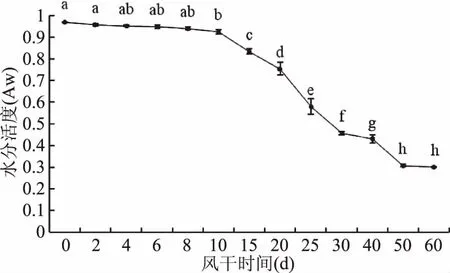
图2 风干牦牛肉加工过程中水分活度的变化Fig.2 The change of water activity during processing of dried yak meat
图2显示,牦牛肉在风干过程中水分活度随加工时间延长呈下降趋势,由最初的0.969降低到60 d时的0.301,下降了68.94%,10~60 d变化显著(p<0.05)。这与高媛[2]对牦牛肉在风干25 d过程中水分活度的研究结果变化趋势基本一致。各类不同的微生物与水分活度的关系主要体现在临界点上,细菌水活>0.9,酵母菌>0.87,霉菌>0.8,当环境中的水分活度低于其临界水分活度时微生物的生长会十分缓慢甚至趋于停滞状态[18]。研究表明当水分活度小于0.50时任何微生物都不能生长[5],本研究发现,牦牛肉在风干30 d时水分活度降至0.46,低于微生物生长临界值,食品中的水分为游离水和结合水,水分活度降低主要是由于自由流动水含量下降造成的[19]。
2.3水分含量变化
风干牦牛肉在加工过程中水分含量变化如图3所示。
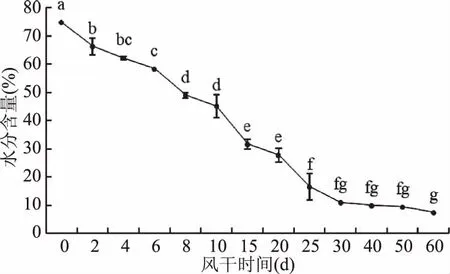
图3 风干牦牛肉加工过程中水分含量的变化Fig.3 The change of moisture content during processing of dried yak meat
由图3可知,随加工过程的进行,牦牛肉水分含量呈下降趋势,由最初的74.64%降低到60 d时的7.37%,下降了67.27%,在0~25 d变化显著(p<0.05),25~60 d变化不显著(p>0.05),耿兄[20]追踪内蒙古吉尔利阁牛在为期75 d的自然风干过程中水分含量变化也有类似规律。肌肉中水分有三种存在形式,自由水约占肌肉10%,60%左右为不易流动水,其余为结合水约为4%[21],牦牛肉在冷冻风干过程中,当内部水分扩散的速度大于等于其表面蒸发速度时,牛肉条进入恒速干制阶段,当牛肉中水分的扩散速度与其表面水分达到负平衡状态时,此时干制进入减速阶段[2]。
2.4蛋白含量变化
风干牦牛肉在加工过程中蛋白相对含量变化如图4所示。
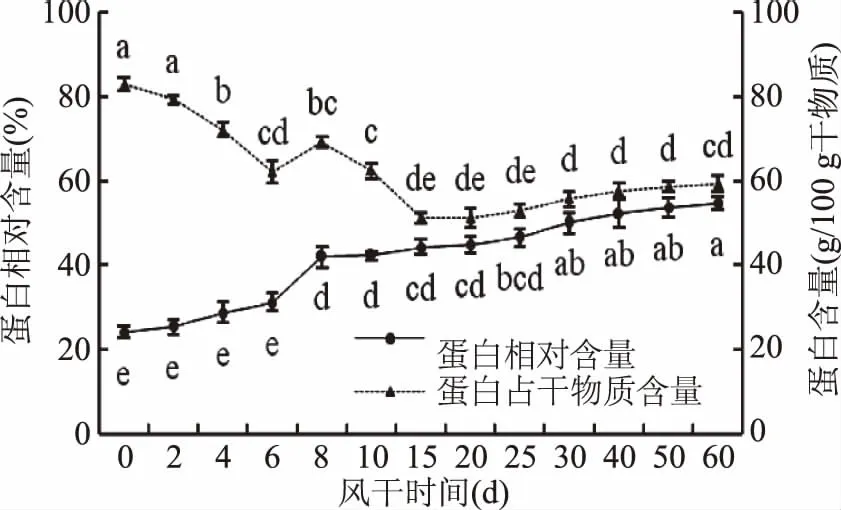
图4 风干牦牛肉加工过程中蛋白含量的变化规律Fig.4 The change of protein content during processing of dried yak meat
由图4知,随风干加工时间延长,牦牛肉蛋白相对含量呈上升趋势,原料肉蛋白含量约为22.15%,风干60 d时达到54.65%,增加了32.35%。30~60 d差异不显著(p>0.05),风干60 d时蛋白相对含量显著高于25 d(p<0.05),极显著高于0~15 d(p<0.01),蛋白质占干物质的含量则呈现下降趋势,60 d时显著低于0~4 d(p<0.05),15~60 d变化不显著(p>0.05),牦牛肉在风干加工过程中随水分散失,蛋白相对含量升高,表明风干牦牛肉是一种高蛋白半干肉制品。
2.5脂肪含量变化
风干牦牛肉在加工过程中脂肪相对含量变化如图5所示。

图5 风干牦牛肉加工过程中脂肪含量的变化规律Fig.5 The changes of fat content during processing of dried yak meat
由图5可知,随风干加工时间延长,牦牛肉脂肪相对含量逐渐升高,风干0 d时,脂肪含量为3.36%,至60 d时,脂肪含量变为10.69%,增加了7.33%。风干60 d时的脂肪含量显著高于25 d(p<0.05),极显著高于0~15 d(p<0.01),30~60 d脂肪含量差异不显著(p>0.05),其脂肪占干物质含量总体呈现下降趋势,60 d时显著低于0~4 d(p<0.05),6~60 d变化不显著(p>0.05)。牦牛肉在自然冷冻风干期间水分含量降低,导致肌内脂肪沉积,脂肪相对含量增加。
2.6风干牦牛肉与原料肉氨基酸含量
氨基酸的种类和数量是评价蛋白质营养价值高低的重要指标,也是影响肉品质的重要因素[22],风干牦牛肉与原料肉氨基酸组成及含量如表1所示。
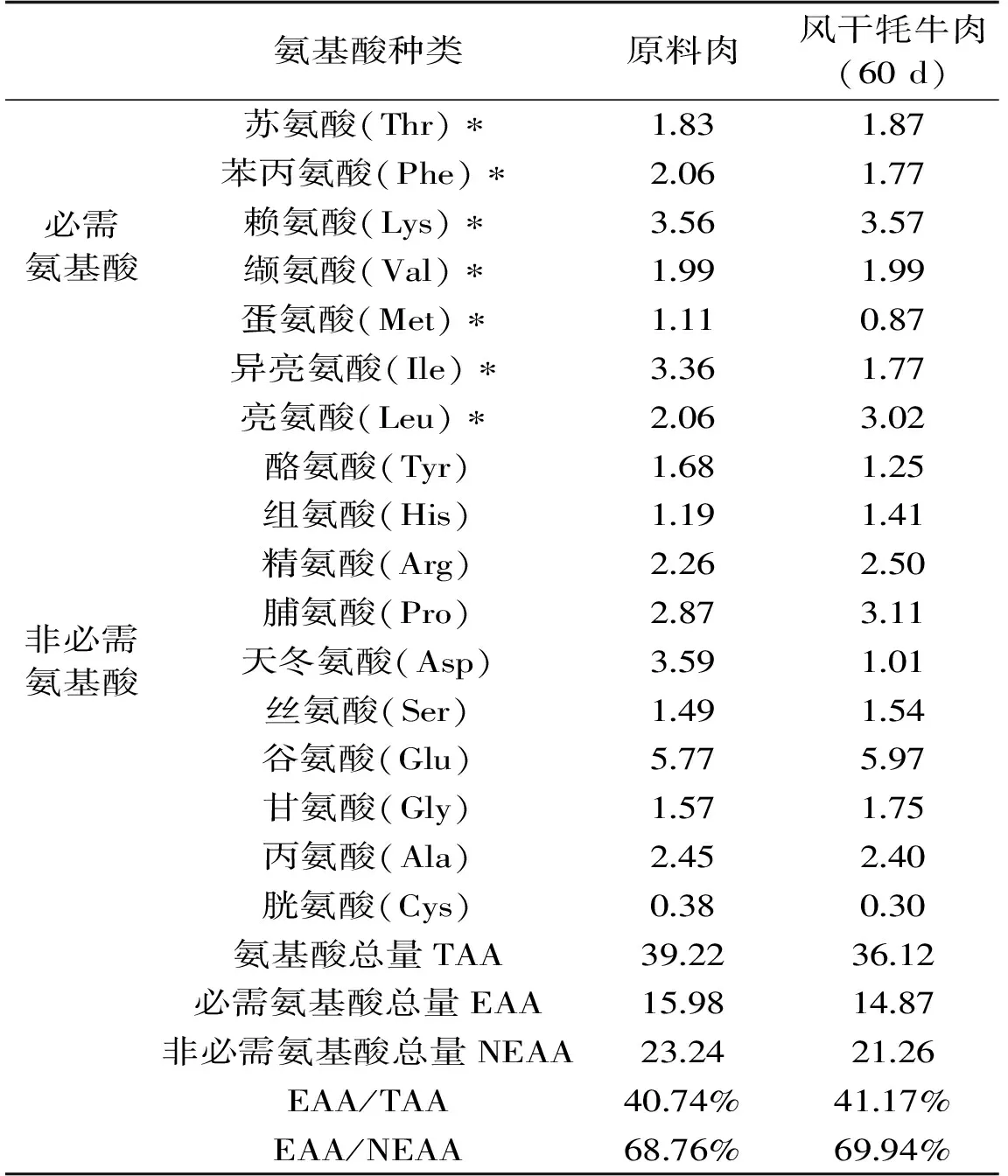
表1 原料肉与风干牦牛肉氨基酸含量(g/100 g干物质)Table 1 Amino acid contents in raw material and airing yak meat(g/100g dry material)
注:“*”表示必需氨基酸。
由表1可知,风干牦牛肉中共检测出水解性氨基酸十七种,其中九种含量均高于原料肉,氨基酸总量为36.12 g/100 g,比原料肉低3.10 g/100 g。本研究显示,风干牦牛肉必需氨基酸中苏氨酸、赖氨酸、亮氨酸含量均高于原料肉。非必需氨基酸中的甘氨酸、精氨酸、脯氨酸、丝氨酸、谷氨酸和组氨酸是形成肉制品香味所必需的前体氨基酸,与肉质的鲜味有直接关系[23-24],且在风干牦牛肉中的含量均高于原料肉,其中谷氨酸含量最高,为5.97 g/100 g,占鲜味氨基酸总量的40.15%,是最主要的鲜味物质,具有形成肉鲜味和缓冲咸与酸等味道的特殊功效[25]。风干牦牛肉中组氨酸含量为1.41 g/100 g,比原料肉高0.22 g/100 g,组氨酸对幼儿是必需氨基酸,也是尿毒症患者的必需氨基酸,组氨酸脱羧后形成组胺,具有很强的血管舒张作用[26]。
根据FAO/WHO的模式标准,质量较好的蛋白质组成中EAA/TAA应在40%左右,EAA/NEAA应在60%以上。原料肉与风干牦牛肉的EAA/TAA分别为40.74%、41.17%,EAA/NEAA分别为68.76%、69.94%,可以判断风干牦牛肉保留了原料肉的营养成分,是优质蛋白质来源。
2.7原料肉与风干牦牛肉脂肪酸含量
通过GC-MS对原料肉和风干牦牛肉脂肪酸进行测定,其组成及含量如表2所示。由表2可知,牦牛肉中SFA含量在脂肪酸中所占比例最大,达到了45.43%,这是由于反刍动物在瘤胃微生物的作用下,可将饲料中不饱和脂肪酸氢化为饱和脂肪酸,且在空肠后部能较好地吸收长链脂肪酸和饱和脂肪酸的原因[25],Bas等[27]检测了影响羊肉中脂肪酸含量的因素,结果表明草饲可提高肉豆蔻酸、硬脂酸的含量。风干牦牛肉的SFA含量比原料肉高2.98%。

表2 原料肉与风干牦牛肉脂肪酸组成Table 2 The composition of fatty acid in raw material and airing yak beef
注:表中数据为各脂肪酸占总脂肪酸相对含量(%)。
风干牦牛肉的MUFA含量高于原料肉,其中二十碳五烯酸和富马酸差异不大,棕榈油酸含量降低,油酸含量比原料肉高2.29%。油酸是牦牛肉中单不饱和脂肪酸的主要组成部分,也是单不饱和脂肪酸中最具代表性的一种脂肪酸,它具有降低低密度脂蛋白胆固醇,预防动脉硬化的效果。多不饱和脂肪酸具有多种特殊的生物活性,在生物系统中有着广泛功能,对于稳定细胞膜功能、调控基因表达、维持细胞因子和脂蛋白平衡、抗心血管疾病以及促进生长发育等方面起着重要作用[26]。原料肉经风干后PUFA 含量下降,亚油酸、α-亚麻酸、花生四烯酸、二十碳三烯酸、二十碳五烯酸和DHA分别下降了1.00%、0.29%、0.95%、0.93%、0.48%、0.31%。
对脂肪酸营养价值进行评价时,通常可以用多聚不饱和脂肪酸和饱和脂肪酸的比例(P:S)来衡量,WHO推荐标准为最好高于0.40为佳[28]。另外,研究发现,肉制品PUFA中n-6/n-3与各种疾病的发病率呈正相关,n-6/n-3已成为当前评价肉品营养价值的重要参考指标[28-29]。风干牦牛肉的P:S分别为0.36,稍低于理想值,原料肉和风干牦牛肉的n-6/n-3分别为2.03和1.95,此比例符合Enser等[30]建议的n-6/n-3应小于4,且与目前大多数研究认为的较低的n-6/n-3比值对降低许多慢性疾病的效果会更好[31]。
2.8质构特性变化
通过TPA 压缩方法进行测量风干牦牛肉在加工过程中质构特性变化,结果如图6所示。
研究表明感官性状与质构特性指标之间有显著的相关关系,可以用仪器分析结果代替感官评定[32]。由图6可知,牦牛肉在自然冷冻风干过程中硬度、内聚性、胶着性均呈显著上升趋势(p<0.05),咀嚼性是硬度、弹性及内聚性的综合体现,反映了肉干从咀嚼到吞咽的整个过程中需要消耗的能量,其原理是模拟了人类牙齿的咀嚼动作,并量化了咀嚼性的感觉,相当于感官评价时肉干具有的咬劲感,其值越大,表明肉干的质构特性越好[33],本研究牦牛肉在风干加工过程中咀嚼性最终达到了1288.39,增加了1229.16,在4~40 d变化差异显著(p<0.05),李真等[15]针对熏马肉干的研究发现,随水分含量降低,咀嚼性增加,其变化趋势与本研究一致。弹性和回复力则显著减小(p<0.05),这是由于牦牛肉在风干过程中水分含量降低,肌束收缩使得缝隙变大,紧密结构遭到破坏[34]。由此看出牦牛肉经风干后赋予其较好的品质和口感。
3 结论
牦牛肉在风干加工过程中,pH升高,风干后期变化不显著,水分活度持续降低,在风干30 d达0.46小于微生物生长临界值0.50,表明牦牛肉在风干后期微生物生长基本处于停滞状态。
随风干时间延长,牦牛肉水分含量显著降低,蛋白、脂肪含量显著升高(p<0.05)。风干牦牛肉氨基酸总量小于原料肉,必需氨基酸苏氨酸、赖氨酸、亮氨酸和非必需氨基酸甘氨酸、精氨酸、脯氨酸、丝氨酸、谷氨酸和组氨酸含量均高于原料肉,风干牦牛肉与原料肉的EAA/TAA分别为41.17%、40.74%,EAA/NEAA 分别为69.94%、68.76%,可以判断风干牦牛肉保留了原料肉的营养成分,是优质蛋白质来源。对脂肪酸营养价值进行评价,风干牦牛肉的P:S分别为0.36,稍低于理想值,原料肉和风干牦牛肉的n-6/n-3为2.03和1.95,处于理想值范围。
随风干时间延长,牦牛肉硬度、内聚性、胶着性和咀嚼性显著升高(p<0.05),弹性以及恢复力显著降低(p<0.05)。
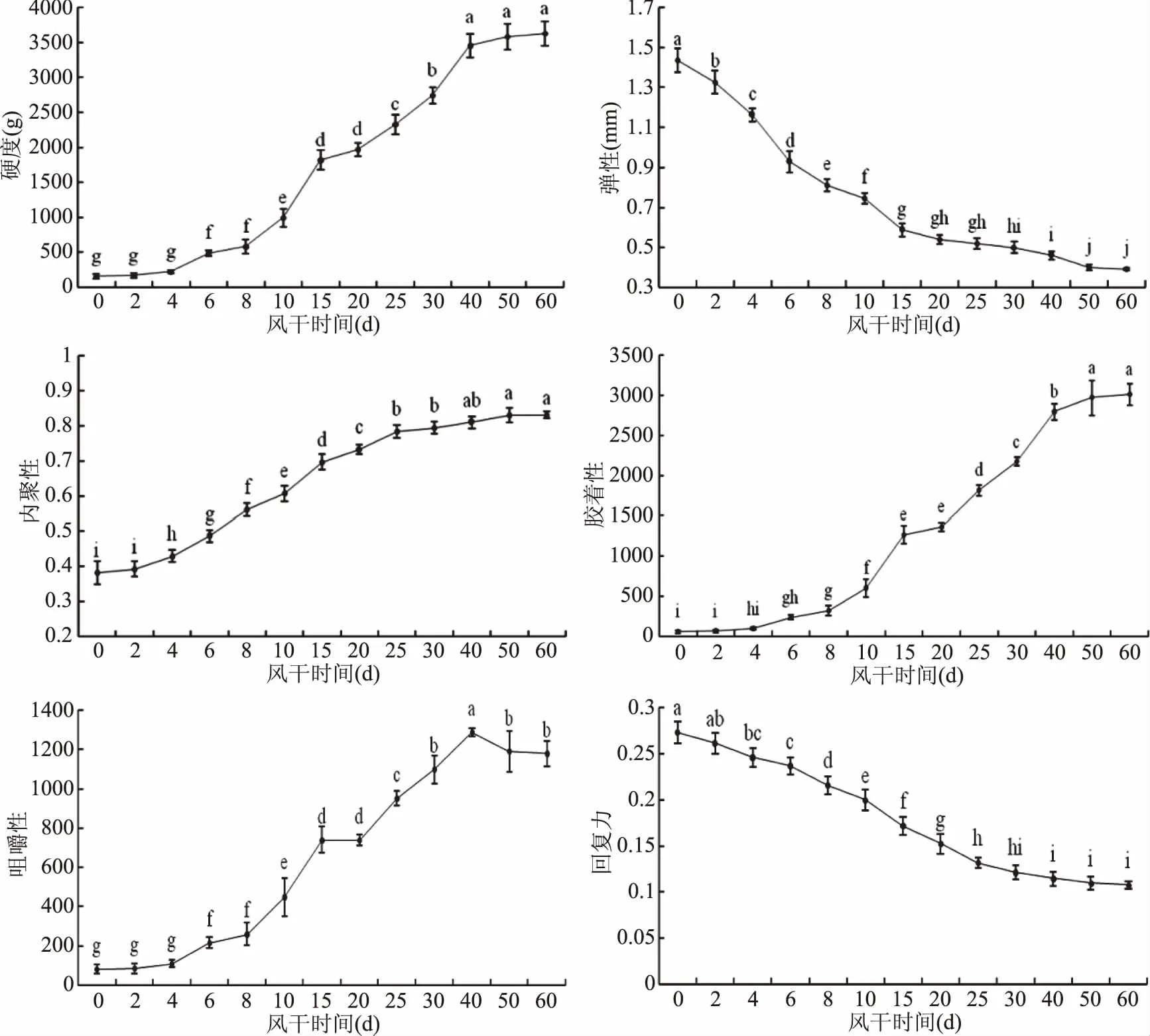
图6 风干牦牛肉加工过程中质构特性变化Fig.6 The change of texture profile analysis during processing of dried yak meat
[1]闫利国,唐善虎,王柳,等. 冷冻贮藏过程中氧化诱导牦牛肉肌原纤维蛋白结构的变化[J]. 食品科学,2015,36(24):337-342.
[2]高媛. 风干牦牛肉品质形成规律与工艺改进技术研究[D].北京:中国农业科学院,2013.
[3]Gray J I,Gomaa E A,Buckley D J. Oxidative quality and shelf life of meats[J]. Meat Science,1996,43(12):111-116.
[4]Johns A M,Birkinshaw L H,Ledward D A. Catalysts of lipid oxidation in meat products[J]. Meat Science,1989,25(3):209-220.
[5]曾静瑜. 自然冷冻风干牛肉品质形成与微生物变化规律的研究[D]. 呼和浩特:内蒙古农业大学,2014.
[6]饶伟丽,王振宇,辛建增,等. 热风干温度对风干肉品质和加工能耗的影响[J]. 肉类研究,2017,31(1):13-18.
[7]Vilar I,Fontán M C G,Prieto B,et al. A survey on the microbiological changes during the manufacture of dry-cured lacón,a Spanish traditional meat product[J]. Journal of Applied Microbiology,2000,89(6):1018-1026.
[8]GB/T 9695.5-2008,肉与肉制品pH测定[S]. 2008.
[9]GB/T 23490-2009,食品水分活度的侧定[S].2009.
[10]GB/T 9695.15-2008,肉与肉制品水分含量侧定[S].2008.
[11]GB 5009.5-2010,食品中蛋白质的测定[S].2010.
[12]GB/T 5009.6-2003,食品中粗脂肪的测定[S].2003.
[13]GB/T 5009.124-2003,食品中氨基酸的测定[S].2003.
[14]GB/T 22223-2008,食品中总脂肪、饱和脂肪(酸)、不饱和脂肪(酸)的测定,水解提取-气相色谱法[S].2008.
[15]李真,刘雅娜,苏里阳,等. 干燥工艺对熏马肉干品质的影响[J]. 肉类研究,2016,30(2):10-14.
[16]于英杰. 牛肉新鲜度检验指标的研究[D]. 长春:吉林大学,2006.
[17]Juneja V K,Valenzuela-Melendres M,Heperkan D,et al. Development of a predictive model for Salmonella,spp. reduction in meat jerky product with temperature,potassium sorbate,pH,and water activity as controlling factors[J]. International Journal of Food Microbiology,2016,236:1-8.
[18]张朦. 水活度用于食品微生物安全检验控制的研究[D]. 武汉:华中农业大学,2013.
[19]伍玉洁,杨瑞金,刘言宁. 水分活度对干制虾仁产品的货架寿命和质构的影响[J]. 水产科学,2006,25(4):175-178.
[20]耿兄. 自然冷冻风干牛肉工艺环境调查及改进[D]. 呼和浩特:内蒙古农业大学,2014.
[21]周光宏. 畜产品加工学[M]. 农业出版社,2002.
[22]刘海珍. 青海牦牛、藏羊的肉品质特性研究[D]. 兰州:甘肃农业大学,2005.
[23]Xiang X,Ye Y,Zhou X,et al. Digestive ability and nutritive value of Silurus asotus[J]. Chinese Journal of Zoology,2004,39:65-69.
[24]孙寿永,张浩. 海门山羊不同部位肌肉中氨基酸含量的研究[J]. 中国畜牧兽医,2012,39(12):77-81.
[25]张永辉. 大通牦牛肉质特性研究[D]. 兰州:甘肃农业大学,2009.
[26]Schmid U,Bornscheuer U T,Soumanou M M,et al. Optimization of the reaction conditions in the lipase-catalyzed synthesis of structured triglycerides.[J]. Journal of the American Oil Chemists Society,1998,75(11):1527-1531.
[27]Bas P,Morand-Fehr P. Effect of nutritional factors on fatty acid composition of lamb fat deposits[J]. Livestock Production Science,2000,64(1):61-79.
[28]Simopoulos A P. Omega-6/omega-3 essential fatty acid ratio and chronic diseases.[J]. Food Reviews International,2004,20(1):77-90.
[29]Realini C E,Guàrdia M D,Díaz I,et al. Effects of acerola fruit extract on sensory and shelf-life of salted beef patties from grinds differing in fatty acid composition.[J]. Meat Science,2015,99:18-24.
[30]Enser M,Hallett K G,Hewett B,et al. Fatty acid content and composition of UK beef and lamb muscle in relation to production system and implications for human nutrition[J]. Meat Science,1998,49(3):329-341.
[31]刘兰,刘英惠,杨月欣. WHO/FAO新观点:总脂肪&脂肪酸膳食推荐摄入量[J]. 中国卫生标准管理,2010,1(3):67-71.
[32]张婷,吴燕燕,李来好,等. 咸鱼品质的质构与感官相关性分析[J]. 水产学报,2013,37(2):303-310.
[33]明建,李洪军. 不同酶嫩化处理对牛肉物性的影响[J]. 食品科学,2008,29(12):156-159.
[34]张春晖,李侠,李银,等. 低温高湿变温解冻提高羊肉的品质[J]. 农业工程学报,2013,29(6):267-273.
Qualitychangeduringprocessingof
driedyakmeatinpastoralareasofGansu
ZHANGLi,MAJi-bing,WANGYan,DONGChao,CUIWen-bing,YUQun-li,HANLing
(College of Food Science and Engineering,Gansu Agriculture University,Lanzhou 730070,China)
To study the quality change of yak meat during natural freeze-drying process in Gansu pastoral area. The semimembranosus were selected to analyse the changes of the physicochemical,nutritive and edible quality during spontaneous freeze-drying 0~60 d. The results showed that pH was increased and not significant after freeze-drying for 30 d(p>0.05),the water activity(Aw)and the moisture content were significantly decreased(p<0.05),and Aw down to 0.46 at 30 d. With the extension of processing time,the content of protein and fat increased significantly(p<0.05). The content of essential amino acids,threonine,lysine,leucine and nonessential amino acids,glycine,arginine,proline,serine glutamic acid and histidine in dried yak meat were higher than those in raw meat. The EAA/TAA(essential amino acids/total amino acids)and the EAA/NEAA(essential amino acids/non essential amino acids)in dried yak meat were 41.17% and 69.64% respectively. Evaluation of nutrition value of fatty acids showed that the P:S(polyunsaturated fatty acid/saturated fatty acid)in dried yak meat was 0.36,slightly lower than the ideal value. It’s n-6/n-3 was 1.95,which was in the ideal range. The hardness,cohesiveness,cohesiveness and chewiness of dried yak meat increased significantly(p<0.05),and the elastic and resilience decreased significantly(p<0.05). It showed that the dried yak meat basically retains the nutrients of raw meat,which was a high protein,chewy and storable semi dry meat product.
Gansu pastoral areas;dried yak meat;processing;quality change
2017-04-18
张丽(1979-),女,博士,副教授,研究方向:动物性食品营养与工程,E-mail:zhanglwubd@163.com。
国家自然基金地区基金项目(31660469);甘肃省“陇原青年创新人才扶持计划”项目;国家现代农业(肉牛牦牛)产业技术体系资助项目(CARS-38)。
TS251
A
1002-0306(2017)21-0001-07
10.13386/j.issn1002-0306.2017.21.001
