布鲁菌铁转录调控因子rirA基因突变株的构建与鉴定
2017-11-16陈创夫李天森王远志刘志强
王 震,王 勇,张 倩,陈创夫*,郭 飞,李天森,张 辉,王远志,刘志强,3*
(1.石河子大学兵团动物疾病防控重点实验室,新疆石河子832000;2.石河子大学新疆地方与民族高发病教育部重点实验室,新疆石河子 832000;3.新疆畜牧科学院兽医研究所,新疆乌鲁木齐 830000)
研究论文
布鲁菌铁转录调控因子rirA基因突变株的构建与鉴定
王 震1△,王 勇1△,张 倩1,2,陈创夫1,2*,郭 飞2,李天森1,张 辉1,王远志2,刘志强1,3*
(1.石河子大学兵团动物疾病防控重点实验室,新疆石河子832000;2.石河子大学新疆地方与民族高发病教育部重点实验室,新疆石河子 832000;3.新疆畜牧科学院兽医研究所,新疆乌鲁木齐 830000)
为了构建牛布鲁菌S2308(简称S2308)的铁转录调控因子rirA基因突变株(S2308ΔrirA),探讨该基因对自身生长的影响以及其对不同类型细胞黏附侵袭和胞内繁殖的作用。利用同源重组和抗性替换的方法,以卡那抗性基因替换rirA基因,获得突变株S2308ΔrirA。将亲本株S2308、疫苗株RB51和突变株S2308ΔrirA在相同营养条件下培养,观察其振荡培养时的生长变化趋势和静置培养时的聚集状态。将各菌株侵染人胚胎滋养层细胞(HPT-8)和小鼠巨噬细胞(RAW264.7),分别检测其黏附侵袭能力和胞内生存能力。结果显示,成功获得了布鲁菌rirA基因突变株且10代内未发生回复性突变;与亲本株相比,S2308ΔrirA在相同体外培养条件下其生长趋势未发生明显改变,且其凝集状态与亲本株类似;黏附侵袭试验显示,S2308ΔrirA对HPT-8细胞的黏附侵袭能力显著强于亲本株,而其对RAW264.7的黏附侵袭能力在一定程度上弱于亲本株;布鲁菌胞内生存试验发现,布鲁菌侵染HPT-8细胞24 h后,其胞内细菌数量显著升高,而侵染巨噬细胞24 h后,S2308ΔrirA的繁殖能力明显低于亲本株。这些结果表明,铁转录调控因子rirA基因参与了布鲁菌胞内寄生的过程,并与菌株的毒力强弱存在密切联系。
布鲁菌;铁转录调控因子;人胚胎滋养层细胞;小鼠巨噬细胞
布鲁菌病(Brucellosis)简称布病,是由布鲁菌(Brucella)引起的世界范围内的人兽共患传染病[1]。自20世纪80年代末,全球就有170多个国家和地区存在人兽布鲁菌病。该病可引起人的波浪热、慢性感染以及动物的流产和睾丸炎等,至今尚无根治方法。布鲁菌病每年在我国引起的经济损失高达数亿元;严重威胁着我国经济建设、人民生活健康和国家安全。
布鲁菌作为一种胞内寄生菌,其没有经典的毒力因子[2-3],如荚膜、外毒素、菌毛和质粒等。布鲁菌的毒力因子是一个复杂的病原体分子网络,其毒力因子的筛选主要取决于其在不同宿主细胞内的生存和繁殖能力[4-5]。目前通过细胞模型或小鼠动物模型成功筛选到200多个布鲁菌毒力基因,功能上可划分为12类;金属离子摄取系统作为布鲁菌的重要毒力因子,不仅指导细菌进入细胞内特定的位点,也是各种酶所必需的共同因子。
铁载体基因是维持布鲁菌铁代谢动态平衡必不可少的毒力因子。布鲁菌比较蛋白质组学研究显示,强弱毒株间的铁离子摄取相关蛋白表达发生显著改变[6]。然而,布鲁菌铁离子的新陈代谢是如何被调控并影响细菌毒力的机制尚不清楚。因此,本研究构建布鲁菌铁转录调节因子rirA基因缺失株,并对其自身生长特性及其在不同细胞内的黏附侵袭和胞内生存能力进行评估,为进一步揭示布鲁菌铁代谢调控机制及其胞内寄生机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、细胞和载体 pMD19-T(sample)载体,TaKaRa公司产品;大肠埃希菌(Escherichiacoli)DH5α、牛布鲁菌(Brucellaabortus2308)标准株、牛布鲁菌疫苗株RB51、人胚胎滋养层细胞(HPT-8)和小鼠巨噬细胞(RAW264.7),兵团动物疫病防控重点实验室保存;pUC19K载体,北京军事医学科学院惠赠。
1.1.2 主要试剂 布鲁菌液体培养基(BrucellaBroth)、布鲁菌固体培养基(BrucellaAgar),美国BD公司产品;氨苄青霉素、卡那青霉素,Sigma公司产品,DMEM培养基、胎牛血清,GIBCO公司产品;0.22 μm滤器,美国Milipore公司产品;细胞培养板,COSTAR公司产品;TaqDNA聚合酶、Pfu DNA聚合酶、DNA Marker,TaKaRa公司产品;质粒小提取试剂盒、dNTP、琼脂糖凝胶DNA回收试剂盒,天根生化科技有限公司产品;其他试剂为国产分析纯。
1.1.3 引物 参照GenBank上公布的卡那抗性基因Kan序列和牛布鲁菌标准株2308的rirA基因(BAB2-0678)序列,使用Primer 5引物设计软件设计相应的引物(表1),引物由北京华大基因公司合成。

表1 引物和序列Table 1 Primers and sequences
1.2 方法
1.2.1 目的基因的高保真扩增 以牛布鲁菌2308的基因组为模板,分别用rirA-N-F、rirA-N-R和rirA-C-F、rirA-C-R引物高保真扩增rirA基因的上、下游同源臂。同时用含有卡那抗性的PUC19K质粒为模板,以Kan-F、Kan-R为引物扩增Kan基因。扩增后的产物于15 g/L琼脂糖凝胶中进行电泳,特异性目的条带用康为世纪的普通琼脂糖凝胶DNA回收试剂盒回收。回收产物置于-20℃保存备用。
1.2.2 布鲁菌rirA基因突变株自杀载体的构建 以胶回收的rirA基因上游同源臂、卡那抗性基因和rirA下游同源臂按含量1∶1∶1混合作为模板进行融合扩增;以第一轮PCR的反应产物为模板,以rirA-N- F和rirA-C-R为引物进行第二轮PCR扩增,扩增产物琼脂糖凝胶电泳后进行胶回收。将回收的DNA片段与pMD19-T载体连接后,转化DH5α感受态细胞,并涂布氨苄抗性LB固体平板,过夜培养后挑取单菌落,进行菌液PCR鉴定,将PCR鉴定正确的菌液和质粒送华大基因有限公司进行测序分析。
1.2.3 布鲁菌rirA基因突变株的构建与初步鉴定 取重组自杀质粒电转化布鲁菌2308感受态细胞中,活化后涂布含氨苄和卡那霉素抗性的布鲁菌固体培养基,37℃培养24 h~72 h,筛选单克隆。以rirA-N-F和Kan-R为引物进行PCR初步鉴定。
1.2.4 布鲁菌rirA基因突变株的遗传稳定性检测 将筛选的阳性布鲁菌突变株经过10次反复传代培养后,分别用外部检测引物(rirA-外检-F/rirA-外检-R)和内部检测引物(rirA-内检-F/rirA-内检-R)对布鲁菌进行PCR鉴定和遗传稳定性分析。检测该缺失株有没有发生回复性突变现象,并对其进行常规的生态学观察。
1.2.5 布鲁菌生长曲线分析 从布鲁菌固体培养基上挑取牛布鲁菌S2308、RB51以及S2308ΔrirA基因突变株的单菌落,接种于布鲁菌液体培养基中,37℃、170 r/min振荡培养至OD 600 nm≈0.6,然后分别将菌液稀释到OD 600 nm≈0.1,置于37℃、170 r/min恒温摇床进行培养。培养过程中每2 h取样1次,每次取样20 μL菌液,用终浓度为40 g/L的甲醛灭活10 min,检测OD 600 nm的变化,直至细菌进入平台期,绘制S2308、RB51以及S2308ΔrirA的生长曲线。
1.2.6 布鲁菌聚集现象的观察 从布鲁菌固体培养基上挑取牛布鲁菌S2308、RB51以及S2308ΔrirA基因突变株的单菌落,接种于布鲁菌液体培养基中,37℃、170 r/min振荡培养至OD 600 nm≈0.6,接种至含有5 mL布鲁菌液体培养基的透明玻璃试管中培养至静止期,观察细菌生长的聚集现象。
1.2.7 布鲁菌黏附侵袭试验 将HPT-8和RAW264.7细胞分别传代至6孔细胞培养板中培养,当单层细胞生长至80%覆盖度时(约1×106个);分别用牛布鲁菌S2308、RB51以及S2308ΔrirA基因突变株以感染复数为200∶1侵染上述两种细胞,在体积分数为5%的CO2、37℃环境中共孵育10、20、40、60、90、120 min后,PBS漂洗3遍,洗去培养液中未黏附的细菌,在含有50 μg/mL庆大霉素的DMEM培养基中再孵育60 min杀死胞外菌,PBS漂洗3遍后,用2 mL/L的Tritonx-100裂解细胞释放胞内菌,倍比稀释后涂布布鲁菌固体平板。记录各组细菌的数量,比较S2308、RB51以及S2308ΔrirA基因突变株黏附入侵胚胎滋养层细胞和小鼠巨噬细胞的能力。
1.2.8 布鲁菌胞内生存试验 HPT-8和RAW264.7细胞在6孔板中培养形成单层细胞(约1×106个),将牛布鲁菌S2308、RB51以及S2308ΔrirA 基因突变株以200∶1的感染复数侵染细胞。37℃共孵育90 min。PBS缓冲液漂洗细胞3次,去除未感染的胞外细菌,添加含有50 μg/mL庆大霉素的DMEM培养基,再孵育60 min杀死胞外菌,PBS漂洗3次,更换不含有抗生素的胎牛血清DMEM培养液,于侵染结束后的不同时间点(0、4、8、12、24 h)去除培养基,PBS漂洗3次。用2 mL/L的Tritonx-100裂解细胞,室温放置10 min,释放胞内菌,将裂解液倍比稀释以后涂布鲁菌固体平板,计算CFU;比较布鲁菌S2308、RB51以及S2308ΔrirA基因突变株在胚胎滋养层细胞和小鼠巨噬细胞内的复制繁殖能力。
2 结果
2.1 布鲁菌rirA基因突变株的构建
2.1.1 目的基因的高保真扩增 以布鲁菌S2308基因组为模板,对rirA 基因的上、下游同源臂序列进行PCR扩增,经琼脂糖凝胶电泳显示,获得了大小分别约为470 bp和437 bp的特异性片段,与布鲁菌 rirA基因上、下游同源臂的理论值相符;同时以pUC19K为模板扩增卡那抗性基因Kan ,获得的基因片段约为1 093 bp(图1)。

A:M.DNA 标准DL 1 000;1.阴性对照;2~4.rirA-N PCR产物;B:M.DNA 标准DL 1 000;1.阴性对照;2~4.rirA-C PCR产物;C:M.DNA标准DL 1 200;1.阴性对照;2~4.卡那抗性基因Kan PCR产物
A:M.DNA Marker DL 1 000;1.Negative control;2-4.PCR products of N-terminal of rirA gene;B:M.DNA Marker DL 1 000;1.Negative control;2-4.PCR products of C-terminal of rirA gene;C:M.DNA Marker of DL 1 200;1.Negative control;2-4.Kanamycin resistance gene
图1 rirA基因同源臂和卡那抗性基因Kan的PCR扩增
Fig.1 PCR amplification of rirA gene homologous arms and Kanamycin resistance gene
2.1.2 布鲁菌rirA基因突变株自杀载体的构建 使用融合PCR对获得的rirA基因上游同源臂、Kan抗性基因和rirA基因下游同源臂三段目的基因进行融合扩增,经琼脂糖凝胶电泳,显示获得了大小约2 000 bp的特异性条带(图2)。将回收后的融合片段与pMD19-T载体连接转化,获得的同源重组载体pMD19-T-ΔrirA-Kan经菌液PCR验证,显示其与rirA上、下游同源臂和卡那抗性基因序列叠加的理论值一致(图3)。经华大基因测序显示,其同源性为100%。
2.1.3 布鲁菌S2308ΔrirA基因突变株的筛选鉴定 将同源重组质粒pMD19-T-ΔrirA-Kan电转化至布鲁菌S2308中,通过rirA上、下游同源序列的交换,置换出染色体上的待缺失区域,获得的卡那抗性克隆菌命名为S2308ΔrirA,用鉴定引物rirA-N-F和Kan-R对S2308ΔrirA行扩增,结果S2308ΔrirA突变株可以扩增出预期大小1 563 bp的特异片段,而对照组S2308的扩增结果为阴性,表明抗性基因正确替换了rirA基因(图4)。
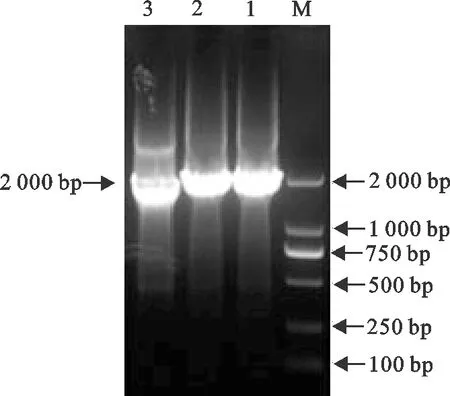
M.DNA 标准DL 2 000;1~3.rirA-N-K-C融合PCR产物M.DNA Marker DL 2 000;1-3.rirA-N-K-C fusion PCR products图2 rirA同源臂与卡那抗性基因Kan的融合PCR扩增Fig.2 PCR amplification of fusion rirA gene homolofous arms and kanamycin resistance gene
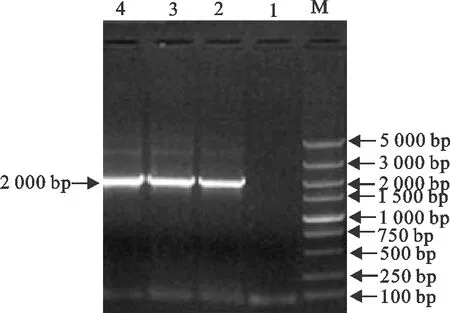
M.DNA 标准DL 5 000;1.阴性对照;2~4.PMD19-T-ΔrirA-Kan重组质粒M.DNA Marker DL 5 000;1.Negative control;2-4.PMD19-T-ΔrirA-Kan plasmid图3 同源重组载体PMD19-T-ΔrirA-Kan的菌液PCR鉴定Fig.3 PCR verification of PMD19-T-ΔrirA-Kan plasmid

M.DNA 标准DL 10 000;1.阴性对照;2.S2308;3~5.S2308ΔrirAM.DNA Marker DL 10 000;1.Negative control;2.S2308;3-5.S2308ΔrirA图4 S2308ΔrirA突变株的筛选鉴定Fig.4 The identification of S2308ΔrirA
2.2 布鲁菌rirA基因突变株的遗传稳定性检测
将鉴定正确的基因突变株S2308ΔrirA传代至第10代,突变菌株在传代培养过程中与亲本菌株比较,未发现肉眼可见的变化,如突变株生长速度,菌落颜色和形态等特征。分别用内部检测引物和外部检测引物对传代菌进行PCR验证,内部引物和外部检测引物检测缺失前后目的片度的变化如表2。
结果显示,构建的基因突变株缺失前后,所扩增的基因片段与理论值一致,说明成功获得了相应的突变株,并且基因突变株经过10代连续培养后未发生回复突变现象,表明S2308ΔrirA突变株可进行稳定遗传(图5)。
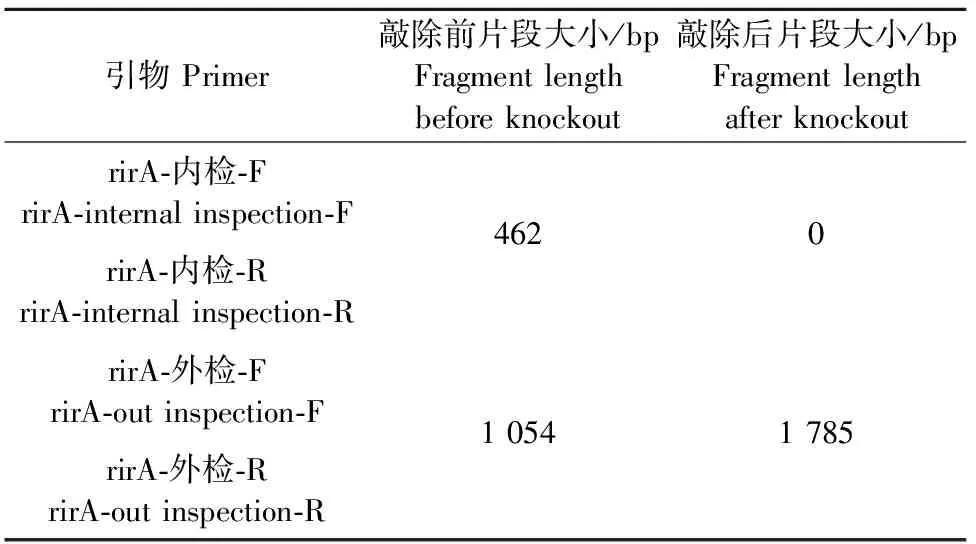
表2 检测引物及片段长度Table 2 Detection primer and fragment length
2.3 生长曲线
布鲁菌S2308、RB51以及S2308ΔrirA基因突变株在相同初始浓度(OD 600 nm≈0.1)下进行培养,每2 h测定一次菌液浓度(OD 600 nm),直至细菌生长进入平台期。从体外培养的生长曲线中可以看出,S2308ΔrirA突变株在初始浓度(OD 600 nm≈0.1) 下培养约32 h 后,细菌进入对数生长期;约40 h后,细菌生长进入平台期。虽然S2308ΔrirA、RB51和S2308菌株整体生长趋势类似,但同一时间点菌株浓度存在微小差异。而且布鲁菌S2308ΔrirA和RB51的生长速度明显快于亲本株2308(图6)。
2.4 布鲁菌聚集现象
对布鲁菌亲本株S2308、疫苗株RB51和S2308ΔrirA基因突变株进行静置培养,当布鲁菌生长至静止期时,发现布鲁菌S2308ΔΔrirA基因突变株与布鲁菌亲本株S2308相比,未发生明显变化,均处于浑浊生长状态;而布鲁菌RB51株培养液中形成生物膜样的聚集现象(图7)。
2.5 布鲁菌的黏附侵袭能力
布鲁菌侵染小鼠巨噬细胞RAW264.7过程中,随着侵染时间的延长,布鲁菌亲本株S2308、疫苗株RB51和S2308ΔrirA基因突变株黏附入侵的数量逐渐增加,至40 min各菌株进入RAW264.7的数量达到饱和。布鲁菌与小鼠巨噬细胞RAW264.7共孵育40 min和60 min时,S2308ΔrirA基因突变株黏附侵袭能力显著低于亲本株S2308和疫苗株RB51(P<0.05)(图8)。由此可见,rirA基因在一定程度上调控了布鲁菌对巨噬细胞的入侵过程。
在胚胎滋养层细胞中,随着细菌与胚胎滋养层细胞共孵育时间的延长,进入胚胎滋养层细胞的细菌数量逐渐增加;大约90 min各株布鲁菌进入细胞的数量不再增加,胞内细菌数接近饱和;各时间段布鲁菌S2308ΔrirA和RB51菌株黏附侵袭能力极显著高于S2308(P<0.01)(图9)。表明rirA基因可通过某些机制抑制布鲁菌入侵胚胎滋养层细胞。

A:外部引物PCR检测;M.DNA 标准DL 7 000;1.阴性对照;2.S2308;3.pMD19-T-ΔrirA-Kan质粒;4~13.S2308ΔrirA基因突变株B:内部引物PCR检测;M.DNA标准DL 4 500;1.阴性对照;2.S2308;3.pMD19-T-ΔrirA-Kan质粒;4~13.S2308ΔrirA基因突变株A:Identification of S2308ΔrirA by outer primers;M.DNA Marker DL 7 000;1.Negative control;2.S2308;3.PMD19-T-ΔrirA-Kan positive control;4-13.S2308ΔrirA mutant strainB:Identification of S2308ΔrirA by inner primers;M.DNA Marker DL 4 500;1.Negative control;2.S2308;3.PMD19-T-ΔrirA-Kan positive control;4-13.S2308ΔrirA mutant strain
图5布鲁菌S2308ΔrirA遗传稳定性检测
Fig.5 The genetic stability test ofBrucellaS2308ΔrirA

图6 布鲁菌生长曲线Fig.6 The gowth curve of Brucella strains

1.空白对照;2.S2308亲本株;3.S2308ΔrirA基因突变株;4.RB51疫苗株
1.Blank control;2.S2308 strain; 3.S2308ΔrirA strain;4.RB51 strain
图7布鲁菌的聚集现象
Fig.7 Aggregates formed duringBrucellagrowth

图8 布鲁菌对小鼠巨噬细胞的黏附侵袭能力Fig.8 Invasive ability of Brucella to RAW264.7
2.6 布鲁菌的胞内生存能力
布鲁菌侵染小鼠巨噬细胞RAW264.7后,4 h各布鲁菌菌株胞内细菌数量显著降低。与亲本株S2308相比,S2308ΔrirA 基因突变株在侵染后24 h,胞内细菌数量显著性下降(P<0.01)。而RB51菌株侵染小鼠巨噬细胞后随着时间的延长,胞内细菌数量持续降低(图10)。
在胚胎滋养层细胞中,布鲁菌亲本株S2308、疫苗株RB51和S2308ΔrirA基因突变株以200∶1的比例侵袭胚胎滋养层细胞90 min,在侵染后的不同时间通过胞内布鲁菌CFU的变化,比较它们在胚胎滋养层细胞内的复制繁殖能力。结果显示,S2308、RB51和S2308ΔrirA基因突变株在侵染后12 h内,同一菌株在不同时间点其胞内细菌数量无显著变化(P>0.05);但侵染24 h后,同一菌株胞内细菌数量极显著高于其他时间点(P<0.01)。同时研究发现,S2308ΔrirA 基因突变株和RB51疫苗株侵染HPT-8细胞后的各个时间段,其胞内细菌数量极显著高于S2308株(P<0.01)(图11)。
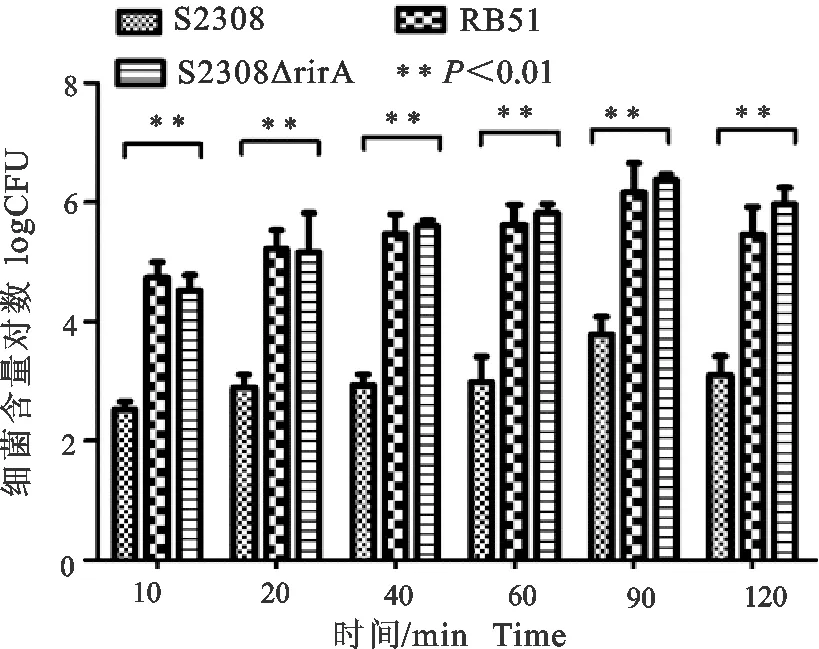
图9 布鲁菌对胚胎滋养层细胞的黏附侵袭能力Fig.9 Invasive ability of Brucella to HPT-8
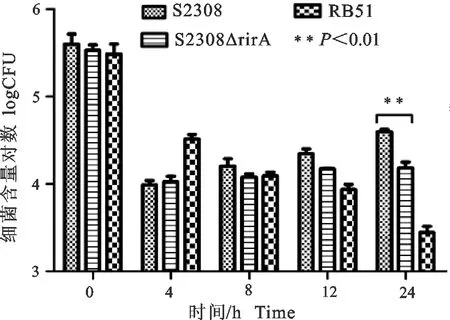
图10 布鲁菌在小鼠巨噬细胞内的存活能力Fig.10 The intracellular survival ability of Brucella in RAW264.7
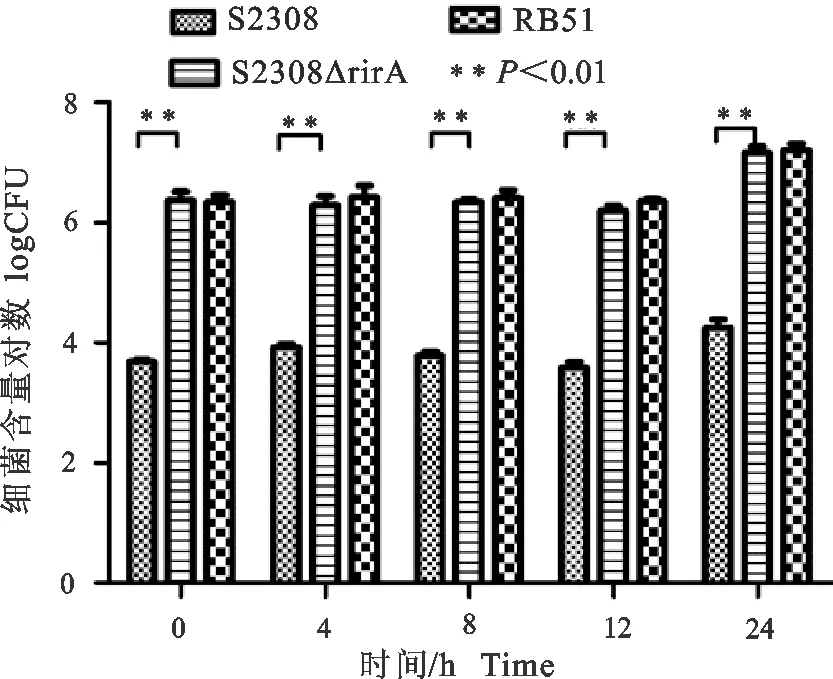
图11 布鲁菌在胚胎滋养层细胞内存活能力Fig.11 The intracellular survival ability of Brucella in HPT-8
由此可以发现,不仅布鲁菌在不同细胞中的存活能力存在一定差异,而且rirA基因的缺失在一定程度上改变了其在不同细胞中的复制能力。表明rirA基因调控布鲁菌的生存繁殖。
3 讨论
布鲁菌病是一种自然疫源性人兽共患病,可通过呼吸道、消化道、皮肤和生殖道感染宿主,以流产和发热为主要特征,易引起多器官的损伤;布鲁菌是布鲁菌病的致病菌,其对营养要求严格,在营养条件较高的培养基中才能生长,因此细菌的生长和增殖需要大量的能量代谢以及生物大分子的合成物质。本研究发现,相同培养条件下的S2308ΔrirA基因突变株较亲本株提前4 h~6 h进入平台期。说明rirA基因可能参与了布鲁菌能量代谢和生物大分子合成等生长相关基因的调控,这也与间接论证了Martin R等提出的rirA基因参与布鲁菌对铁代谢的调控研究[7]。
本研究同时还发现,布鲁菌S2308ΔrirA基因突变株的聚集类似于布鲁菌亲本株2308,而布鲁菌疫苗株RB51出现明显的聚集现象,这与某些粗糙型布鲁菌也会发生聚集现象的报道一致。聚集现象似乎与细菌的毒力没有直接的关系,因为一些具有不同毒力的菌株都可能发生聚集现象[8]。细菌的聚集是生物膜形成的第一步,细菌生物膜的形成有利于其应对恶劣环境,从而有利于细菌的生存。
很多证据已经表明,病原致病能力与其摄取铁的能力直接相关[9-10]。Almirón M等[11]对铁螯合蛋白酶hemH基因的研究发现,缺失hemH基因的布鲁菌其毒力明显降低。布鲁菌没有典型的外毒素,因此,其毒力主要表现为侵袭力和繁殖力。本研究发现,布鲁菌侵染非专业吞噬细胞时间大约90 min才可饱和进入胚胎滋养层细胞,且S2308ΔrirA基因突变株黏附侵袭能力高于亲本株S2308;同时其在滋养层细胞中的生存能力检测发现,该突变株与亲本株或疫苗株其胞内细菌变化趋势基本一致;而在侵染巨噬细胞试验中,布鲁菌黏附入侵40 min细菌量达到最高水平;之前王玉飞[12]在布鲁菌侵染巨噬细胞的研究中也发现,布鲁菌45 min可饱和进入巨噬细胞。本研究中也发现S2308ΔrirA在巨噬细胞内的繁殖能力介于亲本S2308和疫苗株RB51之间;这些结果说明,布鲁菌对专业和非专业吞噬细胞的侵染方式存在明显不同。已有研究表明,布鲁菌进入巨噬细胞时,或者是通过细菌同巨噬细胞表面直接接触,或者是通过细菌表面同血清调理素间接地相互作用[13]。然而,布鲁菌感染非专业吞噬细胞的早期运输和复制机制尚不明确[14]。因此,解析布鲁菌在细胞内的生存繁殖及其分子机制是了解布鲁菌致病性的关键。
[1] Pappas G.The changingBrucellaecology:novel reservoirs,new threats[J].Int J Antimicrob Agents,2010,36(5):S8-S11.
[2] Moreno E,Moriyon I.Brucellamelitensis:a nasty bug with hidden credentials for virulence[J].Proc Natl Acad Sci U S A,2002,99(1):1-3.
[3] Gorve J P,Moreno E.Brucellaintracellular life:from invasion to intracellular replication [J].Vet Microbiol,2002,90(1-4):281-297.
[4] Smith H.What happens to bacterial pathogensinvivo?[J].Trends Microbiol,1998,6(6):239-243.
[5] Plommet M,Plommet A M.Virulence ofBrucella:bacterial growth and decline in mice [J].Ann Rech Vet,1988,19(1):65-67.
[6] Audic S,Lescot M,Claverie J M,et al.Brucellamicroti:the genome sequence of an emerging pathogen[J].BMC Genomics,2009,10(1):1-18.
[7] Roop R M.Metal acquisition and virulence inBrucella[J].Anim Health Res Rev,2012,13(1):10-20.
[8] Uzureau S,Godefroid M,Deschamps C,et al.Mutations of the quorum sensing-dependent regulator VjbR lead to drastic surface modifications inBrucellamelitensis[J].J Bacteriol,2007,189(16):6035-6047.
[9] Eskra L,Covert J,Glasner J,et al.Differential expression of iron acquisition genes byBrucellamelitensisandBrucellacanisduring macrophage infection[J].PLoS One,2012,7(3):e31747.
[10] Hibbing M E,Fuqua C.Antiparallel and interlinked control of cellular iron levels by the Irr and RirA regulators of agrobacterium tumefaciens[J].J Bacteriol,2011,193(14):3461-3472.
[11] Almirón M,Martínez M,Sanjuan N,et al.Ferrochelatase is present inBrucellaabortusand is critical for its intracellular survival and virulence[J].Infect Immun,2001,69(10):6225-6230.
[12] 王玉飞.Ⅳ型分泌系统调控布鲁菌胞内生存的分子机制研究[D].北京:军事医学科学院,2008.
[13] Watarai M,Makino S,Michikawa M,et al.Macrophage plasma membrane cholesterol contributes toBrucellaabortusinfection of mice[J].Infect Immun,2002,70(9):4818-4825.
[14] Celli J.Surviving inside a macrophage:The many ways ofBrucella[J].Res Microbiol,2006,157(2):93-98.
ConstructionandIdentificationofIronTranscriptionFactorrirAGeneMutantofBrucella
WANG Zhen1,WANG Yong1,ZHANG Qian1,2,CHEN Chuang-fu1,2,GUO Fei2,LI Tian-sen1,ZHANG Hui1,WANG Yuan-zhi2,LIU Zhi-qiang1,3
(1.KeyLaboratoryofPreventionandControlofAnimalDisease,ShiheziUniversity,Shihezi,Xinjiang,832000,China;2.EducationKeyLaboratoryofXinjiangEndemicandEthnicDisease,ShiheziUniversity,Shihezi,Xinjiang,832000,China;3.VeterinaryResearchInstituteofXinjiangAcademyofAnimalSciences,Urumqi,Xinjiang,830000,China)
To construct the iron transcription factor rirA gene mutant (S2308ΔrirA) ofB.abortusS2308 (S2308),and explore the impact of this gene on its growth and the function of cell invasion or intracellular survival in various cells,the methods of homologous recombination and replacement were applied,and the kanamycin gene was used to replace rirA gene obtaining mutant S2308ΔrirA.The parent strain S2308,vaccine strain RB51 and mutant S2308ΔrirA were cultured in the same nutrient condition.The growth and aggregation status were recorded.Then human trophoblast cells (HPT-8) and macrophages (RAW264.7) were infected with these strains.The invasive and survival abilities were detected.The results showed that the S2308ΔrirA mutant strain was successfully obtained,and was genetically stable within 10 passages.Compared with the parent strain,the growing trends and aggregation of mutant and parent strains were coincidentinvitro.The adhesion ability of S2308 rirA was significantly stronger than that of the parent strain to HPT-8 cells,but slightly weaker to RAW264.7 cells.After 24 h post-infection,the numbers ofBrucellain HPT-8 cells were significantly increased,while the bacterial counts in RAW264.7 cells infected with S2308ΔrirA were significantly lower than that of the parent strain.All of these results indicated that the iron transcription factor rirA gene is involved in the process of intracellular parasitism ofBrucella,and closely related with the virulence.
Brucella;iron transcription factor;HPT-8;RAW264.7
2017-01-03
新疆生产建设兵团动物疾病防控重点实验室开放课题 (BTDJ06);国家自然科学基金项目(31572491,31660705)
王 震(1987-),男,山东潍坊人,博士研究生,主要从事免疫遗传与抗病机理研究。王 勇(1981-),男,新疆石河子人,讲师,博士,主要从事病原微生物致病机制研究。△同等贡献作者。*
S852.614;Q789
A
1007-5038(2017)10-0001-07