pH及盐分对大丽轮枝菌微菌核形成的影响
2017-11-13徐万里顾美英王建涛刘相春薛泉宏
薛 磊,徐万里,顾美英,王建涛,刘相春,薛泉宏
(1.西北农林科技大学 生命科学学院,陕西杨凌 712100;2.陕西中烟工业有限责任公司技术中心,西安 710065;3.新疆农业科学院 土壤肥料与农业节水研究所,乌鲁木齐 830091;4.新疆农业科学院 微生物应用研究所,乌鲁木齐 830091;5.西北农林科技大学 资源环境学院,陕西杨凌 712100)
pH及盐分对大丽轮枝菌微菌核形成的影响
薛 磊1,2,徐万里3,顾美英4,王建涛5,刘相春5,薛泉宏5
(1.西北农林科技大学 生命科学学院,陕西杨凌 712100;2.陕西中烟工业有限责任公司技术中心,西安 710065;3.新疆农业科学院 土壤肥料与农业节水研究所,乌鲁木齐 830091;4.新疆农业科学院 微生物应用研究所,乌鲁木齐 830091;5.西北农林科技大学 资源环境学院,陕西杨凌 712100)
微菌核是棉花黄萎病原大丽轮枝菌(VerticilliumdahliaeKleb.)在土壤中的主要存活形式及该病的侵染源,研究土壤pH及盐分对大丽轮枝菌微菌核形成的影响对明确黄萎病发生具有重要意义。采用菌丝生长速率法研究培养基pH及盐分质量浓度与种类对病原菌生长及微菌核形成的影响。供试大丽轮枝菌菌丝生长最适pH为7.0,偏酸或偏碱会抑制菌丝生长,但培养基偏碱可显著促进微菌核形成。当pH为8.0时,大丽轮枝菌菌丝生长受抑制较小,同时微菌核区面积较pH为7.0时增加22.6%。盐分质量浓度影响大丽轮枝菌菌丝生长及微菌核形成。随培养基NaCl质量浓度增加,供试大丽轮枝菌生长受到抑制,菌落面积和菌丝面积均逐渐减小,但微菌核形成量却显著增加;当NaCl质量浓度为10 g·L-1时,微菌核区面积较无NaCl时增加40.7%。盐分种类影响供试大丽轮枝菌生长。随盐分质量浓度增加,氯化物(NaCl和KCl)和硫酸盐(Na2SO4和MgSO4)均可促进大丽轮枝菌微菌核形成,而CaCl2则显著促进菌丝生长,并在质量浓度大于7 g·L-1时抑制微菌核形成。在培养环境偏碱性或氯化物和硫酸盐含盐量较高时,均可促进棉花黄萎病原大丽轮枝菌微菌核形成量增加。
棉花黄萎病;大丽轮枝菌;微菌核;pH;盐分
棉花是中国重要的经济作物。棉花黄萎病属土传性维管束系统病害,主要由大丽轮枝菌(VerticilliumdahliaeKleb.)从棉株根部侵染造成[1-2],使棉花维管堵塞、植株枯死和蕾铃脱落,严重影响棉花生产[3-4]。该病害难以根治的主要原因在于大丽轮枝菌形成的微菌核能抵抗不良环境,在土壤中长期存活,成为该病反复发生的侵染源[5-7]。棉田土壤中微菌核的数量及活性直接影响棉花黄萎病的发生与危害程度[8-9]。故研究大丽轮枝菌微菌核形成的影响因素对从微生态角度揭示棉花黄萎病发生及流行原因,从土壤微生态调控途径预防控制棉花黄萎病发生,并减轻其危害具有重要意义。棉田土壤是大丽轮枝菌微菌核形成与存在的重要环境,土壤pH与盐分质量浓度不仅对作物及微生物生长有重要作用,对微菌核形成也会产生一定影响,但目前仅对棉花黄萎病菌微菌核在土壤中的分布[10]、微菌核与病害的关系及土壤条件(温度、湿度和有机质等)对微菌核存活的影响[11-12]进行过研究,尚无pH及盐分对棉花黄萎病菌微菌核形成影响的报道。作为中国棉花主产地的新疆地区属内陆盐土区,棉田土壤pH及盐分质量浓度均较高[13-14],二者对棉花黄萎病菌微菌核的影响均大于其他棉区。近年的研究也表明,新疆地区棉花黄萎病害的发生与菌量呈明显正相关[15]。故研究pH及盐分对大丽轮枝菌微菌核形成的影响对探究棉花黄萎病在新疆棉区长期流行的微生态机制及防治有重要意义。本试验根据新疆棉区土壤pH和盐分质量浓度设计培养基pH、盐分种类及质量浓度,旨在通过皿内模拟研究探索pH及盐分对大丽轮枝菌生长及微菌核形成的影响,进而确定pH及盐分在棉花黄萎病普遍发生及流行中所起的作用,为阐明新疆地区棉花黄萎病流行机理及制定棉花黄萎病综合防治措施提供理论依据。
1 材料与方法
1.1 材 料
供试病原菌 大丽轮枝菌(V.dahliaeKleb.),为丝核型菌株,属棉花黄萎病陕西泾阳落叶型高致病菌株,由西北农林科技大学植物保护学院杨家荣教授提供。
培养基:病原菌活化、培养采用PDA培养基[16]。
1.2 方 法
1.2.1 大丽轮枝菌菌饼制备 将大丽轮枝菌经PDA斜面转接活化后,进行单孢纯化,将纯化后的大丽轮枝菌单一菌核放置于PDA平板中心,25 ℃下避光培养,待其长满培养皿后,用打孔器切取,制成直径为7 mm的病原菌菌饼。
1.2.2 pH对大丽轮枝菌生长及微菌核形成的影响 用0.1 mol·L-1HCl或NaOH调节PDA培养基pH,制成pH分别为5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5的供试平板,将“1.2.1”制备的7 mm大丽轮枝菌菌饼置于平板中央,于25 ℃下避光培养。各处理均重复3次。
1.2.3 盐质量浓度对大丽轮枝菌生长及微菌核形成的影响 在PDA培养基中加入质量浓度分别为0(CK)、1、2、4、6、8、10、15、20、25 g·L-1的NaCl,制成不同质量浓度NaCl供试平板,将“1.2.1”制备的7 mm大丽轮枝菌菌饼置于平板中央,于25 ℃下避光培养。各处理均重复3次。
1.2.4 不同盐种类及质量浓度对大丽轮枝菌生长及微菌核形成的影响 在PDA培养基中按1、3、5、7、9 g·L-1质量浓度分别加入NaCl、KCl、Na2SO4、MgSO4、CaCl2,制成不同质量浓度、含不同种类盐的供试平板,将“1.2.1”制备的7 mm病原菌菌饼置于平板中央,25 ℃下避光培养。各处理均重复3次。
1.2.5 大丽轮枝菌生长状况观察及菌丝与微菌核区大小测定 将上述各处理大丽轮枝菌平板自第6天起每48 h记录生长状况,并观察记录微菌核形成时间;采用十字交叉法测量病原菌菌丝区直径d、菌落总直径D;采用Image Pro Plus 6.0软件进行图片颜色分析,分别测定微菌核区面积像素值(Microselerotia Area Pixels,MSAP)及菌落总面积像素值(Colony Area Pixels,CAP)。
1.2.6 结果计算 根据菌落直径测值计算菌落总面积(Colony Area,缩写为CA)、菌丝面积(Mycelium Area,缩写为MA),计算菌丝占菌落面积比例(Mycelium Percentage,缩写为MP),微菌核区面积占菌落总面积的比例(Microselerotia Proportion,缩写为MSP),微菌核区面积(Microselerotia Area,缩写为MSA)及pH或盐分对CA、MA、MP、MSP及MSA的抑制率ΔK。其计算公式分别为:
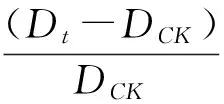
①
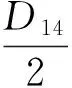
②
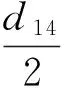
③
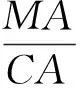
④
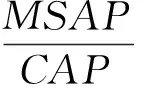
⑤
MSA=CA×MSP14
⑥
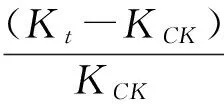
⑦
式①中DCK、Dt分别为对照、处理菌落反面直径;式②、③中D14、d14分别为病原菌在第14天时反面菌落直径、正面菌丝直径;式⑤中MSAP、CAP分别为微菌核区面积、菌落总面积的像素值;式⑥中MSP14为病原菌在第14天时微菌核区面积占菌落总面积比例;式⑦中KCK和Kt分别表示病原菌在以无盐分和添加盐分处理时CA、MA、MP、MSP、MSA的计算值。
2 结果与分析
2.1 pH对大丽轮枝菌生长及微菌核形成的影响
由表1可知,pH对大丽轮枝菌菌落生长影响显著。供试大丽轮枝菌在pH 5.5~9.5时均可生长,其中在pH 7.0时菌落生长速度最快,第14天菌落直径达60.7 mm,pH增大或减小时菌落生长均有所减慢,表明培养环境偏酸性或碱性均抑制大丽轮枝菌菌落生长。
由表2可知,pH对大丽轮枝菌菌落形态和微菌核形成具有一定影响。当培养基pH在一定范围内偏碱性时,大丽轮枝菌菌落总面积CA、菌丝面积MA、菌丝占菌落总面积比例MP均较pH 7.0时有所减少,而大丽轮枝菌微菌核区占菌落总面积的比例MSP及微菌核区面积MSA则较pH 7.0时有所增加,且微菌核形成时间较pH 7.0 时早2 d。当大丽轮枝菌生长环境pH为7.0~8.5 时,其菌落生长状况较好,微菌核形成量较多。而当培养基在一定范围内偏酸性时,大丽轮枝菌菌落生长状况较pH 7.0时也略有下降,但微菌核产生量也明显减少。
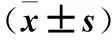
表1 pH对大丽轮枝菌菌落直径的影响Table 1 Effect of pH on colony diameter of V.dahliae mm
注:同列不同字母表示差异显著(P<0.05)。下表同。
Note:Different letters in same column represent significant differences (P<0.05).The same as following table.
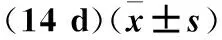
表2 pH对大丽轮枝菌菌丝生长及微菌核形成的影响Table 2 Effect of pH on mycelium growth and microsclerotia formation of V.dahliae (14 d)
2.2 盐质量浓度对大丽轮枝菌生长及微菌核形成的影响
由表3可知,盐质量浓度对大丽轮枝菌菌落生长影响显著。供试大丽轮枝菌在NaCl质量浓度为0~25 g·L-1范围内均可生长,但高质量浓度NaCl可抑制大丽轮枝菌生长,相比无盐培养基(CK),含盐培养基上病原菌生长较慢。在培养6 d时,当盐分质量浓度小于6 g·L-1时,盐分对病原菌生长抑制较小,不同盐质量浓度之间菌落直径差异不显著(P>0.05);当盐分质量浓度超过8 g·L-1时,显著抑制病原菌生长(P<0.05)。随盐质量浓度增加,菌落直径减少。培养14 d时,加盐处理菌落直径较CK减少1.6%~33.4%;培养6~14 d时,质量浓度为25 g·L-1的NaCl处理可使病原菌菌落直径较CK降低31.5%~34.8%。
在含NaCl培养基上,大丽轮枝菌从第8天开始形成微菌核。随培养时间延长,微菌核逐渐增加。从表4可知,在培养14 d时,随培养基中NaCl质量浓度增大,大丽轮枝菌微菌核形成量增加,菌落中菌丝与微菌核的比例发生显著变化,病原菌菌丝占菌落总面积的比例由CK的48.0%下降至9.0%,加盐处理较CK减少4.5%~81.3%;微菌核区占菌落总面积比例(MSP)由CK的53.3%增加到98.3%,加盐处理较CK增加15.6%~84.4%。在CK培养基上,大丽轮枝菌微菌核产生较晚,至培养第10天开始形成微菌核。培养到14 d,MSP为53.3%。
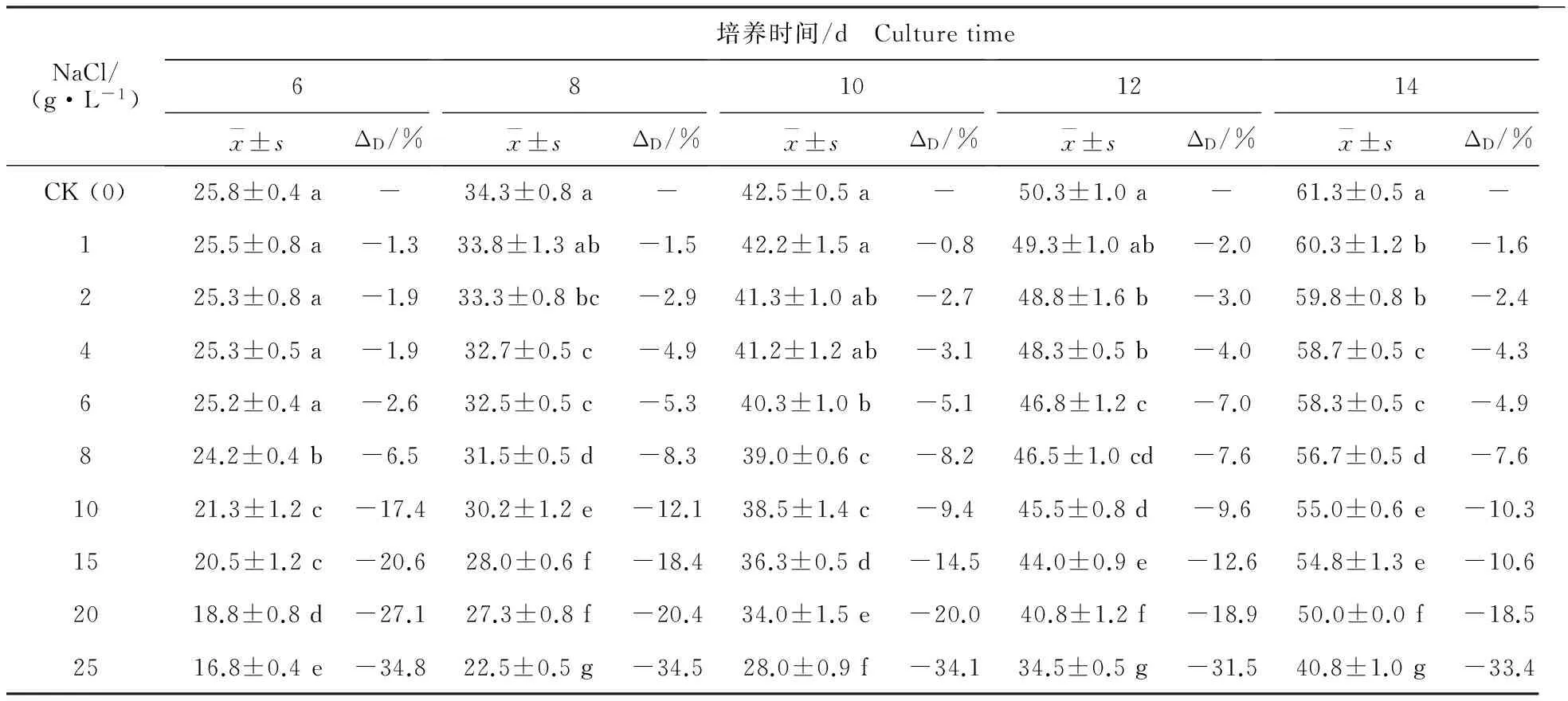
表3 不同质量浓度NaCl对大丽轮枝菌菌落直径的影响Table 3 Effect of different NaCl mass concentration on colony diameter of V.dahliae mm
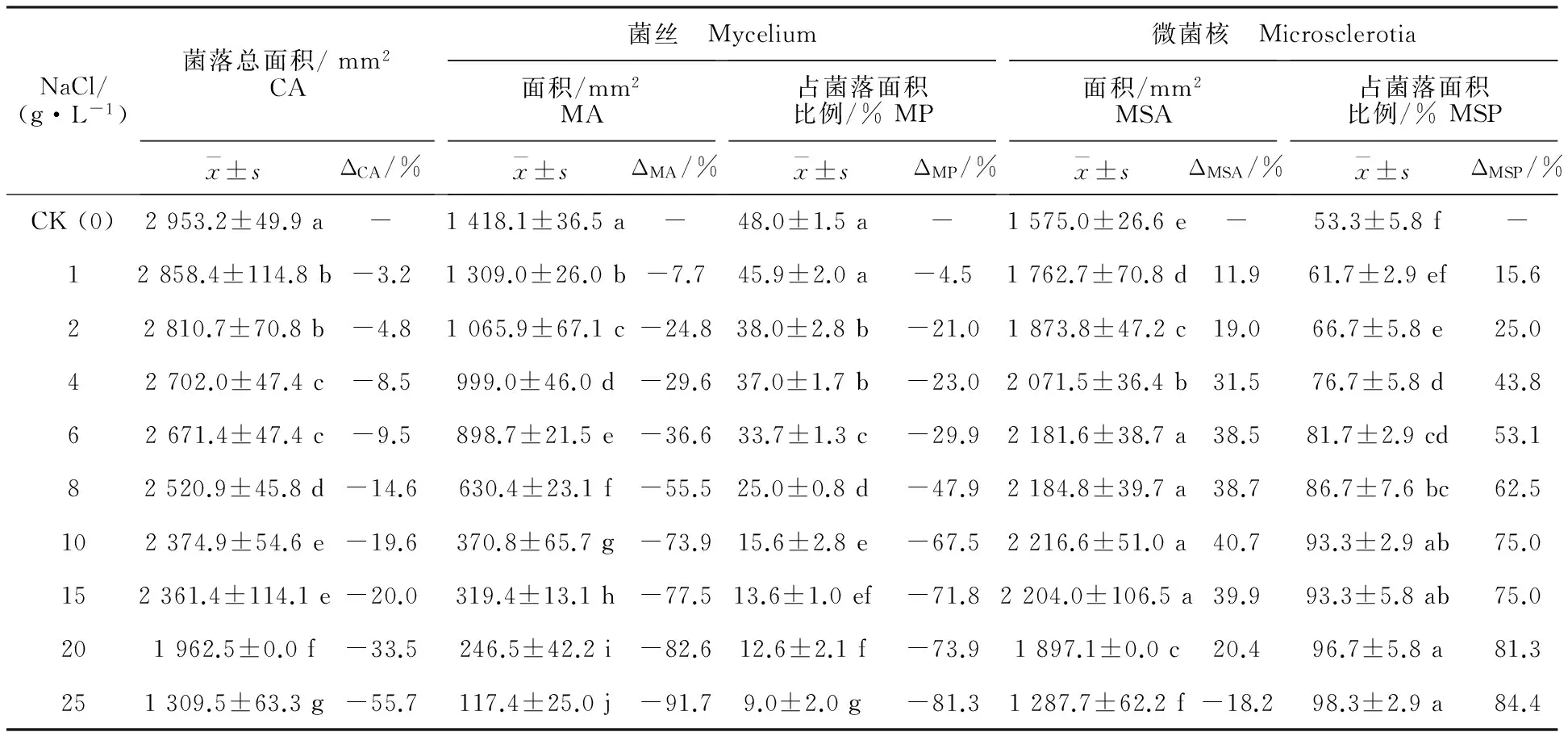
表4 不同质量浓度NaCl对大丽轮枝菌菌丝生长及微菌核形成的影响(14 d)Table 4 Effect of different NaCl mass concentration on mycelium growthand microsclerotia formation of V.dahliae (14 d)
2.3 不同盐种类及质量浓度对大丽轮枝菌生长及微菌核形成的影响
由表5可知,大丽轮枝菌菌落直径依不同盐种类有所差异。在培养6~8 d时,除CaCl2外,其余盐分对大丽轮枝菌均表现出抑制作用。随培养时间延长,盐分抑制效果呈现较大差异,与无盐培养基相比,含有CaCl2的培养基可显著增加病原菌菌落直径。KCl在培养初期对病原菌呈现轻微抑制作用,而培养10 d后,在质量浓度为1~7 g·L-1时,KCl则表现出对菌落直径的轻微促进作用。其余3种盐分均表现出明显抑制作用,依次为Na2SO4>MgSO4>NaCl。从总体上看,除CaCl2外,硫酸盐对菌落大小的抑制作用大于氯化物盐类。
由表6可知,多种盐分均对大丽轮枝菌菌丝生长产生显著影响。在培养14 d时,当盐分质量浓度≥3.0 g·L-1时,Na2SO4、MgSO4和NaCl对菌落总面积产生显著的抑制作用(P<0.05),而CaCl2对菌落总面积(CA)产生显著的促进作用(P<0.05),且不同盐分间对CA大小的影响随盐分质量浓度增加而差异显著。此外,MgSO4和CaCl2对病原菌菌丝生长也有促进作用,在7 g·L-1质量浓度时,其菌丝占菌落总面积的比例(MP)较CK培养基菌落最高增幅分别为103.0%和61.9%。而NaCl、KCl和高质量浓度的Na2SO4则显著抑制菌丝生长,随盐质量浓度增加,菌丝面积(MA)逐渐减小,在9 g·L-1质量浓度时,其较CK培养基分别下降66.3%、72.7%和69.8%。
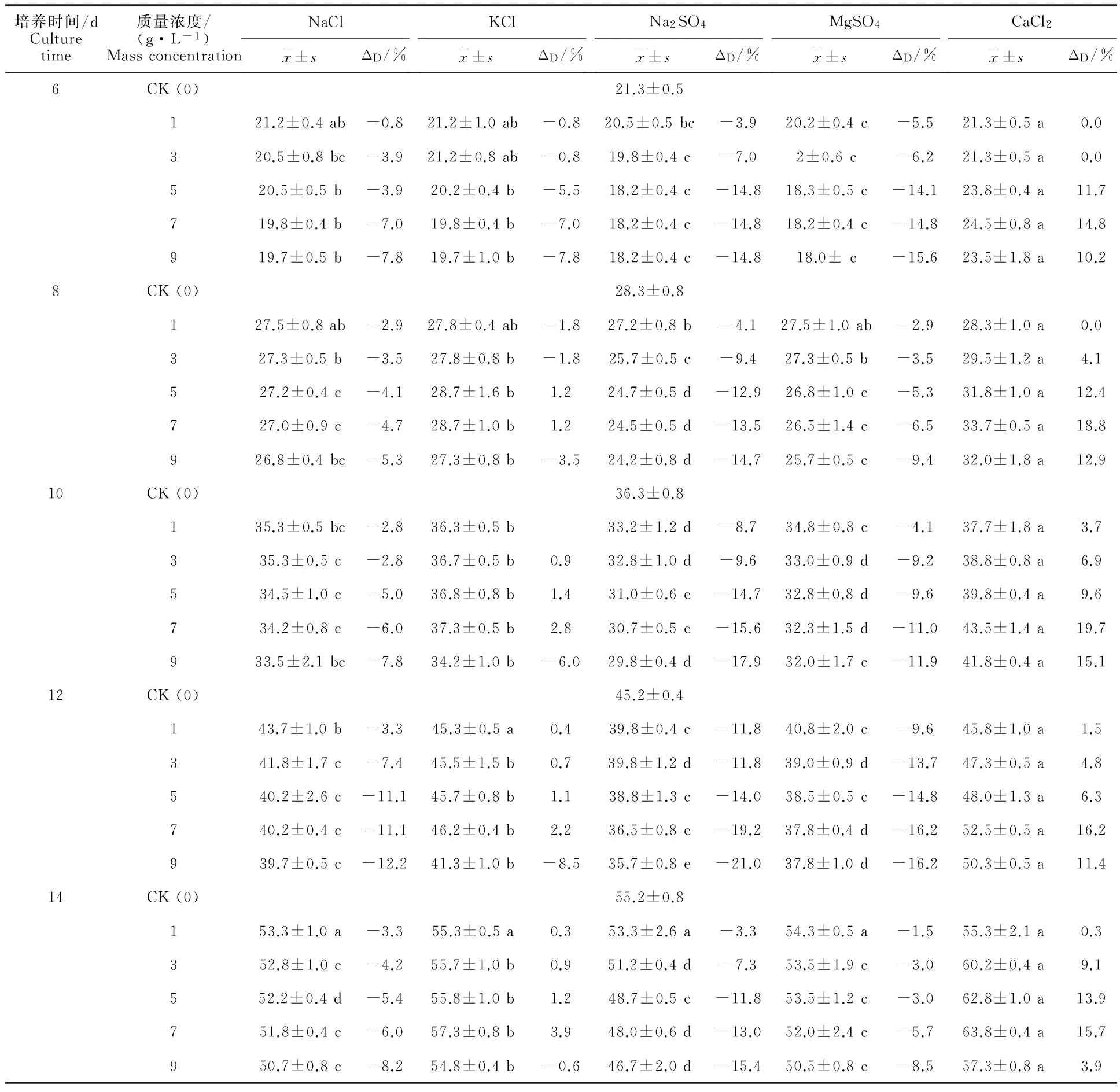
表5 不同盐分及质量浓度对大丽轮枝菌菌落直径的影响Table 5 Effect of different salinity and mass concentration on colony diameter of V.dahliae
由表6还可以看出,不同种类盐分均对大丽轮枝菌微菌核形成有促进作用。除添加量大于7 g·L-1的CaCl2外,其余盐分处理的MSP及MSA均显著增加,说明各种盐分均可诱导微菌核生成,其中,氯化物(NaCl和KCl)的作用大于硫酸盐(Na2SO4和MgSO4)。此外,添加MgSO4的培养基从第6天起便开始形成微菌核,而CaCl2自第12天才开始形成微菌核,其余3种盐处理均在培养第8天起形成微菌核,形成微菌核时间较无盐处理提前2 d。
3 讨 论
中国棉花黄萎病因1935年引进美棉而传入,首先在泾阳等地区发病,随后棉花黄萎病随棉种调运在全国迅速传播[17]。微菌核是大丽轮枝菌抵御不良环境的休眠体。微菌核主要分布在棉田土壤0~40 cm耕作层[9],可随病土移动,耕作时随牲畜、农具、人手足传播及灌溉水流扩散,导致棉花黄萎病大面积发生[18]。作为病原菌在侵染植物前存在的主要介质之一,土壤性质对大丽轮枝菌微菌核的形成与活性有重要影响。杨家荣等[12]研究发现,土壤温度、湿度、pH和有机质影响棉花黄萎病菌微菌核存活。López-Escudero等[17]研究也表明,土壤湿度影响大丽轮枝菌微菌核在土壤中的形成及存活。纪文飞等[19]发现,棉花黄萎病菌在pH为3~10的PDA培养基上均能生长,pH为5~8时,其菌丝生长最快。白应文等[20]研究发现,适合于棉花黄萎病菌大量产生微菌核的条件为:基础改良培养基(BMM),pH 9.5~11.5,温度为20 ℃。此外,Mohammadi等[21]和Saadatmand等[22]研究发现,增加土壤盐分质量浓度可促进大丽轮枝菌对阿月浑子根部的侵染。白霜等[23]研究发现,在新疆棉田含盐量不同的土壤中,棉花黄萎病病株根区土壤中可溶性总盐质量浓度高于无病害健株。即土壤含盐量与棉花黄萎病发生存在一定关系,但目前尚无盐分对大丽轮枝菌微菌核形成影响的报道。
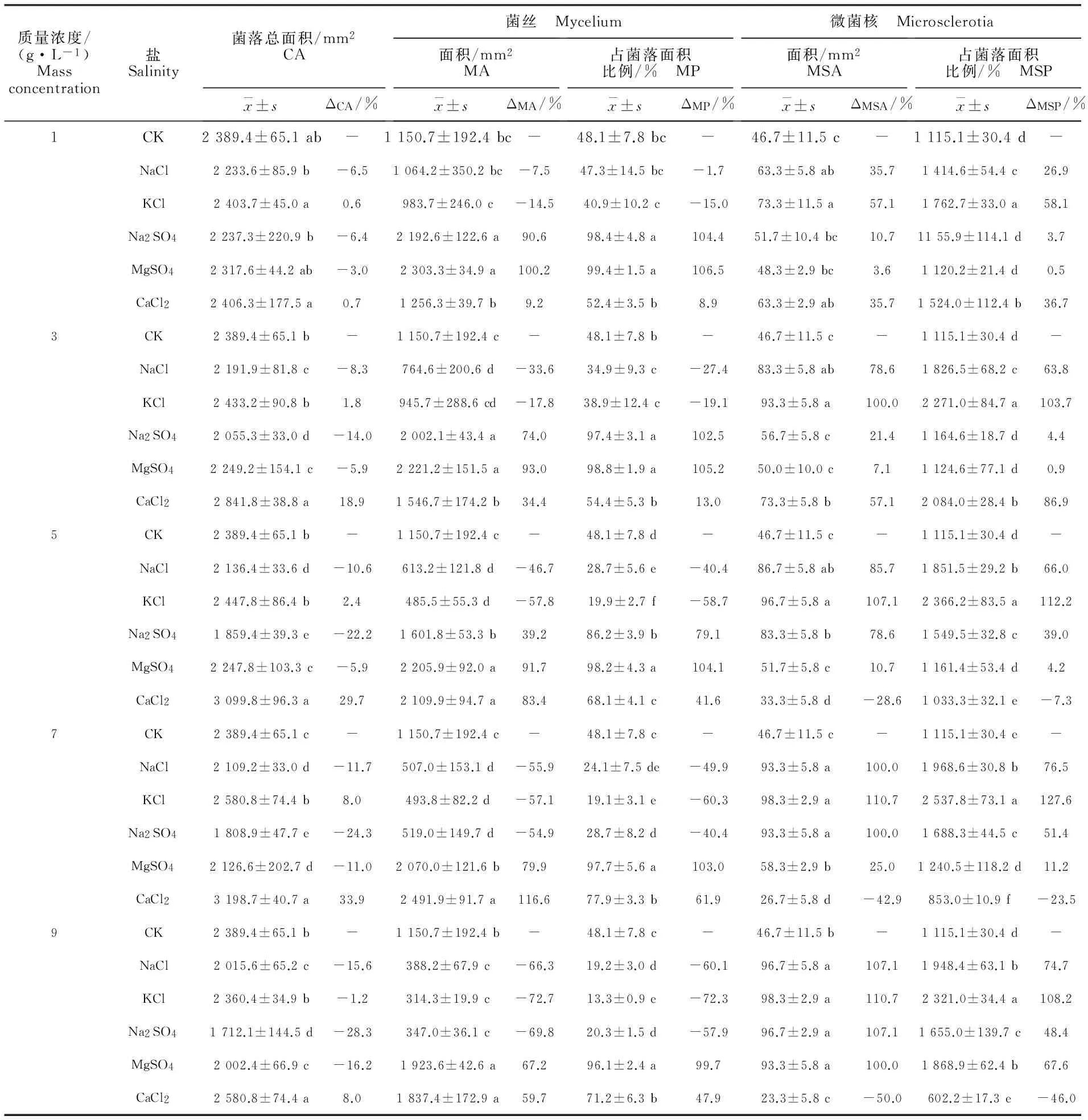
表6 不同盐分及质量浓度对大丽轮枝菌菌丝生长及微菌核形成的影响(14 d)Table 6 Effect of different salinity and concentration on mycelium growth and microsclerotia formation of V.dahliae (14 d)
本研究发现,基质中盐分质量浓度及盐分种类显著影响大丽轮枝菌菌丝生长及微菌核形成。供试大丽轮枝菌在盐质量浓度为0~25 g·L-1时均可生长,增加盐分质量浓度均可抑制大丽轮枝菌丝生长,在盐分质量浓度为2~15 g·L-1时可显著促进大丽轮枝菌微菌核形成;氯化物(NaCl和KCl)及硫酸盐(Na2SO4和MgSO4)均可显著促进大丽轮枝菌微菌核形成,而CaCl2则显著促进菌丝生长,并在质量浓度大于7 g·L-1时抑制微菌核形成。本研究还发现,在培养基pH为8.0~9.5时,大丽轮枝菌微菌核大量形成。新疆属内陆盐土区,土壤pH及盐分质量浓度均较高,且主要为氯化物-硫酸盐类型盐土[13-14,24]。具备大丽轮枝菌微菌核形成所需的pH及盐分条件。故根据本研究结果可以推知,新疆土壤特殊的pH及盐分条件促进了大丽轮枝菌微菌核大量形成。由于微菌核抗逆性强,会在棉田土壤中长时间存活,致使土壤中黄萎病菌数量大,黄萎病发生的潜在风险大、概率高,进而导致新疆棉区棉花黄萎病发病率较高、长期流行及难以防治。
本研究从盐分及pH对大丽轮枝菌微菌核形成的影响角度,对新疆棉区棉花黄萎病大面积发生的原因及长期流行机制提出了新证据。但该推断需要进一步的土壤微菌核检测结果证实。依据形成微菌核的能力,通常将大丽轮枝菌按菌落形态分为菌丝型、丝核型及菌核型菌株[24]。研究表明,新疆地区的棉花黄萎病菌大丽轮枝菌大多为中等致病类型,菌落类型以丝核型和菌核型为主,微菌核形成量较多[25-26],也是从另一角度对本研究所得上述推论的佐证。
此外,微菌核的快速大量制备是进一步研究其致死温度、发育生物学等的基础[21]。获得大量微菌核的培养方法对棉花黄萎病防治研究有重要意义。而目前尚无简单易行的微菌核快速大量制备方法。故本研究的另一重要价值是:寻找到大丽轮枝菌微菌核大量产生的培养基条件,为微菌核相关研究中微菌核的大量制备提供简易的培养方法。
Reference:
[1]ZHANG W W,JIAN G L,JIANG T F,etal.Cotton gene expression profiles in resistantGossypiumhirsutumcv.Zhongzhimian KV1 responding toVerticilliumdahliaestrain V991 infection [J].MolecularBiologyReports,2012,39(10):9765-9774.
[2]张绪振,张树琴,陈吉棣,等.我国棉花黄萎病菌“种”的鉴定[J].植物病理学报,1981,11(3):149-156.
ZHANG X ZH,ZHANG SH Q,CHEN J D,etal.Identification of Verticillium wilt pathogen of cotton in China [J].ActaPhytopathologicaSinica,1981,11(3):149-156(in Chinese with English abstract).
[3]XU F,YANG L,ZHANG J,etal.Effect of temperature on conidial germination,mycelial growth and aggressiveness of the defoliating and nondefoliating pathotypes ofVerticilliumdahliaefrom cotton in China [J].Phytoparasitica,2012,40(4):319-327.
[4]林 玲,张 昕,邓 晟.棉花黄萎病研究进展[J].棉花学报,2014,26(3):260-267.
LIN L,ZHANG X,DENG SH.Research advances in cotton verticillium wilt [J].ActaGossypiiSinica,2014,26(3):260-267(in Chinese with English abstract).
[5]HU X P,BAI Y W,CHEN T,etal.An optimized method for in vitro production ofVerticilliumdahliaemicrosclerotia [J].EuropeanJournalofPlantPathology,2013,136(2):225-229.
[6]王新艳,张丹丹,桂月晶,等.大丽轮枝菌致病性相关突变体快速筛选体系的建立[J].中国农业科学,2015,48(14):2747-2756.
WANG X Y,ZHANG D D,GUI Y J,etal.Construction of a rapid screening system of pathogenicity-related mutants inVerticilliumdahlia[J].ScientiaAgriculturaSinica,2015,48(14):2747-2756(in Chinese with English abstract).
[7]田 黎,王克荣,陆家云.多菌灵、三环唑对大丽轮枝菌微菌核、黑色素形成及致病力的影响[J].植物病理学报,1998,28(3):263-268.
TIAN L,WANG K R,LU J Y.Effect of carbendazim and tricyclazole on microsclerotia and melanin formation ofVerticilliumdahlia[J].ActaPhytopathologicaSinica,1998,28(3):263-268(in Chinese with English abstract).
[8]WILHELM S.Longevity of Verticillium wilt fungus in the laboratory and field[J].Phytopathology,1955,45:180-181.
[9]贾 涛,杨家荣,邢宏宜,等.棉花黄萎病菌在土壤、植株微生态系中的分布[J].中国农学通报,2005,21(3):275-276.
JIA T,YANG J R,XING H Y,etal.The distribution ofVerticilliumdahliaein cotton in field ecological system [J].ChineseAgriculturalScienceBulletin,2005,21(3):275-276(in Chinese with English abstract).
[10]商文静,魏 锋,冯小军,等.棉田大丽轮枝菌微菌核的空间分布及其抽样技术[J].西北农业学报,2014,23(4):192-197.
SHANG W J,WEI F,FENG X J,etal.Spatial pattern and sampling method for microsclerotia ofVerticilliumdahliaein soil of cotton field [J].ActaAgriculturaeBoreali-occidentalisSinica,2014,23(4):192-197(in Chinese with English abstract).
[11]商文静,陈 婷,白应文,等.大丽轮枝菌微菌核的萌发条件及致死温度[J].菌物学报,2013,32(6):986-992.
SHANG W J,CHEN T,BAI Y W,etal.Germination condition and lethal temperature for microsclerotia ofVerticilliumdahliae[J].Mycosystema,2013,32(6):986-992(in Chinese with English abstract).
[12]杨家荣,商鸿生,高立强.土壤环境因素对棉花黄萎病菌微菌核存活的影响[J].植物病理学报,2004,34(2):180-183.
YANG J R,SHANG H SH,GAO L Q.The effect of soil habitat factors on survival of microsclerotia ofVerticilliumdahliaeof cotton [J].ActaPhytopathologicaSinica,2004,34(2):180-183(in Chinese with English abstract).
[13]刘 蕾.新疆土壤盐分的组成和分布特征[J].干旱环境监测,2009,23(4):227-229.
LIU L.Constitute and distributing character of salinity in soil in Xinjiang [J].AridEnvironmentalMonitoring,2009,23(4):227-229(in Chinese with English abstract).
[14]李晓明,杨劲松,刘梅先,等.南疆膜下滴灌棉花花铃期土壤盐分分布研究[J].土壤,2011,43(2):289-292.
LI X M,YANG J S,LIU M X,etal.Study on soil salt distribution with drip irrigation under mulch in cotton boll period in south Xinjiang [J].Soils,2011,43(2):289-292(in Chinese with English abstract).
[15]张丽萍,宋玉萍,岳永亮,等.棉花黄萎病发生时间动态及与菌量和菌系致病性的关系[J].新疆农业科学,2014,51(8):1468-1473.
ZHANG L P,SONG Y P,YUE Y L,etal.Seansonal dynamic cottonVerticilliumdahliaewilt,correlation analyses between incidence and inoculum density and virulence of strains [J].XinjiangAgriculturalSciences,2014,51(8):1468-1473(in Chinese with English abstract).
[16]程丽娟,薛泉宏,韦革宏,等.微生物学实验技术[M].西安:世界图书出版公司,2000:383-384.
CHENG L J,XUE Q H,WEI G H,etal.Experimental Techniques of Microbiology [M].Xi’an:World Press Company,2000:383-384(in Chinese with English abstract).
[18]沈其益.棉花病害基础研究与防治[M].北京:科学出版社,1992:128-137.
SHEN Q Y.Cotton Disease-basic Research and Protection [M].Beijing:Science Press,1992:128-137(in Chinese).
[19]纪文飞,高智谋,曹 君,等.棉花黄萎病菌菌丝生长和产孢量的影响因素研究[J].安徽农业科学,2006,34(17):4330-4331.
JI W F,GAO ZH M,CAO J,etal.Effect of temperature,pH and nutrient on the mycelia growth and conidial production ofVerticilliumdahliae[J].JournalofAnhuiAgriculturalSciences,2006,34(17):4330-4331(in Chinese with English abstract).
[20]白应文,胡东芳,胡小平,等.大丽轮枝孢微菌核的形成条件[J].菌物学报,2011,30(5):695-701.
BAI Y W,HU D F,HU X P,etal.Formation conditions for microsclerotia ofVerticilliumdahliae[J].Mycosystema,2011,30(5):695-701(in Chinese with English abstract).
[21]MOHANNADI A H,BANIHASHEMI Z,MAFTOUN M.Interaction between salinity stress and Verticillium wilt disease in three pistachio rootstocks in a calcareous soil [J].JournalofPlantNutrition,2007,30(2):241-252.
[22]SAADATMAND A R,BANIHASHEMI Z,SEPASKHAH A R.Soil Salinity and water stress and their effect on susceptibility to Verticillium wilt disease,ion composition and growth of pistachio [J].JournalofPhytopathology,2008,156(5):287-292.
[23]白 霜,薛泉宏,赵邑尘,等.新疆棉区不同含盐土壤棉花健株与黄萎病株根区放线菌研究[J].西北农林科技大学学报(自然科学版),2009,37(7):183-190.
BAI SH,XUE Q H,ZHAO Y CH,etal.Study on actinomycetic ecology between heathy and diseased plants’ rhizosphere with different salt contents in Xinjiang [J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2009,37(7):183-190(in Chinese with English abstract).
[24]田秀明.山西棉花黄萎病菌致病力分化与其类型和生理的关系[J].植物保护,1995,21(3):8-10.
TIAN X M.Pathogenicity differentiation inVerticilliumdahliaerelation to their types and physiology in Shanxi province [J].PlantProtection,1995,21(3):8-10(in Chinese with English abstract).
[25]李国英,霍向东,田新莉,等.新疆棉花黄萎病菌的培养特性及致病性分化的研究[J].石河子大学学报(自然科学版),2000,4(1):9-15.
LI G Y,HUO X D,TIAN X L,etal.A study on culturing characters and pathogenic differentiation ofVeticilliumdahliaefrom cotton in Xinjiang [J].JournalofShiheziUniversity(NaturalScienceEdition),2000,4(1):9-15(in Chinese with English abstract).
[26]努尔孜亚·亚力买买提,刘海洋,玛依拉·吐拉普,等.新疆棉花黄萎病菌生物学特性及致病性分化研究[J].新疆农业科学,2010,47(6):1157-1161.
Nuerziya·yalimaimaiti,LIU H Y,Mayila·tulapu,etal.Study on the biological characteristics and pathogenicity differentiation of cottonVerticilliumdahliaestrains in Xinjiang [J].XinjiangAgriculturalSciences,2010,47(6):1157-1161(in Chinese with English abstract).
EffectofpHandSalinityonMicrosclerotiaFormationofVerticilliumdahliae
XUE Lei1,2,XU Wanli3,GU Meiying4,WANG Jiantao5,LIU Xiangchun5and XUE Quanhong5
(1.College of Life Sciences, Northwest A&F University, Yangling Shaanxi 712100, China;2.Technology Center, China Tobacco Shaanxi Industrial Co.Ltd., Xi’an 710065, China;3.Institute of Soil and Fertilizer & Agricultural Water-Saving, Xinjiang Academy of Agricultural Science, Urumqi 830091,China;4.Institute of Microbiology, Xinjiang Academy of Agricultural Sciences, Urumqi 830091, China;5.College of Natural Resources and Environment, Northwest A&F University, Yangling Shaanxi 712100, China)
Microsclerotia produced byVerticilliumdahliaeare the source of Verticillium wilt disease in cotton and are persisted in the soil as the resting structure of this pathogenic fungus. We determined the effect of pH and salinity onV.dahliaemicrosclerotia formation, which is important for preventing the occurrence of Verticillium wilt disease. In this study, the effects of salinity (mass concentration and type) and pH onV.dahliaemicrosclerotia formation were studied by measuring mycelium growth in altered culture mediums. Colony growth ofV.dahliaewas inhibited atacidic and alkaline pH 5.5-9.5 levels and optimal at pH 7.0.Verticilliumdahliaemicrosclerotia formation was enhanced at alkaline pH, and the area of microsclerotia was 22.6% larger under pH 8.0 than pH 7.0. Mycelium growth and microsclerotia formation ofV.dahliaewere also affected by salinity concentration. With a higher mass concentration of NaCl in the culture medium,V.dahliaecolony growth and mycelium area were inhibited and decreased, respectively, whereas microsclerotia formation was enhanced. The area of microsclerotia in the culture medium with 10 g·L-1of NaCl was 40.7% larger than that in the medium without NaCl.Verticilliumdahliaegrowth was also affected by salt type. With the increasing concentration of chloride (i.e., NaCl, KCl) or sulfate (i.e., Na2SO4, MgSO4) salts in the culture medium,V.dahliaemicrosclerotia formation was increased. In contrast, mycelium growth was enhanced in the presence of CaCl2. Additionally,V.dahliamicrosclerotia formation was inhibited at mass concentrations of CaCl2greater than 7 g·L-1.The results indicated that microsclerotia formation ofV.dahliawas enhanced under alkaline pH or high salinity.
Verticillium wilt; Cotton;Verticilliumdahliae; Microsclerotia; pH;Salinity
2016-07-22
2016-08-25
The National Natural Science Foundation of China (No.31460148, No.41261065); the Key Sci-tech Project of the “12th Five-year-Plan” of China (No.2012BAD05B03).
XUE Lei,male,doctoral student.Research area:microbial resources and utilization.E-mail:xuelei@nwsuaf.edu.cn
S435.62
A
1004-1389(2017)10-1520-09
日期:2017-10-18
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20171018.1733.028.html
2016-07-22
2016-08-25
国家自然科学基金(31460148, 41261065);国家“十二五”重大科技支撑计划(2012BAD05B03)。
薛 磊,男,博士研究生,研究方向为微生物资源与利用。E-mail:xuelei@nwsuaf.edu.cn
薛泉宏,男,教授,博士生导师,研究方向为微生物资源与利用。E-mail:xuequanhong123@163.com
顾美英,女,副研究员,研究方向为微生物资源与利用。E-mail:gmyxj2008@163.com
CorrespondingauthorXUE Quanhong,male,professor,doctoral supervisor.Research area:microbial resources and utilization. E-mail:xuequanhong123@163.com
GU Meiying, female, associate research fellow. Research area:microbial resources and utilization. E-mail:gmyxj2008@163.com
(责任编辑:潘学燕Responsibleeditor:PANXueyan)
