SPE-HPLC-MS/MS检测动物源性食品中金刚烷胺残留
2017-11-10云雅光池永红王硕
云雅光,池永红,王硕
(1.天津科技大学,天津300457;2.包头轻工职业技术学院,内蒙古包头014035)
SPE-HPLC-MS/MS检测动物源性食品中金刚烷胺残留
云雅光1,2,池永红2,王硕1,*
(1.天津科技大学,天津300457;2.包头轻工职业技术学院,内蒙古包头014035)
建立一种固相萃取-高效液相色谱-串联质谱(Solid phase extraction coupled to high performance liquid chromatography tandem mass spectrometry,SPE-HPLC-MS/MS)检测动物源性食品中金刚烷胺残留的方法。研究采用Oasis MCX固相萃取小柱为基质净化柱,以Agilent SB-C18柱(2.1 mm×150 mm,3.5 μm)为液相分离柱,0.1%甲酸-乙腈为(体积比,80∶20)为流动相,流速0.2 mL/min。用电喷雾离子源正离子多反应监测(Multi-reaction monitoring,MRM)模式进行检测,外标法定量。在0.1 μg/L~100.0 μg/L范围内具有较好的线性关系,相关系数>0.999。该方法检出限(Limit of detection,LOD)为 1.0 μg/kg,定量限(Limit of quantitation,LOQ)为 3.0 μg/kg,对 3 个添加浓度(30.0、60.0、90.0 μg/kg)下的鸡胸,鸡肝,鸡蛋,猪肉,羊肉5种样品中金刚烷胺残留的检测具有较高的准确度(回收率在83.6%~94.2%之间)和重现性(RSD<4.0%,n=3)。
金刚烷胺;高效液相色谱串联质谱;固相萃取;动物源性食品;检测
金刚烷胺是人工合成饱和三环癸烷的氨基衍生物,用于亚洲A型流感病毒的预防和早期治疗,也可用于治疗帕金森病引起的神经障碍和预防动物常见的病毒类疾病如禽流感等[1-4]。由于价格低廉,曾广泛运用于禽兽养殖业,长期使用会形成药物残留,从而导致抗药性[5],神经过敏,焦虑,梦魇,间歇性的幻觉等[6]一系列的负作用。我国于2005年12月发布《关于清查金刚烷胺等抗病毒药物的紧急通知》,禁止金刚烷胺等抗病毒药作为兽用药[7],FDA规定禁止将人类抗病毒药物用于畜禽类的防治[8]。因此,为了减少对人类的潜在危害,建立一种简单,廉价,高灵敏性的方法来检测动物源性食品中金刚烷胺的残留是非常必要的。
固相萃取(Solid-Phase Extraction,SPE)是近年发展起来一种样品预处理技术,由液固萃取和柱液相色谱技术相结合发展而来,主要用于样品的分离、纯化和富集,目的在于降低样品基质干扰,提高检测灵敏度。与传统的液液萃取法相比较可以提高分析物的回收率,更有效的将分析物与干扰组分分离,减少样品预处理过程,操作简单、省时、省力。广泛的应用在食品中农兽药及食品添加剂残留、环境及药物代谢等领域的检测。
目前公开发表的检测金刚烷胺残留的文献方法主要有气相色谱法[9-11]、高效液相色谱[12-15]、高效液相色谱串联质谱[16-19],分光光度法[20-22]和电位滴定法[23-24]。HPLC-MS/MS法因具有高效分离和集组分定性、定量于一体等优异性能,成为近年来兽药残留检测方法研究的主要方向。本研究采用固相萃取结合高效液相色谱-串联质谱技术,分别对样品前处理条件(提取剂,固相萃取小柱)及金刚烷胺质谱条件进行了优化,建立了一种简单、快速、准确测定动物源性食品中金刚烷胺残留的方法。
1 材料与方法
1.1 主要仪器与试剂
Agilent LC-1200,Agilent 6410,Triple Quad LC/MS高效液相色谱串联质谱体系:美国Agilent公司;AM-6匀浆组织破碎机:日本NISSEI公司;Centrifuge5804R台式冷冻离心机:德国Eppendorf公司;QL-901振荡器:海门其林贝尔仪器制造有限公司;Oasis MCX,Oasis PCX,Oasis MAX 固相萃取柱:3 cc,60 mg,Waters公司;超纯水系统(18.2 MΩ cm):美国Labconco公司。
金刚烷胺标准品:美国Sigma-Aldrich公司;甲醇、乙醇、乙腈(色谱纯)有机溶剂:天津化学试剂一厂。鸡胸、鸡肝、鸡蛋、猪肉、羊肉:天津某超市。
1.2 液相色谱及质谱条件
高效液相色谱串联质谱体系(Agilent LC-1200;Agilent 6410,Triple Quad LC/MS;USA)。
色谱条件:色谱柱为Agilent SB-C18柱(2.1 mm×150 mm,3.5 μm;),流速为0.2 mL/min,柱温为25℃。流动相由乙腈和0.1%甲酸的混合溶液(体积比:20/80)组成。进样量为1 μL。此外,流动相在使用前需要经过0.22 μm滤膜进行过滤处理。
质谱条件:电喷雾离子源(ESI),干燥器温度350℃,雾化气为N2,流速10 L/min,雾化气压力40 psi(1 psi=6.895×103Pa),毛细管电压 4.0 kV,碰撞气为 N2,多反应检测模式(MRM)。金刚烷胺的质谱图见图1。
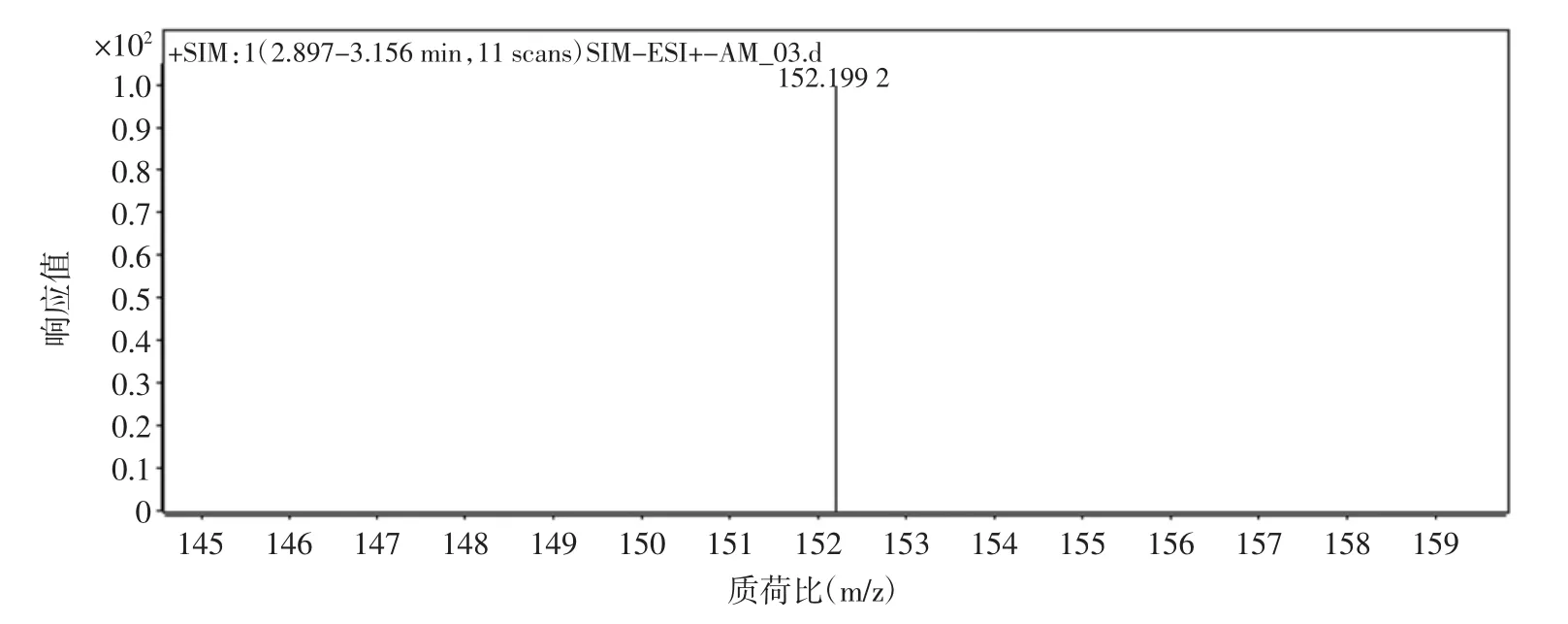
图1 金刚烷胺[M+H]+的分子离子质谱图Fig.1 Product ion mass spectrum diagram of amantadine
1.3 标准溶液的配制
准确称金刚烷胺标准品0.010 g,溶解于10 mL甲醇中,并定容到100 mL,摇匀即得100.0 mg/L标准品储备液,4℃冷藏,储存期一个月。
准确量取金刚烷胺标准品储备液1.0 mL,用甲醇稀释定容至100 mL,即得1.0 mg/L标准工作液。取8个10 mL容量瓶,分别加入标准工作液1.0、5.0、10.0、50.0、100.0、250.0、500.0、1 000 μL,加甲醇定容至刻度,摇匀,即得到浓度为 0.1、0.5、1.0、5.0、10.0、25.0、50.0、100.0 μg/L 系列标准溶液。
1.4 样品前处理
本研究选用5种不同的样品基质(鸡胸,鸡肝,鸡蛋,猪肉,羊肉)均购于天津本地某超市。
样品预处理过程如下:准确称取2.00 g(精确到0.01 g)粉碎的样品,置于50 mL离心管中,加入10 mL乙腈-1%三氯乙酸(体积比,1∶1)溶液。然后将获得的混合物涡旋2 min,超声30 min,在-4℃下10 000 r/min离心10 min。然后将上清液转移到试管中用于固相萃取净化。
净化过程如下:先用3.0 mL甲醇和3.0 mL双蒸水活化萃取柱,流速均为15 mL/min。取5.0 mL提取液上柱,流速为1.0 mL/min。依次用2%盐酸和甲醇各3.0 mL来淋洗,流速为1.0 mL/min。然后用5.0 mL氨水-甲醇-异丙醇(体积比,5∶90∶5)来洗脱,流速为1.0 mL/min。将洗涤液转移到试管中,氮气吹干。获得的残渣用1.0 mL甲醇进行复溶,再经0.22 μm滤膜过滤后用于高效液相色谱串联质谱方法分析。
2 结果与分析
2.1 前处理条件的优化
对浓度为1.0 μg/L的金刚烷胺标准溶液,在相同的实验条件下,分别使用甲醇-1%三氯乙酸(体积比,1∶1)、乙腈-1%三氯乙酸(体积比,1∶1)、1%乙酸乙腈、1%甲酸乙腈、甲醇和乙腈作为提取液,通过回收率来对比提取效果,结果如图2。
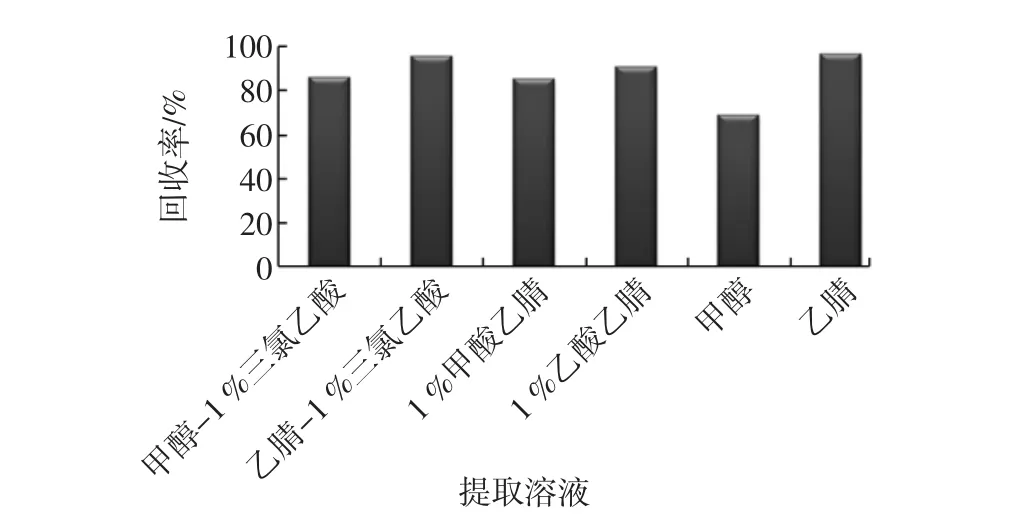
图2 不同提取溶剂对金刚烷胺提取效果的影响(n=3)Fig.2 The influence of different extraction solvents on the amantadine extraction efficiency(n=3)
可见,采用乙腈-1%三氯乙酸(体积比,1∶1)和纯乙腈的提取的回收率最高,但考虑到实际样品中存在蛋白及脂肪,因而本方法选择乙腈-1%三氯乙酸(体积比,1 ∶1)作为提取液。
试验采用空白样品加标的方式,比较了WatersOasis PCX(3 mL,60 mg)、Waters Oasis MCX(3 mL,60 mg)、Waters Oasis MAX(3 mL,60 mg)3种固相萃取柱的净化效果,结果表明,在 0.5,2.0,20.0 μg/kg 3 个加标水平下,Waters Oasis PCX、Waters Oasis MAX小柱的平均回收率分别为83.7%和73.0%,而Oasis MCX的平均回收率均在96.5%以上,试验结果见表1。最终试验选择采用Waters Oasis MCX(3 mL,60 mg)固相萃取小柱净化样品。

表1 金刚烷胺回收率和相对标准偏差(RSD)(n=3)Table 1 Recoveries and RSDs of amantadine standard with different SPE column(n=3)
2.2 质谱条件优化与选择
金刚烷胺盐酸盐溶于水后,极易得到H+,形成稳定的[M+H]+准分子离子,选择正离子电离(ESI+)方式,对金刚烷胺进行质谱条件的优化。先对金刚烷胺进行一级质谱扫描,得到相应的母离子峰;再对其进行二级质谱扫描,得到子离子信息。然后,在选择多反应监测(MRM)模式下对得到离子对进行质谱参数优化。试验结果表明,在电喷雾正离子模式下,金刚烷胺可以生成[M+H]+(m/z152.1)分子离子峰,试验对喷雾电压,锥孔电压,碰撞电压等质谱条件进行优化,得到定性离子对 152.1/135.1,152.1/93.1,152.1/79.1 效果较好,试验结果见表2。金刚烷胺的二级质谱图见图3。

表2 金刚烷胺的质谱参数Table 2 Mass spectrometer conditions of Amantadine
2.3 标准曲线的绘制及实际样品检测
按照1.3所示方法配制不同浓度(X,μg/L)的金刚烷胺分析物的标准工作液,并按试验所列色谱及质谱条件进行分析测定。在0.1 μg/L~100.0 μg/L范围内呈良好线性关系(R2>0.999),标准曲线分别为:Y=1.021X+0.111。试验数据确定本方法的定量限(LOQ)为 3.0 μg/kg。
研究中以鸡胸,鸡肝,鸡蛋,猪肉,羊肉为代表的动物源性食品进行添加回收试验,以考察所建立的基质净化方法及金刚烷胺检测方法的实际应用能力。准确称取的鸡胸,鸡肝,鸡蛋,猪肉,羊肉样品各2.0 g,分别进行金刚烷胺浓度为 30.0、60.0、90.0 μg/kg的浓度添加,每个浓度平行3个,样品前处理过程如上所述。基质提取液上机分析取峰面积根据标准曲线计算目标分析物的浓度,以加入量与测得量之比计算回收率及相对标准偏差。结果如表3所示。
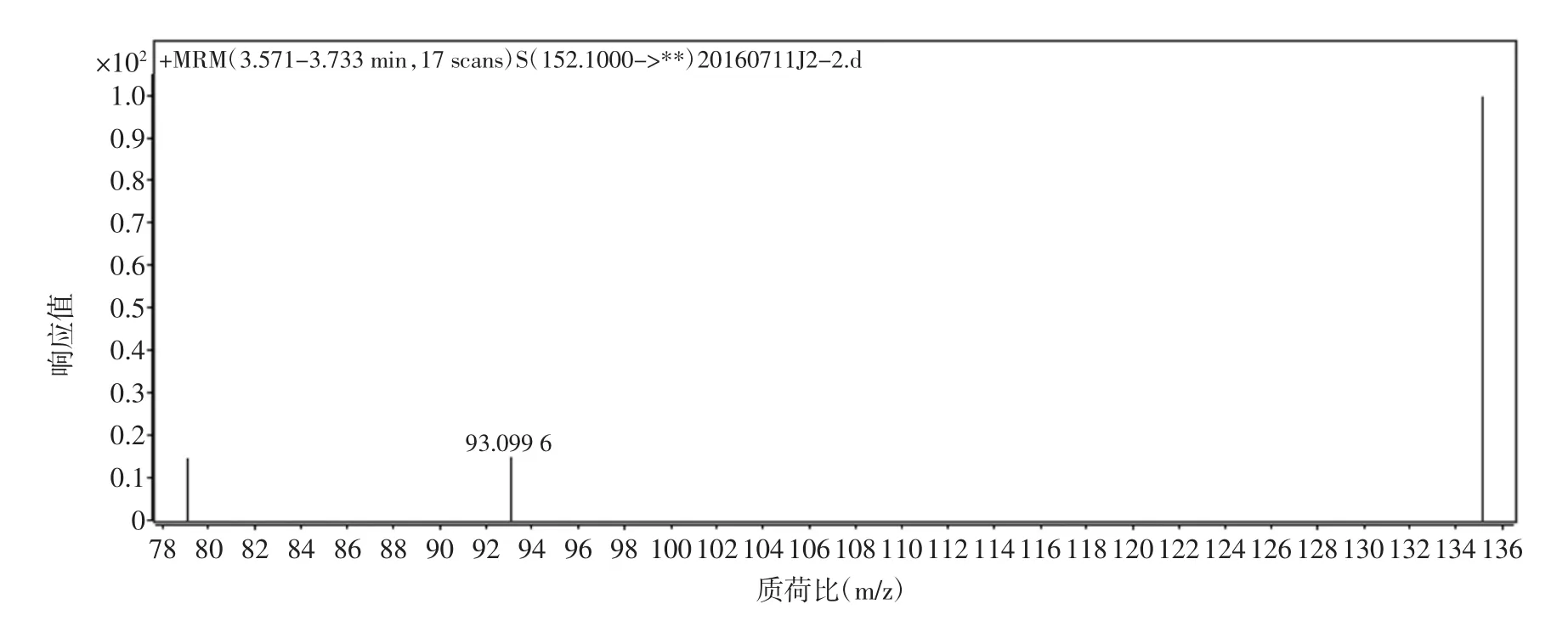
图3 金刚烷胺的二级质谱图Fig.3 Product ion mass spectrum diagram of amantadine
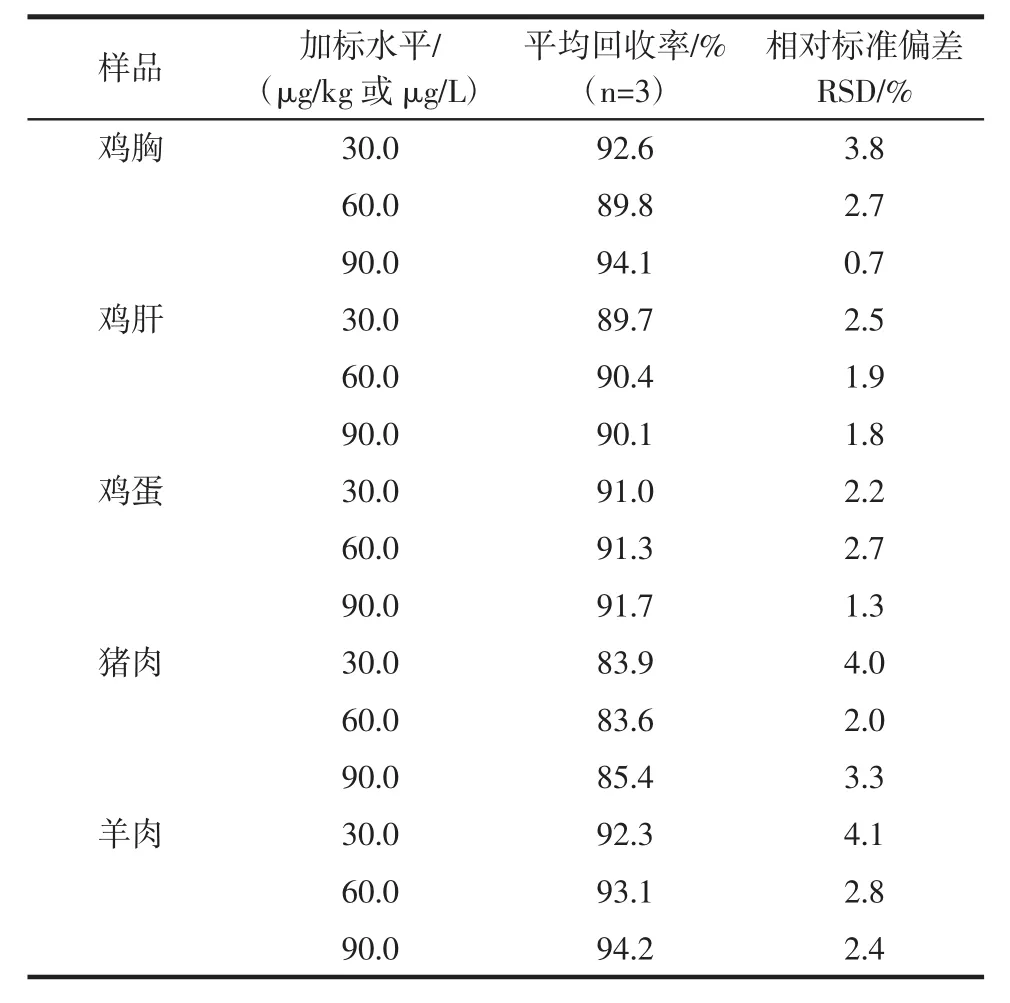
表3 样品中金刚烷胺的回收率及相对标准偏差(n=3)Table 3 Recoveries and relative standard deviation(RSDs)of amantadine in different samples(n=3)
3 结论
本研究建立了一种固相萃取结合高效液相色谱串联质谱法测定鸡胸,鸡肝,鸡蛋,猪肉,羊肉中金刚烷胺残留的方法。通过对各项参数的试验,找出最佳的提取和净化方法,对各项参数的调谐,使仪器检测灵敏度达到最优化。对于分析物的线性范围在0.1 μg/L~100.0 μg/L时的相关系数大于0.999;选定的5种动物源性食品中金刚烷胺的加标回收率在83.6%~94.2%之间;相对标准偏差小于4.0%。该方法具有简便、快捷、精密度和准确性高的特点,可以作为检验检疫行业动物源性食品中金刚烷胺残留量的检测方法。
[1] 葛孝忠,应黄慧,陈晓,等.金刚烷类药物的研究进展[J].中国医药工业杂志,2003,34(11):583-586
[2] 包鸿俊.浅谈抗病毒药在兽医上的应用[J].畜牧与兽医,2002,34(6):1-3
[3] Chew CF,Guy A,Biggin PC.Distribution and Dynamics of Adamantanes in a Lipid Bilayer[J].Biophys J,2008,95:5627-5736
[4] Tominack R,Hayden F.Rimantadine hydrochloride and amantadine hydrochloride use in influenza A virus infections[J].Infectious disease clinics of North America,1987,1:459-478
[5] Wu YL,Chen RX,Xue Y,et al.Simultaneous determination of amantadine,rimantadine and memantine in chicken muscle using multi-walled carbon nanotubes as a reversed-dispersive solid phase extraction sorbent[J].Journal of chromatography B,Analytical technologies in the biomedical and life sciences,2014,965:197-205
[6] He G,Qiao J,Dong C,et al.Amantadine-resistance among H5N1 avian influenza viruses isolated in Northern China[J].Antiviral research,2008,77:72-76
[7] 李秋,王珊.抗病毒药物的研究进展[J].医药导报,2011,6(30):732
[8]FDA Prohibits.Use of Antiviral Drugs in Poultry to Help Keep Drugs Effective for Humans[EB/OL].2009-06-l8.http://www.fda.Gov/NewsEvents/Newsroom/PressAnnouncements/2006/ucml08620
[9] Farajzadeh MA,Nouri N,Alizadeh Nabil AA.Determination of amantadine in biological fluids using simultaneous derivatization and dispersive liquid-liquid microextraction followed by gas chromatography-flame ionization detection[J].Journal of chromatography B,Analytical technologies in the biomedical and life sciences,2013,940:142-149
[10]Leis HJ,Windischhofer W.Determination of memantine in human plasma by GC using negative ion chemical ionization MS detection after derivatization with a new reagent[J].Microchimica Acta,2012,178:309-314
[11]徐文彤.气相色谱法测定硫酸金刚烷胺的含量[J].中国药师,2007,10(1):1082-1083
[12]Van Der Horst FAL,Teeuwsen J,Holthuis JJM,et al.High-performance liquid chromatographic determination of amantadine in urine after micelle-mediated pre-column derivatization with 1-fluoro-2,4-dinitrobenzene[J].Journal of Pharmaceutical and Biomedical Analysis,1990,8:799-804
[13]Duh TH,Wu HL,Pan CW,et al.Fluorimetric liquid chromatographic analysis of amantadine in urine and pharmaceutical formulation[J].Journal of Chromatography A,2005,1088:175-181
[14]朱胜平,钟华,何飞,等.高效液相色谱法测定盐酸美金刚烷胺片的含量[J].中南药学,2005,3(4):209-210
[15]裴璐,张爱兵.高效液相色谱-蒸发光散射检测器法测定盐酸金刚烷胺片中盐酸金刚烷胺含量[J].中国药业,2012,21(24):59-60
[16]Arndt T,Guessregena B,Hohla A,et al.Determination of serum amantadine by liquid chromatography-tandemmass spectrometry[J].Clinica Chimica Acta,2005,359:125-131
[17]陈慧华,韦敏珏,周炜,等.液相色谱-串联质谱法测定动物组织中金刚烷胺和金刚乙胺的残留量[J].质谱学报,2013,34(4):226-232
[18]刘正才,杨方,余孔捷.液相色谱-电喷雾串联质谱法同时检测鸡组织中5种抗病毒类药物的残留量[J].色谱,2012,30(12):1253
[19]Yan H,Liu X,Cui F,et al.Determination of amantadine and rimantadine in chicken muscle by QuEChERS pretreatment method and UHPLC coupled with LTQ Orbitrap mass spectrometry[J].Journal of chromatography B,Analytical technologies in the biomedical and life sciences,2013,938:8-13
[20]Dou Y,Sun Y,Ren Y,et al.Simultaneous non-destructive determination of two components of combined paracetamol and amantadine hydrochloride in tablets and powder by NIR spectroscopy and artificial neural networks[J].J Pharm Biomed Anal 2005,37:543-549
[21]A Darwish,A S Khedr,H F Askal,et al.Simple and sensitive spectrophotometric methods for determination of amantaadine hydrochloride[J].Journal of Applied,2006,73(6):792-797
[22]Higashi Y,Nakamura S,Matsumura H,et al.Simultaneous liquid chromatographic assay of amantadine and its four related compounds in phosphate-buffered saline using 4-fluoro-7-nitro-2,1,3-benzoxadiazole as a fluorescent derivatization reagent[J].Biomedical Chromatography,2006,20:423-428
[23]Nour T Abdel-Ghani,Adel F Shoukry,Salwa H Hussein.Flow injection potentiometric determination of amantadine HCl[J].Journal of Pharmaceutical and Biomedical Analysis,2002,30(3):601-611
[24]Amorim CG,Araújo AN,Montenegro MCBSM,et al.Sequential Injection Lab-on-Valve Procedure for the Determination of Amantadine Using Potentiometric Methods[J].Electroanalysis,2007,19:2227-2233
Determination of Amantadine in Animal-derived Food by Combining SPE with HPLC-MS/MS
YUN Ya-guang1,2,CHI Yong-hong2,WANG Shuo1,*
(1.Tianjin University of Science and Technology,Tianjin 300457,China;2.Baotou Light Industry Vocational Technical College,Baotou 014035,Inner Mongolia,China)
An accurate and sensitive method for the detection of amantadine(AM)residues in animal-derived food products was developed by combining solid-phase extraction with high performance liquid chromatography-tandem mass spectrometry(SPE-HPLC-MS/MS).The Oasis MCX solid-phase extraction column was used for complex matrix purification and Agilent SB-C18 column(2.1 mm ×150 mm,3.5 μm)was employed for separation in liquid chromatography using a mobile phase consisting of 0.1%formic acid and acetonitrile(80∶20,volume ratio)with the flow rate 0.2 mL/min.The electrospray ionization (ESI)source in the positive mode and the multiple-reaction monitoring(MRM)mode were used for the quantitative analysis with external standard method.The results showed that the calibration curves were in good linearity for the AM ranged from 0.1 μg/L to 100 μg/L with the correlation coefficients(R2)> 0.999.The limits of detection(LODs)and the limits of quantification (LOQs)of this method were 1.0 μg/kg and 3.0 μg/kg respectively.The average recovery rates were from 83.6%to 94.2%with the good relative standard deviations (RSDs,RSD<4.0%,n=3)in chosen chicken mus cle,chicken liver,egg,beef and mutton samplesat three standard addition levelsof 30.0,60.0,and 90.0 μg/kg.
amantadine(AM);high performance liquid chromatography-tandem mass spectrometry(HPLCMS/MS);solid-phase extraction(SPE);animal-derived food;detection
10.3969/j.issn.1005-6521.2017.22.034
云雅光(1981—),女(蒙古),讲师,硕士,研究方向:食品科学和食品检测。
*通信作者:王硕(1969—),男,教授,博导,研究方向:食品科学。
2017-03-14
