尖裸鲤病变死亡后微生物群落结构变化分析
2017-11-09陈美群李宝海周建设潘瑛子扎西拉姆王万良
陈美群,李宝海,周建设,潘瑛子,扎西拉姆,王万良
(1.西藏自治区农牧科学院水产研究所,西藏 拉萨 850032;2.西藏自治区农牧科学院,西藏 拉萨 850032)
尖裸鲤病变死亡后微生物群落结构变化分析
陈美群1,李宝海2*,周建设1,潘瑛子1,扎西拉姆1,王万良1
(1.西藏自治区农牧科学院水产研究所,西藏 拉萨 850032;2.西藏自治区农牧科学院,西藏 拉萨 850032)
【目的】本文探讨了尖裸鲤因水霉菌病变死亡后的微生物群落结构变化特征。【方法】采用Illumina-Miseq高通量测序技术对尖裸鲤健康个体和因水霉菌病变死亡个体的表皮皮肤粘液及肠道内容物的微生物多样性进行分析。【结果】尖裸鲤因水霉菌病变死亡后其表皮皮肤和肠道中细菌群落多样性减少,而其真菌多样性增加。尖裸鲤病变死亡后其表皮皮肤粘液中Pseudomonassp.、Vagococcussp.、Providenciasp.、Morganellasp.、Pleosporales、Mucorales、Tremellales和Agaricomycetes等8种优势微生物菌群减少,而Acinetobactersp.、Proteussp.、Carnobacteriumsp.和Malasseziasp.等4种优势微生物菌群增加。同时,尖裸鲤病变死亡后其肠道中Acinetobactersp.、Flavobacteriumsp.、Vagococcussp.、Carnobacteriumsp.、Bacillussp.和Malasseziasp.等6种优势微生物菌群减少,而Pseudomonassp.、Tremellales和Agaricomycetes等3种优势微生物菌群增加。【结论】细菌和真菌的群落结构变化是尖裸鲤病变死亡的主要原因。
高通量测序;尖裸鲤;微生物群落;水霉病
【研究意义】尖裸鲤(Oxygymnocyprisstewarti)属鲤形目(Cypriniformes)、鲤科(Cyprinidae)、裂腹鱼亚科(Schizothoracinae)、尖裸鲤属(Oxygymnocypris),俗称斯氏裸鲤鱼,仅分布于我国西藏地区3600 m以上的雅鲁藏布江中游及其支流中,为我国特有物种[1]。尖裸鲤肉质细腻、脂质含量高,是西藏地区重要的经济鱼类之一。【前人研究进展】目前有关尖裸鲤的研究主要集中在生物地理学、系统分类学、种群生态学、胚胎发育、食性组成和肌肉营养组成等方面[2-4],而对其微生物群落的分析研究未见报道。大量研究表明鱼类肠道及其表皮微生物群落是鱼类的重要组成部分,可直接影响鱼类的正常生长发育、生理平衡和病理变化等[5-6],深入研究鱼类微生物群落组成多样性对其人工驯化和疾病防控具有重要意义。【本研究切入点】本文采用高通量测序技术研究分析西藏尖裸鲤因水霉菌引起病变死亡前后其表皮和肠道中微生物群落的变化特征。【拟解决的关键问题】探讨在尖裸鲤病变死亡过程中起主要作用的微生物种类,以期为尖裸鲤的人工养殖及其疾病防控提供研究基础。
1 材料与方法
1.1 供试材料
健康尖裸鲤样品于2015年3月用拖网法采集于雅鲁藏布江贡嘎江段,然后于西藏农科院水产养殖基地驯养池驯养2个月;病变死亡尖裸鲤样品于2015年5月采集于西藏农科院水产养殖基地驯养池,在尖裸鲤死亡后1 h内采集样品(病变死亡尖裸鲤病理特征主要表现为表皮皮肤斑点状溃疡并长有白色水霉菌,斑点状溃疡病变皮肤较易脱落并显露肌肉组织,背鳍和尾鳍等部位出现红色小斑点并伴有肌肉组织腐烂、残缺等症状)。在无菌条件下分别用50 mL灭菌离心管收集5条健康尖裸鲤[体重:(161.7 ± 2.0 )g,体长:(26 ± 0.8 )cm] 和5条病变死亡尖裸鲤 [体重:(159.5 ± 1.5)g,体长:(28 ± 0.7)cm]的表皮皮肤粘液及肠道内容物样品,分别编号为试验样品5号(健康尖裸鲤表皮皮肤粘液样品)、试验样品6号(健康尖裸鲤肠道内容物样品)、试验样品7号(病变死亡尖裸鲤表皮斑点状溃疡区皮肤粘液样品)、试验样品8号(病变死亡尖裸鲤肠道内容物样品),所有样品于-20 ℃保藏备用。
1.2 试验方法
1.2.1 基因组DNA的提取 采用TIANGEN公司土壤基因组DNA提取试剂盒(DP336)提取尖裸鲤表皮皮肤粘液和肠道内容物样品中微生物的总DNA,具体步骤按说明书操作。所提取的DNA于-20 ℃保藏备用。
1.2.2 细菌16S rDNA-V3区的PCR扩增及测序 用提取的总DNA为模板,采用细菌V3区通用引物 338F/518R(表1)扩增目的片段,PCR扩增体系(50 μl)如下:10×Buffer 5 μl,dNTP(2.5 mM)4 μl,引物各1 μl,TakaRaTaq(5 U/μl) 0.25 μl,模板1 μl,无菌水37.75 μl。扩增条件:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min,4 ℃保存。取2 μl PCR产物,2 % 琼脂糖凝胶电泳检测。将PCR扩增产物送至北京亿鸣复兴生物科技有限公司进行测序,测序平台为Illumina Miseq。
1.2.3 真菌18S rDNA部分片段的PCR扩增及测序 用提取的总DNA为模板,采用巢式PCR扩增法扩增真菌18S rDNA区目的片段。巢式PCR第一轮扩增采用GeoA2/Geo11引物(表1),PCR扩增体系(50 μl)如下:10×Buffer 5 μl,dNTP(2.5 mM) 4 μl,引物各1 μl,TakaRaTaq(5 U/μl) 0.25 μl,模板1μl,无菌水37.75 μl。扩增条件:94 ℃预变性5 min;94 ℃ 30 s,59 ℃ 1 min,72 ℃ 1.5 min,30个循环;72 ℃延伸10 min,扩增产物采用Min Elute PCR Purefication Kit 纯化后4 ℃保存。巢式PCR第二轮扩增采用F-Primer/R-Primer引物(表1),PCR扩增体系(50 μl)如下:10×Buffer 5 μl,dNTP(2.5 mM) 4 μl,引物各1 μl,TakaRaTaq(5 U/μl) 0.25 μl,模板38.75 μl。扩增条件:94 ℃预变性10 min;94 ℃ 30 s,59 ℃ 30 s,72 ℃ 1 min,10个循环;94 ℃ 30 s,47 ℃ 30 s,72 ℃ 1 min,27个循环;72 ℃延伸10 min, 4 ℃保存。取2 μl PCR产物,2 %琼脂糖凝胶电泳检测。将PCR扩增产物送至北京亿鸣复兴生物科技有限公司进行测序,测序平台为Illumina Miseq。
1.2.4 生物信息学分析 采用CASAVA(v1.8.2)软件对原始测序结果图像进行图像碱基识别,原始数据经过预处理去除低质量的序列后应用Pandaseq(v2.7)和Trimmomatic(v0.33)软件进行数据优化分析,获得高质量序列数据。计算在 97 % 的相似水平上每个样本的操作分类单元(OTU)数量,并绘制稀疏曲线[7]。利用Qiime(v1.9)软件计算样品包括Chaol指数和Shannon指数的α多样性值,其Chaol指数值越高表明群落物种的丰富度越高,Shannon指数值越高表明群落物种的多样性越高[8]。
2 结果与分析
2.1 样品物种丰度及多样性分析
通过 Illumina高通量测序,5号样品得到的高质量细菌和真菌序列分别为225 662和97 654条,6号样品分别为15 828和203 285条,7号样品分别为82 362和19 187条,8号样品分别为42 880和14 592条。所有样品在给定非相似度97 %的水平上进行OTU归并,5号样品分别得到6133个细菌OTU和742个真菌OTU,6号样品分别得到1701个细菌OTU和1375个真菌OTU,7号样品分别得到2850个细菌OTU和367个真菌OTU,8号样品分别得到1832个细菌OTU和148个真菌OTU。从图1可见,6号细菌样品的稀释曲线(rarefaction curves)未进入平台期,表明随着测序数量的增加新的细菌种类将被发现;其余样品的稀释曲线均已未进入平台期,能够较好的反映样品中微生物群落组成多样性。
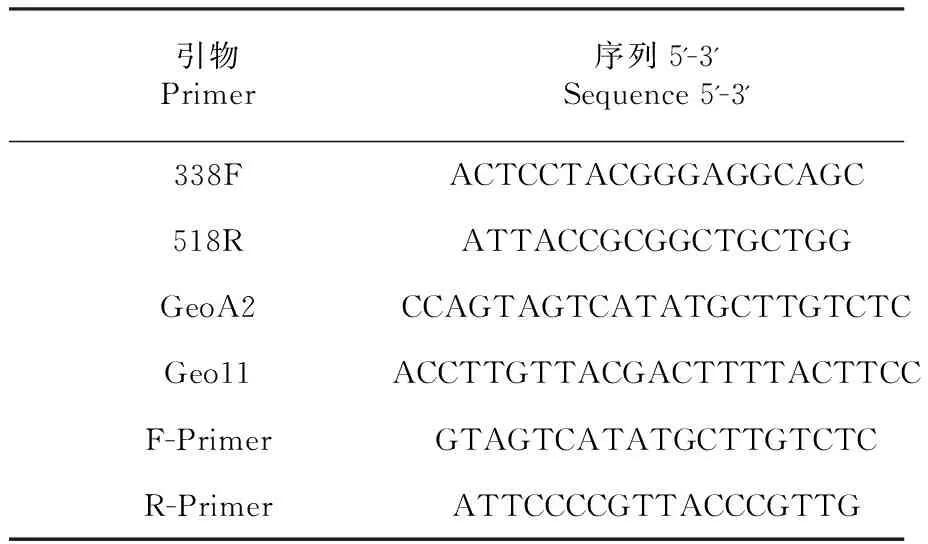
表1 扩增所用PCR引物
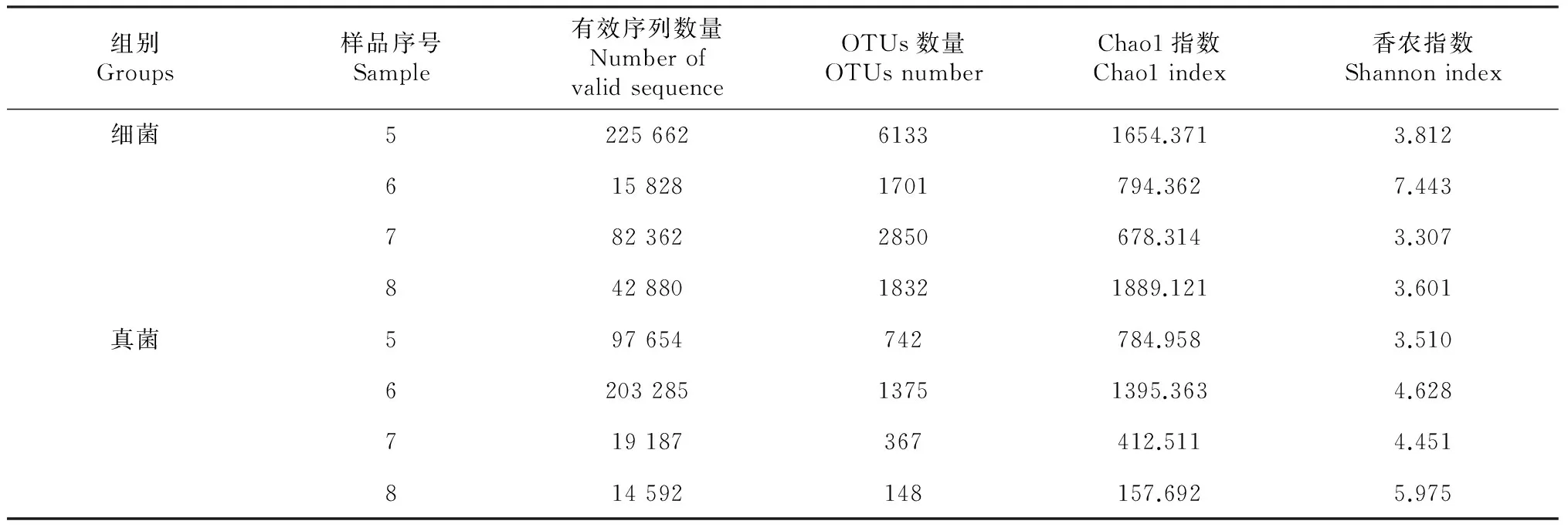
表2 各组样品的OTUs数量及Alpha多样性
通过Chaol指数和Shannon指数对样品的丰度及多样性进行比较分析(表2),5号样品的细菌和真菌Chaol指数数值均较7号样品高,可见5号样品的细菌和真菌含量均大于7号样品;5号样品的细菌Shannon指数数值大于7号样品,而5号样品的真菌Shannon指数数值小于7号样品,可见5号样品较7号样品具有较高的细菌群落多样性和较低的真菌群落多样性。6号样品的细菌Chaol指数小于8号样品,其真菌Chaol指数大于8号样品,可见6号样品的细菌含量小于8号样品(可能是由于6号细菌样品测序深度不够,导致其细菌OTU数量偏少),而其真菌含量大于8号样品;6号样品的细菌Shannon指数数值大于8号样品,而6号样品的真菌Shannon指数数值小于8号样品,可见6号样品较8号样品具有较高的细菌群落多样性和较低的真菌群落多样性。α多样性指数分析表明:尖裸鲤病变死亡后其表皮皮肤和肠道中细菌群落多样性减少,而其真菌多样性增加。
2.2 尖裸鲤病变死亡后细菌群落结构变化分析
将各样品中丰度较高的细菌16S rDNA 序列进行BLAST同源性比较分析。在属分类水平上,5号样品优势类群(相对丰度>2.0 %)主要包括漫游球菌属(Vagococcussp. 36.37 %)、普罗威登斯菌属(Providenciasp. 20.24 %)、摩根氏菌属(Morganellasp. 16.20 %)、假单胞杆菌属(Pseudomonassp. 12.46 %)和不动杆菌属(Acinetobactersp. 4.96 %)。7号样品优势类群主要包括漫游球菌属(32.18 %)、变形杆菌属(Proteussp. 25.91 %)、摩根氏菌属(11.99 %)、假单胞杆菌属(7.95 %)、不动杆菌属(6.65 %)和肉杆菌属(Carnobacteriumsp. 4.83 %)。5和7号样品比较分析表明:尖裸鲤病变死亡后其表皮皮肤粘液中Pseudomonassp.、Vagococcussp.、Providenciasp.、Morganellasp.等4种优势菌群减少,相对丰度分别减少4.51 %、4.19 %、19.41 %和4.21 %;同时Acinetobactersp.、Proteussp.、Carnobacteriumsp.等3种优势菌群增加,相对丰度分别增加1.69 %、25.26 %和4.11 %。6号样品优势类群主要包括假单胞杆菌属(55.64 %)、不动杆菌属(9.38 %)、黄杆菌属(Flavobacteriumsp. 7.47 %)、漫游球菌属(6.09 %)、肉杆菌属(5.42 %)和芽孢杆菌属(Bacillussp. 4.36 %),8号样品优势类群为假单胞杆菌属(94.70 %)。6和8号样品比较分析表明:尖裸鲤病变死亡后其肠道中Acinetobactersp.、Flavobacteriumsp.、Vagococcussp.、Carnobacteriumsp.和Bacillussp.等5种优势菌群减少,相对丰度分别减少7.85 %、7.37 %、5.89 %、5.38 %和4.27 %;同时Pseudomonassp.优势菌群增加,其相对丰度增加39.06 %(表3)。
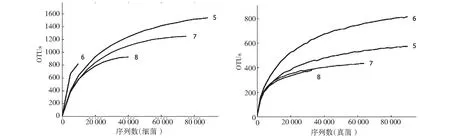
图1 尖裸鲤样品中细菌和真菌的稀释曲线Fig.1 Rarefaction analysis of pyrosequencing reads in bacteria and fungi from Oxygymnocypris stewart samples
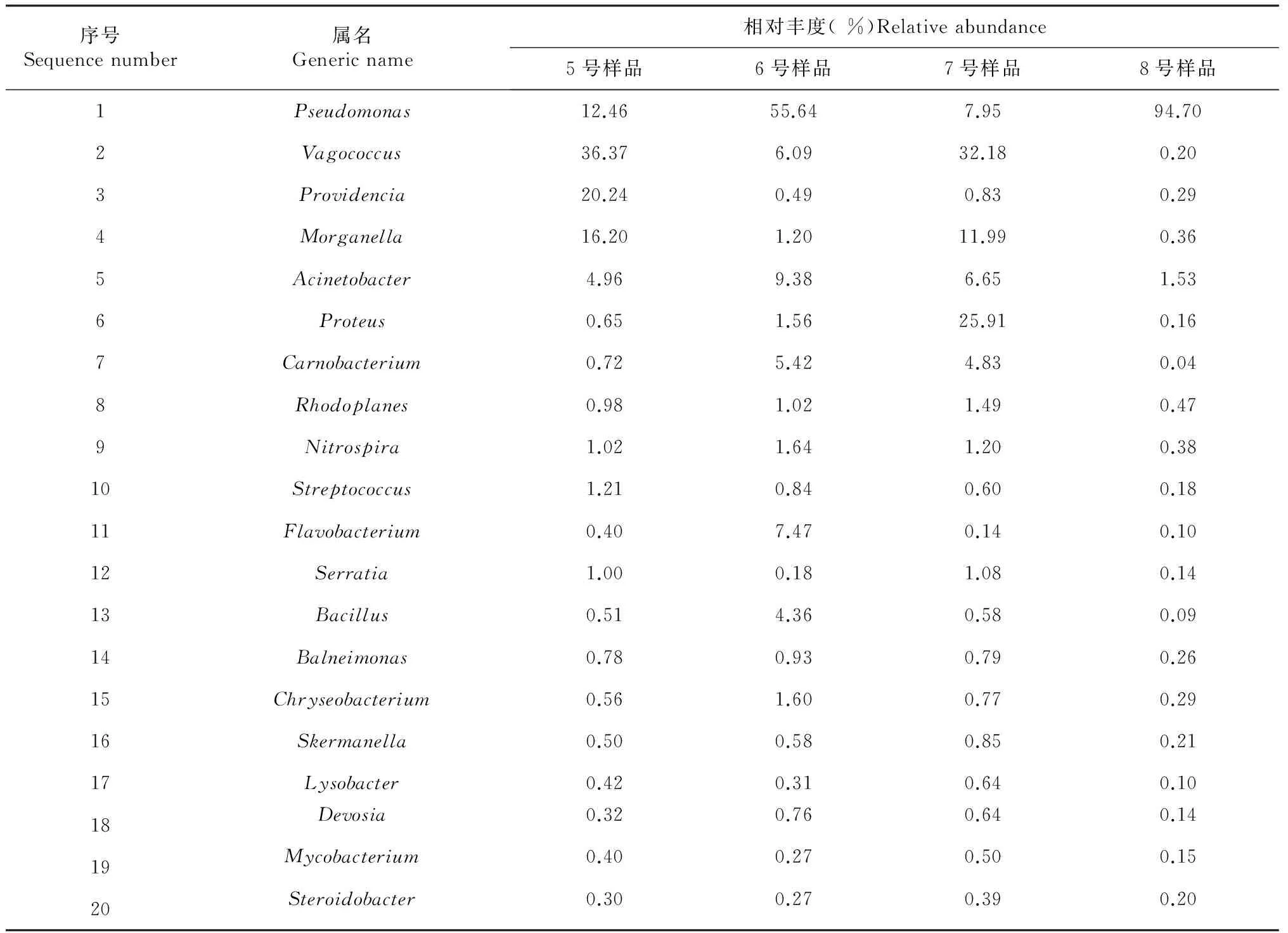
序号Sequencenumber属名Genericname相对丰度(%)Relativeabundance5号样品6号样品7号样品8号样品1Pseudomonas12.4655.647.9594.702Vagococcus36.376.0932.180.203Providencia20.240.490.830.294Morganella16.201.2011.990.365Acinetobacter4.969.386.651.536Proteus0.651.5625.910.167Carnobacterium0.725.424.830.048Rhodoplanes0.981.021.490.479Nitrospira1.021.641.200.3810Streptococcus1.210.840.600.1811Flavobacterium0.407.470.140.1012Serratia1.000.181.080.1413Bacillus0.514.360.580.0914Balneimonas0.780.930.790.2615Chryseobacterium0.561.600.770.2916Skermanella0.500.580.850.2117Lysobacter0.420.310.640.1018Devosia0.320.760.640.1419Mycobacterium0.400.270.500.1520Steroidobacter0.300.270.390.20
2.3 尖裸鲤病变过程中真菌群落结构变化分析
将各样品中丰度较高的真菌18S rDNA 序列进行BLAST同源性比较分析。在各分类水平上,5号样品优势类群(相对丰度>1.0 %)主要包括马拉色霉菌属(Malasseziasp. 84.337 %)、格孢腔菌目(Pleosporales 5.384 %)、毛霉目(Mucorales 4.234 %)、银耳目(Tremellales 1.948 %)和伞菌纲(Agaricomycetes 1.149 %),7号样品优势类群主要为马拉式霉菌属(95.158 %)和银耳目(1.347 %)。5号和7号样品比较分析表明:尖裸鲤病变死亡后其表皮皮肤粘液中Pleosporales、Mucorales、Tremellales和Agaricomycetes等4种优势菌群减少,相对丰度分别减少5.157 %、4.223 %、0.601 %和0.635 %;同时Malasseziasp.优势菌群增加,其相对丰度增加10.821 %。6号样品优势类群为马拉色霉菌属(95.193 %)和银耳目(1.508 %),8号样品优势类群为马拉式霉菌属(81.579 %)、银耳目(10.526 %)和伞菌纲(2.632 %)。6号和8号样品比较分析表明:尖裸鲤病变死亡后其肠道中Malasseziasp. 菌群减少,相对丰度减少13.614 %,同时Tremellales和Agaricomycetes优势菌群增加,其相对丰度增加分别为8.748 %和1.818 %(表4)。
此外样品中还发现有蛛形纲(Arachnida)、类帕金虫生物(Pseudoperkinsidae)、线蚓科(Enchytraeidae) 和硬骨鱼纲(teleostei)等动物的存在。其中8号样品中蛛形纲(Arachnida)丰度明显高于其他3个样品,可能是因为尖裸鲤死亡后其肠道微生态环境失衡,被尖裸鲤当做食物摄取的蛛形纲等动物的残存受精卵开始发育导致。Pseudoperkinsidae[9]是一类类似帕金虫生物的病原生物,在尖裸鲤死亡过程中可能起重要作用。线蚓科(Enchytraeidae) 和硬骨鱼纲(teleostei)的存在为尖裸鲤摄食所致。由此表明尖裸鲤死亡过程中真菌、病原原生生物和寄生腐生动物都起着不可估量的作用。
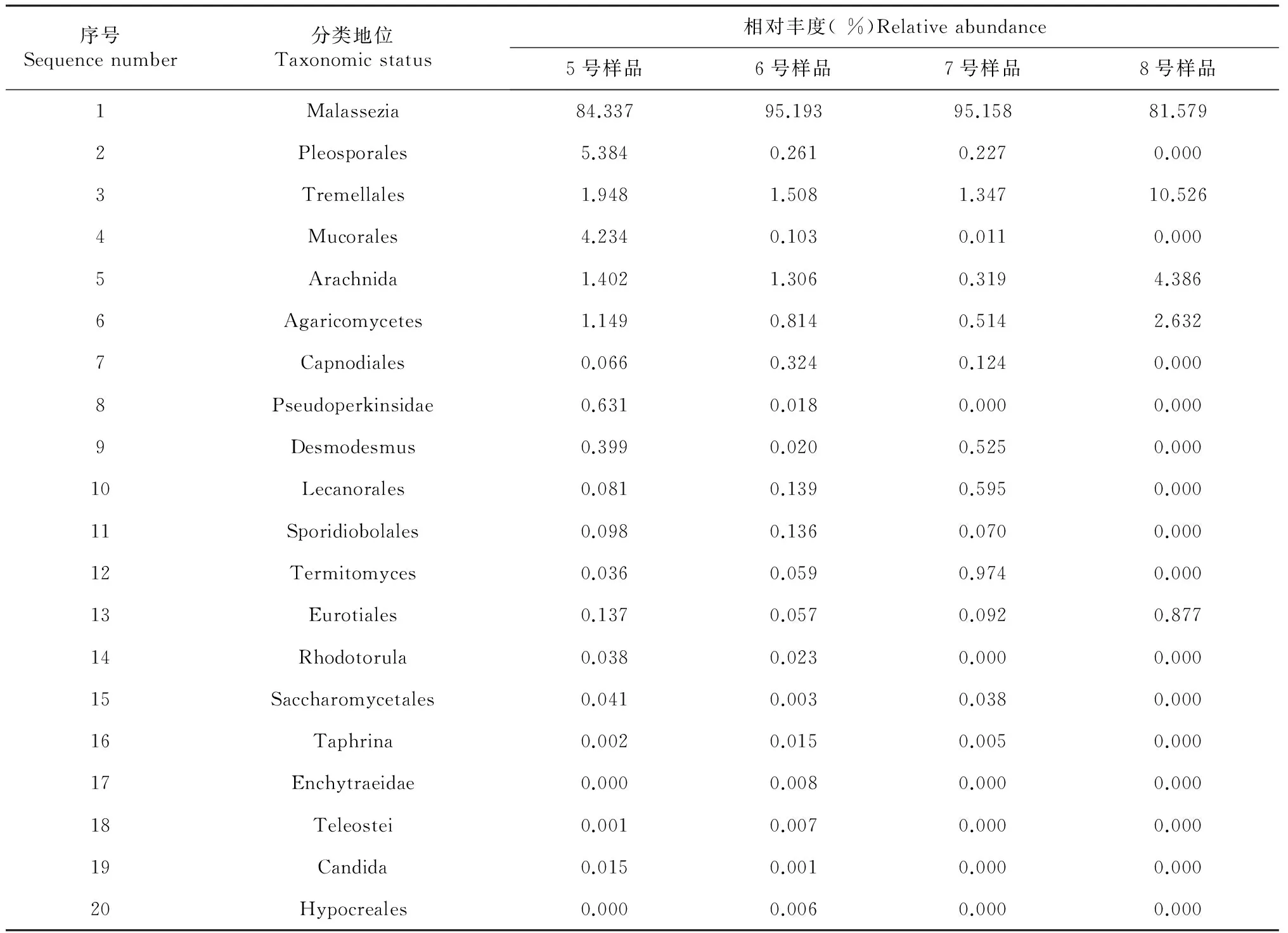
表4 样品中排名前20的真菌OUTs的相对丰度
3 讨论与结论
大量研究发现鱼类肠道菌群的失衡可以导致多种疾病的发生,而疾病的发生也会导致鱼类肠道菌群结构发生明显变化[10-11]。同时溃疡病、烂鳍病等[12]频发性皮肤疾病也是造成鱼类病变死亡的重要因素,是鱼类人工繁育工作的重要威胁。本文采用Illumina高通量测序技术对尖裸鲤健康个体和因水霉菌病变死亡个体的表皮皮肤粘液及肠道内容物的微生物多样性组成进行了系统分析,首次从宏基因组水平较全面的探讨了尖裸鲤病变死亡前后微生物群落变化特征。本研究发现尖裸鲤因水霉菌病变死亡后其表皮皮肤和肠道中细菌群落多样性减少,而其真菌多样性增加。张正等[13]研究半滑舌鳎肠道微生物菌群结构变化指出发生疾病后的鱼肠道细菌多样性较健康个体明显减少,与本文研究相一致。尖裸鲤病变死亡后其表皮皮肤粘液中Pseudomonassp.、Vagococcussp.、Providenciasp.、Morganellasp.、Pleosporales、Mucorales、Tremellales和Agaricomycetes等8种优势微生物菌群在减少,而Acinetobactersp.、Proteussp.、Carnobacteriumsp. 和Malasseziasp.等4种优势微生物菌群在增加,其中Providenciasp.(19.41 %)、Pleosporales(5.157 %)、Mucorales(4.223 %)菌群的减少和Proteussp.(25.26 %)、Pseudomonassp. (10.821 %)菌群的增加尤为显著。假单胞杆菌属细菌(Pseudomonassp.)是低温腐败菌[14],其大量繁殖条件与本文中尖裸鲤的低温生存环境相符。漫游球菌属(Vagococcussp.)最早由Collins MD等[15]从河流中分离得到,随后在病死鲑鱼、死亡海豹等水生生物中大量发现,是一种革兰氏阳性、能运动的水栖病原菌。普罗威登斯菌属(Providenciasp.)是一类革兰氏阴性条件致病肠杆菌,能够引起肠道感染等疾病[16]。摩根氏菌属(Morganellasp.)是一类腐生菌,能够引起养殖动物皮肤、肌肉溃烂,器官淤血肿胀等疾病[17]。不动杆菌属(Acinetobactersp.)具有较好的抗药性,是一类致病性较强的广谱抗药病原微生物[18]。黄杆菌属(Flavobacteriumsp.)和肉杆菌属(Carnobacteriumsp.)是造成冷藏鱼类腐败变质的重要微生物类群[19]。马拉色霉菌属真菌(Malasseziasp.)[20]是一类嗜脂性条件致病菌,是造成动物多种皮肤疾病的常见菌群。同时,尖裸鲤病变死亡后其肠道中Acinetobactersp.、Flavobacteriumsp.、Vagococcussp.、Carnobacteriumsp.、Bacillussp.和Malasseziasp.等6种优势微生物菌群减少,而Pseudomonassp.、Tremellales和Agaricomycetes等3种优势微生物菌群增加,其中Malasseziasp. (13.614 %)菌群的减少和Pseudomonassp.(39.06 %)、Tremellales(8.748 %)、Agaricomycetes(1.818 %)菌群的增加较为明显。此外研究中还发现有Pseudoperkinsidae等病原动物存在于尖裸鲤皮肤和肠道中,表明尖裸鲤病变死亡是由细菌、真菌和病原动物共同作用的结果。
[1]赵亚辉,张 洁,张春光. 青藏高原鱼类的多样性[J]. 生物学通报,2008,43(7):8-10.
[2]霍 斌. 尖裸鲤个体生物学和种群动态学研究[D]. 华中农业大学,2014.
[3]洛 桑,张强英,旦增达瓦,等. 拉萨河尖裸鲤(Oxygymnocyprisstewartii)肌肉营养组成与分析评价[J]. 西藏大学学报(自然科学版),2014,29(1):8-12.
[4]许 静,谢从新,邵 俭,等. 雅鲁藏布江尖裸鲤胚胎和仔稚鱼发育研究[J]. 水生态学杂志,2011,32(2):86-95.
[5]Ke X L, Wang J G, Gu Z M, et al. Morphological and molecular phylogenetic analysis of twoSaprolegniasp.(Oomycetes) isolated from silver crucian carp and zebra fish[J]. Mycological Research, 2009, 113(5): 637-644.
[6]黄光祥. 养殖鱼肠道菌群分子生态的研究[D]. 武汉:华中农业大学,2008.
[7]Micah H, Catherine L, Rob K. Fast unifrac: facilitating high-throughput phylogenetic analyses of microbial communities including analysis of pyrosequencing and PhyloChip data[J]. The ISME Journal, 2010(4): 17-27.
[8]Schloss P D, Westcott S L, Ryabin T, et al. Introducing mothur:open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and Environment Microbiology, 2009, 75(23): 7537-7541.
[9]王 丽,韩余香. 病原生物Perkinsussp.的研究进展[EB/OL]. 北京:中国科技论文在线,2005.
[10]Wang Y B, Lia J R, Lin J D. Probiotics in aquaculture: Challenges and outlook[J]. Aquaculture, 2008, 281(1-4): 1-4.
[11]José L B, Ignacio D B, Imanol R, et al. The role of probiotics in aquaculture[J]. Veterinary Microbiology, 2006, 114(3-4): 173-186.
[12]冯东岳. 2009年我国大宗淡水养殖鱼病害调查及分析[J]. 水产学杂志,2010,23(4):60-65.
[13]张 正,廖梅杰,李 彬,等. 两种疾病发生对养殖半滑舌鳎肠道菌群结构的影响分析[J]. 水产学报,2014,38(9):1565-1572.
[14]Hozbor M C, Saiz A R, Yeannes M I, et al. Microbiological changes and its correlation with quality indices during aerobic iced storage of sea salmon (Pseudopercissemifasciata)[J]. Food Science Technology, 2006, 39(2): 99-104.
[15]Collins M D, Ash C, Farrow J A, et al. 16S ribosomal ribonucleic acidf sequence analyses of Lactococci and related taxa. description ofVagococcusfluvialisgen.nov., sp. nov[J]. J Appl Bacteriol, 1989, 67(4): 453-460.
[16]石 磊,梁思思,岛绫香,等. 食源性普罗威登斯菌的分离鉴定和耐药性研究[J]. 现代食品科技,2014,30(6):24-29.
[17]许赞焕,罗 琳,姜 娜,等. 鼋摩氏摩根氏菌的鉴定及致病性[J]. 四川农业大学学报,2012,30(1):87-91.
[18]张 涵,周 涛,王 岩. 综合养殖池塘中三角帆蚌和鱼类肠道细菌的组成[J]. 水生生物学报,2013, 37(5):824-835.
[19]许振伟. 冷藏鱼类腐败菌腐败能力分析[D]. 上海海洋大学,2011.
[20]Ashbee H R. Recent developments in the immunology and biology of Malassezia species[J]. FEMS Immunol Med Microbiol, 2006, 47: 14-23.
ChangesofMicrobialCommunityafterOxygymnocyprisstewartiDeath
CHEN Mei-qun1, LI Bao-hai2*, ZHOU Jian-she1, PAN Ying-zi1, ZHAxilamu1, WANG Wan-liang1
(1.Institute of Fisheries Research, Tibet Academy of Agricultural and Animal Husbandry Sciences, Tibet Lhasa 850032, China;2.Tibet Academy of Agricultural and Animal Husbandry Sciences, Tibet Lhasa 850032, China)
【Objective】The present paper aims to explore the changes of microorganisms community between healthy individuals and diseased individuals ofOxygymnocyprisstewarti. 【Method】The skin mucus and intestinal contents ofOxygymnocyprisstewartiby using Illumina-Miseq high-throughput sequencing technology were studied. 【Result】The bacterial diversity in the skin mucus and intestinal contents afterOxygymnocyprisstewartideath were decreased, however, the fungi diversity were increased; The dominant microbial ofPseudomonassp.,Vagococcussp.,Providenciasp.,Morganellasp., Pleosporales, Mucorales, Tremellales and Agaricomycetes in the skin mucus were decreased, meanwhile the dominant microbial ofAcinetobactersp.,Proteussp.,Carnobacteriumsp. andMalasseziasp. were increased; The dominant microbial ofAcinetobactersp.,Flavobacteriumsp.,Vagococcussp.,Carnobacteriumsp.,Bacillussp. andMalasseziasp. in the intestinal contents were decreased, meanwhile the dominant microbial ofPseudomonassp., Tremellales and Agaricomycetes were increased. 【Conclusion】The bacterial and fungal community structure changes were the main causes ofOxygymnocyprisstewarti. death.
High-throughput sequence;Oxygymnocyprisstewarti; Microbial community; Saprolegniasis
1001-4829(2017)5-1233-06
10.16213/j.cnki.scjas.2017.5.043
2016-05-20
西藏自治区自然科学基金(13-44);农业公益性行业科研专项(201403012-05)
陈美群(1986-),女,广西南宁人,硕士,助理研究员,主要从事水产养殖研究工作,E-mail:cmq1986007@163.com,Tel:13989986804;*为通讯作者:李宝海(1956-),男,内蒙古呼伦贝尔人,研究员,博士生导师,研究方向:农产品质量安全与检测技术、水产养殖,E-mail:lbh0891@163.com。
S965.116
A
(责任编辑 陈 虹)
