上调miR-320a对注射用核糖核酸Ⅱ诱导的肝癌 Bel-7402细胞凋亡和迁移的影响
2017-11-01吕晓婷石雪萍李海星冉建华
吕晓婷,郭 珮,,宋 丹,熊 伟,石雪萍,李海星,李 静,冉建华
(重庆医科大学1. 基础医学院组织细胞工程与干细胞研究室、2. 附属第一医院肝胆外科、3. 基础医学院解剖教研室,重庆 400016)
◇论著◇
上调miR-320a对注射用核糖核酸Ⅱ诱导的肝癌 Bel-7402细胞凋亡和迁移的影响
吕晓婷1,郭 珮1,3,宋 丹2,熊 伟1,石雪萍1,李海星1,李 静1,冉建华3
(重庆医科大学1. 基础医学院组织细胞工程与干细胞研究室、2. 附属第一医院肝胆外科、3. 基础医学院解剖教研室,重庆 400016)
目的研究上调 miR-320a 对注射用核糖核酸Ⅱ(BP 素)诱导的肝癌 Bel-7402 细胞凋亡和迁移的影响。方法用定量逆转录-聚合酶链反应(qRT-PCR)检测 miR-320a 在正常肝细胞与肝癌细胞中的表达差异;将 miR-320a mimic转染到Bel-7402细胞中,qRT-PCR法检测miR-320a的表达水平;CCK-8法检测注射用核糖核酸Ⅱ对肝癌细胞增殖的影响;FCM检测细胞周期分布及凋亡变化;Transwell法检测注射用核糖核酸Ⅱ对肝癌细胞迁移和侵袭的影响;Western blot检测细胞周期蛋白D1的表达及凋亡相关蛋白p53、Bax、Bcl-2,迁移相关蛋白MMP-3的表达。结果与正常肝细胞相比,miR-320a的表达水平在肝癌细胞中明显下调。转染miR-320a mimic的 Bel-7402 细胞命名为 Bel-7402-miR-320a,CCK-8结果显示,给予注射用核糖核酸Ⅱ(100、200、300、400、500 mg·L-1)后,Bel-7402 及 Bel-7402-miR-320a细胞的增殖均受到了抑制。在 Bel-7402 和 Bel-7402-miR-320a 中,12 h半数抑制浓度为250、200 mg·L-1,24 h半数抑制浓度为150、120 mg·L-1。FCM检测结果显示,注射用核糖核酸Ⅱ可诱导Bel-7402、Bel-7402-miR-320a细胞周期阻滞在G0/G1期,上调miR-320a后细胞凋亡率明显增加。Transwell结果显示,与Control组和加药组相比,Bel-7402-miR-320a+Ribonucleic acid Ⅱ组细胞迁移和侵袭明显受到抑制。Western blot结果显示,注射用核糖核酸Ⅱ作用Bel-7402和Bel-7402-miR-320a细胞后,凋亡相关蛋白p53、Bax的表达增加,而 Cyclin D1、Bcl-2、MMP-3蛋白的表达下调。结论miR-320a在肝癌Bel-7402细胞中的表达水平明显低于正常肝细胞。注射用核糖核酸Ⅱ可以通过下调细胞周期蛋白 Cyclin D1的表达,将细胞周期阻滞在G0/G1期,激活p53信号通路,下调 Bcl-2、上调Bax,破坏Bcl-2/Bax的比例,促进人肝癌Bel-7402细胞的凋亡,并通过抑制MMP-3的表达抑制人肝癌细胞的迁移和侵袭。而过表达 miR-320a后,可提高肝癌细胞对注射用核糖核酸Ⅱ的敏感性,增强注射用核糖核酸Ⅱ对肝癌细胞Bel-7402的作用。
注射用核糖核酸Ⅱ;microRNA-320a;肝细胞肝癌;Bel-7402;凋亡;迁移
原发性肝癌是我国常见的恶性肿瘤之一,主要包括胆管细胞癌和肝细胞肝癌(hepatocellular carcinoma,HCC),其中HCC占原发性肝癌发病率的90%。HCC是世界上最常见的一种具有侵袭性的人类恶性肿瘤,具有恶性程度高、早期诊断率低、预后差和复发率高的特点[1]。尽管对HCC发生、发展过程的研究有了很大的进展,但是HCC病变的精确机制仍然不明确。在过去的几年中,HCC的5年生存率变化也不大[2],这就强调了HCC早期诊断及治疗的重要性。
注射用核糖核酸Ⅱ(BP素)是从牛胰腺中提取的核糖核酸,是一种高纯度的具有生理活性的物质[3]。它既可以非特异性促进T 淋巴细胞的成熟、分化,还可以使受到抑制的免疫功能得以恢复,从而增强人体免疫功能。已有相关文献证明,肿瘤的发生、发展过程与机体的免疫功能具有相关性。临床试验中,已有多项研究表明,注射用核糖核酸Ⅱ在治疗多种癌症中发挥重要作用[3]。其中,应用注射用核糖核酸Ⅱ治疗可使肝癌结节体积明显缩小[4],但其具体的作用机制尚未见报道。
小分子核糖核酸(microRNAs)是一类小型非编码RNA,主要存在于动物和植物中,在转录和转录后水平调控基因的表达[5]。在人类肿瘤疾病中,microRNAs在调节细胞的增殖、凋亡、侵袭和转移方面发挥关键作用[6]。最近有研究发现,miR-320a在乳腺癌、结肠癌和白血病中表达下调[7],提示miR-320a可能在肿瘤发生、发展过程中发挥重要的作用。miR-320a可以通过下调Wnt/β-catenin 信号通路抑制HCC细胞的增殖[8]。上调 miR-320a对注射用核糖核酸Ⅱ诱导的肝癌 Bel-7402细胞产生何种影响?目前尚未见文献报道。
1 材料
1.1药物与试剂注射用核糖核酸Ⅱ(规格50 mg)购自吉林敖东药业,由冉建华教授提供;转染试剂购自RIBOBIO;PCR试剂购自GeneCopoeia;青霉素-链霉素溶液(100×)、BCA蛋白浓度测定试剂盒(增强型)、RIPA裂解液(强)、PMSF(100 nmol·L-1)、SDS-PAGE凝胶配制试剂盒、CCK-8试剂盒均购自碧云天生物技术有限公司;p53、Bax、Bcl-2等抗体购自沈阳万类科技有限公司。
1.2仪器CO2细胞培养箱,美国Forma Scientific公司;正置荧光显微镜,日本Olympus公司;FACScan 型流式细胞仪,BectonDickinson公司;ChemiDocTMTouch Image Syste化学发光仪,Bio-Rad公司。
2 方法
2.1细胞培养正常的肝细胞株HL-7702和人HCC细胞株Hep3B、Bel-7402均购自中国典型培养物保藏中心(武汉)。分别以30%~50%细胞浓度接种于含10%胎牛血清的 RPMI 1640培养液中,在37℃、5% CO2饱和湿度下常规培养,每24~48 h 传代1次。
2.2总RNA提取及定量逆转录-聚合酶链反应(qRT-PCR) 收集正常肝细胞 HL-7702 及肝癌细胞 Hep3B、Bel-7402 后,加1 mL TRIzol,上下倒置震荡后,加1 ∶1氯仿去除蛋白,加2 ∶1异丙醇去除沉淀,提取总 RNA,在260 nm 和280 nm 时测得吸光度进行配平,然后将 RNA 逆转录成 cDNA。使用 GeneCopoeia 试剂,按照说明书进行操作,检测正常肝细胞与肝癌细胞中miR-320a 的表达水平及 miR-320a 的转染效率。反应体系为95℃预变性10 min,45个循环的95℃变性10 s,60℃退火20 s,72℃延伸10 s,实验设2个复孔,以 U6作为内参进行 PCR 检测。
2.3细胞株转染在6孔板中分别加入3 mL含有30%~50%细胞浓度的完全培养基,培养过夜,待细胞完全贴壁后,吸出6孔板内的完全培养基。实验分3组,第1组为阴性对照组:用120 μL riboFECTMCP Buffer 稀释10 μL miR-320a negative control,轻轻混匀后,加入12 μL riboFECTMCP Reagent,轻轻吹打混匀,室温孵育0~15 min,最后将混合液加入到完全培养基中,最终体积为2 mL;第2组为空白对照组:为常规培养的细胞,仅加入2 mL完全培养基;第3组为miR-320a组:同第1组,将稀释好的miR-320a mimic混合液加入到完全培养基中,最终体积为2 mL。每组设2个复孔,培养48 h后收集细胞,通过qRT-PCR检测miR-320a的转染效率。转染miR-320a mimic的Bel-7402细胞命名为Bel-7402-miR-320a。
2.4CCK-8检测细胞增殖活性取对数生长期的细胞,以1×109·L-1接种于96孔板。实验分为两组:第1组为对照组,即Bel-7402组;第2组为给药组,分别加入含终浓度为100、200、300、400、500 mg·L-1注射用核糖核酸Ⅱ的完全培养基,实验设5个复孔,每孔加入100 μL。分别培养12、24 h后,每孔加10 μL CCK-8试剂,37℃孵育2 h。用酶标仪在450 nm处测吸光值(A)。计算细胞生长抑制率和12、24 h的半数抑制浓度(half inhibitory concentration, IC50),以IC50为标准,确定药物最适作用浓度和时间,实验重复3次。抑制率/%=(Acontrol组-A注射用核糖核酸Ⅱ组)/(Acontrol组-A空白对照组)×100%。取对数生长期的Bel-7402-miR-320a细胞,也分为对照组和给药组,检测注射用核糖核酸Ⅱ对 Bel-7402-miR-320a细胞的生长抑制率和IC50。
2.5流式细胞术检测细胞周期取对数生长期的细胞,以1×109·L-1接种于6孔板。实验分为3组,第1组为对照组:为常规培养的Bel-7402细胞;第2组为 Bel-7402+Ribonucleic acid Ⅱ组,给予含终浓度为150 mg·L-1注射用核糖核酸Ⅱ的完全培养基;第3组为Bel-7402-miR-320a+Ribonucleic acid Ⅱ组,给予含终浓度为120 mg·L-1注射用核糖核酸Ⅱ的完全培养基。实验设3个复孔,每孔3 mL,培养24 h后收集细胞,70%冰乙醇重悬,4℃固定过夜。用流式细胞仪进行细胞周期检测,通过软件分析得出细胞周期分布比例。
2.6流式细胞术检测细胞凋亡实验分组同“2.5”,细胞培养24 h后,收集全部细胞,按照 AnnexinV-FTIC/PI 双染细胞凋亡检测试剂盒说明书方法,染色30 min后,上机检测,采用CELIQUEST软件分析得出细胞周期和凋亡的变化,实验重复3次。
2.7Transwell法检测注射用核糖核酸Ⅱ对肝癌细胞迁移和侵袭的影响实验分组同“2.5”,细胞培养24 h后,将各组细胞消化下来。各组细胞以1×109·L-1每孔的密度接种于小室上端,培养于200 μL无血清的RPMI 1640培养基中,小室下端加入300 μL含10%胎牛血清的RPMI 1640完全培养基,注意不要超过小室上端,每组设2个复孔。继续培养24 h后,将小室用刀片沿边缘轻轻切下,PBS洗3次后,用多聚甲醛固定30 min,最后用结晶紫染色30 min,200倍显微镜下观察拍照。
2.8Westernblot检测细胞周期蛋白和凋亡蛋白表达水平实验分组同“2.5”,培养24 h后,分别用全蛋白裂解液抽提试剂盒抽提蛋白。采用BCA法检测各组蛋白的浓度,每一样品取30 μg蛋白上样,SDS-PAGE分离蛋白,随后将分离后的蛋白转移至PDVF膜上;封闭液37℃封闭2 h,4℃孵育一抗过夜。TBST 洗膜3次,37℃孵育二抗1 h,TBST洗膜3次后,用ECL法检测蛋白的表达。
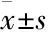
3 结果
3.1miR-320a在肝癌细胞株中的表达差异qRT-PCR检测正常肝细胞HL-7702与肝癌细胞Hep3B、Bel-7402中miR-320a的表达情况。Fig 1结果显示,与正常肝细胞相比,Hep3B和Bel-7402中miR-320a的表达下调。其中,Bel-7402细胞中miR-320a的下调更为明显,故将Bel-7402细胞作为后续实验的研究对象。

Fig 1 Analysis of miR-320a expression in normalhepatic cell lines and HCC cell lines
*P<0.05vsHL-7702
3.2Bel-7402-miR-320a细胞的获得将Bel-7402细胞株按说明书进行转染。以转染了miR-320a negative control的Bel-7402细胞为阴性对照组(Bel-7402-NC),常规培养的Bel-7402细胞为空白对照组,转染miR-320a mimic的为过表达miR-320a组(Bel-7402-miR-320a),用 qRT-PCR检测细胞株中miR-320a的表达水平。Fig 2结果表明,与Bel-7402-NC相比较,Bel-7402-miR-320a组细胞中miR-320a的表达量明显增高(P<0.05),而 Bel-7402-NC组与Bel-7402组相比,差异变化不明显。

Fig 2 Transfection efficiency test ofmiR-320a in Bel-7402 cells
*P<0.05vsBel-7402-NC
3.3注射用核糖核酸Ⅱ对Bel-7402和Bel-7402-miR-320a细胞的增殖抑制作用CCK-8法检测结果显示(Fig 3),对照组细胞体外生长活跃,经注射用核糖核酸Ⅱ(100、200、300、400、500 mg·L-1)处理后,Bel-7402和Bel-7402-miR-320a细胞的增殖均受到抑制,计算12 h半数抑制浓度为250、200 mg·L-1,24 h 半数抑制浓度为150、120 mg·L-1,且注射用核糖核酸Ⅱ对肝癌细胞Bel-7402及 Bel-7402-miR-320a的生长抑制作用呈剂量和时间依赖性。

Fig 3 Inhibitory effect of ribonucleic acid Ⅱ on Bel-7402 andBel-7402-miR-320a cells after treatment for 12, 24 h
3.4注射用核糖核酸Ⅱ对Bel-7402和Bel-7402-miR-320a细胞周期的影响流式细胞术检测结果显示(Tab 1、Fig 4),Bel-7402+Ribonucleic acid Ⅱ组的 G0/G1期的细胞比例(60.01±1.00)%和Bel-7402-miR-320a+Ribonucleic acid Ⅱ组的G0/G1期细胞比例(71.39±3.07)%均高于Bel-7402组的(52.27±0.97)%,细胞周期被阻滞在G0/G1期,差异有统计学意义(P<0. 05)。与 Bel-7402+Ribonucleic acid Ⅱ组相比,Bel-7402-miR-320a+Ribonucleic acid Ⅱ组的G0/G1期细胞比例增高更为明显,差异有统计学意义(P<0.05)。
3.5注射用核糖核酸Ⅱ对Bel-7402和Bel-7402-miR-320a细胞凋亡的影响Bel-7402+Ribonucleic acid Ⅱ组细胞凋亡率为(21.53±1.62)%,Bel-7402-miR-320a+Ribonucleic acid Ⅱ组细胞凋亡率为(27.88±0.89)%,均高于 Control组(7.80±1.13)%,差异有统计学意义(P<0.05)。Bel-7402-miR-320a+Ribonucleic acid Ⅱ组细胞凋亡率高于Bel-7402+Ribonucleic acid Ⅱ组,差异有统计学意义(P<0.05),见Tab 2、Fig 5。
3.6注射用核糖核酸Ⅱ对肝癌细胞迁移和侵袭的影响Transwell法检测注射用核糖核酸Ⅱ对肝癌细胞迁移和侵袭的影响。Fig 6结果显示,与Control组相比,Bel-7402+Ribonucleic acid Ⅱ组和Bel-7402-miR-320a +Ribonucleic acid Ⅱ组细胞的迁移和侵袭能力均受到了抑制;与Bel-7402+ Ribonucleic acid Ⅱ组相比,Bel-7402-miR-320a+Ribonucleic acid Ⅱ组细胞迁移和侵袭能力受抑更为明显,差异有统计学意义(P<0.05)。

Tab 1 Effect of ribonucleic acid Ⅱ on cell cycle of Bel-7402 and Bel-7402-miR-320a cells(±s,n=3 )
*P<0.05vscontrol;#P<0.05vsBel-7402+Ribonucleic acid Ⅱ

Fig 4 Effect of ribonucleic acid Ⅱ on cell cycle of Bel-7402 and Bel-7402- miR-320a cells
A: Control; B: Bel-7402+Ribonucleic acid Ⅱ; C: Bel-7402-miR-320a+Ribonucleic acid Ⅱ

Fig 5 Effect of ribonucleic acid Ⅱ on apoptosis of Bel-7402 and Bel-7402-miR-320a cells
A: Control; B: Bel-7402+Ribonucleic acid Ⅱ; C: Bel-7402- miR-320a+Ribonucleic acid Ⅱ

Tab 2 Effect of ribonucleic acid Ⅱ on apoptosisof Bel-7402 and Bel-7402-miR-320a cells(±s,n=3 )
*P<0.05vscontrol;#P<0.05vsBel-7402+Ribonucleic acid Ⅱ

Fig 6 Effect of ribonucleic acid Ⅱ on migration andinvasion of Bel-7402 and Bel-7402-miR-320a cells
*P<0.05vscontrol;#P<0.05vsBel-7402+Ribonucleic acid Ⅱ
3.7注射用核糖核酸Ⅱ对Bel-7402和Bel-7402-miR-320a细胞CyclinD1、p53、Bax、Bcl-2、MMP-3表达的影响Fig 7结果显示,与Control组相比,Bel-7402+Ribonucleic acid Ⅱ组和 Bel-7402-miR-320a+Ribonucleic acid Ⅱ组凋亡相关蛋白p53、Bax的表达增加,而 Cyclin D1、Bcl-2、MMP-3蛋白表达水平下调。与 Bel-7402+Ribonucleic acid Ⅱ组相比,Bel-7402-miR-320a+Ribonucleic acid Ⅱ组蛋白变化水平更明显,差异有统计学意义(P<0.05)。
4 讨论
HCC具有恶性程度高、早期诊断率低、预后差的特点。在过去十年中,它已成为全世界的一个最频繁发生的肿瘤,是癌症系统最致命的疾病之一,大约占所有恶性肿瘤的三分之一,其发病率及病死率居高不下[9]。HCC患者的免疫力低下,药物治疗价格昂贵。因此,寻找一种能够提高HCC患者免疫力,同时又具有抗癌作用,且价格低廉、药效明显的药物对于人类的健康是至关重要的。

Fig 7 Expression of Cyclin D1, p53, Bax, Bcl-2, MMP-3 proteins in Bel-7402 and Bel-7402-miR-320a cells after ribonucleic acid Ⅱ treatment for 24 h
*P<0.05vscontrol;#P<0.05vsBel-7402+Ribonucleic acid Ⅱ
注射用核糖核酸Ⅱ是从健康的牛胰腺中提取的一种可促进肿瘤组织和细胞空泡样变化以及液化性坏死的核糖核酸,是一种高纯度的生化药物。研究发现,注射用核糖核酸Ⅱ可以通过增加巨噬细胞和淋巴细胞等细胞因子来增加细胞的体液免疫功能,从而抑制肿瘤细胞的增殖。注射用核糖核酸Ⅱ还可以抑制血管内皮因子的表达,抑制肿瘤新生血管的形成,从而抑制肿瘤的形成[10]。已有研究表明,应用注射用核糖核酸Ⅱ治疗,可使肝癌结节体积明显缩小。但是目前关于注射用核糖核酸Ⅱ的报道均来自于临床报告,其具体的作用机制目前尚不明确。
microRNA是在真核生物中发现的一类内源性的具有调控功能的非编码 RNA,其在肿瘤的恶化过程中发挥重要的作用,然而,microRNA在肿瘤中的异常调节机制目前我们知道的并不多[11]。许多研究表明microRNA在肿瘤的发生过程中发挥着关键的作用,如细胞的增殖、凋亡、迁移和侵袭[12]。下调 miR-320a基因在大肠癌中的表达,可以促进肿瘤细胞的侵袭,并导致预后较差[13]。因此,我们认为miR-320a在肿瘤的发生发展中可作为一种抑癌基因发挥作用。
我们采用qRT-PCR检测正常肝细胞HL-7702与肝癌细胞Hep3B、Bel-7402中 miR-320a的表达情况,发现miR-320a在肝癌细胞里呈低表达。Hep3B细胞是一种 HBV为阳性的肝癌细胞,其miR-320a低表达水平相对于Bel-7402细胞不明显,有可能是由于乙型肝炎病毒的影响,但其具体原因需要更进一步的研究。
本研究采用CCK-8法检测了注射用核糖核酸Ⅱ对Bel-7402细胞的增殖抑制作用。结果显示,Bel-7402+Ribonucleic acid Ⅱ组和Bel-7402-miR-320a+Ribonucleic acid Ⅱ组细胞的增殖均受到抑制,12、24 h的半数抑制浓度分别为 250、200 mg·L-1和150、120 mg·L-1。研究证实了上调 miR-320a可以增加肝癌细胞对药物的敏感性,明显减少药物的用量。
流式细胞术检测发现,与Control组相比,Bel-7402+Ribonucleic acid Ⅱ组和 Bel-7402-miR-320a+Ribonucleic acid Ⅱ组细胞周期均阻滞在G0/G1期,且与Bel-7402+Ribonucleic acid Ⅱ组相比,Bel-7402-miR-320a+Ribonucleic acid Ⅱ组的G0/G1期细胞比例及细胞凋亡率增高更为明显。Cyclin D1是细胞周期G1期向S期过渡的关键调控点,与细胞周期密切相关。Western blot结果显示,与Control组相比,Bel-7402+Ribonucleic acid Ⅱ组和Bel-7402-miR-320a+ Ribonucleic acid Ⅱ组Cyclin D1蛋白表达水平下调。与Bel-7402+Ribonucleic acid Ⅱ组相比,Bel-7402-miR-320a+Ribonucleic acid Ⅱ组Cyclin D1蛋白下调更明显,与细胞周期检测结果一致。提示注射用核糖核酸Ⅱ可通过下调细胞周期蛋白Cyclin D1的表达,将细胞阻滞在G0/G1期,从而抑制细胞的增殖;而上调miR-320a的表达水平可进一步增强注射用核糖核酸Ⅱ的这一作用。
流式细胞术检测注射用核糖核酸Ⅱ对细胞凋亡的影响,发现与Control组相比,Bel-7402+Ribonucleic acid Ⅱ组和Bel-7402-miR-320a+Ribonucleic acid Ⅱ组细胞凋亡率增加,且与Bel-7402+Ribonucleic acid Ⅱ组相比,Bel-7402-miR-320a +Ribonucleic acid Ⅱ组细胞凋亡率增高更为明显。p53(mtp53) 基因是一种抑癌基因,是迄今为止与人类恶性肿瘤相关性最高的肿瘤抑制基因,p53信号通路为癌症发生过程中的一个关键信号通路。p53基因可以通过参与诱导细胞周期阻滞、促进细胞凋亡和DNA的修复等发挥作用。Bcl-2蛋白在细胞凋亡过程中起着至关重要的作用,是一种抗凋亡基因,Bax是与Bcl-2同源的水溶性相关蛋白,其可以通过拮抗Bcl-2而发挥促进细胞凋亡的功能[14]。本实验结果显示,与 Control组相比,Bel-7402+Ribonucleic acid Ⅱ组和Bel-7402-miR-320a+Ribonucleic acid Ⅱ组凋亡相关蛋白p53、Bax的表达增加,而抗凋亡蛋白Bcl-2的表达下调。与 Bel-7402+Ribonucleic acid Ⅱ组相比,Bel-7402-miR-320a+Ribonucleic acid Ⅱ组蛋白变化水平更明显。提示注射用核糖核酸Ⅱ可通过激活p53信号通路,下调 Bcl-2、上调Bax,破坏Bcl-2/Bax的比例来促进细胞的凋亡,上调miR-320a可增强这一效应。
Transwell法检测注射用核糖核酸Ⅱ对细胞迁移和侵袭的影响,结果显示,与 Control组相比,Bel-7402+Ribonucleic acid Ⅱ组和Bel-7402-miR-320a +Ribonucleic acid Ⅱ组细胞的迁移和侵袭能力均受到了抑制;与Bel-7402+ Ribonucleic acid Ⅱ组相比,Bel-7402-miR-320a+Ribonucleic acid Ⅱ组细胞迁移和侵袭能力受抑更为明显。基质金属蛋白酶3(matrix metalloproteinase 3, MMP-3)是MMPs家族的主要成员之一。MMP-3基因转录水平的调控主要是在一些生长因子、细胞因子、细胞外成分、原癌基因等的作用下,刺激一系列位于MMP-3启动子的顺式作用元件,从而抑制细胞迁移和侵袭。本实验结果显示,经注射用核糖核酸Ⅱ诱导24 h后,Bel-7402细胞内的MMP-3蛋白表达水平下调,而Bel-7402-miR-320a细胞内的下调更明显。提示注射用核糖核酸Ⅱ可以通过抑制MMP-3蛋白,抑制 Bel-7402细胞的迁移和侵袭。
综上所述,肝癌细胞中miR-320a的表达水平下调,注射用核糖核酸Ⅱ可以通过下调细胞周期蛋白Cyclin D1的表达阻滞细胞周期,进而抑制细胞增殖,通过激活p53信号通路,下调Bcl-2、上调Bax,破坏Bcl-2/Bax的比例来促进细胞凋亡,抑制MMP-3的表达来抑制细胞的迁移和侵袭。而上调miR-320a的表达水平可促进注射用核糖核酸Ⅱ对肝癌细胞的作用。但miR-320a是通过何种方式增强注射用核糖核酸Ⅱ的作用,还需要我们进一步研究。
(致谢:本研究在重庆医科大学基础医学院组织细胞工程与干细胞研究室完成,对实验给予帮助的老师和同学表示感谢!)
[1] Yuan J H,Yang F,Wang F, et al. A long noncoding RNA activated by TGF-β promotes the invasion-metastasis cascade in hepatocellular carcinoma[J].CancerCell, 2014,25(5): 666-81.
[2] Wang F, Ying H Q, He B S, et al. Upregulated lncRNA-UCA1 contributes to progression of hepatocellular carcinoma through inhibition of miR-216b and activation of FGFR1/ERK signaling pathway[J].Oncotarget, 2015,6(10): 7899-917.
[3] 郭 珮, 冉建华, 李 静, 等. 注射用核糖核酸Ⅱ上调p53诱导人白血病细胞凋亡[J]. 中国药理学通报, 2016,32(12): 1729-34.
[3] Guo P, Ran J H, Li J, et al. Ribonucleic acid Ⅱ induces apoptosis in human leukemia cells by up-regulating p53[J].ChinPharmacolBull, 2016,32(12): 1729-34.
[4] 张春华, 王 莹, 王 烨, 等. BP素对肝癌患者血清VEGF的影响及临床疗效观察[J]. 中国伤残医学, 2013,21(3): 78-9.
[4] Zhang C H, Wang Y, Wang Y, et al. The clinical curative effcet observation of ribonucleic acid Ⅱ on hepatocellular carcinoma[J].ChinJTraumaDisabilMed, 2013,21(3): 78-9.
[5] Cheng C, Chen Z Q, Shi X T. MicroRNA-320 inhibits osteosarcoma cells proliferation by directly targeting fatty acid synthase[J].TumorBiol, 2014,35(5): 4177-83.
[6] Kasinski A L, Slack F J. Epigenetics and genetics. MicroRNAs en route to the clinic: progress in validating and targeting microRNAs for cancer therapy[J].NatRevCancer, 2011,11(12): 849-64.
[7] Schaar D G, Medina D J, Moore D F, et al. miR-320 targets transferrin receptor 1 (CD71) and inhibits cell proliferation[J].ExpHematol, 2009,37(2): 245-55.
[8] Lu C, Liao Z, Cai M, Zhang G. MicroRNA-320a downregulation mediates human liver cancer cell proliferation through the Wnt/β-catenin signaling pathway[J].OncolLett, 2017,13(2): 573-8.
[9] Huang J L, Zheng L, Hu Y W, et al. Characteristics of long non-coding RNA and its relation to hepatocellular carcinoma[J].Carcinogenesis, 2014,35(3): 507.
[10] 牛晓晓. BP素在肿瘤治疗中的临床应用价值[J]. 医学综述, 2012,18(2): 221-3.
[10] Niu X X. Clinical value of BP in tumor treatment[J].MedRecap, 2012,18(2): 221-3.
[11] Li C, Feng Y, Coukos G, et al. Therapeutic microRNA strategies in human cancer[J].AAPSJ, 2009,11(4): 747-57.
[12] George J, Patel T. Noncoding RNA as therapeutic targets for hepatocellular carcinoma[J].SeminLiverDis, 2015,35(1): 63-74.
[13] Liu Z X, Ye Y, Zhang Y, et al. microRNA-320a inhibits tumor invasion by targeting neuropilin 1 and is associated with liver metastasis in colorectal cancer[J].OncolRep, 2012,33(4): 685-94.
[14] Gerber J M, Qin L, Kowalski J, et al. Characterization of chronic myeloid leukemia stem cells[J].AmJHematol, 2011,86(1): 31-7.
EffectofmiR-320aup-regulationonapoptosisandmigrationofBel-7402cellsinducedbyribonucleicacidⅡ
LYU Xiao-ting1, GUO Pei1,3, SONG Dan2, XIONG Wei1, SHI Xue-ping1, LI Hai-xing1, LI Jing1, RAN Jian-hua3
(1.LabofStemCellandTissueEngineering,DeptofHistologyandEmbryology; 2.DeptofHepatobiliarySurgery,theFirstAffiliatedHospital; 3.DeptofAnatomy,ChongqingMedicalUniversity,Chongqing400016,China)
AimTo investigate the effect of miR-320a up-regulation on the apoptosis and migration of Bel-7402 cells induced by ribonucleic acid Ⅱ.MethodsThe different expression levels of miR-320a in normal liver cells and hepatocellular carcinoma (HCC) cells were detected by qRT-PCR. Bel-7402 cell was transfected with miR-320a mimic, and the miR-320a expression levels were measured by qRT-PCR. The effect of ribonucleic acid Ⅱ on proliferation of Bel-7402 and Bel-7402-miR-320a cells was measured by CCK-8 assay, and cell cycle and apoptosis were detected by flow cytometry. The migration and invasion ability of ribonucleic acid Ⅱ on Bel-7402 cells were tested by Transwell method. The expression of p53, Cyclin D1, Bax, Bcl-2, MMP-3 proteins were examined by Western blot.ResultsmiR-320a expression levels in HCC cell line Bel-7402 were significantly lower than those in normal cell line HL-7702. Bel-7402 cells were successfully transfected with miR-320a mimic, named Bel-7402-miR-320a. CCK-8 showed that ribonucleic acid Ⅱ could effectively inhibit the proliferation of Bel-7402 and Bel-7402-miR-320a cellsinvitroin a dose-dependent manner at the range of 100, 200, 300, 400, 500 mg·L-1. The IC50of ribonucleic acid Ⅱ exposure on Bel-7402 and Bel-7402-miR-320a cells for 12 h and 24 h was 250, 200 mg·L-1and 150, 120 mg·L-1, respectively; flow cytometric analysis indi-cated that over-expression of miR-320a could arrest Bel-7402 and Bel-7402-miR-320a cells induced by ribonucleic acid Ⅱ in G0/G1phase, and promote the apoptosis of HCC cells. Transwell method showed that Bel-7402-miR-320a+Ribonucleic acid Ⅱ group could significantly inhibit the migration of HCC cells compared with control group and Bel-7402+Ribonucleic acid Ⅱ group. Western blot results showed that the expression of p53, Bax proteins increased, while the Cyclin D1, Bcl-2, MMP-3 proteins were down-regulated in Bel-7402 and Bel-7402-miR-320a cells induced by ribonucleic acid Ⅱ.ConclusionsThe expression of miR-320a is lower in HCC cells than that in normal cell line. While ribonucleic acid Ⅱ could promote the apoptosis of liver cancer cells by arresting the cell cycle protein expression of Cyclin D1, activating p53 signaling pathway, down-regulating Bcl-2, up-regulating Bax and destroying Bcl-2/Bax proportions, and inhibiting the migration and invasion of HCC cells by down-regulating MMP-3. Overexpression of miR-320a could increase the sensitivity and boost the pharmacological effects of ribonucleic acid Ⅱ on HCC cells.
ribonucleic acid Ⅱ; microRNA-320a; hepatocellular carcinoma; Bel-7402; apoptosis; migration
A
1001-1978(2017)11-1503-08
R322.47;R329.25;R342.2;R735.702.2;R979.1
时间:2017-10-10 10:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20171010.1005.014.html
2017-07-04,
2017-08-09
重庆市科技计划资助项目(No cstc2015jcyjA0036)
吕晓婷(1989-),女,硕士生,研究方向:肿瘤基础与临床, E-mail:sungirlxt@163.com; 李 静(1973-),女,博士,副教授,研究方向:肿瘤药理学,通讯作者,E-mail:lijingyangyang@126.com; 冉建华(1974-),女,博士,教授,研究方向:尿素通道蛋白生理功能及药物开发,通讯作者,E-mail:ranjianhua2013@163.cn
10.3969/j.issn.1001-1978.2017.11.007
