揭示中国5000年前酿造谷芽酒的配方
2017-09-14王佳静刘莉TerryBall俞霖洁李元青邢福来
王佳静 刘莉 Terry Ball 俞霖洁 李元青 邢福来
(1.美国斯坦福大学东亚语言文化系;2.美国杨百翰大学古经文系; 3.浙江省化工研究院;4.美国斯坦福大学土木与环境系 ;5.陕西省考古研究院)
中国最早关于谷芽酒酿造的文字记载源于晚商殷墟的甲骨文 (ca. 1250~1046 BC)[1,2]。甲骨文记载了商人利用发芽的粟黍、大麦或小麦作为酿酒的主要材料, 即所谓的蘖法酿醴[1,3]。此前,李仰松等多位学者已提出假设,认为商代的谷芽酒酿造技术可能源于新石器的仰韶文化时期 (公元前5000~2900)[4-6]。中国拥有悠久的谷物发酵的历史,在距今9000年左右的贾湖遗址,McGovern 等人的化学分析发现了用大米发酵的饮品[7],这种谷物发酵的传统很可能衍生于新石器时代早期并发展至仰韶时期。仰韶文化晚期,以粟黍为主的农业社会已在中原地区发展成熟。定居农业的形成为酒的酿造提供了原料的保证。同时,从陶器特点来看,仰韶时期小口尖底瓶为典型器物,且不少遗址出土了漏斗,通过与民族学资料的比较,此类型的器物很可能与酿酒有关。以上两个因素为谷芽酒的酿造提供了可能条件[6];但是,关于仰韶文化酿酒的直接证据仍然欠缺。
陕西西安米家崖遗址位于西安市东郊浐河西岸。2004年至2006年,陕西省考古研究院对遗址进行了抢救性发掘。该遗址的主体遗存的年代为3400BC至2900BC。发掘揭露了丰富的遗迹现象,其中灰坑H82 和H78是属于半坡四期,两个灰坑中出土了一些似与酿酒有关的器物。其中, H82 深3.7米,坑壁平整,内有建造五节台阶方便上下出入;H78 深2.5~2.7米,坑底平整,一边有一层土台[8]。两个灰坑均出土了三种陶器:阔口罐、漏斗、和小口尖底瓶(图一、二),这些器物的内壁均附着浅黄色的残留物(图三)。从形制上来看,这三种器型组合正好适用于谷芽酒酿造的三个步骤:糖化、过滤、发酵储藏。值得关注的是,两个灰坑中各有一个小型灶(图一,e)。在酿酒过程中,低温加热是糖化阶段的重要步骤,灰坑中的灶可以使坑内环境在一定时间内保持恒定温度。根据以上考古学的证据,我们提出一个假设:这两个坑中的器物代表了一套谷芽酒酿造的工具组合。为了验证此假设,我们对陶器内壁的残留物进行了淀粉粒、植硅体以及化学分析。分析样品来源于2件漏斗,4件属于尖底瓶的残片,以及2件来源于阔口罐的残片。
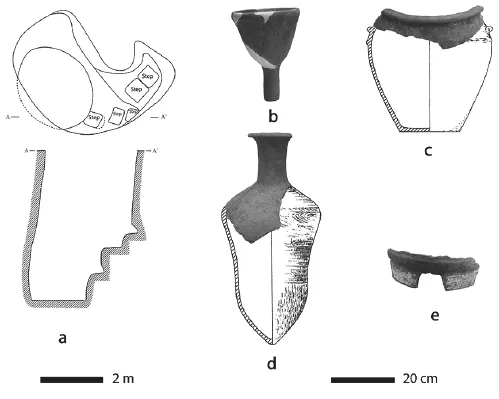
图一 米家崖遗址H82的谷芽酒酿造工具组合

图二 除图一外本研究分析的米家崖器物
一、材料与方法
淀粉粒和植硅体残留物样品的采集及分析方法的过程为:(1)两份对照样品(1和3)用干净的刀片在陶器表面直接刮取固体残留物,其他的样品的提取利用超声波清洗法,获得液体残留物。(2)在实验室通过EDTA(Na2EDTA·2H2O)清洗法和重液离心法将试管中的残留物进行分离,重液为比重为2.35的多钨酸钠(SPT),吸取分离后的残留物溶液滴在干净的载玻片上,干燥后滴加50%甘油溶液,加盖玻片,并用指甲油封片;(3)淀粉粒和植硅体鉴定使用蔡司生物显微镜 (Carl Zeiss Axio Scope A1),配备有微分干涉相差(DIC)及偏振光装置。
用于离子色谱法鉴定草酸的样品用干净的刀片在陶器表面直接刮取而得。漏斗1, 陶器3,和 陶器5的样品分析采用位于浙江省化工研究院实验室的Dionex ICS 5000离子色谱仪,配有电导检测器,Ion Pac-AS 11-HC Analytical (250 x 4 mm I.D.) 色谱柱,Ion Pac AG11-HC(40 x 4 mm I.D.) 预柱,和ASRS_4 mm 抑制器。操作条件包括:隔层温度20 °C,流动相为20mM KOH水溶液,流速1.5 mL/min,进样子量25 uL。草酸根离子的具体操作步骤为:(1)每个米家崖试样平均配置两个试样溶液,每个试样称取约0.03g的残留物固体,加入3 mL硝酸,使样品和硝酸充分反应,得到离子态的草酸根离子。(2)用草酸钠配置不同浓度的标样。(3)在上述色谱操作条件下,分别测定米家崖试样以及不同浓度的标样。用线性线性回归分析法测定试样中的草酸根离子浓度,检出限为0.036%。对照样品4 的分析采用位于斯坦福大学Environmental Measurements Facility的Dionex DX-500离子色谱仪,配有电导检测器。操作条件包括:流动相为20mM NAOH水溶液,用草酸溶液配置不同浓度的标样,其他操作条件与其他三个样品分析的条件相同。
二、植物残留物的鉴定方法
淀粉粒和植硅体的鉴定主要基于两种方法:形态分析(morphological analysis)和形态测量学分析(morphometric analysis)。形态分析的对比材料主要是基于本实验室积累的1000种来源于亚洲的现代植物标本,同时也参考一些已发表的标本材料[9-14]。关于形态测量学的分析,我们具体利用了两种电脑分析手段。首先,利用判别分析法,我们已经建立了区分薏米(Coix lacryma-jobi) 淀粉粒和粟黍 (Setaria italica and Panicum miliaceum) 淀粉粒的统计模型。通过对淀粉粒大小,偏心率,以及消光十字的弯曲臂存在与否,这个多变量模型可将薏米淀粉粒与粟黍淀粉粒区分开来,正确率高达82.4 %[15]。第二,我们对绞合状树枝状型植硅体进行了形态测量学的分析。树枝型植硅体主要来源于谷物花序苞片,在小麦族植物中尤其丰富。绞合状树枝状型植硅体的波浪形纹饰具有可区分其来源植物种属的特性。最近的研究已经成功建立了将驯化大麦、小麦与其他相关的野生物种区分开来的模型。若一个植硅体标本有至少30个波浪形结构纹饰,那么就可通过形态测量的模型来鉴定其种属,置信度高达90%。本研究对米家崖六个残留物标本的绞合状树枝型植硅体进行分析,一共包括776个波浪形结构纹饰。具体步骤见Ball et al.[16],具体分析数据见Wang et al.[17]。我们将米家崖树枝状型植硅体的测量数据与20个相关的早熟禾亚科植物标本的植硅体进行比较,这些标本包括中国本土的早熟禾亚科野生种,例如冰草和赖草,也包括从西方传入中国的外来物种,例如大麦和小麦。

图三 漏斗1内壁的浅黄色残留物
三、分析结果
从陶器内壁提取的残留物中一共发现541颗淀粉粒 (表一)。其中,有488颗(90.2%)为可鉴定淀粉粒,包括黍、小麦族、薏米、以及少量块根类植物,例如栝蒌根(Trichosanthes kirilowii)、薯类(Dioscorea sp.) 和百合(Lilium sp.) (图四,a~f)。大量的淀粉粒(N=166,30.7%) 有损伤的迹象,其中有两种损伤特点与酿酒有关。第一,一些淀粉粒表面出现缺坑和裂沟,缺坑大小不一。有的坑较浅,有坑大且深,使淀粉粒表面呈基本空心状(图五,a)。第二,有大量淀粉粒呈膨胀、折叠、以及变形的状态(图五,b);一些淀粉粒的个体轮廓仍然保留,一些已与其他淀粉粒聚集融合。这两种损伤特征与谷物发芽和糖化时淀粉粒的形态改变完全对应 (图五,c、d; 图七 )[18-21]。在发芽的过程中,谷物产生的酶将一部分淀粉转化为糊精和单糖,这一转化给淀粉粒表面造成缺坑和裂沟[18]。酿酒的糖化阶段包括将谷芽在水里加热一段时间,这一过程会使淀粉粒糊化及变形[18]。结合以上两点,米家崖陶器内淀粉粒
的损伤特征说明这些这些淀粉粒是来源于酿酒过程的残留物。

表一 米家崖淀粉粒鉴定与数量统计表
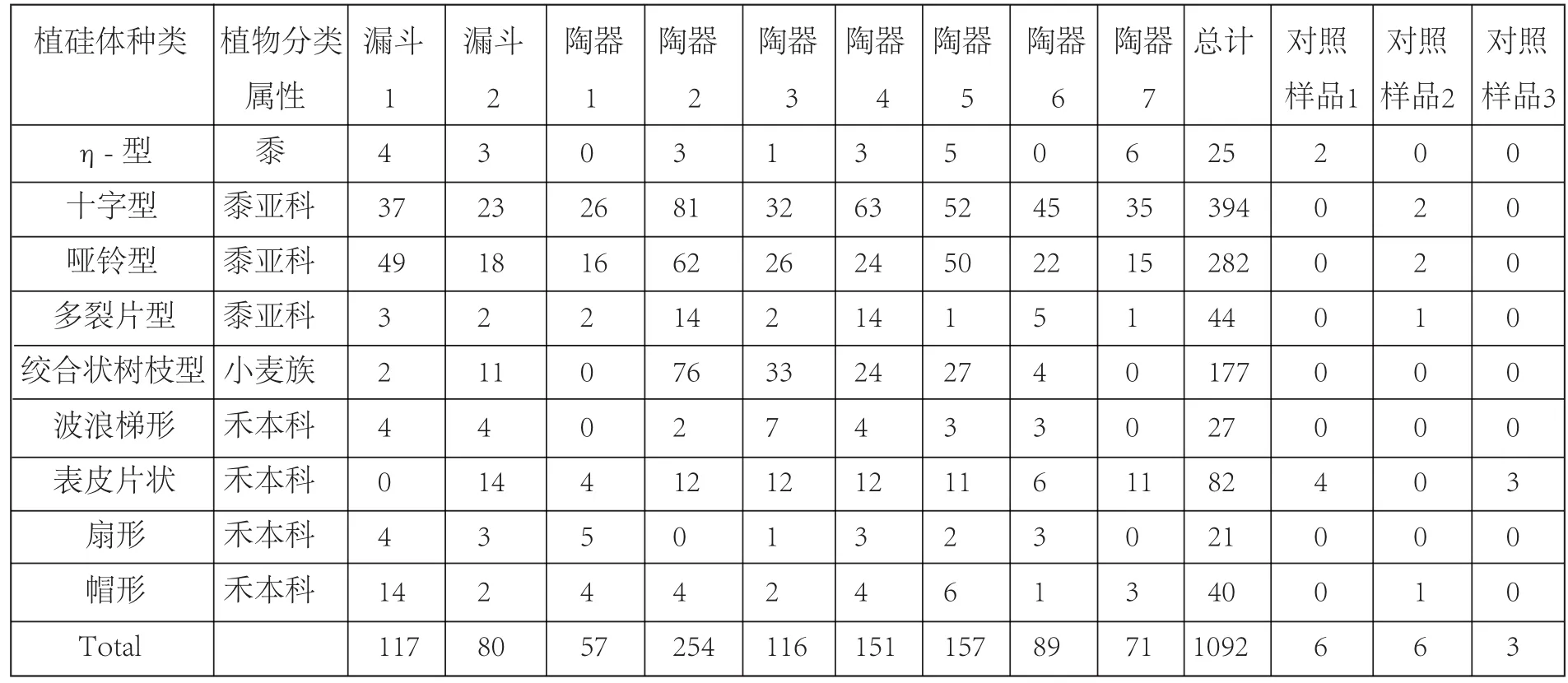
表二 米家崖植硅体鉴定与数量统计表
植硅体的分析结果显示残留物中含有谷壳(表二)。大部分植硅体来源于黍亚科。其中,7个陶器残留物中发现了黍稃壳上特有的 η 型长细胞植硅体(图四,j)[13]。十字型的植硅体的形状和大小多变不一,这种多样性的特点与薏米十字形植硅体相吻合(图四,h)。此外,在早熟禾亚科的植硅体中,我们发现了大量的绞合状树枝型植硅体(图四,k)。通过利用我们已建立的形态测量学模型分析,他们的形态数据与大麦(Hordeum vulgare) 最为接近(详细数据分析见Wang et al[17]的 Supporting Information)。总体而言,植硅体数据支持淀粉粒数据,
均说明米家崖陶器内残留黍、薏米、和大麦。谷芽酒的酿造需要未脱壳的谷物作为原料,因此,在米家崖漏斗以及陶器内壁发现来自于颖壳的植硅体更进一步证明了这些器物是酿造谷芽酒的工具。
通过离子色谱法分析,我们在残留物中发现了草酸根离子(图六)。草酸是谷物在糖化以及发酵过程中产生的副产品[22]。草酸钙,又称“啤酒石”,是谷芽酒酿造过程中析出的结晶体,也是用于鉴定古代麦类酿酒的标志性化合物[23-26]。我们测试了漏斗1、陶器3和陶器 5上的残留物样品。测试结果表明,漏斗1 和陶器 5 的草酸根离子含量分别为0.08%(80mg/100g) 和 0.05% (50mg/100g)。 陶 器 3 未检测出草酸根离子。虽然草酸在自然界一些植物中存在,例如菠菜(Spinacia oleracea),大黄(Rheum rhabarbarum),以及一些根茎作物。但是本研究所分析的陶器器型并不适用于储藏新鲜植物,因此草酸更可能来源于谷芽酒酿造。
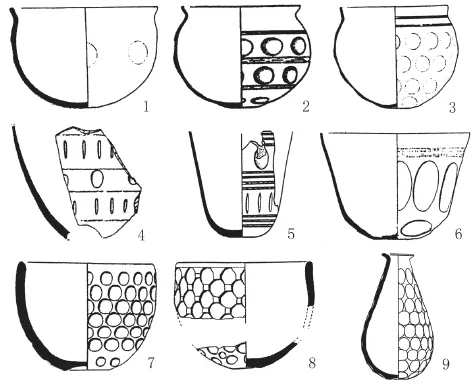
图四 米家崖陶器残留物中的淀粉粒和植硅体(DIC和偏光视野)
为了排除来自于堆积环境或发掘后保存修复过程中造成污染的可能,我们分析了四份对照样品。其中,三份对照样品用于分析植硅体和淀粉粒,它们分别来源于陶器 5 外表面的结垢物(对照样品1),H78中石锛残块的残留物(对照样品2),以及来于漏斗 2上修复所用的石灰材料 (对照样品3)(见图二红圈)。结果显示,对照样品所含的植硅体和淀粉粒的数量远远低于米家崖的陶器内壁的残留物样本,且在这些极少量的淀粉粒上也没有任何损伤的现象。对照样品4来源于陶器 5 外层挂取得结垢物,离子色谱鉴定未测出草酸,此结果和同一器物内壁所测得的高浓度草酸呈明显反差。以上分析结果排除了污染的可能,说明在米家崖陶器上所得的残留物是酿酒而成。

图五 米家崖陶器和酿酒实验中的受损淀粉粒
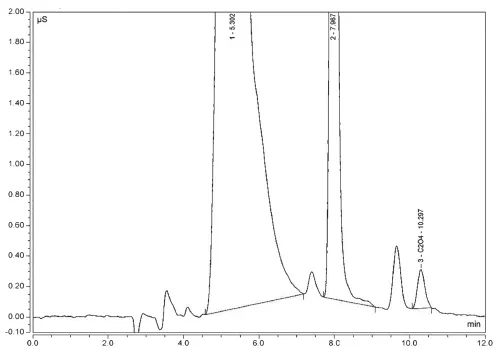
图六 用离子色谱法测定漏斗1中残留物,右起第一个峰值为草酸离子
四、谷芽酒模拟酿造实验
为了获取与古代淀粉粒损伤可比较的对照标本,我们用黍、粟、大麦进行了谷芽酒酿造的模拟实验。我们一共进行了四组不同材料的酿造实验,这四组材料分别包括:黍(40g),粟(40g),黍(30g)和大麦(10g)混合,以及粟(30g)和大麦(10g)混合。每一组谷物材料均经过发芽、糖化、发酵三个步骤。具体方法如下:
第一步为发芽,将谷物种子在水中浸泡直至发芽,室温大约为20~28°C,大部分种子在八天内发芽,发芽后将种子沥水晾干。第二步为糖化,将种子捣碎,倒入一容器内与温水混合,使温度达到65°C,并保持此温度大约两小时。最后一步为发酵,即将芽浆凉至室温,将容器用盖子封口形成缺氧环境,大约两日后基本发酵。

图七 酿酒实验过程中观察到的淀粉粒
我们在实验的三个步骤中均提取了淀粉粒标本。发芽标本来源于二至三粒发芽的黍、粟以及大麦。显微镜观察后总结出两个基本特征:第一,这三种谷物种子的淀粉粒在发芽后均在中心出现明显的缺坑和裂沟。有部分淀粉粒已基本呈空心状,只剩下一圈环式边缘(图七,a~c)。第二,这种坑状损伤大约出现在90%的黍粟淀粉粒上,但在大麦淀粉粒上只有大约1%(另外一个变量可能是种子的新鲜程度,也会影响到发芽造成的淀粉粒损伤度)。第二批淀粉粒标本提取于当糖化完成时的芽浆,显微镜观察发现淀粉粒有不同程度的膨胀和变形,这种形态在各组标本出现率为5%~15% (图七,d、g、j、m)。第三批标本提取于发酵完成时。发酵谷物的淀粉粒呈现出三个特征: 第一,缺坑状损伤仍然可见,但一些淀粉粒的外缘也出现裂痕(见图七,e、h、k中的箭头)。第二,大量淀粉粒膨胀、变形、消光十字不见。一些淀粉粒已经与其他淀粉粒融合一起 (图七,f、o)。和糖化的淀粉粒相比,发酵后的淀粉粒出现更大程度的膨胀和变形,消光十字在大多数大型淀粉粒中不见。第三,一些小型淀粉粒形态未改变,无损伤迹象(见图七,l中的箭头)。由于部分淀粉粒相互融合,我们无法量化各种损伤特征。
五、结论
残留物分析的三方面结果均与考古数据相符合,说明仰韶时期人们已经开始酿造一种混合谷芽酒,且已掌握了一定的用于酿酒的温控技术。和果酒相比,谷芽酒的酿造过程更加复杂,而仰韶人已经懂得如何制芽和糖化多种富含淀粉的植物。大麦比粟黍含有更高的α- 和β-淀粉酶,更高的淀粉酶含量加快淀粉的糖化效率[27]。块根类植物富含可转化为糖的淀粉,同时也可为酒添加甜味。我们推测,仰韶人可能通过反复尝试、实验,得出这种混合酒的酿造配方。
大麦在酿酒原料中的发现说明这种谷物传入中国的过程可能是源于一种社会文化性的推动力[28]。大麦最初在欧亚大陆西部驯化,之后通过中亚草原传入中国。此前的研究尚未对大麦在中国传入的具体时间点得出明确答案[28-30]。在中原地区的仰韶文化时代,大植物遗存在遗址的保存情况较好,其中粟黍为驯化植物遗存的大宗,暂未发现大麦。目前最早的大麦大植物遗存来自于青铜时代的遗址,出现零星,且年代均在公元前2000 年左右或更晚[30,31]。一直到大约3000年之后,也就是秦汉时期,大麦才变为中原地区的人们主食的重要组成部分[28,32]。本次在米家崖发现的大麦是中国目前为止最早的发现。
大麦在中原地区青铜时期的零星发现,说明其传入初期可能被视为一种稀有、有独特用途的异域谷物。米家崖的居民的大麦可能来源于交换或者小规模种植。我们认为,大麦最初是被作为一种酿酒原料引进中原,而不是作为主食。鉴于本研究是首次将形态测量学的方法用于中国的绞合状树枝状型植硅体,这个假设需要得到更多来自其他新石器时代遗址的植硅体材料的验证。
酿酒的发展很可能与中原地区在公元前4000 年左右的社会复杂化现象有关。在这个时期,渭河流域的仰韶晚期遗址呈现出聚落形态阶层化、政体相互竞争的特点。一些大型公共建筑在一些遗址出现,它们可能用于宗教礼仪性的、社会高层组织的宴飨活动[33]。和别的酒精性饮料相似,谷芽酿造而成的酒是最世界上最广泛使用的社交媒介之一[34],可用于建立与交涉各种社会关系。谷芽酒的酿造和其他的资料说明,竞争性的宴享饮酒活动可能在仰韶晚期显著发展。中原地区被称为中华文明的摇篮,谷芽酒的制作和饮用可能促进了该地区阶级化社会的产生与发展。
致谢:本研究经费来源于Min Kwaan Chinese Archaeology Fund,Stanford Archaeology Center,Center for East Asian Studies, 以及一位私人捐献者。我们感谢Maureece Levin博士、Mike Bonomo 以及David Hazard对前期稿件提出的改进意见、感谢孙周勇博士为我们提供采集残留物样本的安排、感谢赵昊在采集样本过程中的协助;最后感谢王敢荣先生和郑莉菁女士在化学残留物分析上提供的建议和帮助!
[1]温少峰,袁庭栋.殷墟卜辞研究——科学技术篇[M].成都:四川省社会科学院出版社,1983.
[2]张德水.殷商酒文化初论[J].中原文物,1994(3):18-24.
[3]陈梦家.殷墟卜辞综述[J].北京:科学出版社,1956.
[4]Huang,H.T.Science and Civilisation in China.Volume 6:Biology and Biological Technology. Part V:Fermentations and Food Science[M].Cambridge University Press,2000.
[5]李仰松.对我国釀酒起源的探讨[J].考古,1962(1):41-44.
[6]包启安,周嘉华主编.酿造[M].郑州:大象出版社,2007.
[7]McGovern PE, et al. Fermented beverages of preand proto-historic China [J]. Proc Natl Acad Sci.2004, 101(51):17593-17598.
[8]陕西考古研究院.西安米家崖—新石器时代遗址2004-2006考古发掘报告[M].科学出版社,2012.
[9]Piperno,D. R. Phytoliths: A Comprehensive Guide for Archaeologists and Paleoecologists [M]. AltaMira Press, 2006.
[10]Ball,T.,Gardner,J.S.& Brotherson,J.D.Identifying phytoliths produced by the inflorescence bracts of three species of wheat (Triticum monococcum L.,T.dicoccon Schrank,and T.aestivumL.) using computerassisted image and statistical analyses[J]. J.Archaeol. Sci. 1996, 23(4):619–632.
[11]Ball,T. B.,Gardner,J. S. & Anderson,N. Identifying inflorescence phytoliths from selected species of wheat (Triticum monococcum,T. dicoccon,T.dicoccoides,and T. aestivum) and barley (Hordeum vulgare and H. spontaneum) (Gramineae) [J]. Am. J.Bot. 1999, 86(11):1615–1623.
[12]Ball,T.B.,Ehlers,R. & Standing,M. D. Review of typologic and morphometric analysis of phytoliths produced by wheat and barley [J]. Breed. Sci. Jpn.2009,59(4):55-102.
[13]Lu,H.et al.Phytoliths analysis for the discrimination of foxtail millet (Setaria italica)and common millet (Panicum miliaceum)[J]. PLoS ONE 4(2),e4448.
[14]Weisskopf,A.R.& Lee,G.-A. Phytolith identification criteria for foxtail and broomcorn millets:a new approach to calculating crop ratios[J]. Archaeol.Anthropol. Sci. 2014,8(1):29-42.
[15]Liu,L.,Ma,S. & Cui,J.Identification of starch granules using a two-step identification method[J]. J. Archaeol. Sci. 2014, 52:421-427.
[16]Wang,J. et al. Revealing a 5,000-y-old beer recipe in China. Proc. Natl. Acad. Sci. 2016, 113:6444-6448.
[17]Ball TB,et al. A morphometric study of variance in articulated dendritic phytolith wave lobes within selected species of Triticeae and Aveneae[J]. Veg Hist Archaeobotany. 2015,26(1):85-97.
[18]Samuel,D. Investigation of Ancient Egyptian Baking and Brewing Methods by Correlative Microscopy[J].Science.1996. 273(5274):488-490.
[19]Dronzek,B. L.,Hwang,P. & Bushuk,W. Scanning electron microscopy of starch from sprouted wheat[J]. Cereal Chem. 1972, 49:232-239.
[20]Sun,Z. & Henson,C. A. Degradation of native starch granules by barley α-glucosidases[J]. Plant Physiol. 1990, 94(1):320-327.
[21]Henry,A. G.,Hudson,H. F. & Piperno,D. R. Changes in starch grain morphologies from cooking[J]. J.Archaeol. Sci. 2009, 36(3),915-922.
[22]Briggs,D. E.,Brookes,P. A.,Stevens,R. & Boulton,C.A. Brewing:Science and Practice[M]. Elsevier,2004.
[23]McGovern,P.E.Uncorking the Past:The Quest for Wine,Beer,and Other Alcoholic Beverages[M].University of California Press, 2009.
[24]Michel,R. H.,McGovern,P. E. & Badler,V. R.Chemical evidence for ancient beer[J]. Nature 1993, 360(6399):24-24.
[25]Michel,R. H.,McGovern,P. E. & Badler,V. R. The first wine and beer:chemical detection of ancient fermented beverages[J]. Anal. Chem. 1993, 65(8):408A-413A.
[26]McGovern,P. E. et al. Chemical Identification and Cultural Implications of a Mixed Fermented Beverage from Late Prehistoric China[J]. Asian Perspect. 2005, 44(2):249-75.
[27]Delcour,J. A. & Hoseney,R. C. Principles of Cereal Science and Technology[M]. AACC International,2010.
[28]Boivin,N.,Fuller,D. Q. & Crowther,A. Old World globalization and the Columbian exchange:comparison and contrast[J]. World Archaeol. 2012,44(3):452-469.
[29]Jones,M.et al.Food globalization in prehistory[J].World Archaeol. 2011, 43(4):665-675.
[30]Chen,F.H.et al.Agriculture facilitated permanent human occupation of the Tibetan Plateau after 3600 B.P. Science[J],2015. 347(6219):248-250.
[31]Flad R,Li S,Xiaohong W,Zhao Z Early wheat in China:Results from new studies at Donghuishan in the Hexi Corridor[J]. The Holocene. 2010, 20(6):955-965.
[32]Yu,Y. in Food in Chinese Culture:Anthropological and Historical Perspectives [C]// ed. Chang,K. SMC publishing Incorporated. 1997:53-83.
[33]Liu,L. The Chinese Neolithic:Trajectories to Early States[M]. Cambridge University Press, 2007.
[34]Jennings,J.& Bowser,B. J. in Drink,Power,and Society in the Andes [C]// eds. Jennings,J. &Bowser,B. J., University Press of Florida, 2009:1-27.
