基于高通量测序的郫县豆瓣后发酵期真菌演替变化分析
2017-09-03赵红宇徐炜桢杨国华刘元福
赵红宇,徐炜桢,杨国华,刘元福,岳 鹏,张 良,*
基于高通量测序的郫县豆瓣后发酵期真菌演替变化分析
赵红宇1,徐炜桢1,杨国华2,刘元福3,岳 鹏2,张 良1,*
(1.西华大学食品与生物工程学院,食品生物技术四川省高校重点实验室,四川 成都 610039;2.四川省丹丹郫县豆瓣集团股份有限公司国家企业技术中心,四川省豆瓣酿制技术工程实验室,四川 成都 611732;3.四川友联味业食品有限公司,四川 成都 611732)
为研究郫县豆瓣后发酵过程中真菌群落变化规律,揭示其特有“日晒夜露”工艺的发酵本质,采用MiSeq测序分析其从后发酵1 周至后发酵6 a期间一共7 个时间点的真菌群落演替变化情况。结果表明,郫县豆瓣后发酵过程中共有3 个门类群、20 个纲类群、47 个目类群、77 个科类群、106 个属类群的真菌参与演替变化;后发酵时间对郫县豆瓣的真菌群落组成具有重要影响,随着后发酵的进行格孢菌科和黑霉科真菌持续减少,而酵母科、类酵母科和毕赤酵母科的真菌则呈现先增加后减少的趋势,其峰值大多出现在3~6 个月之间,但后发酵6 a的郫县豆瓣真菌群落较其他样品呈明显偏低。该方法发现了大量的非培养真菌和未报道真菌,所得真菌多样性更接近于样品微生态,更能够全面解析自然发酵调味品郫县豆瓣的真菌多样性,为传统产业的现代化改造和食品质量安全控制提供科学支撑。
郫县豆瓣;真菌演替;高通量测序
郫县豆瓣属中国传统发酵食品,迄今为止已有300多年的历史,被列为中国非物质文化遗产。郫县豆瓣不仅生产工艺独特,也以其味辣香醇、黏稠绒实、红棕油亮、酱香浓郁等特点在我国酱类产品中独树一帜,堪称川菜之魂[1-2]。截止2015年末,“郫县豆瓣”品牌价值已达607.16亿 元,位列“加工食品类地理标志产品”全国第一;当年产品总产量达到110万 t,实现工业产值102亿 元,出口世界绝大部分国家和地区,创汇超过4 000万 美元[3]。
郫县豆瓣的生产包括前期发酵和后熟发酵2 个阶段,前期发酵主要是指蚕豆霉瓣子的制曲和辣椒坯的预处理[2]。后熟发酵主要是将成熟霉瓣子和成熟辣椒坯按比例配料混合,加入适量食盐和水,进入发酵池发酵,经过一定时期的翻晒和陈化,即是郫县豆瓣特有的日晒夜露工艺[4-5]。因此,郫县豆瓣的生产是以蚕豆瓣制曲、辣椒坯和环境微生物等复杂的物质能量代谢过程为前提,通过独特的“日晒夜露”开放发酵工艺,使得栖息在曲药、辣椒坯、环境中的庞大微生物体系在发酵醅固、液、气三相界面发生复杂的物质转换、能量代谢和信息传递作用,并最终形成郫县豆瓣独特的成分构成和风味特征。
真菌在郫县豆瓣发酵过程中发挥了非常重要的作用,在制曲阶段,霉菌能分泌蛋白酶、淀粉酶、糖化酶等多种酶类,这些酶作用于辣椒和蚕豆不仅生成了大量的风味物质,也为后发酵期其他微生物生长创造了条件。但是,由于郫县豆瓣后发酵阶段的生产处于开放环境,少则半年多则2 a以上的“日晒夜露”后发酵期不仅决定了郫县豆瓣独特的成分构成和风味特征,也存在巨大的食品安全风险,如毛霉菌和青霉菌会产生霉臭味,产毒黄曲霉和部分寄生曲霉还可能产生黄曲霉毒素B1,带来潜在的食品安全隐患。因此,研究郫县豆瓣后发酵期的真菌演替变化显得非常必要。
近年来,国内利用变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)、温度梯度凝胶电泳[6]、DNA克隆文库[7]、末端限制性片段长度多态性分析[8]、16S rRNA基因文库[9]等非培养技术,在分析研究发酵食品生产过程中微生物的功能作用方面,做出了大量卓有成效的成绩,其直接从分子水平上研究微生物资源,避免了传统基于微生物分离培养分析方法的局限,在分析复杂环境微生物群落结构中具有优势。但这些方法也都存在一些问题,如测序通量低、操作复杂、干扰因素多、准确率不高等。高通量测序(high-throughput sequencing,HTS)技术又称为第2代基于宏基因组深度测序技术,具有检测通量更高、用时更少、准确度更高以及检测费用更低等优点,能更可靠、更全面、更直接地反映微生物的群落构成、功能特性、变化演替和多样性[10]。
目前,HTS技术在发酵调味品研究中得到了一定的应用,如韩国学者对海鲜酱(jeotgal)[11]、酱粉(meju)[12]、泡菜(kimchi)[13]、鱼酱(fish sauce)[14]和豆瓣辣酱(doenjang)[15]的发酵微生物多样性已经进行了解析;欧洲学者更是从宏基因组的角度评述了该技术给食品微生物群落变化研究带来的重大影响变化[16-18]。但是,国内外鲜见利用该技术分析郫县豆瓣后发酵期真菌多样性的研究报道。
本研究采用MiSeq测序,对郫县豆瓣后发酵过程中从入池到发酵6 a合计7 个不同发酵阶段的样品进行分析,以期揭示郫县豆瓣不同后发酵阶段的真菌多样性,加深对传统本土调味品发酵机制的认识,为传统产业的现代化改造和食品质量安全控制提供科学支撑。
1 材料与方法
1.1 材料与试剂
样品取自郫县当地知名郫县豆瓣生产企业的生产车间。郫县豆瓣实际生产中将后发酵6 个月的产品即视为传统自然发酵产品,可进入市场销售(主要用于菜肴的炒、拌);同时,厂家也会根据市场需求适当延长后发酵期(该郫县豆瓣用于火锅底料和烧、炖等菜肴的制作)。因此,本研究选取后发酵1 周,3、6 个月,1、2、5 a及6 a的郫县豆瓣样品(共计7 个样品,按发酵时间长短分别编号为1W、3M、6M、1Y、2Y、5Y、6Y)。每个时间节点的样品选取同一后发酵时间的不同发酵池进行3 次重复取样。郫县豆瓣在后发酵时,每日需进行搅拌、翻晒,故取样时从每个发酵池的上层(距表面0~20 cm)、中层(距表面30~50 cm)、下层(距池底0~20 cm)各取25 g左右,混合均匀后密封,低温运至实验室,于-70 ℃条件下保存备用。测序时选取每个样品做3 次平行实验并将数据进行合并以便后续分析。
土壤DNA提取试剂盒 上海Sangon Biotech公司;Taq DNA聚合酶、dNTPs、通用引物ITS4及ITS3_KYO2宝生物工程(大连)有限公司;二代测序快速DNA建库试剂盒 美国Illumina公司。
1.2 仪器与设备
NanoDrop 2000测定仪 美国Thermo公司;台式离心机、聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Eppendorf公司;MiSeq测序仪 美国Illumina公司。
1.3 方法
1.3.1 DNA提取
豆瓣基因组DNA采用土壤DNA提取试剂盒提取。DNA质量与浓度(A260nm/A280nm及A260nm/A230nm)采用NanoDrop 2000测定仪测定。PCR扩增采用rDNA-ITS序列的通用引物ITS4(5’-TCCTCCGCTTATTGATATGC-3’)和ITS3_KYO2(5’-GATGAAGAACGYAGYRAA-3’)并在引物5’端加不同的barcode。
1.3.2 PCR扩增及MiSeq测序
根据提取的样品基因组DNA的浓度配制PCR体系(25 μL):1×PCR buffer、1.5 mmol/L MgCl2、0.4 μmol/L dNTP、1.0 μmol/L上下游引物、0.5 U Taq DNA聚合酶以及10 ng豆瓣基因组DNA。PCR扩增条件为:94 ℃预变性3 min;94 ℃变性40 s,56 ℃退火60 s,72 ℃延伸60 s,30 个循环;最后72 ℃再延伸10 min。1%琼脂糖凝胶电泳检测PCR产物,试剂盒回收纯化PCR产物,按等摩尔比例混合成测序文库后,用MiSeq测序仪进行双端测序。
1.3.3 HTS数据前处理
采用QIIME pipeline去除低质量原始测序数据,使用Uchime去除嵌合体序列[19]。以rDNA-ITS序列97%相似度作为操作分类单元(operational taxonomic units,OTUs)的划分标准。
1.4 数据统计分析
使用QIIME平台计算Chao1、Shannon-Wiener和Simpson多样性指数[20]。
2 结果与分析
2.1 郫县豆瓣不同后发酵阶段真菌多样性分析
微生物群落生态学可通过样品的OTUs、Chao1、Shannon-Wiener和Simpson指数来反映微生物群落的丰度和多样性。不同后发酵阶段的样品真菌多样性指数如表1所示。
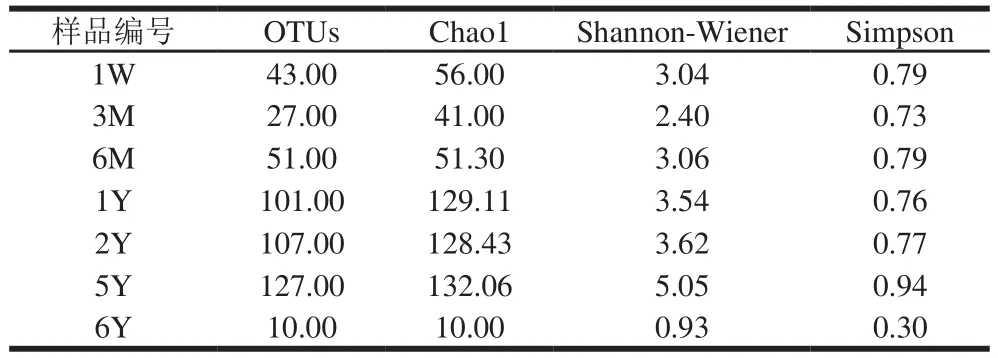
表1 基于97%相似性水平所计算的多样性指数Table 1 Diversity indices calculated based on a cutoff of 97%similarity
由表1可知,随着发酵时间的延长,样品当中的真菌多样性总体呈现先下降后上升再下降的趋势。但后发酵时间过长(6 a)的样品真菌多样性最低,与其他后发酵阶段的真菌多样性存在明显差异。

图1 豆瓣样品的Rank-Abundance曲线Fig. 1 Rank-Abundance curves of samples
图1 为7 个发酵阶段郫县豆瓣真菌的Rank-Abundance曲线,曲线越宽,表示物种的组成越丰富,曲线越平坦,表示物种组成的均匀程度越高,图1展示的样品所含物种的丰富程度和均匀程度也与表1相似。
结合实际生产,郫县豆瓣后发酵期真菌演替变化的过程可以归纳为:郫县豆瓣发酵启动阶段(1周)的真菌大多来源于霉瓣子曲的接种,而这些真菌在适应新生境过程中,出现了种类和构成的急剧变化;到发酵3 个月时,大量真菌由于不适应新的生境或完成其发酵代谢过程而消失;直至发酵6 个月时,“日晒夜露”过程当中大量环境真菌的进入,其真菌多样性超过发酵1 周时样品;这说明环境微生物可能对郫县豆瓣的风味和品质产生了重要的影响。
2.2 郫县豆瓣后发酵期真菌群落结构变化分析

图2 门水平下郫县豆瓣真菌群落变化Fig. 2 Changes in fungal community in Pixian soybean paste during fermentation at phylum level
对不同后发酵阶段郫县豆瓣的7 个样品中的真菌群落,利用Illumina双末端HTS,发现所有样品中可以确认的有3 个门类群、20 个纲类群、47 个目类群、77 个科类群、106 个属类群。
如图2所示,真菌群落中门水平有子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、结合菌门(Zygomycota)和其他未识别真菌,分别占整个发酵阶段总真菌数平均数的88.06%、3.67%、0.36%、3.93%,其中子囊菌门的数量在发酵的整个过程一直处于绝对优势地位。

图3 纲水平下郫县豆瓣真菌群落变化Fig. 3 Changes in fungal community in Pixian soybean paste during fermentation at class level
如图3所示,纲水平平均含量排名前10的分别是酵母菌纲(Saccharomycetes)、座囊菌纲(Dothideomycetes)、散囊菌纲(Eurotiomycetes)、伞型束梗孢菌纲(Agaricostilbomycetes)、锤舌菌纲(Leotiomycetes)、粪壳菌纲(Sordariomycetes)、银耳纲(Tremellomycetes)、伞菌纲(Agaricomycetes)、子囊菌门下类别不明真菌(incertae sedis)和未识别真菌(unidentified),分别占整个发酵阶段真菌平均总数的63.21%、16.88%、3.89%、1.81%、1.74%、1.32%、1.0%、0.61%、0.38%和3.93%,其中酵母菌纲的数量一直处于绝对优势地位。

图4 目水平下郫县豆瓣真菌群落变化Fig. 4 Changes in fungal community in Pixian soybean paste during fermentation at order level
如图4所示,目水平平均相对含量排名前10的分别是酵母菌目(Saccharomycetales)63.21%、格孢腔菌目(Pleosporales)12.80%、散囊菌目(Eurotiales)3.24%、煤炱目(Capnodiales)2.81%、伞型束梗孢菌目(Agaricostilbales)1.81%、蜡钉菌目(Helotiales)1.66%、粪壳菌目(Sordariales)0.92%、座囊菌纲(Dothideomycetes)未识别目0.70%、银耳目(Tremellales)0.32%。值得注意的是,随着后发酵周期由3 个月延长至5 a,目水平相对含量排名前10的真菌总数逐渐变少,而多样性明显增多。后发酵5 a时未识别的真菌相对数量达到了20.14%,明显高于其他阶段,这时的发酵醅物质转换、能量代谢和信息传递作用均接近尾声。这与实际生产过程中,3~5 a的郫县豆瓣鲜味物质最丰富,风味物质极为醇厚的经验相符合。
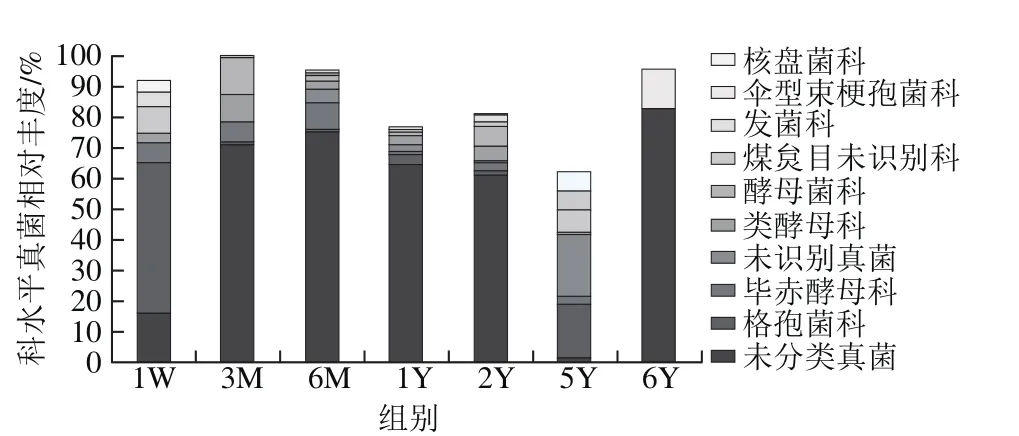
图5 科水平下郫县豆瓣真菌群落变化Fig. 5 Changes in fungal community in Pixian soybean paste during fermentation at family level
如图5所示,科水平平均相对含量排名前10的分别有未分类真菌(incertae sedis)52.81%、格孢菌科(Pleosporaceae)10.56%、毕赤酵母菌科(Pichiaceae)3.97%、类酵母科(Saccharomycodaceae)3.27%、酵母菌科(Saccharomycetaceae)3.16%、煤炱目(Capnodiales)未识别科2.71%、发菌科(Trichocomaceae)2.15%、伞型束梗孢菌科(Agaricostilbaceae)1.81%、黑霉科(Sclerotiniaceae)1.39%。
3 讨 论
汪先丁等[21]运用PCR-DGGE技术,发现郫县豆瓣制曲阶段和发酵初期米曲霉(Aspergillus oryzae)是优势真菌,淀粉丝菌(Amylomyces rouxii)和米根霉(Rhizopus oryzae)是制曲阶段的优势真菌,异常毕赤酵母(Pichia anomala)和汉逊德巴利酵母(Debaryomyces hansenii)是发酵初期的优势真菌。董丹等[22-23]利用纯培养的方法从发酵70 d、5 个月和10 个月的郫县豆瓣中分离得到4 个属的真菌,其中念珠菌(Candida)和威克汉姆酵母(Wickerhamomyces)为发酵5 个月的优势真菌,曲霉和毕赤酵母为发酵5 个月的优势真菌。
Kim等[24]利用PCR-DGGE技术研究韩国辣酱(doenjang)检测出念珠菌、毕赤酵母、曲霉和毕赤酵母等属合计20 株真菌;Ezeokoli等[25]也利用PCRDGGE技术从尼日利亚发酵豆酱(soy-daddawa)中发现了念珠菌、毕赤酵母、曲霉等属,合计16 株真菌。刘春凤等[26]通过构建真菌18S rRNA基因文库,从成熟豆酱中发现5 个属的真菌,分别为接合酵母、Rhizochaete、曲霉、红酵母和Phaseoleae。
针对郫县豆瓣后发酵期真菌演替变化的研究报道还不多,且并没有形成学界和产业界一致公认的说法。李幼筠[1]在2008年就质疑,在郫县豆瓣制曲时将米曲霉作为唯一功能菌并不符合生产实际。本研究发现,曲霉科真菌在郫县豆瓣后发酵的各个阶段的演替过程中相对含量并不占优势,平均相对含量在科水平仅占0.46%。董丹等[22-23]从发酵5 个月的郫县豆瓣分离出148 株微生物,其中鉴定出14 种真菌,但未发现发现曲霉属微生物;从发酵10 个月的郫县豆瓣分离出145 株微生物其中鉴定出20 种真菌,发现曲霉属微生物含量为1%。
值得注意的是,黄曲霉毒素作为曲霉科的黄曲霉菌(Aspergillus flavus)和寄生曲霉菌(Aspergillus parasiticus)等产生的一类含有二氢呋喃环结构的次生代谢产物,长期困扰着郫县豆瓣产业的发展。黄曲霉毒素B1含量是GB/T 20560—2006《地理标志产品 郫县豆瓣》的食品安全关键控制指标。课题组对郫县豆瓣中黄曲霉毒素B1污染的现状进行了调研[27],发现总体形势不容乐观,产品抽样合格率仅为(92.74%)低于国家质检总局公布的2012年度全国加工食品95.6%和酱类调味品96%的平均合格率[28]。汪先丁等[21]发现黄曲霉菌在制曲阶段一直较弱地存在,但在发酵初期消失了,并认为这是黄曲霉毒素B1含量趋于稳定的原因,这与本研究的曲霉科真菌演替变化的研究结果相似。
另外,以往关于郫县豆瓣真菌的报道无论是取样追踪的时间跨度,还是所得微生物菌群数据丰富程度,以及确定优势菌群的全面性,与本结果相比都具有一定局限。这说明HTS技术可以快速、高效地对郫县豆瓣中真菌结构进行精确的分析,尤其是为揭示其一些功能作用的机制提供了新的研究方法。但是,郫县豆瓣长达5 a“日晒夜露”的开放发酵工艺造成了微生物区系极为复杂的状况,且批次间组成差异较大,依靠HTS技术本身并不能全面地解析郫县豆瓣的真菌发酵演替机制,还需要结合实际生产状况和其他物理化学因子分析,才能够更加全面地分析其真菌的作用机制,进一步加深对郫县豆瓣复杂发酵过程的科学认识。
同时,该技术仍有一定的不足,如样品测序前需利用真菌通用引物PCR对序列片段进行扩增,这无形间增加了序列合成的出错率,基于Illumina MiSeq的桥式扩增的“边合成,边测序”也不太适合没有基因组系列的全新测序[29]。另外,由于所得测序数据量巨大,经软件拼接、过滤等处理后,难免出现冗余数据和有效数据丢失的情况。
目前,业内有一种片面的认识:认为后熟周期越长越好。因此常出现由于销售制约而无限期延长后发酵周期的现状。已有学者指出,在现有的发酵条件下,后熟完成后,各种有效成分将会从高峰降至低谷,综合成分整体劣变,同时卫生指标和理化指标也会相应降低,因此应严格控制发酵周期为6 个月至1 a[1]。本研究结果发现后发酵期6 个月至2 a的郫县豆瓣真菌群落演替变化相较于其他阶段变化较小,为该观点从微生物角度提供了一定理论支撑。
4 结 论
本研究利用HTS对郫县豆瓣后发酵过程中的真菌群落进行了分析研究,结果表明该技术可以较为有效、快速、充分地评价郫县豆瓣中的真菌群落演替情况。同时,丰富了对传统本土调味品—郫县豆瓣中真菌的认识,真菌群落的多样性和丰度均显著高于国外传统发酵调味品,这可能与其独特的长时间“日晒夜露”开放发酵工艺有关。发酵时间对郫县豆瓣后发酵期的真菌群落组成有重要影响,无限期延长后发酵周期会带来微生物群落丰度和多样性的大幅度降低。
[1] 李幼筠. “郫县豆瓣”剖析[J]. 中国酿造, 2008, 27(11): 83-86. DOI:10.3969/j.issn.0254-5071.2008.06.027.
[2] 余浪, 阚建全. 传统豆瓣的研究进展[J]. 中国调味品, 2008, 33(5): 26-31. DOI:10.3969/j.issn.1000-9973.2008.05.002.
[3] 杜敬秋, 刘浏. 607亿元 郫县豆瓣跻身中国品牌价值榜[N]. 成都日报, 2015-12-14.
[4] 石磊, 李诚. HACCP在郫县豆瓣生产中的应用[J]. 中国调味品, 2007, 32(6): 25-27. DOI:10.3969/j.issn.1000-9973.2007.06.002.
[5] 高岭. 郫县豆瓣的生产工艺改进[J]. 中国调味品, 2006, 31(5): 34-39. DOI:10.3969/j.issn.1000-9973.2006.05.009.
[6] 张琦, 汪先丁, 杨虎, 等. 郫县豆瓣自然发酵过程中细菌群落结构的变化[J]. 食品与发酵科技, 2010, 46(6): 16-18. DOI:10.3969/ j.issn.1674-506X.2010.06.005.
[7] 聂志强, 韩玥, 郑宇, 等. 宏基因组学技术分析传统食醋发酵过程微生物多样性[J]. 食品科学, 2013, 34(15): 198-203. DOI:10.7506/ spkx1002-6630-201315041.
[8] 左勇, 王小龙, 张晶, 等. 基于高通量测序技术的宜宾芽菜真菌多样性研究[J]. 中国调味品, 2016, 41(4): 19-22. DOI:10.3969/ j.issn.1000-9973.2016.04.004.
[9] 陈玲, 袁玉菊, 曾丽云, 等. 16S rDNA克隆文库法与高通量测序法在浓香型大曲微生物群落结构分析中的对比研究[J]. 酿酒科技, 2015(12): 33-40. DOI:10.13746/j.njkj.2015145.
[10] 韩齐, 李媛媛, 孙方达, 等. 新一代测序技术在食品微生物学中的应用[J]. 食品工业, 2016, 37(1): 278-283.
[11] GUAN L, CHO K H, LEE J H. Analysis of the cultivable bacterial community in jeotgal, a Korean salted and fermented seafood, and identification of its dominant bacteria[J]. Food Microbiology, 2011, 28(1): 101-113. DOI:10.1016/j.fm.2010.09.001.
[12] JUNG J Y, LEE S H, JEON C O. Microbial community dynamics during fermentation of doenjang-meju, traditional Korean fermented soybean[J]. International Journal of Food Microbiology, 2014, 185: 112-120. DOI:10.1016/j.ijfoodmicro.2014.06.003.
[13] PARK E J, CHUN J, CHA C J, et al. Bacterial community analysis during fermentation of ten representative kinds of kimchi with barcoded pyrosequencing[J]. Food Microbiology, 2012, 30(1): 197-204. DOI:10.1016/j.fm.2011.10.011.
[14] LEE S H, JUNG J Y, JEON C O. Bacterial community dynamics and metabolite changes in myeolchi-aekjeot, a Korean traditional fermented fish sauce, during fermentation[J]. International Journal of Food Microbiology, 2015, 203: 15-22. DOI:10.1016/ j.ijfoodmicro.2015.02.031.
[15] NAM Y D, LEE S Y, LIM S I. Microbial community analysis of Korean soybean pastes by next-generation sequencing[J]. International Journal of Food Microbiology, 2012, 155(1/2): 36-42. DOI:10.1016/ j.ijfoodmicro.2012.01.013.
[16] KERGOURLAY G, TAMINIAU B, DAUBE G, et al. Metagenomic insights into the dynamics of microbial communities in food[J]. International Journal of Food Microbiology, 2015, 213: 31-39. DOI:10.1016/j.ijfoodmicro.2015.09.010.
[17] TAMAKI H, WRIGHT C L, LI X, et al. Analysis of 16S rRNA amplicon sequencing options on the Roche/454 next-generation titanium sequencing platform[J]. PLoS ONE, 2011, 6(9): e25263. DOI:10.1371/journal.pone.0025263.
[18] LI X, RUI J, MAO Y, et al. Dynamics of the bacterial community structure in the rhizosphere of a maize cultivar[J]. Soil Biology and Biochemistry, 2014, 6(8): 392-401. DOI:10.1016/ j.soilbio.2013.10.017.
[19] EDGAR R C, HAAS B J, CLEMENTE J C, et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2194-2200. DOI:10.1093/bioinformatics/btr381.
[20] WANG Q, GARRITY G M, TIEDJE J M, et al. Naïve Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267. DOI:10.1128/aem.00062-07.
[21] 汪先丁, 刘敏, 高鹏, 等. 郫县豆瓣自然发酵过程中真菌群落的演替及黄曲霉毒素B1的消长[J]. 食品科学, 2012, 33(11): 142-146.
[22] 董丹, 关统伟, 车振明, 等. 发酵初期豆瓣酱中微生物多样性分析及产酶菌株的筛选[J]. 食品工业, 2015, 36(7): 175-178.
[23] 董丹, 关统伟, 赵辉平, 等. 两个不同发酵时期豆瓣中微生物多样性的差异对比[J]. 中国酿造, 2014, 33(11): 55-58. DOI:10.11882/ j.issn.0254-5071.2014.11.012.
[24] KIM T W, LEE J H, KIM S E, et al. Analysis of microbial communities in doenjang, a Korean fermented soybean paste, using nested PCR-denaturing gradient gel electrophoresis[J]. International Journal of Food Microbiology, 2009, 131: 265-271. DOI:10.1016/ j.ijfoodmicro.2009.03.001.
[25] EZEOKOLI O T, GUPTA A K, MIENIE C, et al. PCR-denaturing gradient gel electrophoresis analysis of microbial community in soydaddawa, a Nigerian fermented soybean (Glycine max (L.) Merr.) condiment[J]. International Journal of Food Microbiology, 2016, 220: 58-62. DOI:10.1016/j.ijfoodmicro.2016.01.003.
[26] 刘春凤, 刘金霞, 蒋立胜, 等. 传统发酵成熟期豆瓣酱醅中的微生物群落分析[J]. 食品工业科技, 2012, 33(13): 122-126.
[27] 赵红宇, 李扬明, 杨国华, 等. 郫县豆瓣黄曲霉毒素B1污染调查与分析[J]. 中国调味品, 2017, 42(4): 119-122; 128. DOI:10.3969/ j.issn.1000-9973.2017.04.027.
[28] 李丹, 王守伟, 臧明伍, 等. 中国加工食品安全现状研究: 基于国家质检总局2009—2012年抽查数据分析[J]. 食品工业科技, 2015, 36(13): 275-281. DOI:10.13386/j.issn1002-0306.2015.13.050.
[29] 焦晶凯, 莫蓓红. Illumina MiSeq平台高覆盖率测定干酪中的细菌微生物多样性[J]. 中国酿造, 2014, 33(5): 34-38. DOI:10.11882/ j.issn.0254-5071.2014.05.009.
Fungal Community Analysis by High-Throughput Sequencing in Pixian Soybean Paste during Post-Fermentation
ZHAO Hongyu1, XU Weizhen1, YANG Guohua2, LIU Yuanfu3, YUE Peng2, ZHANG Liang1,*
(1. Key Lab of Food Biotechnology of Sichuan Province, College of Food & Bioengineering, Xihua University, Chengdu 610039, China; 2. Soybean Paste Brewing Technology and Engineering Laboratory of Sichuan Province, National Enterprise Technology Center of Sichuan Dandan Pixian Soybean Paste Co. Ltd., Chengdu 611732, China; 3. Sichuan Youlian Condiment Food Co. Ltd., Chengdu 611732, China)
The changes in fungal communities in Pixian soybean paste during post-fermentation were analyzed using highthroughput sequencing method in order to reveal the essence of ‘being kept under sunlight in the daytime and being allowed to absorb moisture in the air at night during the fermentation process’. The results revealed that at the taxonomic levels of microbes, including phylum, class, order, family, and genus, high-throughput sequencing method could detect 3 phyla, 20 classes, 47 orders, 77 families and 106 genera. It was shown that the fungal community in Pixian soybean paste was highly diverse and abundant. The dominant microbes were greatly changed during the post-fermentation process; the quantities of Pleosporaceae and Sclerotiniaceae continued to reduce, while those of Saccharomycetaceae, Saccharomycodaceae and Pichiaceae increased firstly and then decreased. In addition, a large number of non-cultivated fungi and unclassified fungi were also found in this study. The observed fungal diversity was highly similar to the microbial ecology of the investigated samples. This study may provide scientific support for the modernization of the traditional Pixian soybean paste industry as well as food safety and quality control.
Pixian soybean paste; fungal community; high-throughput sequencing
10.7506/spkx1002-6630-201716008
Q939.97
A
1002-6630(2017)16-0051-06
2016-10-12
国家教育部春晖计划项目(Z2015117);四川省战略性新兴新产品项目(2015GZX0021);四川省重点研发项目(2016NZ0093);成都市科技惠民技术研发项目(2015-HM01-00003-SF);成都市农业技术成果应用示范项目(2015-NY01-00001-NC);成都市农业技术研发项目(2015-NY02-00097-NC);成都市产学研联合实验室项目(2015-YF04-00047-JH);西华大学食品生物技术重点实验室建设项目(川教2006-313)
赵红宇(1992—),男,硕士研究生,研究方向为食品生物技术。E-mail:redrain.z@foxmail.com
*通信作者:张良(1982—),男,副教授,博士,研究方向为食品生物技术。E-mail:zhang-liang@foxmail.com
赵红宇, 徐炜桢, 杨国华, 等. 基于高通量测序的郫县豆瓣后发酵期真菌演替变化分析[J]. 食品科学, 2017, 38(16): 51-56. DOI:10.7506/spkx1002-6630-201716008. http://www.spkx.net.cn
ZHAO Hongyu, XU Weizhen, YANG Guohua, et al. Fungal community analysis by high-throughput sequencing in Pixian soybean paste during post-fermentation[J]. Food Science, 2017, 38(16): 51-56. (in Chinese with English abstract)
10.7506/spkx1002-6630-201716008. http://www.spkx.net.cn
