扩散法测定土壤无机氮15N丰度方法优化研究*
2017-08-31张珮仪温张金波4蔡祖聪
张珮仪温 腾,2,3,4†张金波,2,3,4蔡祖聪,2,3,4
(1 南京师范大学地理科学学院,南京 210023)
(2 江苏省地理环境演化国家重点实验室培育建设点,南京 210023)
(3 江苏省地理信息资源开发与利用协同创新中心,南京 210023)
(4 虚拟地理环境教育部重点实验室(南京师范大学),南京 210023)
扩散法测定土壤无机氮15N丰度方法优化研究*
张珮仪1温 腾1,2,3,4†张金波1,2,3,4蔡祖聪1,2,3,4
(1 南京师范大学地理科学学院,南京 210023)
(2 江苏省地理环境演化国家重点实验室培育建设点,南京 210023)
(3 江苏省地理信息资源开发与利用协同创新中心,南京 210023)
(4 虚拟地理环境教育部重点实验室(南京师范大学),南京 210023)
扩散法与质谱测定技术相结合,被广泛应用于环境、生态和农业领域中土壤、水等样品中无机氮15N同位素丰度的测定。为建立一套可快速、准确测定土壤无机氮15N同位素丰度的扩散培养体系,针对土壤样品无机氮量的变化特点,从培养温度、培养时间、试剂选择和用量等方面对扩散条件进行优化。结果发现,对于大部分无机氮浓度大于2 mg L-1的土壤样品,20 ml土壤提取液,在不小于250 ml的蓝盖瓶中,悬挂两张各滴加了10 µl 1 mol L-1草酸的滤纸,加入0.1 g的MgO,25 ℃下以140 r min-1的转速振荡培养24 h即可完成对样品中NH4+-N的扩散与回收;换入2张加酸滤纸继续摇培48 h可基本去除残余的NH4+-N;再换入2张加酸滤纸并加入0.1 g的戴氏合金振荡培养24 h即可。对于无机氮浓度低于2 mg L-1的土壤提取液,需用50 ml提取液按以上条件进行扩散培养即可保证测定结果的准确性。本方法大大缩短了扩散法所需的实验周期,实现在一份样品内同时完成NH4+-N和NO3--N的扩散与回收,减少了样品的需要量,并通过优化MgO、戴氏合金(Devarda’s alloy)的用量减少杂质氮可能带来的污染。
扩散;土壤;铵态氮;硝态氮;15N
15N稳定同位素示踪技术,已广泛应用于氮转化研究,无机态氮作为氮转化过程的重要形态,其15N丰度的测定(尤其是-N和-N)对陆地生态系统的氮循环研究尤其重要,如何有效、快速、定量地从样品中提取出-N和-N是关键步骤[1-3]。早期提取、分离土壤样品中的无机态氮一般采用蒸馏法,近年来扩散法已逐渐取代蒸馏法[4-8]。扩散法是在一密闭容器内,加入MgO等碱性试剂使样品中的-N转化为NH3,并被加有酸吸收剂(如H2SO4、KHSO4等)的滤纸所吸收,滤纸干燥后送至元素分析仪-同位素质谱联用仪上测定其15N丰度[3];对于样品中的-N,需去除-N后,利用戴氏合金(Devarda’s alloy)将-N还原为-N,再扩散培养。与蒸馏法相比,扩散法不但适用于15N示踪样品,也适合自然丰度样品,测定的准确度和精确度较高,而且操作简便、交叉污染少,减少了高温蒸馏引起的有机氮分解[4,9-11]。
土壤中的无机氮浓度不高,因土壤异质性,浓度差异较大,对于土壤标记试验,无机氮变化范围可为2 mg L-1~8 mg L-1。扩散法通常采用常温静置培养,培养周期需≥6 d,土壤样品中DON会缓慢降解为无机氮,干扰测定结果,因此极有必要缩短扩散培养时间,这可通过改变培养温度、样品体积、扩散容器大小形状、pH等实现[3-4,9-12]。土壤无机氮浓度变化较大这一特点,使得低浓度样品体积需适当高于高浓度样品,以避免同位素分馏影响测定结果[13]。由于-N的测定需先去除样品中的-N,在二者15N丰度差异较大的情况下,少量的-N残留均会显著影响-N[4,14]。Stark和Hart[15]建议土壤样品开盖敞口静置5 d以上,能基本去除-N,但长时间敞口培养,不但易污染样品,还降低-N的回收率,因此如何快速有效去除-N是关键。此外,扩散培养使用的MgO、戴氏合金等试剂均含不同程度杂质氮,对于土壤样品MgO和戴氏合金的使用量往往偏大,杂质氮干扰明显,优化试剂用量有助于提高测定结果的准确度[15-16]。
综上,本研究针对土壤标记试验中土壤样品的无机氮浓度变化特点,从培养温度、培养时间、试剂选择和用量等方面对扩散培养条件进行优化,旨在建立一套可快速、准确测定土壤标记试验中无机氮15N同位素丰度的扩散培养体系。
1 材料与方法
1.1 扩散法的操作步骤
实验尽量使用同一厂家同一批次的试剂,MgO(国药分析纯)450~600 ℃下高温灼烧以消除杂质氮的污染,戴氏合金研磨过300目筛。在干净铝箔纸上用一次性手套进行操作,打孔器、针头和镊子均用酒精擦拭干净[17]。如图1所示,首先将回形针制成钩状固定到穿孔硅胶片上,并安放在培养瓶的盖子上,再用打孔器制作直径7 mm的小圆滤纸片(Whatman No.42 Cat No. 1442-055),用镊子将其穿在挂钩下部。移取适量样品溶液于培养瓶中,瓶内放入3颗玻璃珠。吸取一定量的酸吸收剂均匀润湿滤纸后,向瓶中加入0.3 g MgO,立即盖上瓶盖并旋紧,适当摇匀。将培养瓶放于恒温摇床(常州普天仪器制造有限公司,HZQ X160,HZQ F160),140 r min-1摇培一定时间后,取出滤纸片,放入96孔板内,在干燥器内至少干燥24 h[9]后,锡杯包样,通过同位素比值质谱仪(Thermo Fisher Scientific Delta V Plus)测定15N丰度,即样品中的-N的15N丰度。样品中-N的测定则是在完成-N的扩散培养并去除残留-N后,加入0.3 g戴氏合金,摇培、干燥、包样和测定方法同-N。
1.2 培养温度和培养时间的优化
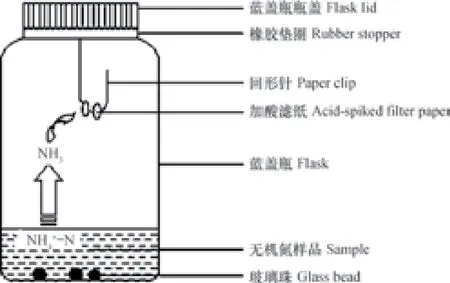
图1 扩散法培养体系示意图Fig. 1 Diagram of the diffusion method
土壤样品的无机氮浓度一般为2~8 mg L-1,试验选用购自上海化工研究院的15NH4NO3标准样,配置成2、6、8 mg L-1的15NH4NO3标记液(-15N丰度5 atom%;-15N丰度 0.3663 atom%),分成两组,其中一组直接使用标记液作为样品溶液,其对照组为同体积高纯水;另一组标记液中加入2 mol L-1KCl以模拟土壤提取液,对照组为同体积2 mol L-1KCl溶液。设置25、35和45 ℃ 3个扩散培养温度水平,每个温度水平分别设置12、24、36和48 h 4个扩散培养时间,酸吸收剂为20 µl 1 mol L-1H2C2O4,MgO和戴氏合金用量均为0.3 g。
1.3 低氮浓度样品扩散体系的优化
在1.2试验结果的基础上,对浓度为2 mg L-1低浓度样品扩散体系做进一步的优化,以提高测定精度。设置3个样品体积处理,分别为20 ml、50 ml和100 ml的15NH4NO3溶液(浓度2 mg L-1,-15N丰度5 atom%;NO3-15N丰度 0.3663 atom%),在25 ℃下按1.1扩散培养24 h和48 h,其中100 ml溶液改用500 ml蓝盖瓶中扩散培养,酸吸收剂为H2C2O4,MgO和戴氏合金用量均为0.3 g,每组处理均设对照组,为同体积高纯水。
1.5 试剂选择和用量优化
在1.2和1.4试验结果的基础上,对试剂选择和用量进行优化。使用8 mg L-1的15NH4NO3溶液(-15N丰度5 atom%;NO3-15N丰度 0.3663 atom%),按1.1在25 ℃下扩散培养,MgO和戴氏合金的用量均为0.1 g、0.2 g和0.3 g,酸吸收剂选用2 mol L-1H2SO4、2.5 mol L-1KHSO4和1 mol L-1H2C2O4,每组处理以同体积高纯水为对照组。
1.6 数据处理
以上试验每个处理均设有3个重复,试验数据处理采用Origin 9、SPSS 19.0统计分析,并采用t检验法及Duncan法检验差异显著性。
2 结 果
2.1 不同氮浓度样品培养温度和培养时间的优化
氮回收量是影响扩散法测定15N丰度精度的重要因素,质谱仪上m/z 28和m/z 29的信号值一定程度上可近似表征回收的氮量。以在25 ℃下8 mg L-1NH4NO3溶液中NH4+-N的扩散培养结果为例(图2),培养12 h时m/z 28和m/z 29的信号值均最低,但培养24 h后二者信号值与36 h、48 h无显著差异,可见培养24 h时已完成大部分氮量的回收;与12、36、48 h相比,培养24 h的组内误差最小。同时,流动分析仪检测扩散后的剩余溶液显示-N浓度已降至0.2 mg L-1以下。因此,培养24 h即可较好完成大部分-N或-N的扩散与回收。
本试验设置了3个不同的温度(25、35、45 ℃)来筛选适合土壤样品的最佳扩散培养温度。对比3个温度的结果可以发现(图3A~图3C),3个温度下测得的-N的15N丰度值均接近其理论丰度(5 atom%),但升高扩散培养温度,且随着扩散时间的延长,空白氮量进一步上升(图3D)。此外,与高浓度的测定结果相比,在3个温度条件下,低浓度样品(2 mg L-1)的15N丰度值与理论丰度偏差较大。
试验还发现,滴加20 µl草酸的滤纸片m/z 28信号值约为35 mV,仅含高纯水的对照组中m/z 28信号值约为50 mV,而同等条件下加有2 mol L-1KCl溶液的对照组的信号值可达270~400 mV,同时测定发现2 mol L-1的KCl中含有约0.46 mg L-1的-N和0.52 mg L-1的-N。
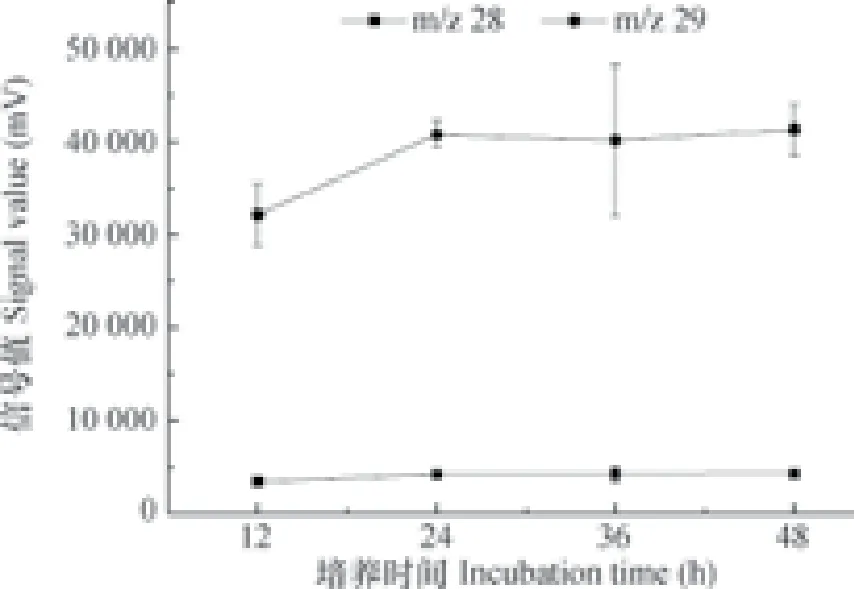
图2 25 ℃下8 mg L-1NH4NO3溶液中-N在不同扩散培养时间下的氮量回收变化Fig. 2- N recovery in extracts 8 mg L-1in NH4NO3concentration incubated at 25 ℃ relative to incubation time
2.2 低氮浓度样品扩散体系的优化
对于无机氮浓度(< 2 mg L-1)较低的土壤样品,提高样品量可增加氮回收量并提高测定的准确性。对比不同体积的2 mg L-1NH4NO3溶液(20、50、100 ml)的-N测定结果可发现,在同一培养条件下,20 ml体系样品的15N丰度明显低于理论值,而50和100 ml体系均基本接近理论值(图4B)。在氮回收量上,20 ml体系的氮回收量最低,延长培养时间至48 h,氮回收量无明显提高,而50和100 ml体系的氮回收量均显著高于20 ml体系,且随着培养时间的延长而增加(图4A)。虽然延长培养时间可提高50 ml和100 ml体系的氮回收量,但在15N丰度的测定上无明显差异(p >0.05),也就是说,对于低氮浓度的土壤样品,将其体积增大至50 ml扩散培养24 h即可保证测定结果的准确性。
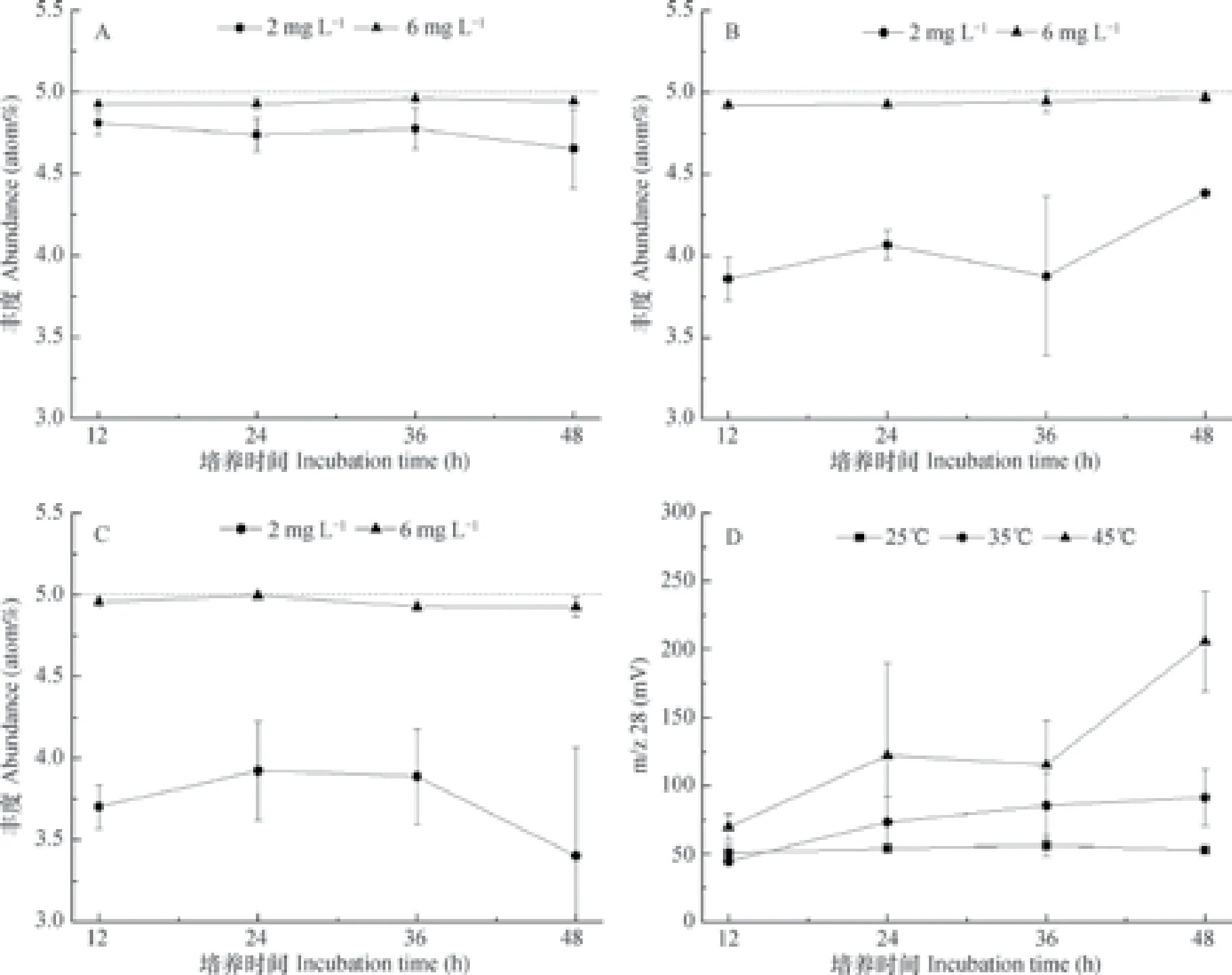
图3 不同温度下(25、35、45 ℃)2 mg L-1和6 mg L-1NH4NO3溶液(-N:5 atom%;-N:0.3663 atom%)扩散培养12、24、36和48 h后-N的15N变化Fig. 3 Variation of δ15N of-N in NH4NO3solutions,2 mg L-1and 6 mg L-1in volume(-N:5 atom%;-N:0.3663 atom%)relative to incubation temperatures(25,35 and 45 ℃)and time(12,24,36 and 48 h)
2.3 残留NH4+-N去除的优化
2.4 试剂选择和用量优化
优化MgO和戴氏合金的用量,可有效减少杂质氮的干扰,保证测定结果的准确性。在溶液中加入不同量的MgO(0.1~0.3 g)后发现,0.1 g的MgO即可使样品溶液pH > 11;添加 0.1 g或0.3 g的MgO,在8 mg L-120 ml15NH4NO3溶液中-N的氮回收量和15N丰度均无明显差异(p > 0.05)。对照的结果显示,高温灼烧过的MgO,用量的增加并未引起信号值的升高(表2)。从加入0.1~0.3 g戴氏合金的结果可发现(表3),合金用量与氮回收量呈正比,虽然0.1 g戴氏合金还原的-N氮量显著低于0.3 g,二者在-N的15N丰度测定结果上无明显差异(p > 0.05),且0.1 g的合金用量得到的丰度最接近理论丰度(0.3663 atom%)。从对照组的结果可看出,随着戴氏合金用量增加,扩散体系中的杂质氮量随之升高。因此对于2~8 mg L-1的土壤样品,0.1 g的MgO和0.1 g戴氏合金用量已足以实现对样品中无机氮的15N值的准确测定。
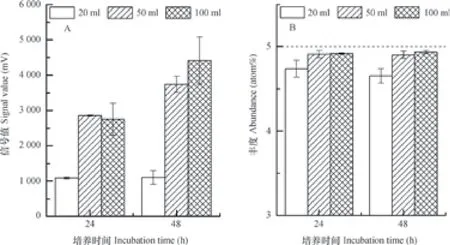
图4 25 ℃下不同体积(20、50和 100 ml)的2 mg L-1NH4NO3溶液(-N:5 atom%;-N:0.3663 atom%)扩散培养24和 48 h后-N的氮回收量变化和15N测定结果Fig. 4 Recoveries of-N and δ15N NH4NO3solutions,2 mg L-1in concentration(-N:5 atom%;-N:0.3663 atom%)relative to volume of the solution(20,50 and 100 ml)and incubation time(24 and 48 h)at 25 ℃
表1 加酸滤纸对20 ml 8 mg L-115NH4NO3溶液(-N:5 atom%;-N:0.3663 atom%)中残留-N去除效果的影响Table 1 Effects of acid-spiked filter paper removing residue-N in15NH4NO3(-N:5 atom%;-N:0.3663 atom%)solution 20 ml in volume and 8 mg L-1in concentration
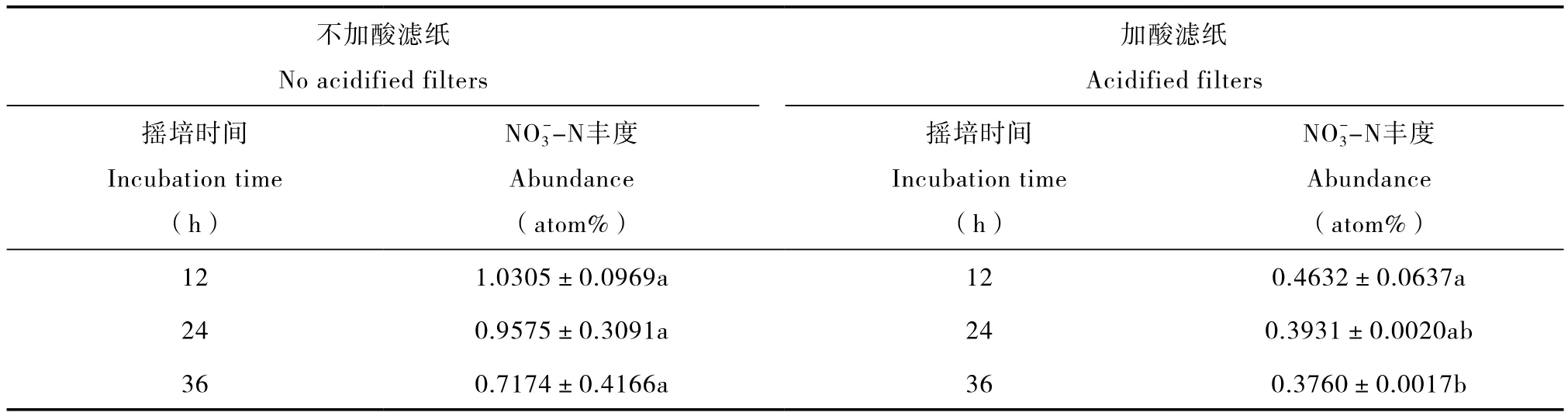
表1 加酸滤纸对20 ml 8 mg L-115NH4NO3溶液(-N:5 atom%;-N:0.3663 atom%)中残留-N去除效果的影响Table 1 Effects of acid-spiked filter paper removing residue-N in15NH4NO3(-N:5 atom%;-N:0.3663 atom%)solution 20 ml in volume and 8 mg L-1in concentration
注:摇培24 h完成对样品中NH4+-N的扩散后,敞口摇培(无加酸滤纸)或换入两张新的滴加酸吸收剂的滤纸(有加酸滤纸)去除残留-N,12、24、36 h后再换入新的滤纸并加戴氏合金完成-N的扩散培养。标准数据为平均值±标准差(n=3),同一列中不同小写字母表示差异显著(p < 0.05)。下同 Note:Incubate the sample for 24 h on a rotator for-N diffusion,incubate again the sample on a rotator with the flask lid removed(no filter paper)or with 2 pieces of new acid-spiked filter paper hung inside,for 12,24 and 36 h to remove residue-N and then replace the filter paper with new ones and add Devarda’s alloy for diffusion of-N. Values are means ± standard deviation(n=3). Values with different lowercase letters within the same column are significantly different at p < 0.05. The same below
不加酸滤纸No acidified filters加酸滤纸Acidified filters摇培时间Incubation time(h)NO3--N丰度Abundance(atom%)摇培时间Incubation time(h)NO3--N丰度Abundance(atom%)121.0305±0.0969a120.4632±0.0637a 240.9575±0.3091a240.3931±0.0020ab 360.7174±0.4166a360.3760±0.0017b
3种酸吸收剂对NH3均有较强的吸收能力,不产生同位素分馏。如表4所示,同等体积的3种酸吸收剂(1 mol L-1H2C2O4、2.5 mol L-1KHSO4和2 mol L-1H2SO4)的氮回收量均较高,且在8 mg L-120 ml15NH4NO3溶液中-N的15N丰度测定结果上
无明显差异(p > 0.05)。虽然2 mol L-1H2SO4的扩散培养回收的氮量低于其他两种酸吸收剂,但其15N值最接近理论丰度(5 atom%)。可见,3种酸吸收剂均可用于扩散法。
表2 不同MgO用量对8 mg L-120 ml15NH4NO3溶液(-N:5 atom%;-N:0.3663 atom%)中-N15N丰度测定的影响Table 2 Effects of MgO on determination of δ15N of-N in the15NH4NO3(-N:5 atom%;-N:0.3663 atom%)solution 8 mg L-1in concentration and 20 ml in volume relative to rate of MgO
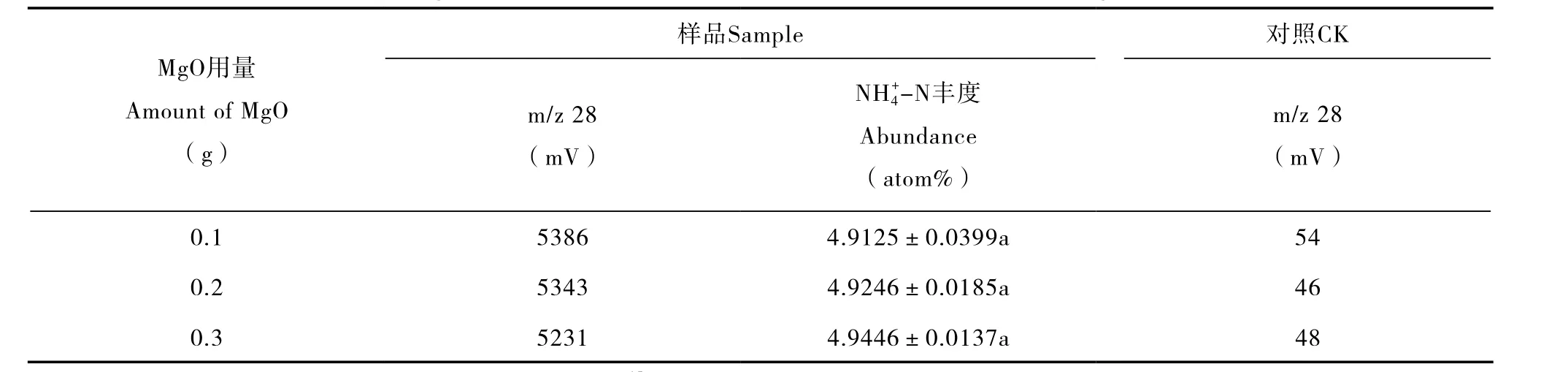
表2 不同MgO用量对8 mg L-120 ml15NH4NO3溶液(-N:5 atom%;-N:0.3663 atom%)中-N15N丰度测定的影响Table 2 Effects of MgO on determination of δ15N of-N in the15NH4NO3(-N:5 atom%;-N:0.3663 atom%)solution 8 mg L-1in concentration and 20 ml in volume relative to rate of MgO
注:m/z 28信号值表示滤纸上的氮量,对照为不含15NH4NO3的高纯水,其m/z 28值为扩散培养体系中的杂质氮量。下同 Note:m/z 28 is the signal value of the amount of N in the filter paper. CK is15NH4NO3-free ultrapure water,of which m/z 28 value represents the amount of nitrogen impurities. The same below
MgO用量Amount of MgO(g)样品Sample对照CK m/z 28(mV)NH4+-N丰度Abundance(atom%)m/z 28(mV)0.153864.9125±0.0399a54 0.253434.9246±0.0185a46 0.352314.9446±0.0137a48
表3 不同戴氏合金用量对8 mg L-120 ml15NH4NO3溶液(-N:5 atom%;-N:0.3663 atom%)中-N15N丰度测定的影响Table 3 Effects of Devarda’s alloy on determination of δ15N of-N in the15NH4NO3(-N:5 atom%;-N:0.3663 atom%)solution 8 mg L-1in concentration and 20 ml in volume relative to rate of the alloy used
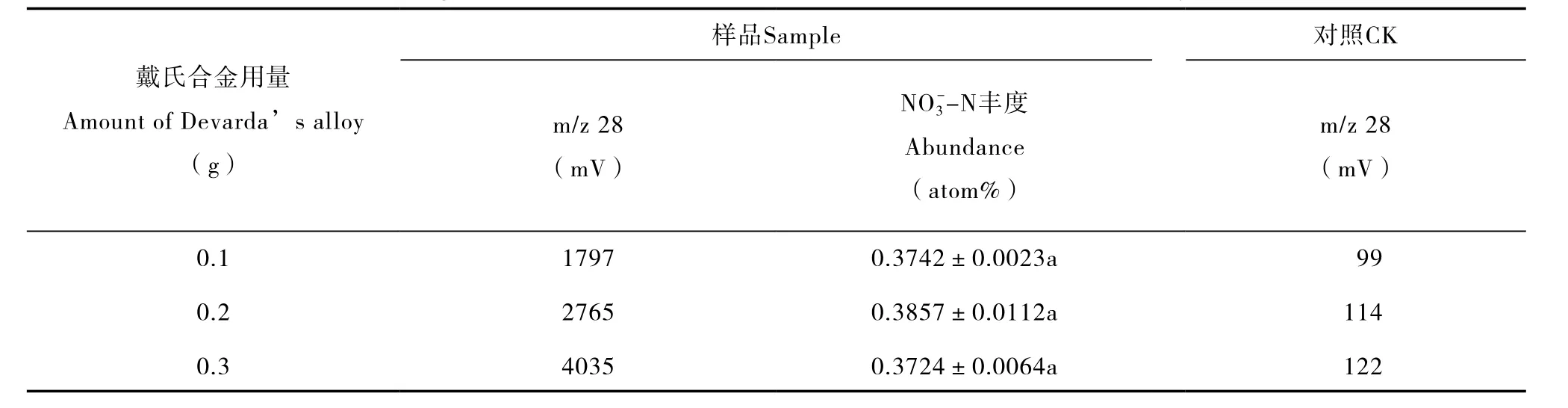
表3 不同戴氏合金用量对8 mg L-120 ml15NH4NO3溶液(-N:5 atom%;-N:0.3663 atom%)中-N15N丰度测定的影响Table 3 Effects of Devarda’s alloy on determination of δ15N of-N in the15NH4NO3(-N:5 atom%;-N:0.3663 atom%)solution 8 mg L-1in concentration and 20 ml in volume relative to rate of the alloy used
样品Sample对照CK戴氏合金用量Amount of Devarda’s alloy(g)m/z 28(mV)NO3--N丰度Abundance(atom%)m/z 28(mV)0.117970.3742±0.0023a99 0.227650.3857±0.0112a114 0.340350.3724±0.0064a122
表4 不同酸吸收剂对8 mg L-120 ml15NH4NO3溶液(-N:5 atom%;-N:0.3663 atom%)中-N15N测定结果的影响Table 4 Effects of acid absorbent on determination of-N in the15NH4NO3(-N:5 atom%;-N:0.3663 atom%)solution 8 mg L-1in concentration and 20 ml in volume relative to type of the absorbent
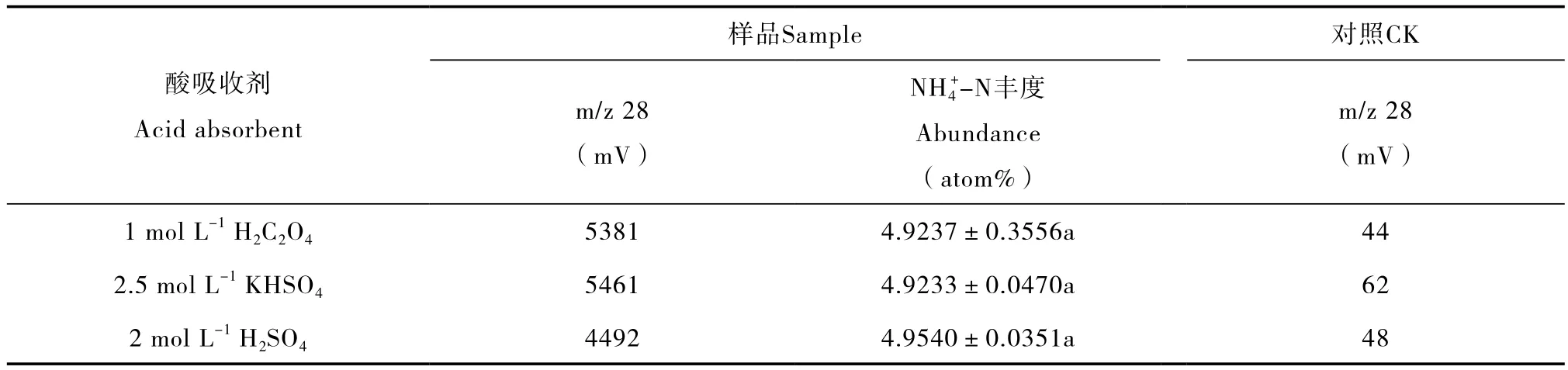
表4 不同酸吸收剂对8 mg L-120 ml15NH4NO3溶液(-N:5 atom%;-N:0.3663 atom%)中-N15N测定结果的影响Table 4 Effects of acid absorbent on determination of-N in the15NH4NO3(-N:5 atom%;-N:0.3663 atom%)solution 8 mg L-1in concentration and 20 ml in volume relative to type of the absorbent
样品Sample对照CK m/z 28(mV)1 mol L-1H2C2O453814.9237±0.3556a44 2.5 mol L-1KHSO454614.9233±0.0470a62 2 mol L-1H2SO444924.9540±0.0351a48酸吸收剂Acid absorbent m/z 28(mV)NH4+-N丰度Abundance(atom%)
3 讨 论
以往学者们大多采用常温静置的方法进行扩散培养,周期较长,还可能导致体系中杂质氮分解,影响测定结果的准确性(≥6 d )[4,14-15,18]。后来Lachouani等[19]发现在37 ℃下摇培(100 r min-1)可加快扩散速度,减少器壁上产生的冷凝水珠,减少其竞争吸收NH3的能力。本研究发现对于含2~8 mg L-1无机氮的土壤样品,在25 ℃下摇床振荡(140 r min-1)培养24 h,即可完成样品中大部分氮量的扩散与回收。甚至20 mg L-1的15NH4NO3溶液在24 h扩散培养后,也不发生分馏,完成大部分氮量回收。
对于无机氮含量为2~8 mg L-1的样品,提高培养温度不会明显加快扩散进程,但可能增加杂质氮量,试验中35、45、55 ℃下对照组的空白氮量明显偏高,并随着扩散时间延长进一步上升。这些杂质氮主要来源于土壤中的DON和扩散使用的试剂及用品(高纯水、滤纸片、酸吸收剂、MgO和戴氏合金),部分也受环境中微量NH3的影响。此外,用来提取土壤无机氮的KCl溶液中也含有主要以-N和-N形式存在的杂质氮,试验中2 mol L-1KCl含0.46 mg L-1的-N和0.52 mg L-1的-N,事先将KCl 450 ℃煅烧24 h以上,并设仅加有KCl的对照进行空白校正,可减少杂质氮对测定结果的干扰[15,18,20-21]。滤纸片一旦滴加酸吸收剂后,会马上吸收环境中的NH3,应尽量避免滤纸片长时间暴露在空气中。随着温度的提高,容器内还可能产生大量的冷凝水珠竞争吸收NH3,反而减少氮回收率[9]。Khan等[11]虽在45~50 ℃下仅用1.5~5 h就完成含4 mg N 土壤提取液的扩散回收,但同样发现这一问题。Mulvaney等[22]还发现高温会升高扩散瓶内的气压,可能引起NH3泄露。
要准确测定低氮浓度土壤样品,需要回收足够的氮量,否则易导致同位素分馏,因此要适当地增加样品体积[13,23]。本次试验发现含2 mg L-1N的土壤样品,培养体积从20 ml增加至50 ml,扩散培养24 h后基本无分馏现象发生。Holmes等[13]发现,将低氮浓度的海水样品的培养体积扩大至200 ml,同位素分馏就可降低至0.2‰。除增加氮量外,扩大样品体积还可减少扩散过程中瓶壁上的冷凝水珠,从而提高氮的回收率。需要注意的是,本文探讨的扩散方法体系是针对15N土壤标记试验的样品,并不适用于自然丰度土壤样品的测定;而且对于氮浓度低(如0.4~0.8 mg L-1)的样品,本文的方法并不适合,可考虑直接化学转化或扩散后转化为N2O气体,以测定其N、O同位素丰度[2,20]。
优化MgO、戴氏合金的用量,可减少试剂所含杂质氮的干扰。过去人们对MgO和戴氏合金的用量并未统一,通常采用与蒸馏法相同的用量(0.2~0.4 g),但扩散无需使用MgO去除水中的CO32-,过量添加反而干扰测定[4,11,16-17,25]。本研究发现,对于含2~8 mg L-1无机氮的土壤样品,0.1 g的MgO足以扩散出足量的NH3。Mulvaney和Khan[25]也在对含2 mg N的(NH4)2SO4标准溶液扩散时发现0.05 g和1.0 g的MgO效果相同,虽然MgO已实现高温灼烧去除杂质氮,提高MgO的用量不会明显增加杂质氮量,但过量MgO可能增加固相阻碍NH3的释放。戴氏合金用量则与杂质氮量呈正比,而合金中的铝由于强还原性可与水反应生成H2,阻碍NH3的释放[26]。Sigman等[9]曾建议高温灼烧戴氏合金减少合金中的杂质氮,但这会降低其对-N的还原能力。虽然现在缺少合金用量与溶液含氮量的定量关系,但对大部分土壤提取液来说,0.1 g的戴氏合金就足够完成扩散,而如何减少戴氏合金中的杂质氮仍是需要解决的一大问题。
本文使用的3种酸吸收剂(H2C2O4、KHSO4和H2SO4)对NH3吸收能力均较强。过去多采用H2SO4和KHSO4,10 µl的5 mol L-1H2SO4可吸收1 400 µg的N,10 µl的2.5 mol L-1KHSO4可吸收350 µg的N,但试验发现,2 mol L-1的H2SO4就因在滤纸上吸附过多水分,水珠回滴损失部分氮,KHSO4虽吸水性较弱,但也会有水珠回滴,而1 mol L-1H2C2O4则未发生此现象,且滤纸干燥最快。尽管Liu和Mulvaney[14]通过降低H2SO4浓度,使用1 mol L-1H2SO4作酸吸收剂,可避免滤纸水分完全饱和的现象,但含H2SO4和KHSO4的滤纸不易干燥,且H2SO4具有较强的腐蚀性,易腐蚀锡杯和同位素质谱仪的管路,会对同位素质谱仪造成不可修复的损害[4,15,26]。对于一般的土壤样品,20 µl 1 mol L-1H2C2O4即可完成氮量的回收。
4 结 论
扩散法早已取代蒸馏法在国外得到广泛应用,是用于测定土壤提取液中无机氮15N丰度的重要方法。本研究针对土壤样品的无机氮浓度变化特点,在培养温度和培养时间、低无机氮浓度样品扩散条件、残留铵态氮的去除、试剂的选择和用量这四方面进行了优化,发现对于大部分样品,仅需20 ml土壤提取液,选用0.1 g的MgO和20 µl 1 mol L-1H2C2O4,在25 ℃下以140 r min-1的转速扩散24 h即可完成对-N的扩散,然后换入2张加酸滤纸扩散培养48 h可有效去除残余的-N,再换入2张加酸滤纸并加入0.1 g的戴氏合金扩散培养24 h即完成-N的扩散。对于低氮浓度的土壤提取液(2 mg L-1)来说,需用50 ml提取液按以上条件进行扩散24 h即可保证测定结果的准确性。这一结果可为研究陆地生态系统的氮循环提供一个可靠的方法和技术,下一步还需对排除土壤提取液中杂质氮的干扰、铵硝同测时尽快完全去除残余-N等问题进行研究。
[1] 张文,周广威,闵伟,等. 应用15N示踪法研究咸水滴灌棉田氮肥去向. 土壤学报,2015,52(2):372—380
Zhang W,Zhou G W,Min W,et al. Fate of fertilizer N in saline water drip-irrigated cotton field using15N tracing method(In Chinese). Acta Pedologica Sinica,2015,52(2):372—380
[2] 曹亚澄,钟明,龚华,等. N2O产生法测定土壤无机态氮15N丰度. 土壤学报,2013,50(1):113—119
Cao Y C,Zhong M,Gong H,et al. Determining15N abundance in ammonium,nitrate and nitirite in soil by measuring nitrous oxide produced(In Chinese). Acta Pedologica Sinica,2013,50(1):113—119
[3] 温腾,曹亚澄,张珮仪,等. 扩散法测定铵态氮、硝态氮的15N稳定同位素研究综述. 土壤,2016,48(4):634—640
Wen T,Cao Y C,Zhang P Y,et al. On progress in use of micro-diffusion method for δ15N-and15N-measurements(In Chinese). Soils,2016,48(4):634—640
[4] Brooks P D,Stark J M,McInteer B B,et al. Diffusion method to prepare soil extracts for automated nitrogen-15 analysis. Soil Science Society of America Journal,1989,53(6):1707—1711
[5] Premi P R,Cornfield A H. The use of iron(II)sulphate for the reduction of nitrate to ammonia in the microdiffusion method for determining nitrate in soil extracts. Analyst,1967,92:196—197
[6] Keeney D R,Nelson D W. Nitrogen-inorganic forms// Page A L. Methods of soil analysis. Part 2:Chemical and microbiological properties. Madison,USA:American Society of Agronomy,Inc.,1982:643—698
[7] Bremner J M,Shaw K. Determination of ammonia and nitrate in soil. Journal of Agricultural Science,1955,46(3):320—328
[8] Adamsen F J,Reeder J D. A comparison of diffusion and distillation methods for preparing samples for15N analyses. Soil Science Society of America Journal,1983,47(3):612—613
[9] Sigman D M,Altabet M A,Michener R,et al. Natural abundance-level measurement of the nitrogen isotopic composition of oceanic nitrate:An adaptation of the ammonia diffusion method. Marine Chemistry,1997,57(3/4):227—242
[10] Lory J A,Russelle M P. Evaluation of a diffusion method for preparing low-nitrogen samples for nitrogen-15 analysis. Soil Science Society of America Journal,1994,58(5):1400—1404
[11] Khan S A,Mulvaney R L,Mulvaney C S. Accelerated diffusion methods for inorganic-nitrogen analysis of soil extracts and water. Soil Science Society of America Journal,1997,61(3):936—942
[12] Conway E J. Microdiffusion analysis and volumetric error. 4th ed. London:Crosby Lockwood and Son,1957:449—458
[13] Holmes R M,McClelland J W,Sigman D M,et al.Measuring15N-in marine,estuarine and fresh waters:An adaptation of the ammonia diffusion method for samples with low ammonium concentrations. Marine Chemistry,1998,60(3):235—243
[14] Liu Y P,Mulvaney R L. Diffusion of kjeldahl digests for automated nitrogen-15 analysis by the rittenberg technique. Soil Science Society of America Journal,1992,56(4):1151—1154
[15] Stark J M,Hart S C. Diffusion technique for preparing salt solutions,kjeldahl digests and persulfate digests for nitrogen-15 analysis. Soil Science Society of America Journal,1996,60(6):1846—1855
[16] Jensen E S. Evaluation of automated analysis of15N and total N in plant material and soil. Plant and Soil,1991,133(1):83—92
[17] Sebilo M,Mayer B,Grably M,et al. The use of the 'ammonium diffusion' method for δ15N-and δ15N-measurements:Comparison with other techniques. Environmental Chemistry,2004,1(2):99—103
[18] Kelley K R,Ditsch D C,Alley M M. Diffusion and automated nitrogen-15 analysis of low-mass ammonium samples. Soil Science Society of America Journal,1991,55(4):1016—1020
[19] Lachouani P L,Frank A H,Wanek W. A suite of sensitive chemical methods to determine the δ15N of ammonium,nitrate and total dissolved N in soil extracts. Rapid Communications in Mass Spectrometry,2010,24(24):3615—3623
[20] Zhang S S,Fang Y T,Xi D. Adaptation of microdiffusion method for the analysis of15N natural abundance of ammonium in samples with small volume. Rapid Communications in Mass Spectrometry,2015,29(14):1297—1306
[21] Bell M D,Sickman J O. Correcting for background nitrate contamination in KCl-extracted samples during isotopic analysis of oxygen and nitrogen by the denitrifier method. Rapid Communications in Mass Spectrometry,2014,28(5):520—526
[22] Mulvaney R L,Khan S A,Stevens W B,et al. Improved diffusion methods for determination of inorganic nitrogen in soil extracts and water. Biology and Fertility of Soils,1997,24(4):413—420
[23] Burke I C,O'Deen L A,Mosier A R,et al. Diffusion of soil extracts for nitrogen and nitrogen-15 analyses by automated combustion/mass spectrometry. Soil Science Society of America Journal,1990,54(4):1190—1192
[24] Saghir N S,Mungwari F P,Mulvaney R L,et al. Determination of nitrogen by microdiffusion in mason jars:II. Inorganic nitrogen-15 in soil extracts. Communications in Soil Science and Plant Analysis,1993,24(19/20):2747—2763
[25] Mulvaney R L,Khan S A. Diffusion methods to determine different forms of nitrogen in soil hydrolysates. Soil Science Society of America Journal,2001,65(4):1284—1292
[26] 孙建飞,白娥,戴崴巍,等.15N标记土壤连续培养过程中扩散法测定无机氮同位素方法改进. 生态学杂志,2014,33(9):2574—2580
Sun J F,Bai E,Dai W W,et al. Improvements of the diffusion method to measure inorganic nitrogen isotope of15N labeled(In Chinese). Chinese Journal of Ecology,2014,33(9):2574—2580
On Improving the Diffusion Method for Determination of δ15N-and δ15N-in Soil Extracts
ZHANG Peiyi1WEN Teng1,2,3,4†ZHANG Jinbo1,2,3,4CAI Zucong1,2,3,4
(1 School of Geography Science,Nanjing Normal University,Nanjing 210023,China)
(2 State Key Laboratory Cultivation Base of Geographical Environment Evolution(Jiangsu Province),Nanjing Normal University,Nanjing 210023,China)
(3 Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application,Nanjing 210023,China)
(4 Key Laboratory of Virtual Geographic Environment(Nanjing Normal University),Ministry of Education,Nanjing 210023,China)
【Objective】 The use of the diffusion method coupled with mass spectrometry to determine δ15N of inorganic nitrogen in soil and water samples in researches in the environmental,ecological andagricultural fields. Compared with the distillation method,the diffusion method consumes less labor and material resources,and can be used in massive operation. The diffusion method not only works when the sample is low in nitrogen content,but also avoids the risk of cross contamination and the need for fractionation. However,for application of the diffusion method,it is essential for the researchers in China to have a sound diffusion-incubation system which is able to perform rapid and accurate determination of δ15N of inorganic N in the soil. 【Methods】The diffusion method proceeds as follows:put a set amount of soil extract in a small airtight grass container;add some alkaline reagent to convert-N into NH3,which is adsorbed by acid-spiked filter paper;for determination of-N,titrate some alkaline reagent to remove-N in the sample;and add some Devarda’s alloy to reduce-N into-N. In the light of characteristics of the variation of inorganic nitrogen in soil extracts,diffusion conditions,such as incubation temperature,incubation time,type and rate of reagents were tested and optimized. 【Results】Results show that for soil extracts,>2 mg L-1in inorganic N concentration,only 20 ml soil extract is needed. put it into a 250 ml flask;hang 2 pieces of filter paper spiked with 10 µl 1 mol L-1H2C2O4each in the flask;add 0.1 g MgO,and then incubate the sample for 24 h at 25 ℃ on a rotator running at 140 r min-1to complete the processes of diffusion and recovery of-N;and then replace the used filter paper with two new ones also spiked with H2C2O4;incubate it on a rotator running at 140 r min-1for 48 h to remove remaining-N;and again replace the used filter paper with two new acid-spiked ones,add 0.1 g Devarda’s alloy,and incubate it for 24 h to complete the processes of diffusion and recovery of-N. For soil extracts < 2 mg L-1in inorganic nitrogen concentration,50 ml is needed to ensure accuracy of the determination once the same incubation procedure is followed. The experiment also reveals that nitrogen impurities that may affect accuracy of the determination,come mainly from highly purified water,filter paper,acid absorbent,MgO and Devarda’s alloy. To avoid the effects of the nitrogen impurities,samples should be incubated at 25 ℃ for 24 h,and filter paper dried as far as possible in NH3-free environment. In addition,results of the determination should be calibrated against that of the control.【Conclusions】 It can be concluded that this method greatly shortens the incubation cycle of the general incubation method and is capable of accomplishing diffusion and recovery of both-N and-N simultaneously,decreasing the amount required of a sample and reducing the risk of contamination by nitrogen impurities by optimizing the rate of MgO and Devarda’s alloy. However,the diffusion method discussed here is oriented towards determination of15N-labeled soil extracts,2~8 mg L-1in inorganic N concentration,but not applicable to determination of soils samples natural in15N abundance or low in nitrogen concentration. Consequently,in future studies,efforts should be devoted to such issues as how to remove nitrogen impurities and quickly,how to rule out the interference of soluble organic nitrogen in the soil.
Diffusion;Soil;Ammonium;Nitrate;15N
S153.1
A
(责任编辑:卢 萍)
10.11766/trxb201611250485
* 国家自然科学基金项目(41501254)和江苏高校优势学科建设工程资助项目资助 Supported by the National Natural Science
Foundation of China(No. 41501254)and the Priority Academic Program Development of Jiangsu Higher Education Institution† 通讯作者 Corresponding author,E-mail:wenteng@njnu.edu.cn
张珮仪(1993—),女,江苏人,硕士研究生,主要从事土壤氮转化研究。E-mail:zhangpeiyi2016@163.com
2016-11-25;
2017-01-25;优先数字出版日期(www.cnki.net):2017-05-02
