春小麦品种“和尚头”的抗旱生理机制及评价
2017-08-16王海庆陈志国刘德梅
杨 倩,王海庆,陈志国,刘德梅
(1.中国科学院大学, 北京 100001; 2.中国科学院西北高原生物研究所, 青海 西宁 810008;3.中国科学院高原适应与进化重点实验室, 青海 西宁 810008)
春小麦品种“和尚头”的抗旱生理机制及评价
杨 倩1,2,3,王海庆2,3,陈志国2,3,刘德梅2,3
(1.中国科学院大学, 北京 100001; 2.中国科学院西北高原生物研究所, 青海 西宁 810008;3.中国科学院高原适应与进化重点实验室, 青海 西宁 810008)
为探讨旱地春小麦“和尚头”的抗旱生理机制,以西北地区各生态区不同基因型春小麦品种宁春4号、高原448作对照,采用20% PEG-6000模拟渗透胁迫,研究幼苗叶片含水量、膜透性、游离脯氨酸及丙二醛含量等生理指标,并进行相关性及聚类分析。结果表明,不同品种对干旱胁迫的生理响应差异显著(P<0.05)。“和尚头”表现出相对高的叶片含水量和脯氨酸含量、低的细胞膜损伤率和丙二醛含量,生理响应指标优于宁春4号和高原448。干旱胁迫48 h“和尚头”叶片含水量和脯氨酸含量分别为72.06%±0.41%和37.06±2.35 μg·g-1,显著高于对照品种(P<0.05);丙二醛含量为46.12±1.20 μmol·g-1,显著低于对照品种(P<0.05);电导率为70.11%±1.69%,显著低于对照品种高原448(P<0.05),与宁春4号差异不显著(P>0.05)。春小麦各生理响应指标间具有显著的相关性(P<0.05),通过聚类分析实现了干旱胁迫条件下不同春小麦品种生理响应间差异。综合评价品种的抗旱性强弱依次为:“和尚头”>宁春4号>高原448。
春小麦;抗旱生理;抗旱性评价
干旱是制约我国作物产量的一个重要因素,据报道,主要作物产量超过50%的损失和全世界接近70%的粮食减产均由干旱引起[1-3]。近年来,随着全球气候变暖,西北地区气温向温干化发展,农作物大幅度减产[4],提高农作物的抗旱性成为研究的重点。因此,准确鉴定作物品种的抗旱性,筛选抗旱品种的优异基因是培育抗旱品种的必要前提,也是保障粮食安全的有效途径。
植物的抗旱性是一个非常复杂的综合性状,不同的植物基因型响应干旱胁迫的机制也不同[5],由于长期生长在不同的生态条件下,经过自然和人工的多次选择,不同的植物对干旱的适应和抵抗能力也不同,方式也多种多样[6]。因此,通过测定一些生理生化指标可了解植物的抗旱生理机制,为进一步评价其抗旱性及筛选优异抗旱基因提供理论依据。据报道,叶片水分含量、电导率、丙二醛和脯氨酸含量等都与植物抗旱性有直接相关。干旱胁迫条件下,抗旱性强的植物叶片含水量下降速度相对较慢,细胞膜损伤程度低[7];植物体内游离脯氨酸含量在逆境条件下约为正常条件下的数十至数百倍[8];丙二醛是膜脂过氧化的终产物,其含量越低说明植物越抗旱[9]。国内外学者对蚕豆[7]、柳枝稷草[10]、豌豆[11]、西红柿和芦笋[12]、紫花苜蓿[13]等干旱胁迫的生理机制进行了大量研究,为抗旱胁迫评价和优异品种抗旱基因型的研究提供了科学依据。
我国华北北部、东北和西北的寒冷、干旱和高原地区,冬季严寒,秋播的小麦不能安全越冬,因此多以春小麦种植为主。作为西北春麦区的青海省,旱灾占全省气象灾害的7%,主要发生在小麦种植区,是农业首害,平均每年造成7.71×104hm2小麦受害[14]。因此,利用优异品种筛选、建构抗旱基因模块,培育新品种十分迫切。本研究利用20% PEG-6000模拟干旱胁迫,以水地主栽品种宁春4号和高原448为对照,研究西北地区旱地优异农家品种“和尚头”抗旱生理响应机制,为进一步利用该品种筛选抗旱基因和培育旱地新品种提供理论依据。
1 材料与方法
1.1 试验材料
3个不同基因型春小麦品种:“和尚头”是甘肃干旱区种植的优质农家品种之一,抗旱性强、耐瘠薄、耐盐碱、耐深播,而且面粉品质好,在甘肃兰州市皋兰县、白银市景泰县、靖远县的干旱砂田大面积种植;宁春4号是宁夏永宁农科所培育的品种,在宁夏、甘肃和新疆灌区大面积种植,是西北水地播种面积最大的品种,适应性广。其谱系是索诺拉64/宏图,母本“索诺拉64”来自墨西哥国际玉米小麦改良中心,父本“宏图”是由阿勃与碧玉麦杂交组合而成的丰产小麦品种[15];高原448是近年来青海灌区主栽品种之一,具有高产、抗倒伏等优良特性,在青海柴达木盆地产量超过850 kg·667m-2,其谱系是青春533/高原602[16],父母本均是种植面积大,丰产性很好的春小麦品种。
1.2 试验设计
挑选籽粒饱满,大小一致的同一年份种子,采用70%的乙醇浸泡种子5 min,然后用纯水清洗6次。放置在铺有滤纸的培养皿上(滤纸吸足水分),4℃冰箱放置2~3 d,待种子统一露白后播种于蛭石基质的塑料盆中,每盆播种80~90粒,置于室温25℃的人工培养间,人工光照(光照强度:80 μmol·m-2·s-1,光周期为光/暗:16 h/8 h)。待小麦长至两叶一心至三叶一心时,将幼苗根部蛭石清洗干净,对照置于装有自来水的烧杯中,处理置于20% PEG-6000的烧杯中(期间不进行根系通气及更换处理液),分别于12 h、24 h及48 h取样,进行叶片含水量(LWC)、细胞膜透性(EL)、游离脯氨酸(Pro)和丙二醛(MDA)等生理生化指标的测定,每个指标测定重复3次,对照和处理方法一样。
1.3 测定项目及方法
叶片含水量(LWC)采用直接烘干法,即80℃烘箱烘干至恒重;细胞膜透性(EL)采用电导仪测定法;游离脯氨酸(Pro)采用酸性茚三酮显色法;丙二醛(MDA)含量采用Heath和Packer提出的硫代巴比妥酸法。
1.4 数据统计与分析
测定结果以“平均值±方差”表示,采用SPASS 18.0版软件对数据进行方差分析,并进行Tukey差异显著性分析、距离Pearson相关性分析和系统聚类分析。
2 结果与分析
2.1 PEG胁迫下叶片水分含量(LWC)的变化
由图1可知,PEG胁迫下不同处理时间,3个品种间的LWC均具有显著性差异(P<0.05)。对照条件下,3个品种都能保持完好的叶片形态,LWC变化差异不显著(P>0.05)。PEG胁迫下“和尚头”表现出高的叶片含水量,宁春4号次之,高原448最低。试验还表明,叶片失水是由叶尖向叶根部失水,经过48 h处理后,高原448失水最严重,叶尖接近干枯。
对照条件下,3个品种的LWC维持在88%左右,胁迫处理下,不同品种LWC均表现出下降趋势,胁迫处理12~48 h,“和尚头”LWC从76.78%下降到72.06%,失水最少,而高原448从71.27%下降到62.84%,下降最明显,宁春4号从74.03%下降到69.53%(图1)。说明“和尚头”抗胁迫能力最强,宁春4号次之,高原448最差,这也与3个品种的田间表现一致。
2.2 PEG胁迫下叶片细胞膜透性(EL)的变化
试验表明,对照条件下,3个品种EL的变化差异不显著(P>0.05)。PEG胁迫条件下3个品种EL均表现出一个明显的上升趋势,其中,EL的变化为:高原448>宁春4号>“和尚头”。高原448品种EL上升的最快,在48 h时已经达到92.52%,“和尚头”和宁春4号表现较一致,上升较缓慢;同时,3个品种间的电导率在12 h时差异不显著(P>0.05),而24 h和48 h时,高原448显著高于其它两个品种(P<0.05)。
对照条件下,3个品种的EL维持在18%左右,胁迫处理条件下,EL表现出一个明显上升趋势,表明干旱胁迫对叶片细胞膜具有较大的损伤(图2)。
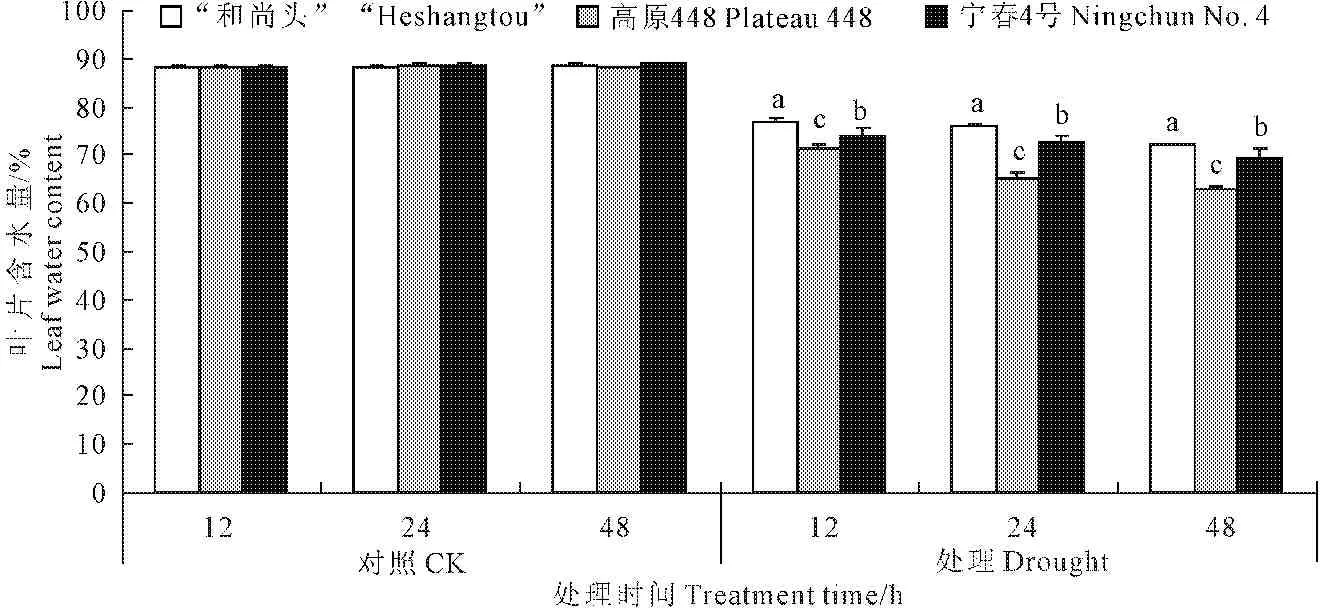

图1 3个品种的叶片含水量在对照和处理条件下的差异
图2 3个品种的叶片电导率在对照和处理条件下的差异
Fig.2 Electrolyte leakage(EL) under control and treatment
2.3 PEG胁迫下叶片脯氨酸含量(Pro)的变化
脯氨酸(Pro)调控细胞膜的稳定性,平衡细胞质和外环境的渗透压,对于植物应对不良的胁迫具有一定的贡献[17]。对照条件下,3个品种Pro含量一直处于极低的水平,PEG胁迫下Pro含量明显上升,含量的变化差异为:“和尚头”>高原448>宁春4号,并且“和尚头”和高原448两个品种Pro含量随胁迫时间上升很快,而宁春4号Pro含量受胁迫时间的影响较小(12 h为11.9 μg·g-1,48 h为13.3 μg·g-1)。
对照条件下,3个品种Pro的变化差异不显著(P>0.05)。PEG处理12 h“和尚头”与高原448、宁春4号差异显著(P<0.05),高原448与宁春4号差异不显著(P>0.05),24 h和48 h处理,3个品种均有显著性差异(P<0.05)(图3)。
2.4 PEG胁迫下叶片丙二醛含量(MDA)的变化
植物体内丙二醛(MDA)含量表明植物对逆境反应的强弱[18]。从图4可知,3个品种MDA含量在PEG胁迫下升高。不同基因型品种中MDA含量表现为:高原448>宁春4号>“和尚头”。24 h对照组,宁春4号与“和尚头”MDA含量差异显著(P<0.05);48 h,宁春4号、高原448均与“和尚头”差异显著(P<0.05),总体上“和尚头”含量最低。
从图4可以看出,PEG胁迫下MDA整体表现出上升趋势,胁迫处理12 h,高原448升高速率较其他品种都快,MDA含量显著高于宁春4号及“和尚头”(P<0.05);在24 h和48 h虽有下降,但是在同一处理时间段,不同基因型品种中,高原448品种MDA含量仍处于最高水平。在胁迫处理12 h到48 h之间,“和尚头”始终保持低的相对稳定的MDA水平;宁春4号在处理48 h时有明显的上升,与高原448差异不显著(P>0.05),但与“和尚头”差异显著(P<0.05)。

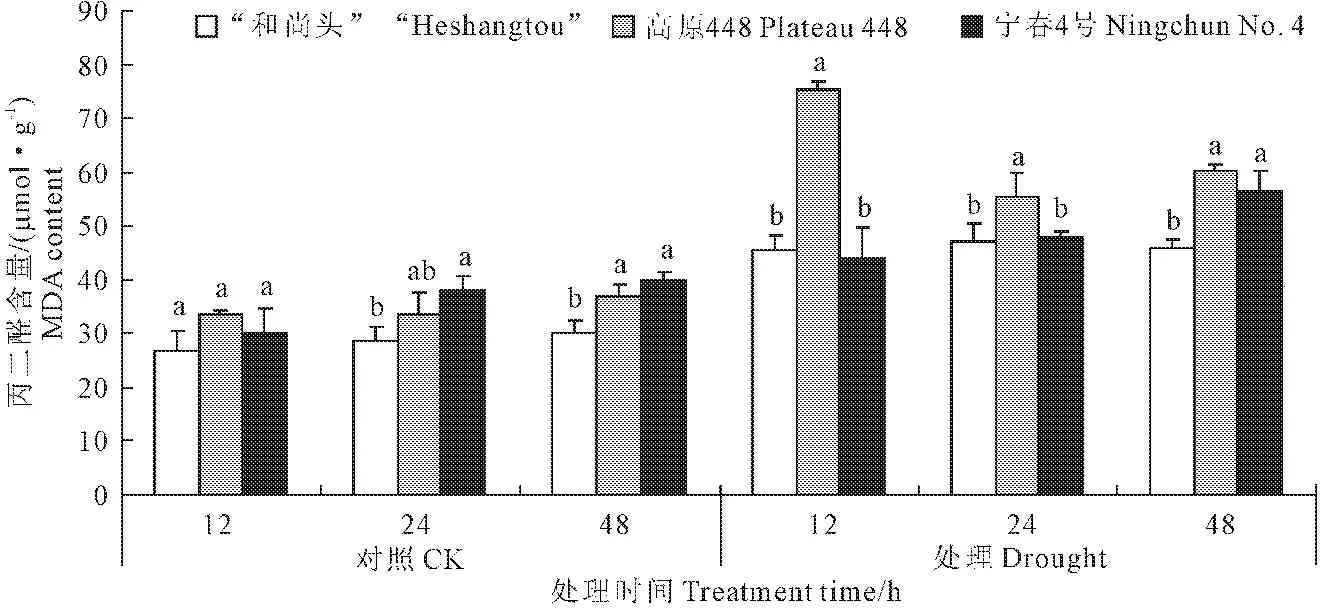
图3 3个品种的脯氨酸含量在对照和处理条件下的差异
图4 3个品种的丙二醛含量在对照和处理条件下的差异
Fig.4 MDA content under control and treatment
2.5 相关性分析及聚类分析
通过对3个品种叶片水分含量(LWC)、细胞膜透性(EL)、脯氨酸含量(Pro)和丙二醛含量(MDA)等生理生化指标进行相关性分析,结果表明:LWC和EL呈极显著负相关,表明叶片含水量与干旱胁迫诱导的细胞膜损伤有一定的关系;LWC和MDA呈显著负相关,与Pro相关性较差;EL和Pro呈弱相关,与MDA呈显著正相关;Pro和MDA的相关性低。因此,叶片水分状态、细胞膜损伤情况及膜脂过氧化水平与春小麦品种抗旱性关系密切(表1)。

表1 4个指标的相关性分析
注:*表示在0.05水平下显著相关,**表示在0.01水平下显著相关。 Note: *,** were significantly correlated at 0.05 and 0.01 level, respectively.
从相关性分析还可以看出,不同基因型品种生理生化指标间具有很好的相关性。因此,进一步对3个不同基因型春小麦的生理生化指标进行系统聚类,采用平方Euclidean距离、The Ward方法,结果如图5。由图可知,当聚类距离为1.0时,“和尚头”和宁春4号聚为一类,高原448为一类,表明20% PEG胁迫48 h时,“和尚头”和宁春4号具有较相似抗逆反应。
聚类结果在一定程度上反映了胁迫对不同春小麦品种生理生化指标的影响,生理生化指标差异较小的首先被聚为一类。通过对不同春小麦品种生理生化指标的系统聚类分析,可实现对“和尚头”抗旱性的评价,了解其抗旱生理机制,为进一步利用“和尚头”寻找抗旱基因奠定基础。
2.6 抗旱综合性评价
3个春小麦品种经过48 h全水和PEG处理,通过分析LWC、EL、Pro、MDA等4个生理生化指标变化,初步评价了品种的抗旱性。不同春小麦品种各个指标的变化不尽相同。表2显示,对照条件下LWC、EL、Pro、MDA等生理生化指标都维持在一个相似的水平,差异不显著(P>0.05);PEG-6000胁迫处理48 h,除LWC呈现下降趋势外,EL、Pro、MDA都呈现上升趋势,且差异显著(P<0.05)。
生产中表现抗旱性强的“和尚头”品种和抗旱适中的宁春4号品种在胁迫48 h后具有较高的叶片含水量和脯氨酸含量,低的电导率和丙二醛含量。对干旱敏感的高原448品种在胁迫48 h后,表现出较低的叶片含水量和脯氨酸含量,高的电导率和丙二醛含量,与抗旱品种差异明显。基于生理生化参数变化,通过系统聚类分析,可以将这3个品种划分为2组,抗旱型和干旱敏感型,其中“和尚头”和宁春4号为抗旱型,高原448为干旱敏感型。

图5 3个品种的系统聚类分析
Fig.5 System cluster analysis of three varieties
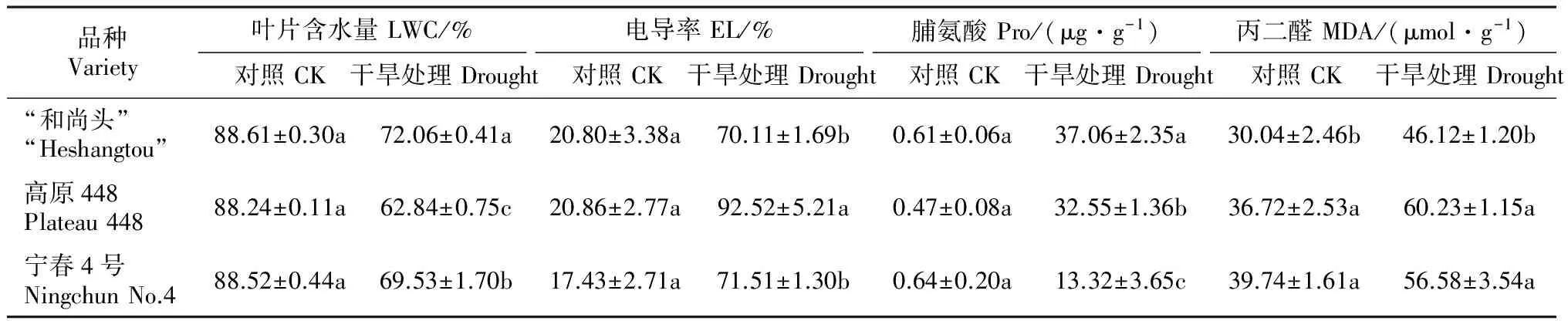
表2 PEG处理48 h 3个品种生理响应
3 讨 论
植物的抗旱性是一个复杂的多因素结果,因此对于植物抗旱性评价多采用不同的指标来综合评价。采用PEG模拟水分胁迫研究植物的抗旱性特征是一种经济可靠的方法[8,19-21〗[22],抗旱性强的植物叶片含水量相对较高[23-24]。本研究表明,“和尚头”的叶片含水量高于宁春4号与高原448,这可能与“和尚头”的叶片上下表皮被有绒毛有关。
细胞膜具有维持细胞完整性和稳定性的功能,细胞膜损伤程度是植物干旱条件下的一个重要生理响应指标,而细胞膜的损伤率可以通过细胞的电解质渗出率测得,这一方法已广泛应用于植物抗旱性的评价。电导率越高,表明细胞膜损失越严重,植物抗旱性越差[25-27]。本研究结果表明,电导率与叶片水分含量呈显著负相关。高原448的电导率在PEG-6000处理48 h已达到92.52%,显著高于“和尚头”与宁春4号(P<0.05),“和尚头”与宁春4号差异不显著(P>0.05)。
植物细胞受到生理干旱时,脯氨酸的增加可使植物细胞和组织具有持水能力,它的积累是由脯氨酸生物合成的活化和生物降解的抑制而产生。研究表明,干旱胁迫下植物的适应性表现在脯氨酸的积累量,抗旱性强的植物积累量较高[28]。PEG胁迫条件下,本文选用的3个基因型的春小麦品种脯氨酸含量均有上升趋势,时间越长,积累量越高。“和尚头”脯氨酸含量显著高于宁春4号与高原448(P<0.05)。但脯氨酸含量与电导率、叶片含水量和丙二醛相关性较差,由此认为脯氨酸含量可以作为独立的指标评价抗旱性[29]。
丙二醛可以通过交联作用使膜结构上的蛋白质和酶失活从而使膜结构破坏,作为多元不饱和脂肪酸的分解产物,被广泛用于脂质过氧化的测定指标[30-31],其含量的多少反映膜脂过氧化作用的强弱,抗旱性强的品种表现较低的丙二醛含量。较高的丙二醛含量说明脂膜过氧化作用强,使脂膜受损,膜的透性增大,选择透性丧失,有机物大量外渗,细胞内物质交换平衡被打破,严重时植物细胞受伤或死亡。本研究表明,胁迫处理后的3个品种叶片中丙二醛含量都变化不明显。但“和尚头”叶片中丙二醛的上升很缓慢,48 h处理显著低于宁春4号与高原448(P<0.05),这可能与植物受到水分胁迫时体内SOD、AP等抗氧化酶活性增大,从而抑制了膜内不饱和脂肪酸产物丙二醛的积累[32]。
干旱胁迫条件下,“和尚头”表现出相对低的细胞膜损伤率和丙二醛含量,高的叶片含水量及脯氨酸含量,具有明显的抗旱生理特征。宁春4号虽为水地品种,但其抗旱性较高,可能与当初品种选择环境有关(宁夏河套地区小麦生育期高温干旱环境)。
综合评价抗旱性为:“和尚头”>宁春4号>高原448。品种的表型和生理生化指标反映基因型的差异,王世红等[33]开展了对“和尚头”品质性状的QTL定位研究,但对抗旱基因的发掘尚处于空白,我们已经构建了“和尚头”与高原448品种F2分离群体,以期开展与抗旱相关基因的QTL定位,充分发掘利用这一农家抗旱品种的抗旱基因资源。
[1] Atkinson Nicky J, Urwin Peter E. The interaction of plant biotic and abiotic stresses: from genes to the field[J]. Journal of experimental botany, 2012,63(10):3523-3543.
[2] Boyer J S. Plant productivity and environment[J]. Science (New York, N.Y.), 1982,218(4571):443-448.
[3] Ghasem Hosseini Salekdeh, Matthew Reynolds, John Bennett, et al. Conceptual framework for drought phenotyping during molecular breeding[J]. Trends in plant science, 2009,14(9):488-496.
[4] 颜亮东,李 林,李红梅.青海省气象干旱对粮食产量的影响及其评估方法研究[J].冰川冻土,2013,35(3):687-691.
[5] Barnabas B, Jager K, Feher A. The effect of drought and heat stress on reproductive processes in cereals[J]. Plant, cell & environment, 2008,31(1):11-38.
[6] Singh N P, Pal P K, Vaishali S K. Morpho-physiological characterization of Indian wheat genotypes and their evaluation under drought condition[J]. African Journal of Biotechnology, 2014,13(20):2022-2027.
[7] Siddiqui M H, Al-Khaishany M Y, Al-Qutami M A, et al. Response of different genotypes of faba bean plant to drought stress[J]. International journal of molecular sciences, 2015,16(5):10214-10227.
[8] 万里强,石永红,李向林,等.PEG胁迫下3个多年生黑麦草品种抗性生理研究[J].草地学报,2009,17(4):440-444.
[9] Shao H B, Liang Z S, Shao M A, et al. Changes of anti-oxidative enzymes and membrane peroxidation for soil water deficits among 10 wheat genotypes at seedling stage[J]. Colloids and Surfaces B: Biointerfaces, 2005,42(2):107-113
[10] Liu Y, Zhang X, Tran H, et al. Assessment of drought tolerance of 49 switchgrass (Panicumvirgatum) genotypes using physiological and morphological parameters[J]. Biotechnology for Biofuels, 2015,8(1):1.
[11] Jinglong Jiang, Miao Su, Yueru Chen, et al. Correlation of drought resistance in grass pea (Lathyrussativus) with reactive oxygen species scavenging and osmotic adjustment[J]. Biologia, 2013,68(2):231-240
[12] Pill W G, Frett J J, Morneau D C. Germination and seedling emergence of primed tomato and asparagus seeds under adverse conditions[J]. HortScience, 1991,26(9):1160-1162.
[13] Castroluna A, Ruiz O M, Quiroga A M, et al. Effects of salinity and drought stress on germination, biomass and growth in three varieties of Medicago sativa L[J]. Avances en Investigación Agropecuaria, 2014,18(1):39-50.
[14] 刘义花,李 林,苏建军,等.青海省春小麦干旱灾害风险评估与区划[J].冰川冻土,2012,34(6):1416-1423.
[15] 袁汉民,裘志新,陈东升,等.小麦种质资源宁春4号的研究和利用[J].麦类作物学报,2009,29(1):160-165.
[16] 程大志,张怀刚,谢忠奎,等.高产节水春小麦新品种-高原448[J].麦类作物学报,2005,25(4):152.
[17] Lemos J M, Vendruscolo E C G, Schuster I, et al. Physiological and biochemical responses of wheat subjected to water deficit stress at different phenological stages of development[J]. J Agric Sci Technol B, 2011,(1):22-30.
[18] Ma J, Du G, Li X, et al. A major locus controlling malondialdehyde content under water stress is associated with Fusarium crown rot resistance in wheat[J]. Molecular Genetics and Genomics, 2015,290(5):1955.
[19] Vivas A, Marulanda A, Ruizlozano J M, et al. Influence of a Bacillus sp. on physiological activities of two arbuscular mycorrhizal fungi and on plant responses to PEG-induced drought stress[J]. Mycorrhiza, 2003,13(5):249-256.
[20] Kautz B, Noga G, Hunsche M. PEG and drought cause distinct changes in biochemical, physiological and morphological parameters of apple seedlings[J]. Acta Physiologiae Plantarum, 2015,37(8):1-6.
[21] Rahman M A, Ren L, Wu W, et al. Proteomic analysis of PEG-induced drought stress responsive protein in TERF1 overexpressed sugarcane (Saccharumofficinarum) leaves[J]. Plant Molecular Biology Reporter, 2014,33(3):716-730.
[22] 李吉跃.植物耐旱性及其机理[J].北京林业大学学报,1991,13(3):92-100.
[23] Matsuo N, Ozawa K, Mochizuki T. Physiological and morphological traits related to water use by three rice (OryzasativaL.) genotypes grown under aerobic rice systems[J]. Plant and Soil, 2010,335(1-2):349-361.
[24] Shi H, Wang Y, Cheng Z, et al. Analysis of natural variation in bermudagrass (Cynodondactylon) reveals physiological responses under lying drought tolerance[J]. PLoS ONE. 2012,7(12):e53422.
[25] Mohammed Bajji, Jean-Marie Kinet, Stanley Lutts. The use of the electrolyte leakage method for assessing cell membrane stability as a water stress tolerance test in durum wheat[J]. Plant Growth Regulation, 2002,36(1):61-70.
[26] Blum A, Ebercon A. Cell membrane stability as a measure of drought and heat tolerance in wheat[J]. Crop Science, 1981,21(1):43-47.
[27] Demirevska K, Simova-Stoilova L, Vassileva V, et al. Rubisco and some chaperone protein responses to water stress and rewatering at early seedling growth of drought sensitive and tolerant wheat varieties[J]. Plant Growth Regulation, 2008,56(2):97-106.
[28] Hayat S, Hayat Q, Alyemeni M N, et al. Role of proline under changing environments: a review[J]. Plant Signaling & Behavior, 2012,7(11):1456-1466.
[29] Shao H B, Chen X Y, Chu L Y, et al. Investigation on the relationship of proline with wheat anti-drought under soil water deficits[J]. Colloids and Surfaces B: Biointerfaces, 2006,53(1):113-119.
[30] Muqing Z, Rukai C. Morphophysiolological responses of sugarcane genotypes to water tresses[J]. Scientia Agricultura Sinica,1997,30(6):72-77.
[31] Mittler R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in plant science, 2002,7(9):405-410.
[32] 肖佳雷,尹 静,孙连发,等.不同类型春小麦抗旱生理指标耐旱指数的主成分分析[J].东北农业大学学报,2007,38(4):478-482.
[33] 王世红.甘肃省主要优质小麦品种品质性状分析及和尚头品质性状QTL定位[D].兰州:甘肃农业大学,2014.
Evaluation on the drought resistance mechanism of spring wheat “Heshangtou”
YANG Qian1,2,3, WANG Hai-qing2,3, CHEN Zhi-guo2,3, LIU De-mei2,3
(1.UniversityofChineseAcademyofSciences,Beijing100001,China; 2.NorthwestInstituteofPlateauBiology,ChinaAcademyofSciences,Xining,Qinghai810008,China;3.KeyLaboratoryofAdaptationandEvolutionofPlateauBiota,ChinaAcademyofSciences,Xining,Qinghai810008,China)
To explore drought resistance mechanism of “Heshangtou”, a dryland spring wheat variety, drought stress (20% PEG-6000) was used to investigate leaf water content (LWC),proline content, electrolyte leakage(EL) and MDA content, with “Plateau 448” and “Ningchun No. 4” being the control. The results indicated“Heshangtou”showed relatively higher LWC, proline content, lower EL and MDA content, compared with the control. Under the condition of 48 h drought, the LWC and proline content of “Heshangtou” were significantly higher, and MDA content was significantly lower than the control. Additionally, no significant EL was observed between “Heshangtou” and “Ningchun No.4”, while significantly lower EL than “Plateau 448” showed in “Heshangtou”. The three varieties could be distinguished by physiological index based on cluster analysis. In terms of comprehensive evaluation on drought resistance, the three varieties were ranked in the sequence of “Heshangtou”, “Ningchun No. 4”, and “Plateau 448” from high to low.
spring wheat; drought physiological; drought resistance evaluation
1000-7601(2017)04-0243-06
10.7606/j.issn.1000-7601.2017.04.37
2016-06-20
中国科学院战略性先导科技专项(A类)子课题“高产优质小麦新品种分子设计与培育——西北高产抗病分子设计育种”(XDA08030106-2);青海省科技计划项目“抗病、优质、高产春小麦青麦1号等品种示范推广”(2014-NS-511)
杨 倩(1987—),女,陕西宝鸡人,硕士研究生,主要从事小麦遗传育种研究。E-mail:496980565@qq.com。
陈志国(1963—),研究员,主要从事小麦遗传育种和栽培研究。E-mail: zgchen@nwipb.cas.cn。
S512.1+2
A
