姬松茸深层发酵多糖提取工艺优化及抗氧化活性
2017-08-09任朝辉冯国辉张传博贵州师范大学生命科学学院贵州贵阳550001
任朝辉,冯国辉,张传博(贵州师范大学生命科学学院,贵州贵阳 550001)
姬松茸深层发酵多糖提取工艺优化及抗氧化活性
任朝辉,冯国辉,张传博*
(贵州师范大学生命科学学院,贵州贵阳 550001)

姬松茸,响应面法,多糖,提取,抗氧化活性
姬松茸(AgaricusblazeiMurrill)又称巴西蘑菇,属担子菌门、蘑菇科、蘑菇属,是一种药食兼备的珍稀食用菌类,营养丰富,子实体脆嫩鲜美,具杏仁香味,食用价值颇高。姬松茸多糖具有抗肿瘤、抗病毒、抗氧化、护肝、提高免疫调节等多种生物学活性与药理功能[1-2]。具文献报道,姬松茸发酵菌丝体多糖和子实体多糖具有相似的药理活性[3],与姬松茸子实体栽培的方法相比较,采用液态深层发酵培养姬松茸菌丝体具有生产周期短、成本低、不受季节及气候的影响、可以大规模工业化生产等优势[4]。以液态深层发酵菌丝体提取多糖替代子实体多糖是姬松茸产业发展需求,具有广阔的开发利用前景与科学意义。
多糖是一种极性大分子化合物,真菌多糖通常采用热水浸提法,该方法简单方便、成本低、适合于大规模的工业化生产、不会引起多糖降解等优点,但提出的多糖主要是胞外多糖,因而,多糖提取率较低[5]。随着多糖提取技术的发展,近年来逐步出现了超声波法、酶法以及微波法等辅助提取方法,大大缩短了提取时间,同时也提高了多糖的提取率[6-10]。近年来主要对姬松茸多糖的热水浸提法进行研究,具文献报道,先采用超声波破壁处理后再用热水浸提的方法可以提高多糖的提取率,但超声波处理时间不宜过长[11]。本实验以液体深层发酵培养的姬松茸菌丝体为材料,采用超声波辅助热水浸提法提取姬松茸多糖,在单因素实验的基础之上,运用响应面统计分析软件优化多糖提取工艺,并进行抗氧化活性检测,为开发利用姬松茸多糖相关产品,改进多糖高效制备工艺,拓展姬松茸的应用领域,提供了理论依据。
1 材料与方法
1.1 材料与仪器
姬松茸(AgaricusblazeiMurrill) 贵州师范大学微生物重点实验室保藏菌种;原种培养基、液体种子培养基 均为PDA培养基;液体发酵培养基 玉米粉30 g,豆饼粉3 g,葡萄糖20 g,酵母膏3 g,KH2PO42 g,MgSO4·5H2O 0.2 g,盐酸硫胺素(VB1)100 mg,蒸馏水1000 mL,pH自然;1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma公司;玉米粉、豆饼粉 市售;苯酚、三羟甲基氨基甲烷(Tris)、邻苯三酚、维生素C、硫酸亚铁、水杨酸、H2O2、葡萄糖、酵母膏、KH2PO4、MgSO4·5H2O、VB1、浓硫酸、无水乙醇、氯仿、正丁醇等 均为国产分析纯。
JA2003N电子天平 上海精密科学仪器有限公司;752E紫外可见光分光光度计 天津普瑞斯仪器有限公司;TD6低速离心机 长沙湘智离心机仪器有限公司;DH6000B电热恒温培养箱 天津市泰斯特仪器有限公司;DK-98-IIA电热恒温水浴锅 天津市泰斯特有限公司;TS-2102双层恒温摇床 上海梦蓝仪器设备有限公司;DHG-9245A电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;RE-5286A旋转蒸发器 上海亚荣生化仪器厂;超声波仪 上海生析超声仪器有限公司;SW-CJ-2F双人双面净化工作台 苏州净化设备有限公司;HVE-50高压蒸汽灭菌锅 HIRAYAMA公司。
1.2 实验方法
1.2.1 深层液体发酵 将活化好的斜面菌种用接种铲切割成黄豆大小的菌丝块,接种于摇瓶种子培养基中,25 ℃,150 r/min振荡培养4 d后以10%的接种量转接500 mL发酵瓶,每瓶液体量为200 mL,25 ℃、150 r/min振荡培养7 d。
1.2.2 多糖提取 发酵液经3500 r/min离心10 min收集姬松茸发酵菌丝体,用蒸馏水反复洗涤,去除残余的培养基,60 ℃烘干,将菌丝体研磨粉碎,过60目筛。
称取一定量的菌丝体粉末,以一定的加水量、提取温度、提取时间、提取次数在恒温水浴锅中保温提取,离心过滤并收集滤液,浓缩得多糖溶液。
1.2.3 多糖去蛋白处理与醇沉 Sevag法去除多糖溶液中的蛋白,重复除蛋白3次。合并多糖,旋转真空浓缩至无油状物漂浮液面即得多糖浓缩液[12]。向装有已知体积的多糖浓缩液的烧杯中加入3倍体积的95%乙醇,静置过夜(有絮状物质析出),3500 r/min离心10 min,将沉淀物置于电热恒温干燥箱内45 ℃干燥至恒重得姬松茸多糖。
1.2.4 多糖得率分析 准确称取一定质量的姬松茸多糖,加水溶解后定容到一定体积,分别测定总糖含量和还原糖含量。总糖含量测定:采用硫酸-苯酚法[13],以干燥至恒重的葡萄糖配制标准液,于490 nm波长处测定吸光度,绘制标准曲线,得葡萄糖对照品溶液的回归方程:y=0.4554x+0.0001,其相关系数R2=0.9999。还原糖含量测定采用DNS法[14]。
多糖含量=总糖含量-还原糖含量。
多糖得率(%)=多糖含量/菌丝体原料重量×100
1.2.5 姬松茸菌丝体多糖提取单因素实验 称取1.0 g姬松茸菌丝体粉末于圆底烧瓶中,以姬松茸菌丝体粗多糖得率为指标,考察提取温度、提取时间、料液比及提取次数对姬松茸菌丝体多糖得率的影响,每组实验重复3次。
提取温度:设定回流时间2 h,料液比1∶30 g∶mL,提取1次,分别设定温度80、85、90、95、100 ℃回流提取。
提取时间:温度为90 ℃,料液比1∶30 g∶mL,提取1次,分别回流提取1、1.5、2、2.5、3 h。
料液比:设定提取温度为90 ℃,回流提取2 h,提取1次,按料液比分别为1∶20、1∶25、1∶30、1∶35、1∶40 g∶mL)。
总提取次数:提取温度为90 ℃,回流提取2 h,料液比为1∶30 g∶mL,回流总提取次数分别为1、2、3、4、5次。
1.2.6 Box-Benhnken的中心组合实验设计 在单因素实验的基础上,以姬松茸菌丝体多糖得率为响应值,考察提取温度(A)、提取时间(B)、料液比(C)以及提取次数(D)为实验因素,设计四因素三水平Box-Benhnken中心组合实验,对姬松茸菌丝体多糖提取工艺进行优化研究(表1)。

表1 正交实验因素与水平Table 1 Factors and levels of orthogonal test
1.2.7 姬松茸多糖抗氧化活性检测
1.2.7.1 清除DPPH自由基测定 以95%乙醇为溶剂,配制浓度为1×10-4mol/L DPPH自由基溶液。加入不同浓度(0.02、0.04、0.06、0.08、0.1 mg/mL)的姬松茸多糖溶液各1.0 mL,3 mL DPPH溶液,使总体积为4 mL,摇匀。混匀后于28 ℃恒温30 min,在517 nm吸光值为A值[15-16],即为AX。向3 mL DPPH溶液中加入1 mL蒸馏水,记录吸光值为A空白值(A0),即为空白对照;以3 mL 95%乙醇溶液,不同浓度的姬松茸多糖溶液各1.0 mL作为样品组(AX0),每个浓度组平行测定3次,求其平均值;以VC作为阳性对照。测定结果以清除率(%)表示,计算公式如下:
1.2.7.2 清除·OH自由基测定 采用Fronton反应体系方法[17],在试管中加入9 mmol/L的硫酸亚铁溶液1 mL,9 mmol/L水杨酸-乙醇溶液1 mL,加入不同浓度(0.02、0.04、0.06、0.08、0.1 mg/mL)的姬松茸多糖溶液各1.0 mL,立即混匀,最后加入8.8 mmol/L的过氧化氢溶液1 mL开始反应,37 ℃反应30 min,在510 nm下测量吸光度(AX),以等体积的蒸馏水作为空白对照(A0)。以9 mmol/L的硫酸亚铁溶液1 mL,9 mmol/L水杨酸-乙醇溶液1 mL,不同浓度的姬松茸多糖溶液各1 mL和1 mL蒸馏水代替过氧化氢混匀后作为本底吸收值(AX0)。每个浓度组平行测定3次,求其平均值;以VC作为阳性对照组。测定结果以清除率(%)表示,计算公式如下:

1.2.8 数据处理 利用Design-Expert 8.0统计分析软件进行多元二次回归模型方程的建立及方差分析,再利用该软件中响应面值优化程序求得当响应面值最大时各因素的最优组合。
2 结果与分析
2.1 单因素实验
2.1.1 温度对姬松茸多糖得率的影响 当温度在80~90 ℃范围内,随着提取温度的增加,多糖得率增加迅速;当温度在90~100 ℃范围内,随着提取温度的增加,曲线变得平坦,多糖得率缓慢降低(图1),这可能是温度过高(大于90 ℃)导致多糖被降解所致,因此,提取温度选择85、90、95 ℃作为中心组合实验的三个水平。

图1 温度对姬松茸多糖得率的影响Fig.1 Effect of temperature on the yield of Agaricus blazei Murrill polysaccharides
2.1.2 时间对姬松茸多糖得率的影响 最初,随着提取时间的延长,多糖得率逐渐增加;2 h后,随着提取时间的延长,多糖得率缓慢降低(图2),可能是由于长时间的高温条件使多糖被破坏或原料中其他物质被提取出来,所以浸提时间不宜过长。因此,提取时间选择1.5、2、2.5 h作为中心组合实验的三个水平。

图2 时间对姬松茸多糖得率的影响Fig.2 Effect of time on the yield of Agaricus blazei Murrill polysaccharides

图3 料液比对姬松茸多糖得率的影响Fig.3 Effect of solid-liquid ratio on the yield of Agaricus blazei Murrill polysaccharides
2.1.3 料液比对姬松茸多糖得率的影响 当料液比在1∶20~1∶30 g∶mL范围内,随着提取料液比的增加,多糖得率增加迅速;当料液比在1∶30~1∶40 g∶mL范围内,随着提取料液比的增加,曲线趋于平坦,多糖得率几乎没有增加,并有缓慢降低的趋势(图3);这是因为当料液比较小时,随着水量增多有利于多糖的溶出与扩散,多糖的得率随之增大;但过高的料液比会导致原料中其他水溶物的溶出,抑制了多糖的提取。因此,提取料液比选择1∶25、1∶30、1∶35 g∶mL作为中心组合实验的三个水平。
2.1.4 次数对姬松茸多糖得率的影响 当总提取次数为1次时,多糖得率比较低;随着提取次数的增加,多糖得率也随之增大;当总提取次数在2~4次范围时,多糖得率曲线基本趋于平坦,并有下降的趋势;当总提取次数为5次时,多糖得率有明显的下降趋势,考虑到后期多糖溶液浓缩困难以及节省能源,因此,提取次数选择1、2、3次作为中心组合实验的三个水平。

图4 次数对姬松茸多糖得率的影响Fig.4 Effect of times on the yield of Agaricus blazei Murrill polysaccharides

图4 次数对姬松茸多糖得率的影响Fig.4 Effect of times on the yield of Agaricus blazei Murrill polysaccharides
2.2 响应面优化实验
在单因素实验结果的基础上,根据Box-Benhnken设计原理,以温度、时间、料液比和次数4个因素为自变量,姬松茸多糖得率为响应值,采用响应面法进行四因素三水平的响应面分析,研究各因素对姬松茸多糖得率影响的显著性和各因素的最佳组合。共包括29组实验方案,实验设计方案及实验结果见表2,ANOVA分析见表3。
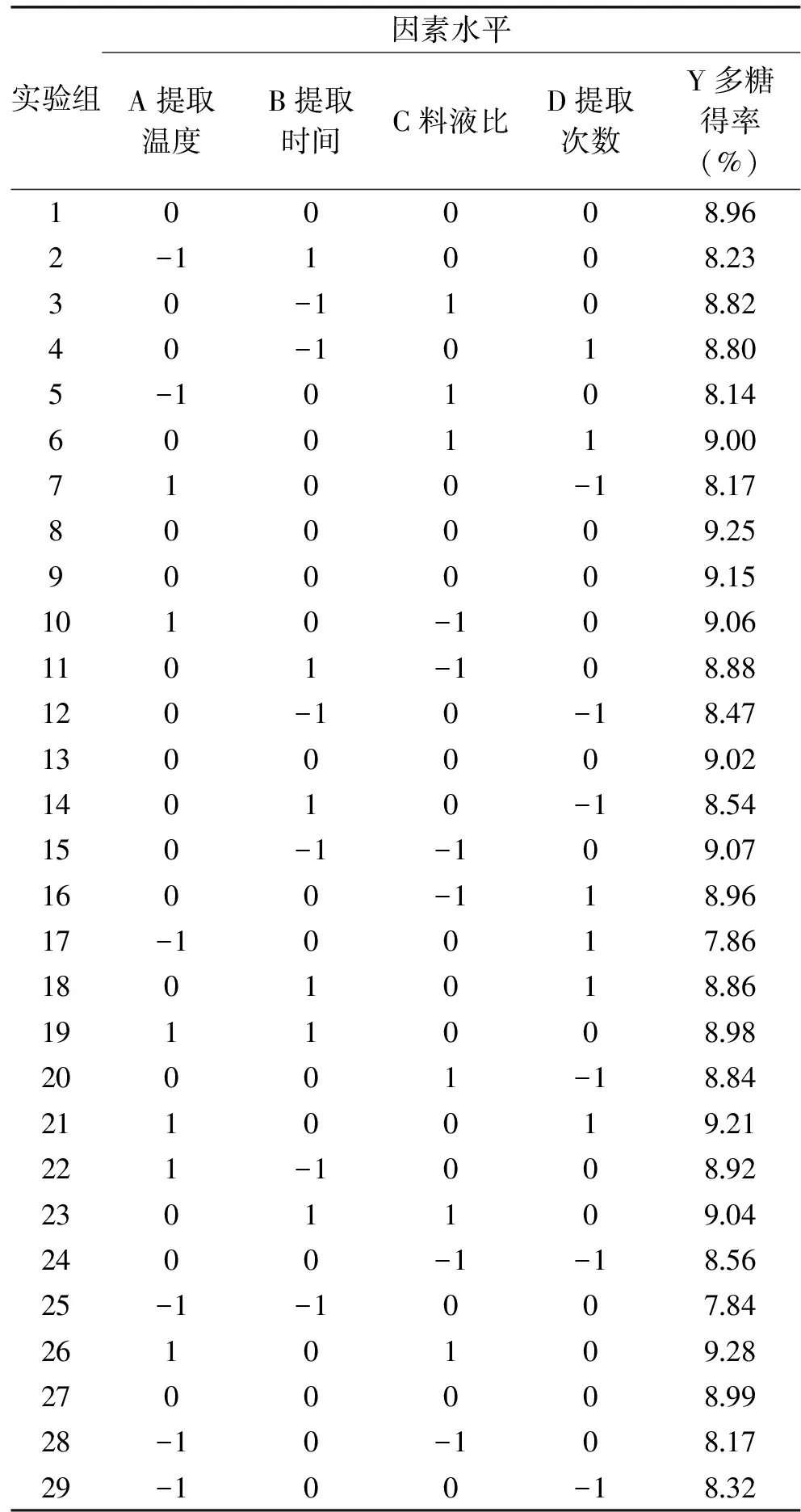
表2 姬松茸多糖得率的响应面法设计方案及实验结果Table 2 Response surface design arrangement of the yield ofAgaricus blazei Murrill polysaccharides and experimental results
2.2.1 拟合模型方程的建立与方差分析 通过统计分析软件Design-Expert 8.0对表2中的数据进行多元回归拟合分析,建立二次响应面回归模型,并获得多糖得率(Y)的二次多项回归方程如下:
Y=9.07+0.42A+0.051B+0.035C+0.15D-0.082AB+0.062AC+0.38AD+0.1BC-2.5×10-3BD-0.06CD-0.43A2-0.15B2+0.023C2-0.26D2

该回归模型方程ANOVA分析结果表明(表3):提取温度A、提取次数D、交互因素AD(即提取温度和提取次数交互作用)、提取温度的二次项A2、提取时间的二次项B2、提取次数的二次项D2的p值均小于0.01,说明这些因素对姬松茸多糖得率有极显著的影响;其他因素的p值均大于0.05,说明无显著影响[21]。由此得出4个因素对姬松茸多糖得率的影响程度由大到小依次为:温度(A)>次数(D)>时间(B)>料液比(C)。

表3 响应面对多糖得率的ANOVA分析Table 3 ANOVA analysis of response surface on the yield of polysaccharides

图5 两因素交互作用对姬松茸多糖得率影响的响应面图Fig.5 Response surface plots showing the effects of operating parameters on the yield of Agaricus blazei Murrill polysaccharides
注:**为差异性极显著,p<0.01;*为差异性显著,p<0.05。
2.2.2 响应面分析 通过回归方程绘制该模型的响应面分析图,如图5所示;根据响应面实验的设计原理及分析,三维响应面图弯曲度越大,表示两因素间显著性差异越明显,由此能有效的反映出各因素之间的交互作用对响应值多糖得率的影响[22]。从图5中的6组三维图可知:提取温度(A)和提取次数(D)两因素之间的交互作用对姬松茸多糖得率影响具有极显著性差异,其他因素两两之间的交互作用对姬松茸多糖得率影响不显著。
2.2.3 响应面优化提取工艺条件验证 从图5可以看出,6组三维响应面图均开口向下,随着两个交互因素值的增加,多糖得率呈现先上升后下降的趋势,说明在这些因素中必然存在一个最佳的组合使得姬松茸多糖得率达到最大值。在所选实验因素范围内,对响应面法实验设计结果进行优化分析,通过对回归模型求解方程,得出姬松茸多糖的最优提取工艺条件:温度94 ℃、时间2.1 h、料液比1∶35 (g∶mL)、次数3次,此时多糖得率为9.30%,模型预测值为9.41%,模型预测值与实际测得值相比,其相对误差为1.17%,说明本实验建立的二次多项回归方程能够有效的反应各因素对姬松茸多糖得率的影响,同时也证明了用响应面法优化姬松茸多糖得率回归方程模型是可行的。
2.3 姬松茸多糖体外抗氧化活性分析
2.3.1 姬松茸多糖对DPPH自由基清除能力 DPPH法是一种检测天然产物抗氧化活性的常用方法[23],操作简单、重复性好、经济可靠。从图6可以得知,姬松茸多糖对DPPH自由基具有一定的清除能力;在测定的质量浓度范围内,姬松茸多糖对DPPH自由基的清除能力随着样品浓度的增加而增强,但在相同质量浓度时,姬松茸多糖清除率显著低于VC,其中IC50分别是0.184 mg/mL和0.012 mg/mL;在质量浓度为0.1 mg/mL时,姬松茸多糖对DPPH自由基的清除率仅为26.9%,而VC的清除率高达94.2%。

图6 姬松茸多糖对DPPH自由基的清除率Fig.6 Effect of Agaricus blazei Murrill polysaccharides on DPPH free radical scavenging
2.3.2 姬松茸多糖对·OH自由基清除能力 清除羟自由基的实验原理是根据Fronton反应,该方法操作简单、重复性好等优点,常用于医学及分子生物学领域测定天然产物的抗氧化活性[24]。从图7可知,姬松茸多糖对·OH自由基具有一定的清除能力;在测定的质量浓度范围内,姬松茸多糖对·OH自由基的清除能力随着质量浓度的增加而增强;在相同质量浓度时,姬松茸多糖对·OH自由基的清除率显著低于VC,其中IC50分别是0.316 mg/mL和0.075 mg/mL。

图7 姬松茸多糖对·OH自由基的清除率Fig.7 Effect of Agaricus blazei Murrill polysoccharides on hydroxyl free radical scavenging

图8 姬松茸多糖对超氧阴离子自由基的清除率Fig.8 Effect of Agaricus blazei Murrill polysaccharides on superoxide anion free radical scavenging
2.3.3 姬松茸多糖对超氧阴离子自由基清除能力 利用邻苯三酚自氧化测定天然产物的抗氧化活性,该方法灵敏度高、反应时间短。从图8可知,姬松茸多糖对超氧阴离子自由基具有一定的清除能力;在测定的质量浓度范围内,随着姬松茸多糖质量浓度的增加,对超氧阴离子自由基的清除能力也增强,在整个测定的质量浓度范围内,姬松茸多糖对超氧阴离子自由基的清除率都要低于VC,其中IC50分别是0.198 mg/mL和0.036 mg/mL。
3 结论
采用超声波辅助热水浸提姬松茸多糖,具有提取条件温和、提取率高、多糖活性好等优点[25]。在单因素实验的基础之上,以姬松茸多糖得率为响应值,经响应面法优化后,得到姬松茸多糖的最优提取工艺条件:温度94 ℃、时间2.1 h、料液比1∶35(g∶mL)、次数3次;在此条件下姬松茸多糖的得率为9.30%,与预测值基本相符,说明经响应面优化的实验条件具有实际意义;同时,也表明该模型设计合理,对姬松茸多糖的最优提取工艺具有现实指导作用。
[1]Wang H,Li G,Zhang W,et al. The protective effect ofAgaricusblazeiMurrill,submerged culture using the optimized medium composition,on alcohol-induced liver injury[J]. Biomed Research International,2014:573978.
[2]Liu Y,Zhang L,Zhu X,et al. PolysaccharideAgaricusblazeiMurill stimulates myeloid derived suppressor cell differentiation from M2 to M1 type,which mediates inhibition of tumour immune-evasion via the Toll-like receptor 2 pathway[J]. Immunology,2015,146(3):379-391.
[3]孙培龙.姬松茸多糖的分离纯化、结构鉴定及抗肿瘤活性研究[D].浙江:浙江大学,2007.
[4]赵永勋.食药用菌液体发酵的现状和展望[J].农业与技术,2004,24(3):111-114.
[5]方积年,丁侃.天然药物——多糖的主要生物活性及分离纯化方法[J].中国天然药物,2007,5(5):338-347.
[6]李堆淑.超声提取细黄链霉菌胞外多糖工艺与抗氧化活性研究[J].食品发酵与工业,2016,42(5):253-258.
[7]洪胜,潘利华,罗建平.生物多糖超声波辅助提取研究进展[J].食品工业科技,2011,32(8):481-484.
[8]闫培生,马丽雅,朱国振,等.荷叶离褶伞液体发酵及生物酶法提取菌丝体多糖的研究[J].中国农业科技导报,2010,12(4):84-89.
[9]张虽栓,李延磊,高诚伟.响应曲面法优化裂褶菌多糖的微波辅助提取工艺研究[J].河南农业大学学报,2014,48(4):449-454.
[10]阿燕.真菌胞内多糖提取方法的研究进展[J].微生物学杂志,2011,31(5):82-86.
[11]邓岩,张英华.物理波强化提取金针菇多糖[J].现代化农业,2001(6):22.
[12]刘翠.姬松茸多糖的提取纯化及注射液的研制[D].长春:吉林农业大学,2007.
[13]杨林,刘翠花,刘刚,等.西藏野生荨麻水溶性多糖提取工艺的优化设计[J].食品工业,2013,34(2):35-37.
[14]张维杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1994:13-14.
[15]李燮听,蒲彪.锦橙皮膳食纤维抗氧化活性研究[J].食品工业科技,2010,31(3):166-168.
[16]韦献雅,殷丽琴,钟成,等.DPPH法评价抗氧化活性研究进展[J].食品科学,2014,35(9):317-322.
[17]刘静,李湘利,张艳,等. 响应面法优化提取香椿叶总膳食纤维的工艺条件及其抗氧化活性研究[J].食品工业科技,2014(5):182-187.
[18]张文军,葛超.NBT光还原法、邻苯三酚自氧化法测定SOD酶活性的比较(简报)[J].河北职业技术师范学院学报,2000,14(2):68-70.
[19]于金威.姬松茸菌液体发酵及其多糖活性研究[D].长春:吉林大学,2010.
[20]程振玉,宋海燕,杨英杰,等.不同提取方法对北五味子多糖提取率的影响[J].湖北农业科学,2015,54(1):159-163.
[21]周晓明,闫鹏,马凯,等.响应面法优化超声波辅助提取玛咖总黄酮的工艺研究[J].新疆农业科学,2012,49(8):1414-1420.
[22]王永菲,王成国.响应面法的理论与应用[J].中央民族大学学报(自然科学版),2005,14(3):236-240.
[23]韦献雅,殷丽琴,钟成,等. DPPH法评价抗氧化活性研究进展[J].食品科学,2014,35(9):317-322.
[24]杨芬,张瑞萍,贺玖明,等.羟自由基的产生、捕集及检测方法[J].药学学报,2007,42(7):692-697.
[25]Raza A,Li F,Xu X,et al. Optimization of ultrasonic-assisted extraction of antioxidant polysaccharides from the stem of Trapa quadrispinosa using response surface methodology[J]. International Journal of Biological Macromolecules,2017,94:335-344.
Optimization of extraction technology and antioxidant activity determination of polysaccharide from submerged fermentation mycelium inAgaricusblazeiMurrill
REN Chao-hui,FENG Guo-hui,ZHANG Chuan-bo*
(Shool of Life Sciences,Guizhou Normal University,Guiyang 550001,China)

AgaricusblazeiMurrill;response surface methodology;polysaccharides;extraction;antioxidant activity
2016-12-14
任朝辉(1991-),男,硕士研究生,研究方向:真菌次生代谢产物,E-mail:1247560652@qq.com。
*通讯作者:张传博(1976-),男,博士,教授,研究方向:真菌次生代谢产物,E-mail:Zhangchuanbo2004@163.com。
贵阳市:2012现代农业与农村科技计划(筑科合同[2012102]2-3-2);贵州省林业厅育林基金(黔林科合[2012]08号)。
TS255.1
B
1002-0306(2017)14-0216-07
10.13386/j.issn1002-0306.2017.14.042
