酶解—磷酸化协同改性对卵白蛋白特性与结构的影响
2017-08-08刘丽莉杨陈柳
刘丽莉 李 玉 王 焕 杨陈柳
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
酶解—磷酸化协同改性对卵白蛋白特性与结构的影响
刘丽莉 李 玉 王 焕 杨陈柳
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
为考察酶解和磷酸化协同改性对卵白蛋白特性和结构的影响,针对酶解和磷酸化协同改性的卵白蛋白的功能特性变化进行分析,并通过FT-IR、DSC和SEM对协同改性的卵白蛋白结构变化进行分析。结果表明,协同改性后的卵白蛋白的溶解度、凝胶强度、乳化性较酶解后的和未改性的卵白蛋白都有较大的提高,但起泡性和泡沫稳定性有所降低;结构上,卵白蛋白因酶解导致其肽链发生断裂,使得更多的氨基酸残基暴露出来,α-螺旋和β-折叠均有所增加;协同改性的卵白蛋白热变性温度较酶解的和未改性的卵白蛋白分别升高了7.13,10.19 ℃;此外,由于磷酸基团的嵌入,使蛋白的结构发生了变化,分子结构由球状体变成了层叠的片状结构。关键词:卵白蛋白;酶解;磷酸化;协同改性;功能特性;结构分析
鸡蛋中含有丰富的蛋白,其中卵白蛋白(OVA)占蛋清蛋白的54%~69%,是一种优质蛋白质[1]。OVA资源丰富,具有良好的营养价值和功能特性,水溶性好,极易被人体消化吸收[2]。它具有蛋白质典型的乳化性、凝胶性、起泡性等功能特性,在食品中可作为乳化剂、凝胶剂、起泡剂等,大大提高了其在食品中的应用价值。但蛋清粉腥味重、溶解性差、黏度大、受热易凝固,这些性质又限制了它在食品加工中的应用[3]。因此,应用适当的方法对蛋清粉的特性进行改造,开发出功能性的蛋清粉,对于拓展其在食品及其他领域的应用将具有非常重要的市场价值。涂勇刚等[4]通过酶解改善蛋清蛋白的起泡性,在蛋清液5 mL、酶解时间45 min、酶添加量38.2 mg、酶解温度47.5 ℃、pH 6.3的条件下,酶解液的起泡性比原蛋清液提高了140%左右。Li等[5]通过干燥加热磷酸化分别对蛋清蛋白和OVA进行改性,使得干燥加热磷酸化改性的蛋清蛋白乳化性、溶解性、热稳定性、持水性等功能特性得到了一定程度的提高,并分析了干燥加热磷酸化对OVA结构的变化与其功能特性变化之间的联系。
目前,提高OVA的功能特性主要通过物理、化学、酶法实现,但使用协同改性的方法对OVA进行改性的研究尚未见相关报道。因此本试验采用碱性蛋白酶对OVA进行酶解,随后采用三聚磷酸钠对酶解产物进行磷酸化改性,探讨协同改性对OVA功能物性和结构的影响,从而使卵白蛋白的功能特性进一步提高,为其在食品行业中的应用提供理论依据,以适应不同产品的需要。
1 材料与方法
1.1 材料与试剂
鲜鸡蛋:洛阳市农贸市场;
三聚磷酸钠:分析纯,郑州市米莱化工产品有限公司;
氢氧化钾:分析纯,广东西陇化工试剂厂;
磷酸氢二钠、磷酸二氢钾:分析纯,天津市北辰方正试剂厂;
KBr:分析纯,天津市光复经济化工研究所。
1.2 仪器与设备
真空冷冻干燥机:Beta2.8LD型,德国CHRIST公司;
超速冷冻离心机:Avanti J-E型,美国Beckman Coulter公司;
均质机:FJ-200型,上海标本模型厂;
质构仪:Instron 5544型,美国Brookfield公司;
FT-IR红外光谱仪:Perten DA7200型,德国Bruker公司;
差示扫描量热仪:DSC204F1型,瑞士Mettler-Toledo公司;
电子扫描显微镜:JSM-5610LV型,日本JEOL公司。
1.3 方法
1.3.1 OVA的酶解和磷酸化协同改性的产物制备 配制质量分数为5%的OVA溶液,调节pH至8.2,碱性蛋白酶的添加量为5 500 U/g,在恒温水浴锅中以52.5 ℃的温度反应5 h。反应结束后,将反应物置于90 ℃的水浴锅中加热5 min,使酶钝化,冷却至室温,4 500 r/min离心10 min,取上清液冷冻干燥,得到OVA的酶解物[6]。
取一定量的OVA酶解物溶于0.02 mol/L pH 7.4的磷酸盐缓冲溶液中,配制成1 g/100 mL的蛋白质溶液,调节pH至8,三聚磷酸钠添加量为9%,在30 ℃的条件下反应4 h,同时磁力搅拌3 h,采用截留分子量为8 000~12 000的透析袋在4 ℃条件下用蒸馏水透析48 h,冷冻干燥备用。
1.3.2 协同改性OVA功能特性的测定
(1) 溶解度的测定:蛋白质的溶解度通常采用KOH溶解法[7]测定水溶性氮的含量,称取1 g 样品置于烧杯中,准确量取质量分数为2% 的KOH溶液50 mL 与样品充分混合,磁力搅拌2 h,4 ℃条件下3 500 r/min冷冻离心5 min,室温下静置10 min,取上清液15 mL,样品中总氮含量与上清液中氮含量均用凯氏定氮法测定[8]。溶解度按式(1) 计算:
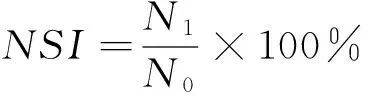
(1)
式中:
NSI——溶解度,%;
N0——样品中总氮含量,mg/mL;
N1——溶于2%的氢氧化钾上清液氮含量,mg/mL。
(2) 凝胶强度的测定:将蛋白样品溶于0.1 mol/L pH 7.4的磷酸盐缓冲溶液中,配制成浓度为10%的蛋白溶液,取50 mL 于100 mL 烧杯中,用保鲜膜密封,置于80 ℃水浴锅中加热1 h,然后立即用冷水冲洗烧杯外壁,冷却至室温后的凝胶样品于4 ℃冰箱中放置12 h,采用质构仪测定其凝胶强度。
测试条件:探头为圆柱状平头探头;测试前速5 mm/s,测试速度2 mm/s,距离(探头与样品的距离)15 mm。硬度,即探头在下压的过程中最大感应压力(单位g),每份样品重复5次,计算其平均值。
(3) 乳化特性的测定:分别取OVA、酶解OVA和协同改性OVA,加入一定体积pH 7.4 Tris-HCl缓冲液,将其配制成质量浓度为1%的蛋白溶液。取15 mL蛋白溶液和5 mL大豆油,于10 000 r/min均质1 min,分别取均质后0,10 min的最底层乳化液100 μL加入到100 mL 0.1%的SDS溶液中,用紫外分光光度计在500 nm波长处测定其吸光值,空白为0.1% SDS溶液。乳化活性指数(EAI)和乳化稳定性(ESI)分别按式(2)、(3)计算:
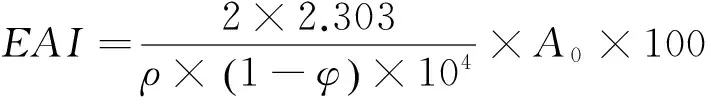
(2)
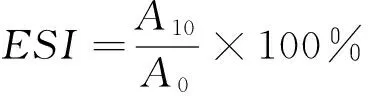
(3)
式中:
EAI——乳化活性指数,m2/g;
ESI——乳化稳定性,%;
A0、A10——乳浊液在0,10 min的吸光值;
φ——油相体积分数(油的体积/乳浊液的体积),%;
ρ——蛋白质质量浓度,g/mL。
(4) 起泡性的测定:分别将OVA、酶解OVA和协同改性OVA溶于pH 7.4 Tris-HCl缓冲液中,配成5%的蛋白溶液,取50 mL蛋白溶液,记录起始高度H0,10 000 r/min均质2 min后,记录高度H1,静置10 min后再次记录高度H2。蛋白溶液起泡性(FAI)和泡沫稳定性(FSI)按式(4)、(5)计算:
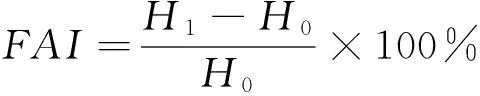
(4)
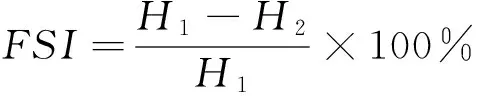
(5)
式中:
FAI——蛋白溶液起泡性,%;
FSI——泡沫稳定性,%。
1.3.3 协同改性OVA的结构分析
(1) 傅里叶红外光谱分析:将一定量干燥后的KBr分别与冷冻干燥后的OVA、酶解OVA和协同改性OVA按质量比100∶1置于玛瑙研钵中,研磨均匀至混合物为粉末状,将样品置于样品槽中,在压力10~15 MPa下压片,将样品取出,放入样品室,采用红外光谱仪在400~4 000 cm-1波长区间对样品进行扫描[9]。
(2) 差示扫描量热分析:分别称量(5.0±0.1) mg 的OVA、酶解OVA和协同改性OVA于铝坩埚中,样品升温范围为30~300 ℃,升温速率10 ℃/min,以空白为参比,并做重复试验[10]。
(3) 扫描电镜分析:将导电胶带均匀地贴在样片台上,样品粉末均匀地散落在导电胶上,把样品台朝下使粉与胶未带接触的颗粒脱落,用洗耳球吹掉多余的粉末,喷金处理后,利用扫描电镜观察其形貌,放大200倍,加速电压为20 kV。
1.3.4 数据分析 通过Origin Pro 8.5软件进行统计分析。
2 结果与分析
2.1 协同改性前后OVA的功能特性
2.1.1 溶解性分析 由图1可知,在pH 2.5~8.5条件下酶解后的OVA溶解性显著高于OVA(P<0.05),而协同改性OVA的溶解性显著高于OVA和酶解OVA(P<0.05)。因为在酶解过程中使蛋白分子断裂,形成了小分子肽链,增加蛋白与水的接触,使得酶解后的OVA溶解度升高。另外,酶解OVA的溶解度在pH 5.0时最低,而OVA的溶解度在其等电点4.5时最低,表明酶解使OVA等电点升高了。协同改性OVA在酶解的基础上,其肽链上又多了极性的磷酸根基团与某些特定基团相结合,增强了蛋白的水化作用,使水化层上蛋白的厚度增加,导致蛋白分子不易聚集沉降,从而提高了其溶解性[11]。协同改性OVA的等电点又降低到4.0,因此通过酶解和磷酸化协同改性OVA,既能在一定程度上提高OVA功能特性,又能改善OVA在加工过程中的特性。
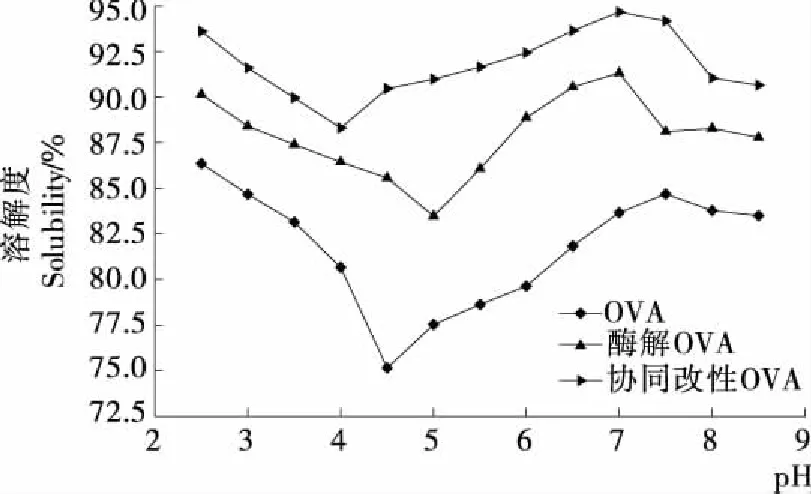
图1 协同改性前后OVA溶解性分析
2.1.2 凝胶性分析 由图2可知,酶解显著改善了OVA的凝胶强度,OVA在热处理4 d后凝胶强度达到681 g,而酶解后的OVA在热处理4 d后凝胶强度达到740 g,显著高于未处理的OVA,酶解使OVA球状结构破坏,形成了紧密的纤维状结构。在一定的加热时间内,协同改性OVA的凝胶强度明显高于OVA。当加热到3 d时协同改性OVA的凝胶强度达到783 g较OVA提高了180 g,可能是磷酸化改性的蛋白质表面电荷发生变化,在加热过程中促进了紧密有序的三维空间凝胶结构的形成,使其凝胶强度增大[12]。通过酶解和磷酸化协同改性OVA有效改善了OVA的凝胶特性,利于具有特殊功能性食品的加工。2.1.3 乳化性和乳化稳定性分析 由图3可知,酶解OVA乳化活性指数和乳化稳定性较未改性OVA分别提高了45.32%,10.46%,因为酶解使得OVA的疏水基团增加,结合油滴的能力增强[13],亲水基团伸展到水相中,提高了OVA的乳化性和乳化稳定性。协同改性OVA的乳化活性指数比OVA的提高了18.46 m2/g,乳化稳定性提高了12.44%。主要原因:① 磷酸化改性后,蛋白质中引入了PO3-,PO3-增加液滴之间的斥力,易于分子的扩散,更利于蛋白质在油/水界面重新排列;② 磷酸化改性使得更多的疏水基团暴露出来,提高了蛋白质的亲油性,降低了乳化液的表面张力,使之更易形成乳状液滴[14]。
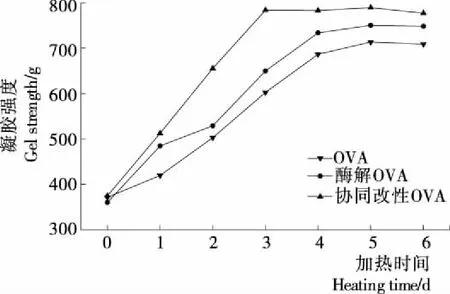
图2 协同改性前后OVA凝胶强度分析
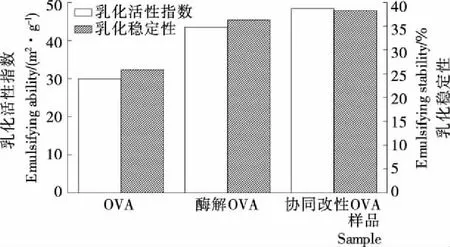
图3 协同改性前后OVA的乳化性和乳化稳定性分析
Figure 3 Analysis of the emulsifying and emulsifying stability of the OVA before and after the synergistic modification
2.1.4 起泡性和泡沫稳定性分析 由图4可知,酶解会引起OVA起泡性的下降,原因可能是:① OVA分子的肽链断裂,无法形成稳定的泡沫黏膜;② 虽然酶解使OVA的溶解性增加,但酶解使其溶液的黏度下降,在搅打和起泡过程中不利于OVA分子在气液界面上快速吸附[15]。协同改性OVA起泡性与OVA相比降低了21.9%,泡沫稳定性降低了13.11%。蛋白质的起泡性与溶液的温度、pH值有关。温度与蛋白质泡沫的形成和稳定有直接关系,温度太低或太高均不利于蛋白的起泡,蛋白质溶液一般在30 ℃时起泡性最好,因此夏季的新鲜鸡蛋在搅打过程中易起泡。溶液的pH对蛋白泡沫的形成影响很大,蛋白质在等电点时,形成泡沫的能力较差,因此在搅打蛋白时通过调节蛋白的pH,以增强蛋白质的起泡性[16]。
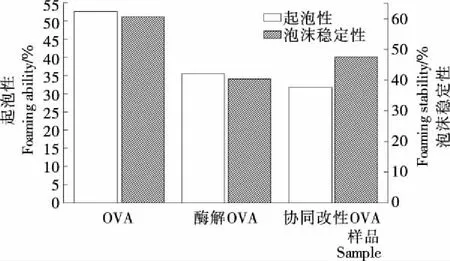
图4 协同改性前后OVA的起泡性与泡沫稳定性分析
Figure 4 Analysis of the foaming ability and foam stabilityof the OVA before and after the synergistic modification
2.2 协同改性前后OVA的结构分析
2.2.1 傅里叶红外光谱分析 由图5可知,OVA(Ⅰ)、酶解OVA(Ⅱ)及协同改性OVA(Ⅲ)的红外图谱存在一定的差异,说明三者的结构有一定不同。蛋白质在红外区有若干特征吸收带,对分析二级结构最有价值的区域是1 600~1 700 cm-1酰胺Ⅰ带和1 220~1 330 cm-1酰胺Ⅲ带[17];在3 200~3 700 cm-1处为游离羟基的伸缩振动吸收带。
图5中Ⅰ、Ⅱ、Ⅲ在1 220~1 330 cm-1处都有蛋白质的特征吸收峰,但Ⅲ的吸收峰较强,其次是Ⅰ、Ⅱ,说明酶解作用使OVA肽链断裂,蛋白质多以二级结构存在,因此酶解处理的蛋白质在酰胺Ⅲ带(1 220~1 330 cm-1)有强的吸收峰;α-螺旋特征吸收频率为1 290~1 330 cm-1,三者在1 290~1 330 cm-1均出现了蛋白质的特征吸收峰,且吸收强度 Ⅲ>Ⅱ>Ⅰ,说明在酶解和磷酸化后促进了α-螺旋的形成,因为酶解和磷酸化作用引起了N—H键变形振动,从而使其在1 290~1 330 cm-1的吸收峰增强;β-转角的特征吸收频率在1 290~1 265 cm-1,图中Ⅰ、Ⅱ、Ⅲ在1 265~1 290 cm-1处均出现了特征吸收峰,且吸收强度 Ⅲ>Ⅱ>Ⅰ,说明酶解和磷酸化OVA促进了β-转角的形成,在改性过程中更多氨基酸的残基游离出来,其中脯氨酸具有环状结构和固定的肽平面角,这种特殊结构能够在一定程度上促进β-转角形成。
2.2.2 差示扫描量热分析 差示扫描量热法(DSC)是用来测定蛋白质的热变性温度,在系统升温过程中,是分析温度与样品和参比之间量热差的一种方法。
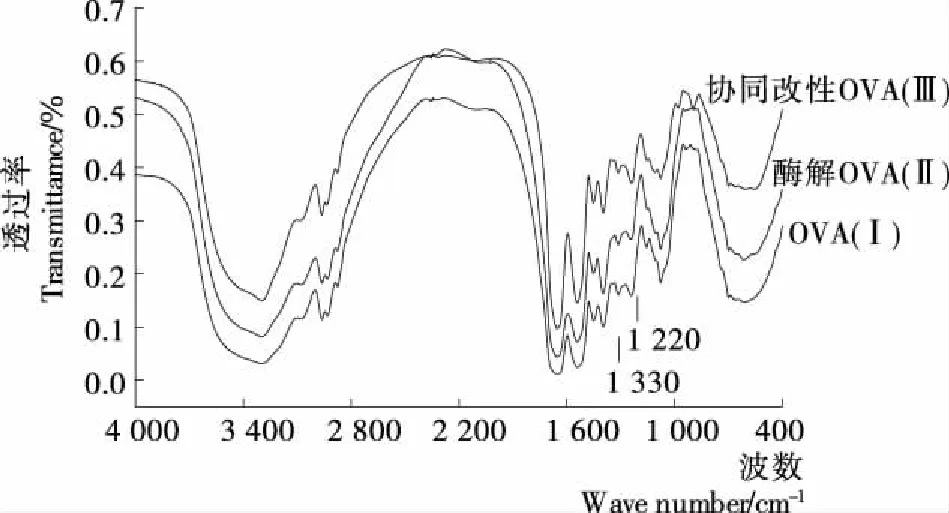
图5 红外光谱图分析结果
由图6可知,三者的DSC热变性温度曲线均出现了明显的放热峰,原因是蛋白质受热变性导致分子构象发生了变化。蛋白质的热稳定性与其氨基酸组成相关,疏水性氨基酸比亲水性氨基酸比例高的蛋白质一般热稳定较好[18]。酶解后的OVA球状结构遭到破坏,埋藏在分子内部的疏水基被释放出来,所以酶解OVA的热变性温度比OVA的升高6.70 ℃;协同改性后,OVA球状结构遭到破坏,埋藏在分子内部的疏水基被释放出来,所以协同改性的OVA热变性温度较OVA升高了10.19 ℃,说明协同改性可以提高蛋白的热变性温度。
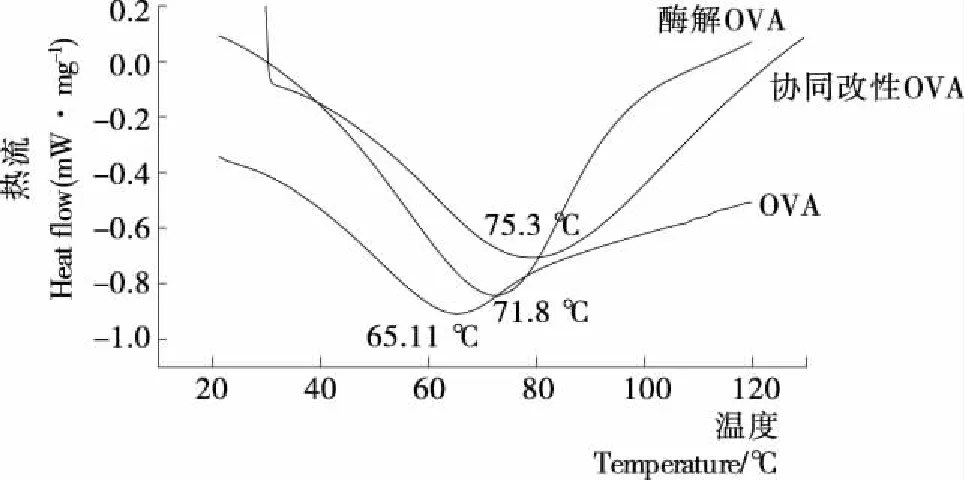
图6 热收缩温度分析结果
2.2.3 扫描电镜分析 SEM是通过高倍数放大样品,从分子形态上分析样品结构。对改性前后的OVA进行SEM分析,结果见图7。
由图7(a)可知,OVA为典型的球蛋白;图7(b)为酶解OVA,因肽链的断裂,球状结构遭到破坏;图7(c)为协同改性OVA,可以看出协同改性后的OVA,因磷酸根与蛋白结合,使蛋白的结构发生变化,形成了层叠的片状结构。

图7 改性前后OVA的微观结构
3 结论
(1) 通过对OVA、酶解OVA和协同改性OVA功能特性进行分析,得出协同改性OVA溶解度较酶解OVA和OVA都有较大的提高,凝胶强度分别提高了49,96 g,乳化活性指数分别提高了4.90,18.46 m2/g,乳化稳定性分别提高了1.97%,12.43%,起泡性分别降低了3.72%,20.90%,泡沫稳定性分别降低了7.13%,13.11%。
(2) 对OVA、酶解OVA和协同改性OVA进行结构分析,通过FT-IR光谱、DSC、SEM分析表明:卵白蛋白因酶解导致其肽链发生断裂,使得更多的氨基酸残基暴露出来,α-螺旋和β-折叠均有所增加;协同改性OVA热变性温度较酶解OVA和OVA分别升高了7.13,10.19 ℃;此外,由于磷酸基团的嵌入使蛋白的结构发生了变化,分子结构由球状体变成了层叠的片状结构。
[1] 高艳华, 王联结. 国内外食品蛋白质发展概况[J]. 食品研究与开发, 2003, 24(5): 58-60.
[2] 潘超然. 卵白蛋白提取及其口服液的研制[J]. 福建农林大学学报: 自然科学版, 2005, 34(4): 531-534.
[3] 张治国, 王君虹, 陈新峰, 等. 酶解蛋清粉制备蛋清蛋白肽工艺条件研究[J]. 浙江农业科学, 2010(2): 318-320.
[4] 涂勇刚, 聂旭亮, 徐明生, 等. 响应曲面法优化木瓜蛋白酶改善蛋清蛋白起泡性能工艺[J]. 食品科学, 2011(20): 84-88.
[5] LI Can-peng, CHEN De-yi, PENG Jian-lin, et al. Improvement of functional properties of whey soy protein phosphorylated by dry-heating in the presence of pyrophosphate[J]. Lebensmittel-Wissenschaft und-Technologie, 2010, 43(6): 919-925.
[6] 刘丽莉, 王焕, 李丹, 等. 鸡蛋清卵白蛋白酶解工艺优化及其结构性质[J]. 食品科学, 2016(10): 54-61.
[7] WIRIYAUMPAIWONG S, SOPONRPNNARIT S, PRACHAYAW-ARAKORN S. Comparative study of heating processes for full-fat soybeans[J]. Journal of Food Engineering, 2005, 65(3): 371-382.
[8] 卫生部. GB 5009.5—2010 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2010.
[9] DUARTE M L, FERREIRA M C, MARYAO M R, et al. An optimised method to determine the degree of acetylation of chitin and chitosan by FTIRspectroscopy[J]. International Journal of Biological Macromolecules, 2002, 31(1/2/3): 1-8.
[10] WANG Xin-wei, WANG Yang-liang, XU Su-ming. DSC anal-ysis of a simply supported anisotropic rectangular plate[J]. Composite Structures, 2012, 94(8): 2 576-2 584.
[11] 金丽丽, 朱秀清, 赵兴明, 等. 磷酸化修饰对大豆分离蛋白酶解液溶解性的影响[J]. 食品工业, 2014(8): 98-103.
[12] 徐幸莲, 王霞, 周光宏, 等. 磷酸盐对肌球蛋白热凝胶硬度、保水性和超微结构的影响[J]. 食品科学, 2005, 26(3): 42-46.
[13] LAM R S H, NICKERSON M T. Food proteins: A review on their emulsifying properties using a structure-function approach[J]. Food Chemistry, 2013, 141(2): 975-984.
[14] 张利兵, 赵妍嫣, 姜绍通. 小麦醇溶蛋白磷酸化改性工艺及性质的研究[J]. 食品工业科技, 2012, 33(12): 318-321.
[15] 杨瑾, 唐传核. 鸡蛋清蛋白水解物的物化及功能性质的研究[J]. 现代食品科技, 2011, 27(11): 1 316-1 319.
[16] 黄群, 杨万根, 金永国, 等. 卵白蛋白起泡性影响因素研究[J]. 食品与机械, 2014, 30(5): 54-56, 63.
[17] MILLER L M, BOURASSA M W, SMITH R J. FTIR spectroscopic imaging of protein aggregation in living cells[J]. Biochimica Et Biophysica Acta, 2013, 1 828(10): 2 339-2 346.
[18] GENG Xiao-peng, CUI Bing, LI Yan, et al. Preparation and characterization of ovalbumin and carboxymethyl cellulose conjugates via glycosylation[J]. Food Hydrocolloids, 2014, 37: 86-92.
Effect of the synergistic modification of enzymatic hydrolysis and phosphorylation on functional and structural characteristics of ovalbumin
LIU Li-li LI Yu WANG Huan YANG Chen-liu
(College of Food and Bioengineering, Henan University of Science and Technology, Luoyang, Henan 471023, China)
In this study, effects of the synergistic modification of enzymatic hydrolysis and phosphorylation on the functional properties and structural characterization of ovalbumin were studied. Comparison of functional properties of before and after the synergistic modification of ovalbumin, and the structural changes of the synergistic modification ovalbumin were analyzed by FT-IR, DSC and SEM. The results showed that the solubility, gel strength and emulsifying properties of the synergistic modification ovalbumin were higher than both the enzymatic hydrolyzed and unmodified ovalbumin, whereas the foaming and its stability were reduced. Moreover, the enzymatic hydrolysis of the ovalbumin peptide chain caused more amino acid residues to be exposed, therefore thea-helix andβ-turns increased accordingly. The synergistic modification of ovalbumin thermal denaturation temperature increased by 7.13 ℃ and 10.19 ℃, respectively, compared with the enzymatic hydrolyzed and unmodified one. In addition, due to the embedding of phosphate groups, collaborative modified molecular structure consisted of a spherical body into a laminated sheet structure.
ovalbumin; enzymatic hydrolysis; phosphorylation; synergistic modification; functional properties; structural analysis
国家自然科学基金(编号:31401622);公益性行业(农业)科研专项(编号:201303084);河南省重点攻关项目(编号:152102110080);河南科技大学高级别项目培育基金项目(编号:2013ZCX012);河南省教育厅自然科学研究项目(编号:13A550255)
刘丽莉(1974—),女,河南科技大学副教授,博士。 E-mail:yangliuyilang@126.com
2017—04—18
10.13652/j.issn.1003-5788.2017.06.004
