黄瓜硝酸还原酶基因(CsNR)序列分析及正反义表达载体的构建
2017-07-25潘玲玲王秀峰李强杨凤娟魏珉史庆
潘玲玲+王秀峰+李强+杨凤娟+魏珉+史庆华

摘 要:为进一步研究CsNR的作用机制,从黄瓜幼叶中克隆获得硝酸还原酶基因编码区序列(CDS)全长和片段(CsNR; EC 1.6.6.1),并运用生物学软件对该基因进行序列分析。其中CDS全长2 748 bp,编码915个氨基酸;CDS片段360 bp。CDS全长和pROKⅡ经KpnI单酶切和连接,构建了CsNR正义表达载体;CDS片段和pROKⅡ经KpnI和SacI双酶切,构建了CsNR反义表达载体。通过与其他高等植物NR蛋白进行同源性比对分析,结果发现,CsNR基因的氨基酸序列与甜瓜、烟草、拟南芥、油菜NR基因编码的氨基酸序列高度同源,其中与甜瓜NR蛋白之间同源性最高,为98.25%。
关键词:黄瓜;硝酸还原酶;生物信息学;正义表达载体;反义表达载体
中图分类号:S642.2 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2017.07.001
Sequence Analysis and Construction of Sense and Antisense Expressing Vector of Cucumber Nitrate Reductase(CsNR)
PAN Lingling1, WANG Xiufeng1,2, LI Qiang1, YANG Fengjuan1,2,WEI Min1,3, SHI Qinghua1,2
(1.College of Horticulture Science and Engineering, Shandong Agricultural University, Tai'an, Shandong 271018, China; 2.State Key Laboratory of Crop Science, Tai'an, Shandong 271018, China;3. Scientific Observing and Experimental Station of Environment Controlled Agricultural Engineering in Huang-Huai-Hai Region, Ministry of Agriculture, Tai'an, Shandong 271018, China)
Abstract: To further study the mechanism of CsNR, a fragment and full length CDS of cucumber nitrate reductase (CsNR; EC 1.6.6.1) was isolated from cucumber (Cucumis sativus L.) young leaves, respectively. Meanwhile, the gene sequence was analyzed by the biology software. The fragment and full-length CDS was 2 952 and 360 bp, respectively. The full-length CDS and pROKII were digested to construct sense expressing vector. The fragment CDS and pROKII were digested to construct sense expressing vector. The homology alignment analysis indicated that the protein encoded by CsNR was in high similarity with NR-encoding protein in Cucumis melo, Nicotiana tabacum, Arabidopsis thaliana and Brassica campestris. The homology with amino acid sequences of CsNR compared with Cucumis melo was the highest by 98.25%.
Key words: Cucumis satinus L.; nitrate reduatase; bioinformatics; sense expressing vector; antisense expression vector
植物硝酸還原酶(Nitrate reductase,NR)是氮同化代谢的关键酶和限速酶,它以还原型辅酶(NAD(P)H)为电子供体催化硝酸盐的还原,生成亚硝酸盐。硝酸盐通过谷氨酸合成循环转变为铵,分别由胞质中的NR以及叶片叶绿体中的亚硝酸还原酶催化[1]。NR催化硝酸盐还原成亚硝酸盐是植物整个硝酸盐同化过程中的限速和关键作用步骤[2-4],故NR被认为是硝酸盐同化过程中的限速酶和诱导酶[5-8],那么植物中的硝酸还原酶活性和NO3- 含量之间就应该存在着密切联系[9]。对高等植物而言,研究发现硝酸盐是调节硝酸还原酶活性[5]以及NR表达[6]的主要因子。现已从大麦[10]、笋瓜[11]、烟草[12-13]、拟南芥[14-15]、番茄[16]、玉米[17]、萝卜[18]、生菜[19]和大白菜[20]等多种植物种类中克隆出了多种NR基因。目前,人们在植物的盐胁迫信号转导机制方面研究已取得了大量成就[21],但均以NaCl作为盐胁迫处理手段。
黄瓜作为主要的设施蔬菜作物之一,在栽培中人们为了获高产,盲目施用大量氮肥;加之设施环境地温高、蒸发量大、无雨水淋洗以及连作等不合理的栽培方式,导致土壤发生次生盐渍化[22]。温室土壤次生盐渍化的盐分组成中,其阴离子主要是NO3-,且占阴离子总量的67%~76%[23]。但在过量NO3-胁迫下,设施黄瓜NR表达水平以及NR活性的变化尚未见报道。本试验通过克隆黄瓜硝酸还原酶基因全长和片段,构建其正义和反义表达载体,可为硝酸还原酶功能研究以及在黄瓜抗性育种中的应用提供一定的理论依据和实践途径。
1 材料和方法
1.1 试验材料
以‘津优35号黄瓜品种为试材。
大肠杆菌E.coli DH5α、表达载体pROKⅡ由本实验室保存。pMD18-T 载体、KpnⅠ、SacⅠ等购自大连宝生物公司。Tap DNA聚合酶、快速琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒等购自北京康为世纪生物科技有限公司。
1.2 试验方法
1.2.1 模板cDNA的制备 当黄瓜幼苗长至三叶一心时,用50 mmol·L-1 KNO3于光下诱导4 h,选取健壮植株幼苗叶片进行试验。总RNA的提取参照Salzman等[24]的方法进行,第一链cDNA的合成参照康为世纪公司说明书。
1.2.2 引物设计与合成 用DNAman软件设计并由北京六合华大基因科技股份有限公司合成引物。正义上游引物P1:5′-CACAACAAAGGTGGTGGAGGGCAAAA-3′;下游引物P2:5′- ACAAAACGAATCCAACGTCCTTTTC-3′。反义上游引物P3:5′-GAGCTCGTGGAGGTGACAATGG-3′;下游引物P4:5′-GGTACCGGTGGATATTTCTAGATG-3′。
1.2.3 PCR扩增 PCR反应体系为:模板cDNA 2 μL,10× Buffer 10 μL,10 mmol·L-1 dNPT 8 μL,上下游引物各4 μL,Tap DNA聚合酶1 μL,加双蒸馏水至100 μL,平均到两个PCR管。扩增程序为:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸120 s,进行22个循环,最后于72 ℃延伸10 min。PCR扩增后,取PCR产物在l%琼脂糖凝胶进行电泳,观察结果。
1.2.4 PCR产物的克隆與鉴定 用DNA凝胶回收试剂盒回收PCR产物,并将其与pMD18-T载体连接,转化到E.coli DH5α感受态细胞。在Amp抗性LB固体培养基上培养10~12 h,挑取白色单菌落进行菌落PCR并摇菌提取质粒酶切验证。分别将正反义阳性克隆质粒命名为pMD18-CsNR(+)与pMD18-CsNR(-)。
1.2.5 核苷酸序列的测定和分析 将含阳性克隆质粒的菌液送北京六合华大基因科技股份有限公司测序。
1.2.6 生物信息学分析 通过NCBI数据库中的BLASTx对CsNR的cDNA序列和开放阅读框编码的氨基酸进行同源性搜素和比对;通过DNAMAN比较分析黄瓜NR蛋白与其他作物中NR蛋白的进化关系;通过Expasy数据库预测CsNR蛋白质PI和其相对分子质量。
1.2.7 植物表达载体的构建和鉴定 用限制性内切酶KpnⅠ分别对pMD18-CsNR(+)载体和pROKⅡ载体进行单酶切,同时用限制性内切酶KpnⅠ和SacⅠ分别对pMD18-CsNR(-)载体和pROKⅡ载体进行双酶切,回收目的片段。
用T4 DNA连接酶分别将对应的两个回收片段进行连接,转化E.coli DH5α感受态细胞,在含有卡那霉素100 mg·L-1的LB平板上筛选阳性菌落,碱法提取质粒经酶切鉴定后送北京六合华大基因科技股份有限公司测序。构建好的植物表达载体分别命名为pROKⅡ-CsNR(+)与pROKⅡ-CsNR(-)。
2 结果与分析
2.1 CsNR基因的克隆与鉴定
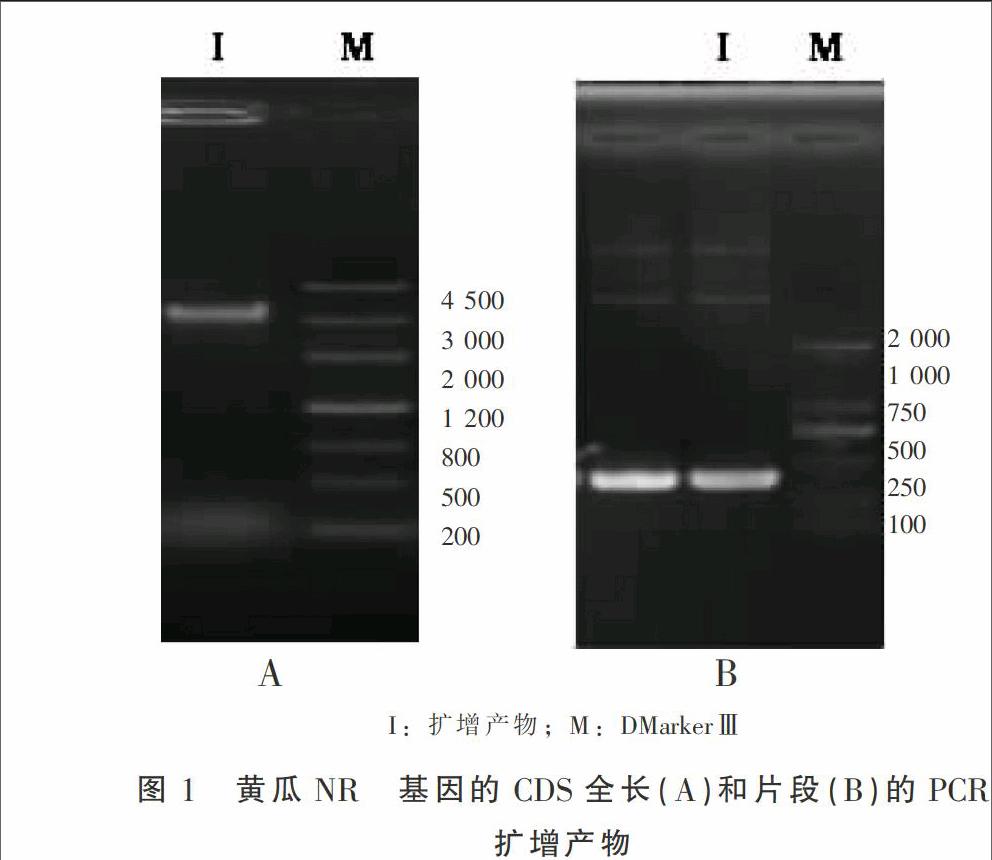
以黄瓜幼苗叶片cDNA为模板,利用基因特异引物P1/P2和P3/P4分别进行PCR扩增,获得CsNR基因CDS全长和片段,将PCR产物进行1%琼脂糖凝胶电泳,目的条带大小为2 952 bp(图1A)和360 bp(图1B)。测序结果表明, CDS全长2 952 bp,CsNR基因cDNA开放阅读框(ORF) 为2 748 bp,编码 915 个氨基酸,Gen Bank 登录号为NM_001280767。分别将图1中的目的条带回收,与克隆载体pMD18-T连接,经筛选获得阳性克隆质粒pMD18-CsNR(+)与pMD18-CsNR(-)。
2.2 CsNR基因生物信息学分析
利用DNAMAN 6.0软件将CsNR基因推导的氨基酸序列与NCBI中已登陆的其他高等植物NR蛋白进行同源性比对分析(图2) ,结果表明该序列与甜瓜、烟草、拟南芥、油菜NR基因编码的氨基酸序列高度同源,其中与甜瓜NR蛋白之间同源性最高,为98.25%。
Expasy数据库预测表明,CsNR蛋白理论等电点( pI) 为7.00,相对分子质量为103.227 1×103 Da。
2.3植物表达载体的构建及鉴定
用限制性内切酶KpnⅠ分别酶切pMD18-CsNR(+)和pROKⅡ载体,回收目的片段并用T4连接酶连接,构建正义表达载体pROKⅡ-CsNR(+)。用限制性内切酶KpnⅠ和SacⅠ分别酶切pMD18-CsNR(-)和pROKⅡ载体并用T4连接酶连接,构建反义表达载体pROKⅡ-CsNR(-)。将连接产物转化到E.coli DH5α感受态细胞。挑取单克隆进行菌落PCR验证。同时,摇菌提质粒进行酶切验证。从图3的A、B中可以看出,目的片段已经插入pROKⅡ载体中,经测序证明植物表达载体构建正确。载体构建过程如图4(正义)和图5(反义)。
3结论与讨论
早在1981年Harper在测定大豆叶片硝酸还原酶活性时,就首次发现了不依赖于氧气的NOx(NO+NO2)酶促产生现象,进一步的突变体试验初步证实与组成型硝酸还原酶(constitutive NR,cNR,EC1.6.6.2)中的C1NR类型有关。以后,Dean和Harper [25]报道了豆科菜豆属植物cNR的钼-蝶呤中心也可能具有催化亚硝酸盐生成NO的功能,并认为这种依赖于硝酸还原酶的NOx合成能力仅局限于高等植物中的豆科植物。而Wildt等[26]则发现在光照条件下高浓度的硝酸盐培养液也可以诱发向日葵、烟草、甘蔗、玉米、葡萄、云杉和菠菜等植物大量产生NO,暗示NO可能是所有植物氮代谢的副产物。由此可见,硝酸还原酶也是植物体内的NO合成酶,NO3-胁迫下体内NR活性以及NO3-、NO2-和NO含量的改变与植物抗盐性关系密切。这说明NO3-盐胁迫下,体内NO变化对黄瓜幼苗生理生化特性及信号转导相关基因表达的影响具有重要意义。
本研究根據GeneBank中已发表的黄瓜硝酸还原酶基因序列设计引物进行RT-PCR,将PCR产物回收连接到pMD18-T载体上,得到长度为2 748 bp的CDS全长与360 bp的反义片段,进而分别构建了CsNR正义和反义表达载体。这为研究CsNR对黄瓜内源NO的分子调控机理及对NO级联信号转导系统的影响,阐明内源NO对NO3-胁迫的响应机制,改良根际环境、减轻盐渍化危害奠定了基础。同时,CsNR基因的氨基酸序列与甜瓜、烟草、拟南芥、油菜NR基因编码的氨基酸序列高度同源,其中与甜瓜NR蛋白之间同源性最高,为98.25%。
参考文献:
[1]LI G J, PENG F T, ZHANG L, et al. Cloning and characterization of a SnRK1-encoding gene from Malus hupehensis Rehd. and heterologous expression in tomato[J]. Mol biol rep, 2010, 37: 947-954.
[2]STITT M, MULLER C, MATT P, et al. Steps towards an integrated view of nitrogen metabolism[J]. J exp bot, 2002, 53: 959-970.
[3]BEEVERS L, HAGEMAN R H. Nitrate reduction in higher plants[J]. Annu rev plant physiol,1969,20: 495-522.
[4]HEWITT E J. Assimilatory nitrate-nitrite reduction[J]. Annu rev plant physiol ,1975,26: 73-100.
[5]CAMPBELL W H. Structure and function of eukaryotic NAD (P) H: nitrate reductase[J].Cell mol life sci ,2001, 58: 194-204.
[6]KAISER W M, WEINER H, HUBER S C. Nitrate reductase in higher plants: a case study for transduction of environmental stimuli into control of catalytic activity[J]. Physiol plant,1999,105: 385-390.
[7]DANIEL-VEDELE F, CABOCHE M . Molecular analysis of nitrate assimilation in higher plants[J].Cracad sci paris, life sci,1996, 319: 961-968.
[8]CABA J M, LLUCH C, LIGERO F. Distribution of nitrate reductase activity in Vicia faba: effect of nitrate and plant genotype[J]. Physiol plant ,1995,93: 667-672.
[9]BUSSI C, GOJON A, PASSAMA L. In situ nitrate reductase activity in leaves of adult peach trees[J]. J hortic sci ,1997,72: 347-353.
[10]SKRDLETA V, GAUDINOVA A, NEMCOVA M. Relationships between nitrate level, nitrate reductase activity and anaerobic nitrite production in Pisum sativum leaf tissue[J]. Biol plant,1979, 21: 307-310.
[11]CHENG C L, DEWDNEY J, KLEINHOFS A, et al. Cloning and nitrate induction of nitrate reductase mRNA[J]. Proc natl acad sci USA,1986,83: 6825-6828.
[12]CRAWFORD N M, CAMPBELL W H, DAVIS R W. Nitrate reductase from squash: cDNA cloning and nitrate regulation[J]. Proc natl acad sci USA,1986,83: 8073-8076.
[13]CALZA R, HUTTNER E, VINCENTZ M, et al. Cloning of DNA fragments complementary to tobacco nitrate reductase mRNA and encoding epitopes common to the nitrate reductases from higher plants[J]. Mol gen genet ,1987,209: 552-562.
[14]VAUCHERET H, KORNENBERGER J, ROUZE′ P, et al. Complete nucleotide sequence of the two homeologous tobacco nitrate reductase genes[J]. Plant mol bio,1989(12): 597-600.
[15]CRAWFORD N M, SMITH M, BELLISSIMO D, et al. Sequence and nitrate regulation of the Arabidopsis thaliana mRNA encoding nitrate reductase, a metal of lavo protein with three functional domains[J].Proc natl acad sci USA,1988,85: 5006-5010.
[16]CHENG C L, DEWDNEY J, NAM H G, et al. A new locus (NIA1) in Arabidopsis thaliana encoding nitrate reductase[J]. EMBO J ,1988(7): 3309-3314.
[17]DANIEL-VEDELE F, DORBE M F, CABOCHE M,et al. Cloning and analysis of the tomato nitrate reductase-encoding gene: protein domain structure and amino acid homologies in higher plants[J].Gene,1989,85: 371-380.
[18]武悅, 徐良, 王娟娟,等.萝卜硝酸还原酶基因的克隆与表达分析[J].南京农业大学学报,2015,38(2):205-211.
[19]田真,李敬蕊,王祥,等.生菜硝酸还原酶基因的克隆及高氮水平下外源γ-氨基丁酸对其表达和叶片硝酸盐含量的影响[J].西北植物学报,2015,35(6):1098-1105.
[20]HYDE G E, CAMPBELL W H. High-level expression in Escherichia coli of the catalytically active flavin domain of corn leaf NADH: nitrate reductase and its comparison to human NADH: cytochrome B5 reductase Biochem[J]. Biophys res commun,1990,168: 1285-1291.
[21]SUN F F, HOU X L, LI Y, et al. Molecular cloning and characterization of nitrate reductase gene from non-heading Chinese cabbage[J].Sci hortic,2008,119: 1-10.
[22]李海云,王秀峰,邢禹贤.设施土壤盐分积累及防治措施研究进展[J].山东农业大学学报,2001,32(4):535-538.
[23]薛继澄,毕德义,李家金,等.保护地栽培蔬菜生理障碍的土壤因子与对策[J].土壤肥料,1994(1):4-9.
[24]SALZMAN R A, FUJITA T, HASEGAWA P, et al. An improved RNA isolation method for plant tissues containing high levels of phenolic compounds or carbohydrates[J]. Plant molecular biology reporter, 1999,17:11-17.
[25]DEAN J V, HARPER J E. The conversion of nitrite to nitrogen oxide(s) by the constitutive NAD(P)H-nitrate reductase enzyme from soybean[J].Plant physiol, 1988, 88: 389-395.
[26]WILDT J, KLEY D, ROCKEL A, et al. Emission of NO from several higher plant species[J]. J geophys res, 1997,102, 5919-5927.
