理化复合预处理对TGase改性小麦蛋白性质的影响
2017-07-19孙撬撬王凯强罗水忠赵妍嫣姜绍通
孙撬撬 王凯强 罗水忠 蔡 静 赵妍嫣 姜绍通 郑 志
(合肥工业大学生物与食品工程学院;安徽省农产品精深加工重点实验室,合肥 230009)
理化复合预处理对TGase改性小麦蛋白性质的影响
孙撬撬 王凯强 罗水忠 蔡 静 赵妍嫣 姜绍通 郑 志
(合肥工业大学生物与食品工程学院;安徽省农产品精深加工重点实验室,合肥 230009)
本试验采用Na2SO3/超声波、尿素/ Na2SO3/超声波理化复合预处理小麦蛋白,以提高谷氨酰胺转氨酶(TGase)凝胶效率。结果表明, Na2SO3/超声波、尿素/ Na2SO3/超声波处理的小麦蛋白,其溶解性分别提高325%和437%。理化复合预处理的小麦蛋白,氢键作用降低,离子键作用有一定程度增加,疏水相互作用显著增加,游离巯基增加,表面结构松散,β-折叠的含量降低,无规则卷曲的含量增加。理化复合预处理后加入TGase后的小麦蛋白,氢键作用增加,离子键作用有一定程度降低,疏水相互作用、游离巯基和二硫键基本不变,呈现多孔紧密连接的蛋白质网络结构,且蛋白质簇和孔的大小及分布均匀,β-折叠的含量增加,无规则卷曲的含量均降低。经Na2SO3/超声波预处理后的小麦蛋白加入TGase后,其凝胶强度达到最高,为344.13g/cm2。
小麦蛋白 理化预处理 凝胶性 谷氨酰胺转氨酶 蛋白质构象
小麦蛋白是小麦淀粉加工过程中的副产物,蛋白质质量分数达72%~85%,富含人体必需氨基酸[1]。小麦蛋白组成中含较多脯氨酸等疏水性氨基酸,溶于水中时易凝聚成团,致使以蛋白质为底物时的酶改性位点不易暴露,酶改性效率低下[2]。已有研究表明,采用物理、化学等方法,作用于蛋白质氨基酸残基或多肽链,可以使蛋白质相的空间结构、静电荷和表面疏水性等发生改变,有利于酶作用位点的暴露,提高酶催化效率。
尿素是一种极性化合物,可以与蛋白质表面结合,从而促使蛋白展开,致使埋藏的非极性表面进一步暴露[3]。张忠慧等[4]在采用尿素处理大豆分离蛋白时发现低浓度的尿素可以影响大豆分离蛋白分子之间的疏水相互作用,导致蛋白质分子展开,非极性基团暴露。Na2SO3是一种还原剂,可以将小麦蛋白中的二硫键部分裂解为游离巯基,破坏小麦蛋白的网络结构。严梅荣等[5]在Alcalase 水解菜籽粕反应中添加Na2SO3,发现Na2SO3能断裂菜籽蛋白的二硫键,增大了与蛋白酶的接触,从而提高酶解效率。进一步研究表明,加入还原剂Na2SO3可以降低蛋白质分子质量,促使蛋白质结构变得松散,提高其水溶性[6]。Qu等[7]研究表明,超声波有利于蛋白质四级结构的解离以及一些较小的多肽的释放,可以改变游离巯基和二硫键的含量,增加蛋白质在水中的溶解度。
谷氨酰胺转氨酶(简称TGase)是一种催化酰胺基转移反应的转移酶,催化蛋白质以及肽键中谷氨酰胺残基的γ-羟基酰胺基和伯胺之间的酰胺基转移反应,形成ε-(γ-谷氨酰胺)赖氨酸共价键[8]。小麦蛋白通过TGase交联反应,促进分子内和分子间的交联,可以增加小麦蛋白中的大分子数量,优化面筋的网络结构,提高其凝胶性,扩大小麦蛋白的应用领域[9]。李鑫等[10]研究发现微生物谷氨酰胺转氨酶(MTG)通过可催化面筋蛋白中各组分发生分子内和分子间的交联作用,改善面团的拉伸特性。
本试验采用尿素、 Na2SO3,结合超声波复合预处理小麦蛋白,研究其对小麦蛋白分散性的影响,并在此基础上,添加TGase酶促进其凝胶化,研究凝胶强度的变化,以期为提高小麦蛋白的凝胶性,促进小麦蛋白在食品领域的应用提供参考。
1 材料与方法
1.1 材料与设备
小麦蛋白(粗蛋白质量分数72.57%,水分、粗脂肪、灰分和淀粉质量分数分别为9.55%、2.23%、1.56%和5.67%):安徽省瑞福祥食品有限公司;TGase(120 U/g):南宁东恒华道生物科技有限公司;试验中其他试剂均为食品级或分析纯。
冷冻离心机(G1-20G-II):上海安亭科学仪器厂;真空冷冻干燥机(FD-1B-50):北京博医康实验仪器有限公司;质构仪(TA-XT2i):美国TA仪器公司;傅里叶红外光谱仪(NICOLE67):美国Thermo公司。
1.2 试验方法
1.2.1 小麦蛋白理化复合预处理方法
取小麦蛋白原料适量,分别溶于800 mg/kg Na2SO3溶液和尿素/ Na2SO3溶液(其中尿素溶液浓度为0.01 mol/L,Na2SO3为800 mg/kg)中,使其构成5%的悬浊液,搅拌30 min后,将悬浊液在超声功率为0.9 W/mL,超声频率为50%的条件下超声50 min。将样品7 000 r/min,离心10 min,将离心所得沉淀进行真空冷冻干燥,得预处理的小麦蛋白样品。理化复合预处理样品用于溶解性,化学作用力,扫描电镜及二级结构的检测,未处理样品为对照。Na2SO3和尿素/ Na2SO3溶液的浓度,以及超声波频率和功率等条件参数均由单因素优化试验获得。
1.2.2 TG酶改性小麦蛋白工艺
取小麦蛋白原料及理化预处理后的小麦蛋白,边搅拌边加入一定量的去离子水中,配成20%的悬浮液,用1 mol/L的NaOH调节反应体系pH为7.0,按14 U/g(TGase/小麦蛋白) 用量加入TGase,小麦蛋白悬浮液与TGase反应30 min后,90 ℃加热10 min灭酶,将悬浮液在7 000 r/min条件下,离心10 min,将离心后所得沉淀真空冷冻干燥,得TGase 改性后的小麦蛋白样品。TGase 改性后的小麦蛋白样品进行凝胶强度,化学作用力,扫描电镜及二级结构的检测。
1.3 分析方法
1.3.1 蛋白质溶解度的测定
将理化预处理后的小麦蛋白样品配制成浓度为5%的悬浊液,溶解介质为0.01 mol/L的NaOH溶液,3 000 r/min条件下冷冻离心10 min,福林酚法测定上清液中蛋白含量。
蛋白质溶解度=

1.3.2 化学作用力的测定
参考Gomez-Guillen等[11]的方法。取小麦蛋白原样、预处理的小麦蛋白样品和TGase改性后的小麦蛋白样品各2g(4个平行),分别与10mL的0.05mol/LNaCl(SA)、0.6mol/LNaCl(SB)、0.6mol/LNaCl+1.5mol/L尿素(SC)(原子比2∶5)和0.6mol/LNaCl+8mol/L尿素(SC)(原子比3∶40) 混合并均质,4 ℃静止1h,10 000r/min离心15min。用福林酚法测定上清液中蛋白质的含量。离子键的贡献以溶解于SB溶液与SA溶液中的蛋白质含量之差来表示;氢键的贡献以溶解于SC溶液与SB溶液中的蛋白质含量之差来表示;疏水相互作用的贡献以溶解于SD溶液与SC溶液中的蛋白质含量之差来表示。
1.3.3 巯基和二硫键的测定
参考Lutz[12]的方法对小麦蛋白原料及样品的巯基和二硫键含量进行测定。
1.3.4 凝胶强度的测定
将TGase改性的小麦蛋白样品溶于0.05mol/L的NaCl溶液,配置成20%的蛋白质溶液, 于100 ℃加热1h,然后迅速冰浴冷却,4 ℃静置24h,即获得用于凝胶强度检测的样品。25 ℃下采用质构仪测定凝胶样品,穿刺试验操作条件:p0.5探头,测试前速度:2.0mm/s,测试后速度:10.0mm/s,出发力10g,下压凝胶5mm所需力为凝胶强度,单位g/cm2,重复试验3次,以平均值作为测定结果。
1.3.5 扫描电子显微镜观察
将小麦蛋白原样及处理所得小麦蛋白样品涂片,喷金。将样品转移到JEOLJSM-6701F扫描电子显微镜上,在15kV的加速电压下观察小麦蛋白网络结构的形貌并拍照。
1.3.6 傅里叶红外光谱的测定
取一定量的小麦蛋白原样及上述处理所得小麦蛋白样品与溴化钾混合,磨成均匀粉末,干燥,压片,利用傅里叶红外光谱仪做全波段扫描(波段范围为:400~4 000cm-1),背景扫描64次,样品扫描32次。根据小麦蛋白红外光谱图中酰胺Ⅰ带(1 600~1 700cm-1)各峰的指认标准(表1),利用PeakFitv4.12软件计算小麦蛋白二级结构含量比例。

表1 红外光谱中酰胺Ⅰ带中峰的位置和对应的二级结构
1.4 数据处理
每个试验重复3次,结果采用平均值±标准差的形式表示,试验数据采用Excel2 007、Origin7.5、TAAnalysis、Ominic和PeakFitv4.12进行处理,数据的显著性(P<0.05)通过SPSS软件进行分析。
2 结果与讨论
2.1 理化复合预处理对小麦蛋白溶解性及结构的影响
2.1.1 预处理对小麦蛋白溶解性的影响
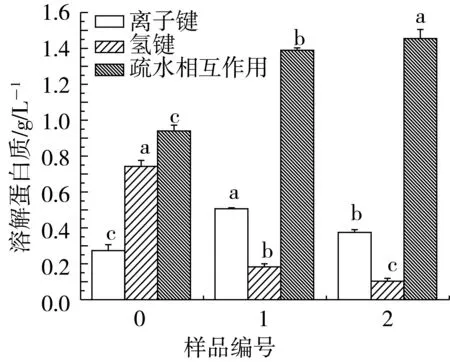
小麦蛋白的溶解性是功能性质的一个重要指标,其大小与组成氨基酸的平均疏水性和电荷分布有关。预处理对小麦蛋白溶解性的影响,如图1所示。
图1a表明,未处理的小麦蛋白溶解性为8%,而经过Na2SO3/超声波,尿素/ Na2SO3/超声波处理的小麦蛋白的溶解性分别为34%和43%。Na2SO3和尿素的处理,大大增加了小面蛋白的溶解性。Na2SO3的添加破坏了小麦蛋白的网络结构,同时,尿素可以与水分子迅速形成氢键,使蛋白质分子展开,而超声波处理有利于蛋白质四级结构的解离以及一些较小的多肽的释放,三者均有利于小麦蛋白的溶解性的增加。
2.1.2 预处理对小麦蛋白化学作用力影响
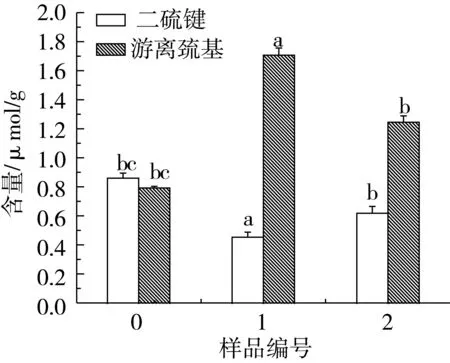
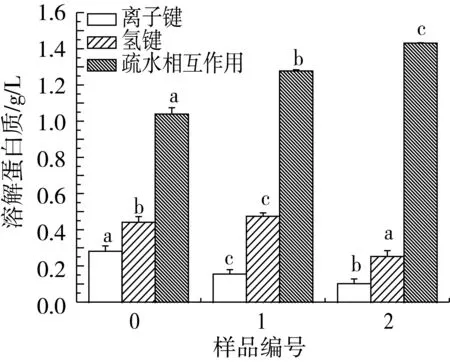
小麦蛋白是由各种氨基酸相互联接而构成的具有空间结构的生物大分子,其构象是通过氢键、二硫键、离子键、疏水相互作用、范德华力以及二硫键、ε-(γ-谷氨酰基)-赖氨酸共价键等化学作用力来维持的。预处理过程中小麦蛋白化学作用力,即离子键、氢键、疏水相互作用和二硫键的变化情况如图1b和图1c所示。
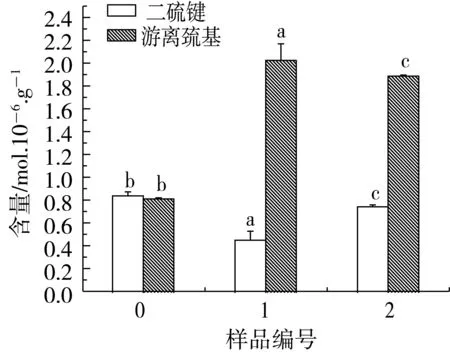
从图1b可以看出,样品1和样品2的离子键稍微增大,可能是由于Na2SO3的添加,影响了蛋白质分子的表面电荷,使离子键稍微增大。尿素能够与蛋白质分子的氨基酸之间形成氢键,强烈地破坏高分子内和分子间氢键,使氢键含量降低。同时,尿素的添加使肽链伸展,疏水氨基酸残基和疏水氨基酸侧链暴露出来,超声波处理促进疏水氨基酸残基的暴露程度,肽链疏水性增加,促使疏水相互作用增强。由图1c可以看出,Na2SO3的添加破坏了小麦蛋白的二硫键,使游离巯基释放,二硫键含量降低,游离巯基含量提高。
2.1.3 预处理对小麦蛋白微观结构影响
小麦蛋白原料及理化预处理后样品的微观结构,如图2所示。可以看出,天然小麦蛋白呈现不规则且无序的蛋白质聚合体组成的不规则结构形态,蛋白质簇和孔的大小和分布不均匀。Na2SO3和尿素及超声波预处理过后,蛋白质侧链展开,结构更加松散。

0 1 2图2 预处理的小麦蛋白微观结构的影响
2.1.4 预处理小麦蛋白的二级结构变化
利用傅里叶红外光谱仪对理化复合预处理的小麦蛋白做全波段扫描,其酰胺Ⅰ带(1 600~1 700 cm-1)图谱如图3所示。根据蛋白质不同二级结构的红外酰胺带各峰的指认标准,计算出小麦蛋白二级结构的含量比例图,见图4。

a
b
c
注:0 未处理的小麦蛋白,1 Na2SO3/超声波处理的小麦蛋白,2 尿素/Na2SO3/超声波处理的小麦蛋白图中的不同小写字母代表数据间具有显著性差异(P<0.05)。本节内下同。
图1 预处理对小麦蛋白溶解性及结构的影响
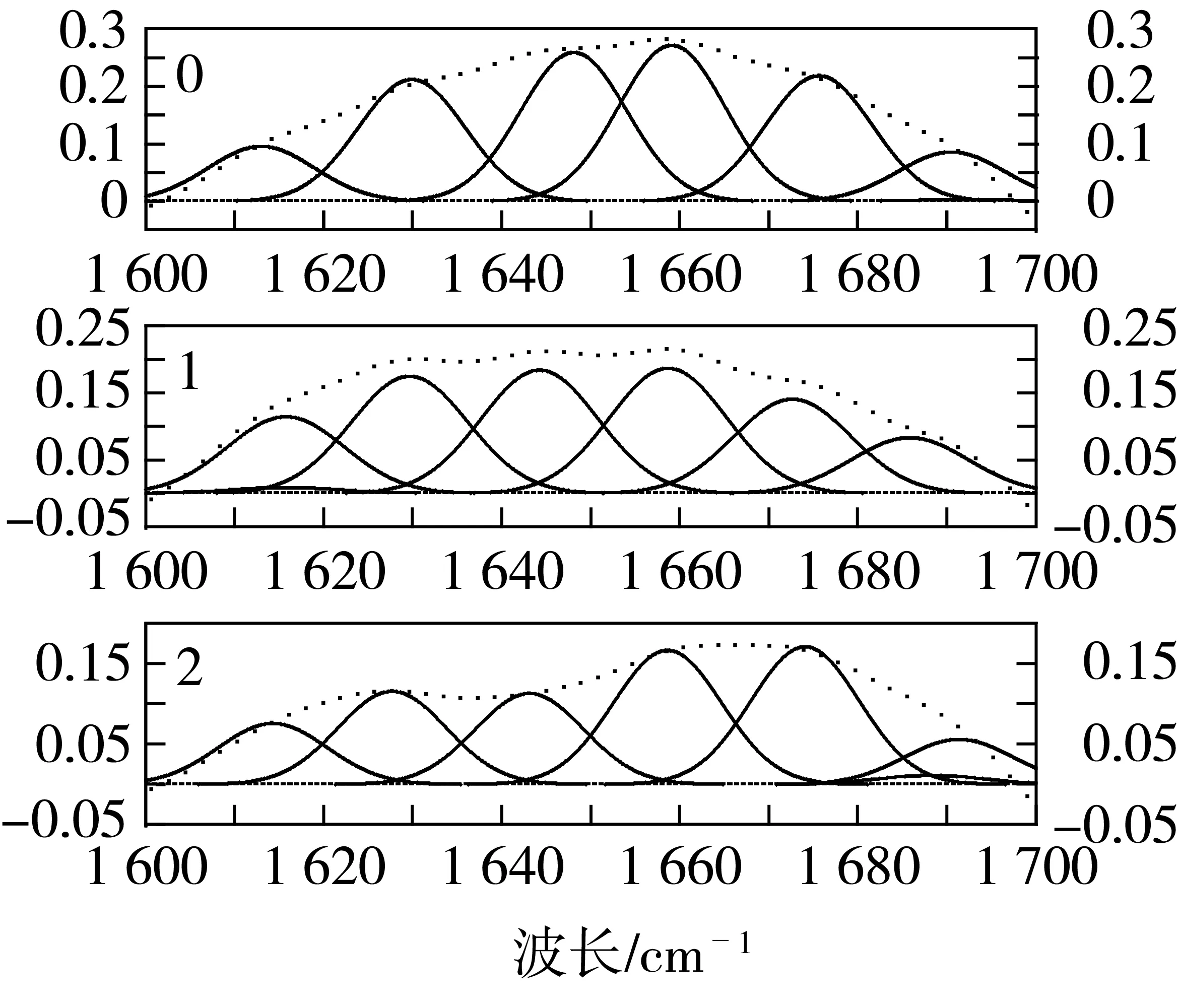
图3 预处理的小麦蛋白的红外光谱图

图4 预处理的小麦蛋白的二级结构变化
图4结果表明,天然小麦蛋白的二级结构约为:22.63%α-螺旋、28.14%β-折叠、28.25%β-转角和21.01%无规则卷曲,小麦蛋白的二级结构以β-折叠和β-转角为主。小麦蛋白预处理前后,α-螺旋的含量并未发生显著变化,β-折叠的含量有一定程度的降低,无规则卷曲的含量均增加。
尿素导致蛋白质分子的展开,非极性基团暴露出来,表现为β-折叠降低,如图4所示。β-转角是由多肽链反转180°形成的,Na2SO3预处理使得蛋白质结构伸展,阻止了多肽链的反转,使得β-转角含量降低。α-螺旋和β-折叠都是依赖氢键而稳定,Na2SO3预处理后,氢键受到破坏,如图1b,使得α-螺旋和β-折叠含量降低。由于α-螺旋构象的空间位阻比β-折叠大,由图4可以看出,β-折叠变化更明显。无规则卷曲增大有利于酶交联反应,从而改善小麦蛋白的功能性质。
2.2 TGase改性对小麦蛋白凝胶性及结构的影响
2.2.1 TGase对小麦蛋白凝胶强度的影响
凝胶是介于固体和液体之间的一个中间相。它是由聚合物经共价或非共价键交联而形成的一种网络结构,能截留水和其他低分子质量的物质。TGase改性后的小麦蛋白凝胶强度如图5a所示 。
TGase可以催化蛋白质分子间形成ε-(γ-谷氨酰基)-赖氨酸共价键,此交联键的形成可强化蛋白凝胶结构,提高凝胶强度。理化复合预处理后的小麦蛋白,空间结构相对松散变得,活性作用位点暴露,有利于TGase催化其发生交联反应,优化面筋的网络结构,提高蛋白质的凝胶性。图5a结果表明,Na2SO3/超声波预处理结合TGase的小麦蛋白的凝胶强度达到最高,为344.13 g/cm2,比未经理化预处理的样品提高134%。
2.2.2 TGase对小麦蛋白化学作用力的影响
TGase改性后小麦蛋白的化学作用力的变化如图5b、图5c所示。
图5b结果表明,TGase改性的小麦蛋白离子键作用降低,氢键得到一定的增强,疏水相互作用基本不变。TGase改性后,形成更大的小麦蛋白分子,其网络结构由理化复合预处理后的松散状态变成均匀紧密的结构。由于蛋白质结构变得紧密,影响了蛋白质表面的电荷分布,离子键作用降低,但紧密的结构也使得氢键得到一定的增强。小麦蛋白经TGase改性前后,其疏水相互作用基本不变,说明TGase的改性对小麦蛋白的疏水性氨基酸残基并没有太大的影响。图5c则表明,TGase改性对蛋白质中二硫键和游离巯基的含量基本无影响。
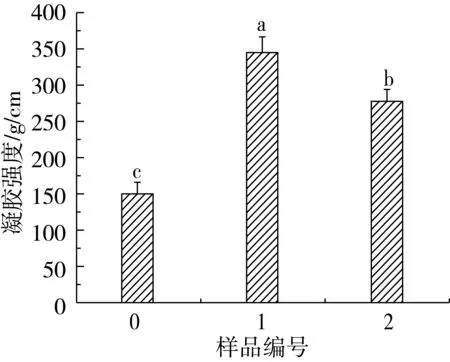
a
b
c
注:0 TGase处理的小麦蛋白,1 Na2SO3/超声波/TGase 处理的小麦蛋白,2 尿素/Na2SO3/超声波/TGase 处理的小麦蛋白;图中的不同小写字母代表数据间具有显著性差异(P<0.05)。本节内下同。
图5 TGase改性对小麦蛋白凝胶强度的影响
2.2.3 TGase对小麦蛋白微观结构的影响
TGase改性后的小麦蛋白的扫描电镜图,如图6所示。

0 1 2图6 TGase改性对小麦蛋白微观结构的影响
图6表明,TGase改性后的小麦蛋白呈现多孔紧密连接的蛋白质网络结构,且蛋白质簇和孔的大小及分布均匀。改性后蛋白质网络更加紧密,这有可能因为连接蛋白质的二硫键断裂,加入TGase后,蛋白质分子内和分子间通过共价键和非共价键重新连接,小分子质量的聚合物消失,大分子质量的蛋白质聚合物的形成和含量增加,使蛋白质呈现更紧密的网络结构,有利于提高小麦面筋蛋白的凝胶的强度。如Yang等[14]报道这种紧密的蛋白质网络结构可以增强蛋白质的凝胶强度和机械性能。
2.2.4 TGase改性对小麦蛋白构象的影响
利用傅里叶红外光谱仪对TGase改性后的小麦蛋白做全波段扫描,其酰胺Ⅰ带(1 600~1 700 cm-1)图谱如图7所示。根据蛋白质不同二级结构的红外酰胺带各峰的指认标准,计算出小麦蛋白二级结构的含量比例图,见图8。
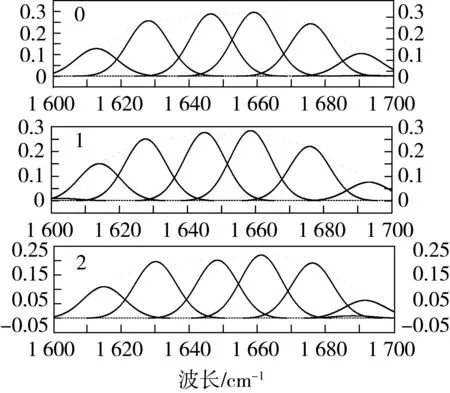
图7 TGase改性后的小麦蛋白的红外光谱图

图8 TGase改性对小麦蛋白二级结构的影响
由图8可知,天然小麦蛋白经TGase改性后,其二级结构为:22.07%α-螺旋、29.49%β-折叠、26.95%β-转角和21.49%无规则卷曲。与天然小麦蛋白比,β-折叠提高了4.8%,无规则卷曲降低了7.2%,可以看出:在所有的样品中,β-折叠和β-转角的含量均高于α-螺旋和无规则卷曲。研究表明β-折叠和β-转角较α-螺旋和无规则卷曲稳定。从能量守恒方面出发,蛋白质总以最低的能量耗损和最低的能量状态以适应周围的溶液环境,最终保持稳定。
3 结论
本试验研究了Na2SO3/超声波、尿素/ Na2SO3/超声波理化复合预处理对小麦蛋白分散性的影响,以及TGase酶改性后对小麦蛋白凝胶强度的影响。结果表明:1)Na2SO3/超声波、尿素/ Na2SO3/超声波复合预处理可以使小麦蛋白化学作用力中氢键作用降低,离子键作用有一定程度增加,疏水相互作用显著增加,游离巯基增加。复合预处理后的小麦蛋白表面结构松散,二级结构中β-折叠的含量降低,无规则卷曲的含量增加。2)理化复合预处理后加入TGase,小麦蛋白的化学作用力中氢键作用增加,离子键作用有一定程度降低,疏水相互作用、游离巯基和二硫键基本不变。TGase改性后的小麦蛋白呈现多孔紧密连接的蛋白质网络结构,且蛋白质簇和孔的大小及分布均匀,二级结构中β-折叠的含量增加,无规则卷曲的含量均降低。3)Na2SO3/超声波、尿素/ Na2SO3/超声波复合预处理的小麦蛋白,与小麦蛋白原样相比,溶解性分别提高325%和437%。经Na2SO3/超声波预处理后的小麦蛋白加入TGase酶后,其凝胶强度达到最高,为344.13g/cm2,与TGase改性的小麦蛋白原样相比提高了134%。
[1]Steertegem B V,Pareyt B, Brijs K, et al. The role of gluten proteins in production and quality of a yeast leavened sugar and fat rich wheat based food model system[J]. Food Research International, 2014, 62: 991-997
[2]张涛, 沐万孟, 江波, 等. 谷氨酰胺转胺酶对豆腐凝胶强度的影响[J]. 现代食品科技, 2007, 23(10): 18-21 Zhang Tao, Mu Wanmeng, Jiang Bo, et al. Effects of transglutaminase on the gel strength of tofu[J]. Modern Food Science and Technology, 2007, 23(10): 18-21
[3]No D S, Zhao T T, Kim Y Yoon, et al. Preparation of highly purified pinolenic acid from pine nut oil using a combination of enzymatic esterification and urea complexation[J]. Food Chemistry, 2015, 170: 386-393
[4]张忠慧,华欲飞. 大豆分离蛋白与低浓度尿素相互作用的红外光谱分析[J]. 大豆科学,2008,27(1):134-136 Zhang Zhonghui, HuaYufei. Study on Infrared spectroscopy in isolated soy protein with low concentrations of urea interaction [J]. Soybean Science, 2008,27(1):134-136
[5]严荣梅,王丹丹,鞠兴荣. 碱性蛋白酶和亚硫酸钠水解菜籽粕蛋白制取菜籽多肽的研究[J]. 中国粮油学报,2010,25(3):45-48 Yan Rongmei, Wang Dandan, Ju Xingrong. Preparation of peptides by hydrolysis of rapeseed meal with Alcalase in presence of sodium sulfite[J]. Journal of the Chinese Cereals and Oils Association, 2010,25,(3):45-48
[6]Xiong Y L, Agyare K K, Addo K Hydrolyzed wheat gluten suppresses transglutaminase-mediated gelation but improves emulsification of pork myofibrillar protein[J]. Meat Science, 2008, 80(2): 535-544
[7]Qu W, Ma H, Liu B ,et al. Enzymolysis reaction kinetics and thermodynamics of defatted wheat germ protein with ultrasonic pretreatment[J]. Ultrasonic Sonochemistry, 2013, 20(6); 1408-1413
[8]Tang C H, Luo L J, Liu F, et al. Transglutaminase-set soy globulin-stabilized emulsion gels: Influence of soy β-conglycinin/glycinin ratio on properties, microstructure and gelling mechanism[J]. Food Research International, 2013, 51(2): 804-812
[9]Jiang J, Xiong Y L. Extreme pH treatments enhance the structure-reinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J]. Meat Science, 2013, 93(3): 469-476
[10]李鑫,赵燕,李建科. 微生物谷氨酰胺转氨酶对小麦粉品质的影响[J].食品科学, 2013, 34(1): 135-139 Li Xin, Zhao Yan, Li Jianke. Influence of microbial transglutaminase on the quality of wheat flour[J]. Food Science, 2013,34(1):135-139
[11]Gómez-Guillén M C, Borderías A J, Montero P. Chemical interactions of nonmuscle proteins in the nerwork of sardine (Sardine pilchardus) muscle gels[J]. Lebensm-Wissu-Technology, 1997, 29: 602-608
[12]Lutz E, Wieser H,Koehler P. Identification of disulfide bonds in wheat gluten proteins by means of mass spectrometry/electron transfer dissociation[J]. Journal of Agriculture and Food Chemistry, 2012, 60(14): 3708-3716[13]Hernández-Muoz P, Villalobos R, Chiralt A. Effect of cross-linking using aldehydes on properties of glutenin-rich films[J]. Food Hydrocolloids, 2004, 18(3): 403-411
[14]Yang C, Wang Y, Vasanthan T, et al. Impacts of pH and heating temperature on formation mechanisms and properties of thermally induced canola protein gels[J]. Food Hydrocolloids, 2014, 40: 225-236.
Effect of Physicochemical Pretreatments on Transglutaminase-Enhanced Gelation of Wheat Gluten
Sun Qiaoqiao Wang Kaiqiang Luo Shuizhong Cai Jing Zhao Yanyan Jiang Shaotong Zheng Zhi
(Key Laboratory for Agriculture Products Processing of Anhui Province; School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009)
The low solubility of wheat gluten in aqueous solution limited the modification efficiency. Some physicochemical pretreatments could improve the solubility and dispersion of wheat gluten, and could effectively promote
the interactions between wheat gluten and TGase. The pretreatments included ultrasound combined with Na2SO3, urea/ Na2SO3. Results indicated that the solubility of wheat gluten were increased 325%and 437% respectively, after the pretreatments of ultrasound combined with Na2SO3, urea/ Na2SO3. After pretreating, the content of the hydrogen bonds were decreased;the content of the ion bonds, the hydrophobic interactions and the sulfhyedryl (SH) group were increased, as well as the content of the random coil. But the content of β-sheet structure was dropped. A loose structure with inhomogeneous clusters and pore sizes composed of small irregular aggregates was observed after the pretreatments. When the TGase was enhanced after the pretreatments, the content of the hydrogen bonds was increased; the content the ion bonds had the opposite result, and the content of the hydrophobic interactions , the sulfhyedryl (SH) group and the disulfide bond were unchanged. The network formed by the wheat gluten was transformed into a dense and homogenous structure after the crosslinking. The content of β-sheet structure were increased, otherwise the content of the random coil were dropped. The gel strength of wheat gluten was 344.13 g/cm2after treatment TGase-enchanced with Na2SO3/ultrasound.
wheat gluten, physicochemical pretreatment, gelation, transglutaminase, structural characteristics
863计划(2013AA102201),安徽省科技攻关项目(1301031031)
2015-11-23
孙撬撬,男,1991年出生,硕士,食品工程
郑志,男,1971出生,教授,农产品加工及贮藏工程研究
TS213
A
1003-0174(2017)06-0015-07
