51种外用药膏说明书标注项情况分析
2017-07-03慈溪市皮肤病医院药剂科浙江慈溪315311
许 雯,陶 靓(慈溪市皮肤病医院药剂科,浙江慈溪 315311)
51种外用药膏说明书标注项情况分析
许 雯*,陶 靓(慈溪市皮肤病医院药剂科,浙江慈溪 315311)
目的:为生产企业合理设计外用药膏说明书提供参考。方法:根据《药品说明书和标签管理规定》和《化学药品和治疗用生物制品说明书规范细则》对药品说明书应标注项目,分析我院2016年1-6月使用的51种外用药膏说明书标注项情况。结果:在51种外用药膏中,国产品种39种,进口品种12种。在39种国产药膏说明书中,标注率较低的项目有药物过量、药动学、使用指导、药理毒理,标注率分别为2.6%、5.1%、15.4%、28.2%,而进口品种的标注率分别为16.7%、83.3%、75.0%、100%。与进口药膏说明书比较,国产药膏说明书标注内容不够详细的项目有成分、用法用量、不良反应、禁忌、注意事项、药物相互作用、特殊人群用药。结论:建议生产企业咨询医药学专家,按照《药品说明书和标签管理规定》要求列出全部辅料,细化和完善用法用量、不良反应、注意事项、特殊人群用药、药理毒理及药物过量等项的标注内容,同时行政主管部门要加强监管审批力度。
外用药膏;药品说明书;标注
药品说明书作为传达自身信息的最直接方式,是广大群众购买、使用药品的依据,错误或者不清晰的信息会导致严重的后果[1]。我院临床调配外用制剂以采购外用药膏及医院自制外用液体制剂为主。临床实践中,大部分患者认为外用药膏安全性比口服制剂、注射剂好,故常根据药膏说明书进行自我治疗。如果药膏说明书不规范、不完整,不能给患者正确的用药指导,就可能对患者造成严重危害。鉴于此,笔者对我院最常用的51种皮肤病外用药膏说明书内容进行整理、分析,以了解我院常用外用药膏说明书标注内容的完整性,为生产企业合理设计外用药膏说明书提供参考。
1 资料与方法
收集2016年1-6月在我院使用的有关皮肤病常用外用药膏说明书共51份,其中国产品种39份,进口品种12份,并以原国家食品药品监督管理局令第24号文件《药品说明书和标签管理规定》(以下简称《规定》)[2]及《化学药品和治疗用生物制品说明书规范细则》(以下简称《细则》)[3]对药品说明书应标注项目进行统计和分析。
2 结果
2.1 药品说明书项目总体标注情况
51种外用药膏说明书具体标注情况见表1。
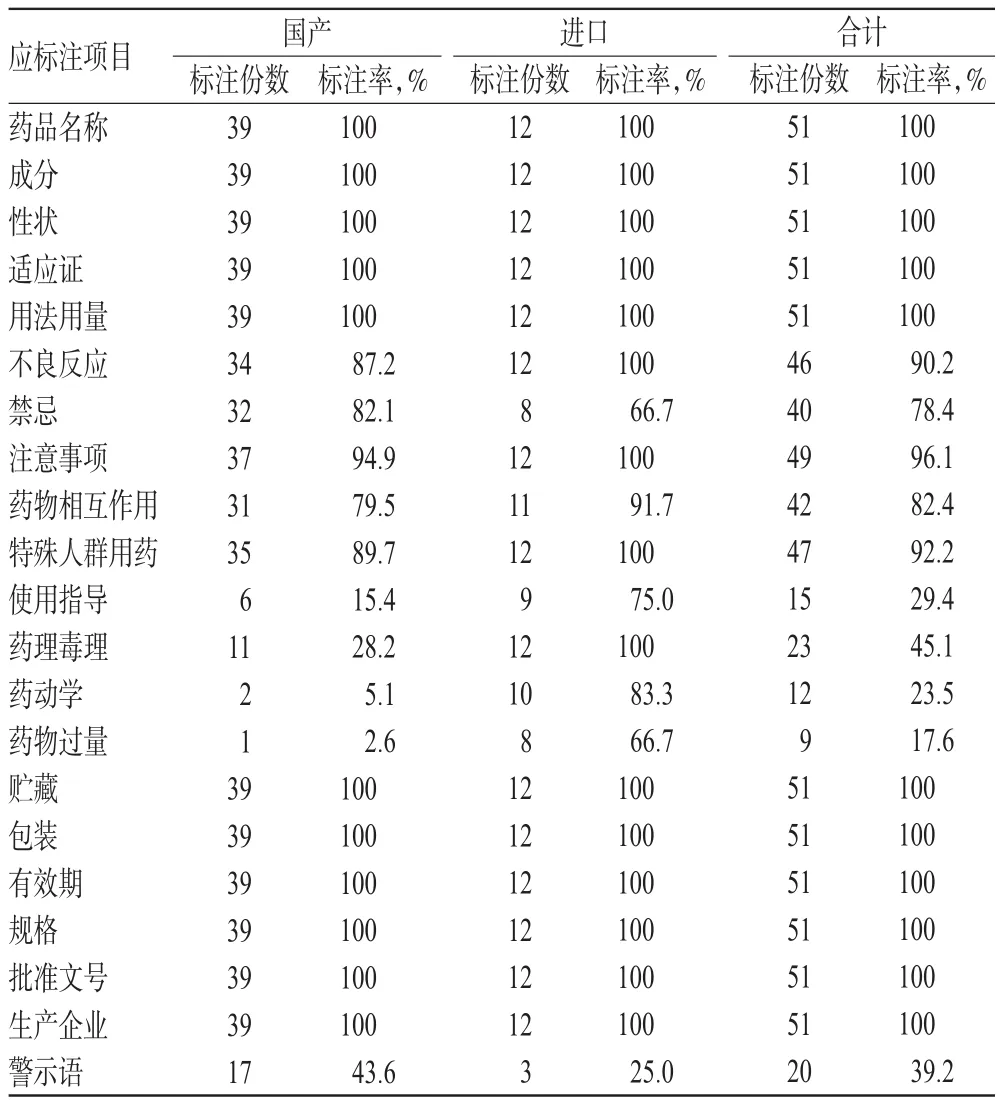
表1 51种外用药膏说明书标注项情况统计Tab 1 M arked item s of package inserts for 51 kinds of ointment for externaluse
由表1可见,标注率较低的项目有使用指导、药动学、药理毒理、药物过量。标注内容不够详细的项目有成分、用法用量、不良反应、禁忌、注意事项、药物相互作用、特殊人群用药。而禁忌、不良反应、用法用量等恰恰是患者阅读药品说明书时最关注的内容[4]。
2.2 药品说明书项目具体标注情况
2.2.1 成分 根据《规定》第一条的要求,药品说明书应列出全部活性成分或组方中的全部中药药味;注射剂和非处方药应列出全部辅料名称;药品处方中含有的成分或辅料,如果可能引起严重不良反应的,应当予以说明[2]。本次调查发现,51份药膏说明书均标注了主要成分,仅45.1%(23/51)标注了辅料,其中国产药膏说明书有16份(41.0%)标注了相关辅料,进口药膏说明书有7份(58.3%)标注了相关辅料。部分说明书在“禁忌”和“注意事项”项又标注“对其中任何一种成分过敏者禁用”。因为辅料标注不全,即使患者知道自己对某物质过敏也不能在说明书中获得信息来避免用药。建议生产企业按照《规定》要求列出全部辅料。
2.2.2 用法用量 用法用量是药品说明书核心部分,直接关系到用药的安全性和有效性。《细则》规定:“每种药品说明书应明确列出用法用量、计量方法、用药次数及疗程极限,特别注意与制剂规格的关系”[3]。本次调查发现,所有药膏说明书均标注了“用法用量”,但是该项标注不详细,没有列出具体给药方式、时间、临床推荐使用的剂量范围、给药时间间隔及疗程,仅用“每日2~3次”或“取适量”含糊的表述。同时,很多患者打开药膏直接用手涂抹,在一定程度上增加了交叉感染的几率。部分皮肤病外用药膏含有激素,不能长期使用,但是说明书并没标注最长使用期限,仅部分标注不适宜长期大面积使用。因用法用量标注的不规范,很容易造成用药过量及超说明书用药现象[5]。建议生产企业按《细则》要求规范和细化用法用量的标注。
2.2.3 不良反应 不良反应是指合格药品在正常用法、用量下出现的与用药目的无关或意外的有害反应。本次调查发现,有46份药膏说明书标注了“不良反应”项,标注率为90.2%,其中国产药膏34份,进口药膏12份。进口药膏说明书对不良反应描述详细,但国产药膏说明书对该项的表述过于简单和不规范,例如“偶见或可见局部过敏(红肿、瘙痒等)”“引起接触性皮炎”“未见相关报道”“尚不明确”等字样表述模糊,根本不能准确描述不良反应的范围和程度,而且仅17.9%(7/39)国产药膏在“注意事项”中简单表述了出现不良反应后如何处理。赵瑞霞等[6]研究发现,药品不良反应相关研究来自医院及药品评价中心较多,因此,生产企业应咨询医药学专家,及时将不良反应在说明书中细致阐述。
2.2.4 禁忌 根据《细则》规定“禁忌”项应当列出禁止应用该药品的人群或者疾病情况[3]。本次调查发现,有40份药膏说明书标注了“禁忌”项,标注率为78.4%,其中国产药膏32份,进口药膏8份。国产和进口药膏说明书对该项标注均不详细。17.9%(7/39)国产、33.3%(4/ 12)进口药膏说明书仅用“未发现或未进行相关报道”简单描述,表述最多为“某些疾病或症状、任何一种成分过敏忌用”,既没有提到禁止使用的人群,也没有提到具体的疾病或症状,同时“成分”项下也没有列出具体的原辅料,导致说明书前后内容不能衔接。生产企业应进一步完善该项内容标注,清楚表述并做到前后一致。
2.2.5 注意事项 药品说明书注意事项是临床用药的关键。注意事项内容包括影响疗效的因素(食物、烟、酒、病史),需要慎用的情况(肝肾功能不全者),用药过程中应进行的观察(变态反应、定期查血象)以及用药对临床的影响等[7]。调查发现,有49份药膏说明书标注了“注意事项”项。相比进口药膏,国产药膏说明书此项归类较为混乱,部分药膏说明书将不良反应、禁忌、特殊人群用药及药物相互作用等内容写在该项下,没有单列一项或缺项。即使有该项内容,但其表述也较为简单,例如“局部不适或过敏者勿用或停用”“不宜长期大面积使用”“避免接触眼睛”等,并没有详述临床表现、严重后果及处理办法。建议行政主管部门加强监管力度,规范该项内容标注。
2.2.6 药物相互作用 药物相互作用是指患者在使用一种药物同时或在一定时间内先后使用另一种药物、食品添加剂出现的复合效应,其既可能使其疗效提高或毒性加大,也可能使疗效降低或毒性减轻[8]。本次调查发现,有42份的药膏说明书标注了“药物相互作用”项,标注率为82.4%,其中国产药膏31份,进口药膏11份。进口药膏说明书该项内容较为详细,而国产药膏说明书该项非常简单,基本使用“尚不确定”字样描述。在临床治疗中,通常需要多种药物联合治疗,药物相互作用信息不仅可以指导临床合理正确联合用药而起到关键作用,而且在一定程度上也可预防药物不良事件的发生。建议生产企业尽可能地完善该项内容标注,减少因该项缺失或阐述不清给临床用药带来的困难。
2.2.7 特殊人群用药 特殊人群包括儿童、老人、孕妇及哺乳期妇女。儿童各器官生理功能尚未成熟,免疫功能低下,对体内药物的清除能力差,且对药品的敏感性较高,极易发生不良反应[9]。老年人由于器官功能的减退,可影响药物的代谢,故用药时须多加注意[10]。孕妇及哺乳期妇女在妊娠期和哺乳期新陈代谢发生改变从而影响药动学,药动学的改变直接影响到胎儿,严重则影响胎儿正常生长发育[11]。所以,药品说明书应对特殊人群用药情况进行明确标注。本次调查发现,12份进口药膏说明书都标注了特殊人群用药情况,且均作了较为细致的解释。国产药膏说明书89.7%(35/39)标注了特殊人群用药,但仅2份有细致解释,大部分使用“忌用”“慎用”“禁用”“遵医嘱”等简单字样,根本无法达到指导特殊人群合理用药的目的。同时,部分说明书将特殊人群用药标注在“注意事项”下。建议生产企业尽可能细致地标注该项内容。
2.2.8 药理毒理 药理毒理包括药理作用和非临床毒理研究两部分。药理作用是临床药理和药物对人体作用的相关信息,是医患了解药物特性、正确使用药品的准确的科学依据;临床非毒理研究包括致癌性、致畸性、致突变、长期毒性、急性毒性等内容,研究结果由动物实验获得;毒理是标示该药品对哪些细菌、病毒有明显效果,明确指导合理用药,在使用时可能有哪些不良反应,有助于判断药物临床应用的安全性[12]。本次调查发现,进口药膏说明书该项标注相对详细,其中药理作用机制进口药膏说明书全部标注,而国产药膏说明书仅有28.2%标注;临床非毒理研究中动物实验和药敏试验内容上,进口药膏说明书有58.3%、41.7%,国产药膏说明书有5.1%、7.7%进行了标注;毒理说明内容上,进口药膏说明书有66.7%,国产药膏说明书有7.7%进行了标注。该项标注内容对医师和患者选择药物有很大指导意义,生产企业应联系和咨询有实力的医院或科研机构获取相关信息,尽可能地完善该项内容标注。
2.2.9 药物过量 《细则》规定“药物过量”应详细列出过量应用该药品可能发生的毒性反应、剂量及处理方法;未进行该项实验且无可靠参考文献的,应当在该项下予以说明[3]。本次调查发现,该项标注率最低,其中进口药膏8份(66.7%)标注了药物过量,国产药膏只有1份(2.6%)标注药物过量。特别是国产药膏说明书对药物过量的症状及补救办法涉及太少。婴幼儿的皮肤又薄又嫩,血管丰富,若经皮给药,药物极易吸收,如果大面积过量使用极易影响婴幼儿的生长发育。因此,生产企业应加强此项内容的说明,在药膏说明书中标明药物过量的症状、急救措施等内容。
3 讨论
通过本次调查可知,在药物相互作用、特殊人群用药、药理毒理及药物过量等方面进口药膏说明书标注相对全面,优于国产药膏说明书;单一项目所提供的信息有限,归类也相对混乱,特别是国产药膏说明书在成分、用法用量、不良反应、禁忌、注意事项、药物相互作用、特殊人群用药、药理毒理、药物过量内容不够详细,影响了患者及医务人员对说明书的理解,直接影响药物的疗效及安全性。建议生产企业咨询医药学专家,按照《规定》要求列出全部辅料,细化和完善用法用量、不良反应、注意事项、特殊人群用药、药理毒理及药物过量等项的标注内容;同时,行政主管部门也应加强监管审批力度,严格考核药品说明书上的每一个信息。
[1] 张璐,张伏.目前药品标签和说明书存在的不足及对策[J].中国药业,2013,22(20):7-8.
[2] 国家食品药品监督管理局.药品说明书和标签管理规定[S].2006-03-15.
[3] 国家食品药品监督管理局.关于印发化学药品和治疗用生物制品说明书规范细则的通知[S].2006-05-10.
[4] 于美玲,徐建国,于欣,等.消费者对药品说明书及合理用药认知度的调查[J].中国药房,2011,22(36):3376-3379.
[5] 陈永法,黄丽.我国超说明书用药现象探析[J].中国药房,2013,24(13):1162-1164.
[6] 赵瑞霞,王慧玲,赵丽玲,等.2005-2014年我国基本药物不良反应文献计量学分析[J].中国药房,2016,27(9):1156-1160.
[7] 陈丽,李惠萍.药品说明书存在的问题及分析[J].华夏医学,2006,19(6):1186-1189.
[8] 萧惠来.FDA对药物相互作用研究及其说明书该项的建议[J].药物评价研究,2013,36(1):1-4.
[9] 褚淑贞,李胤飞.我国儿童基本药物制度建立落实中的障碍初探[J].首都医药,2014(4):12-14.
[10] 芦小燕,陈维,龚燕波,等.超说明书用药对高龄患者药品不良反应的影响[J].中国现代应用药学,2014,31(8):1010-1013.
[11] 崔媛,秦耿.特殊人群用药指导及相关调查分析[J].西部中医药,2014,27(2):88-90.
[12] 薛松,吴高蕾,孙显峰,等.药品说明书存在的问题及调查分析[J].中国医药导报,2011,8(18):156-158.
(编辑:余庆华)
Analysis of Labeled Item s in Package Inserts of 51 K inds of Ointment for External Use
XUWen,TAO Liang(Dept.of Pharmacy,Dermatology Hospital of Cixi City,Zhejiang Cixi315311,China)
OBJECTIVE:To provide reference for reasonably designing package inserts of ointment formanufacturers.METHODS:According to items included in Management Regulation for Package Insert and Label and Specification for Chemicals and Biological Products for Treatment,labeled items in package inserts of 51 kinds of ointment for external use during Jan.-Jun.2016 in our hospital were analyzed.RESULTS:Among the 51 kinds of ointment,39 were domestic varieties and 12 were imported varieties.In the package inserts of 39 domestic varieties,items w ith lower labeling rates were overdose,pharmacokinetics,use guidance,pharmacology and toxicology,w ith labeling rates of 2.6%,5.1%,15.4%,28.2%;while the labeling rates of imported varieties were 16.7%,83.3%,75.0%,100%.Compared w ith package inserts of imported ointment,composition,dosage and usage,adverse reactions,contraindications,precautions,drug interactions,medication for special populations were not enough detailed in domestic ointments.CONCLUSIONS:It is suggested that manufacturers consult medicine experts,list all auxiliary materials through Management Regulation for Drug Description and Label,refine and improve the labeling contents of dosage and usage,adverse reactions,precautions,medication for special populations,pharmacology and toxicology,overdose,etc.In addition,administrative departments should strengthen the regulatory approval efforts.
Ointment for external use;Package insert;Labeling
R95
A
1001-0408(2017)16-2286-03
2016-08-13
2016-10-27)
*副主任药师。研究方向:医院药学。电话:0574-58963801。E-mail:330265092@qq.com
DOI10.6039/j.issn.1001-0408.2017.16.35
