全自动固相萃取-高效液相色谱法测定花生油中黄曲霉毒素B1
2017-06-27刘兰周培华
刘兰,周培华
(广西壮族自治区玉林食品药品检验所,广西玉林537000)
全自动固相萃取-高效液相色谱法测定花生油中黄曲霉毒素B1
刘兰,周培华
(广西壮族自治区玉林食品药品检验所,广西玉林537000)
目的建立花生油中黄曲霉毒素B1的快速准确检测方法。方法以四通道全自动固相萃取仪(Automated Solid Phase Extraction Apparatus,ASPEA)对样品提取液进行自动净化,再通过高效液相色谱(High Performance Liquid Chromatography,HPLC)带荧光检测器,联合柱后衍生仪对花生油样品中所含有黄曲霉毒素B1(Aflatoxin B1,AFB1)进行测定。结果显示黄曲霉毒素B1的工作曲线为:Y=531.92X-387.02;r=0.9991。方法的重复性RSD=2.18%;方法精密性RSD=1.58%。测定样品黄曲霉毒素B1含量浓度为1.632μg/kg~81.6μg/kg;加标回收率为90.3%~110.8%。结论所建立方法快速灵敏,绿色环保,9min完成分析,适合多批次食品中黄曲霉毒素B1的快速准确检测。
全自动固相萃取仪;黄曲霉毒素B1;重复性;精密度;回收率
黄曲霉毒素为真菌黄曲霉菌和寄生曲霉的次级代谢产物,其毒性在所有真菌毒素和化学毒物中为最强,是世界公认的分布最广,危害最大的一类毒素,可分为B1,B2,G1,G2和M1等18种,其中B1的毒性最强,是目前已知的毒性最强的致癌物,属Ⅰ类致癌物[1,2]。对人体肝脏细胞有损害作用,可诱发肝癌的发生[3,4]。通过随机抽样及试验检测,发现黄曲霉毒素B1易存在于霉变的坚果、粮油中,如花生、玉米及其制品花生油、玉米粉,偶见于陈皮,少见于大米、米粉、腐竹等食品中。黄曲霉毒素B1的检测方法包括薄层色谱法[2]、酶联免疫吸附法[1,2,5]、高效液相色谱法[6,7]、高效液相色谱串联质谱法[8-10]、以及基于核酸荧光的先进测定方法[11,12]。本文改进了高效液相色谱带荧光检测器及柱后衍生仪对黄曲霉毒素B1的含量进行测定的方法[13],采用了全自动固相萃取装置对样品提取液通过免疫亲和柱的自动净化。国家标准对食品中黄曲霉毒素B1的含量限度大多在5~20μg/kg[14]。随着新的食品安全法的颁布实施,对食品安全要求更加严格,国家对食品安全的监管力度加强,抽检范围覆盖广,抽检批数多,准确和快速的测定方法是必须的。当然随着科技的发展,国内近年来也涌现出一些控制产品中黄曲霉毒素的含量和对食品中存在的黄曲霉毒素的降解方面的相关研究[15,16]。本实验通过试验建立对花生油中黄曲霉毒素B1的含量进行了测定的快速,高效,准确的方法。
1 材料与方法
1.1 试剂与材料黄曲霉毒素B1对照品为国家粮食局科学研究院,批号:GBW(E)090015a,浓度为1.02μg/ml;固相萃取免疫亲和柱Beacon公司,规格为300ng,3ml;色谱纯甲醇Thermo Scientific;水为超纯水,其它试剂均为分析纯。
1.2 仪器与设备ML3002电子天平METTLER TOLEDO;GX-274 ASPEC四通道全自动固相萃取仪GILSON;U3000高效液相色谱仪Thermo Scientific;柱后衍生仪Pickering Pinnacle;超纯水系统Millipore Synergy;VXR B S25基本型振荡器IKA;G560E漩涡震荡仪。
1.3 样品花生油(散装和预包装)样品来自玉林、贵港市区及辖区各县。
1.4 方法
1.4.1 色谱条件高效液相色谱仪:Thermo C18反相色谱柱(4.6mm×250mm,5μm),流动相配比为甲醇:水=55:45,流速为0.8ml/min,柱温为30℃;荧光检测器激发波长为360nm,发射波长为450nm;进样量为10μl。
柱后衍生仪:碘液浓度为0.05%,流速为0.2ml/min,衍生反应温度为70℃。
1.4.2 对照品溶液制备精密吸取黄曲霉毒素B1对照品溶液1ml置25ml容量瓶,用甲醇稀释定容到刻度,摇匀,即得储备液为40.8ng/ml。再分别精密吸取不同体积到10容量瓶,用甲醇稀释定容到刻度,摇匀,得到系列浓度为0.408ng/ml到40.8ng/ ml的标准工作溶液。检出限浓度为0.408ng/ml,折算为S/N=3时,方法实际检出限为0.2μg/kg,标准检出限为1μg/kg。
1.4.3 供试品溶液制备样品经过260r/min回旋振荡器振摇30min混匀,再取样。准确称取经上述方法处理样品25.00g至250ml具塞锥形瓶中,加入氯化钠5.00g,再准确加入甲醇:水(7:3)125.0ml,经过260r/min回旋振荡器振摇提取35min,定量滤纸过滤,弃去初滤液,准确移取续滤液15.0ml到50ml离心管中,加入30.0ml水稀释,摇匀,即得。
1.4.4 供试品溶液净化制备好的供试品溶液经过全自动固相萃取装置按表1的条件,按上样、淋洗杂质、洗脱顺序净化后,2ml洗脱液收集于2ml容量瓶,经过涡旋混匀后,再通过0.45μm的尼龙滤膜过滤,收集续滤液于进样小瓶,以备高效液相色谱仪分析。净化过程中的淋洗液为水,洗脱液为甲醇。

表1 全自动固相萃取仪萃取条件
2 结果
2.1 方法学
2.1.1 精密度取浓度为0.816ng/ml对照品溶液连续进样6次,黄曲霉毒素B1衍生后色谱峰保留时间RSD=0.75%及色谱峰响应值按峰面积计算RSD=1.58%。数据显示仪器的精密度良好。
2.1.2 重复性在检出黄曲霉毒素B1的花生油样品中,选取同一批次的样品,取6份平行样,经过提取,再经过自动固相萃取,净化后的黄曲霉毒素B1衍生色谱峰保留时间RSD=1.03%及色谱峰响应值按峰面积计算RSD=2.18%。数据显示样品按本实验条件处理重复性良好。
2.1.3 回收实验在花生油的检测中,黄曲霉毒素B1国家标准规定最高残留限量(MRL)为20μg/kg[14]。选择最低定量限,合适含量点,最高残留限量3点,对应质量浓度分别为0.816ng/ml,4.08ng/ml, 10.2ng/ml做回收试验,各取两份样加标。取样量为25.00g,稀释倍数为50倍。试验结果见表2显示回收率范围为90.3%~110.8%。表明试验方法可行性良好。
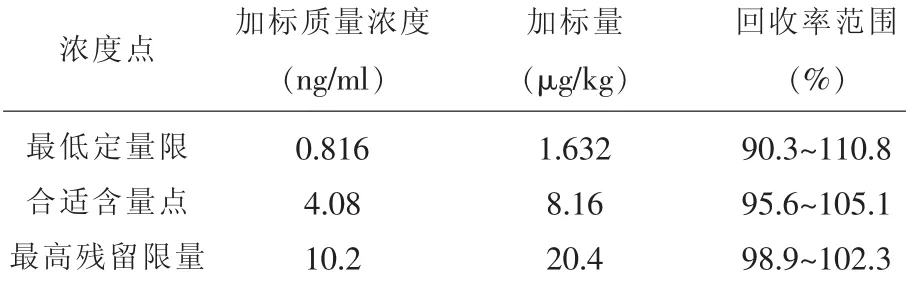
表2 回收率
2.2 样品测定结果对所抽取的花生油205批次的样品测定结果(见表3)进行统计,发现检出批次及超过国家标准限度[14]的批次占所检验样品的比率还是比较低,检测超限的样品主要来源于少数小作坊的自制压榨散装花生油。产生原因由于南方潮湿气候导致原料发霉,以及压榨器具长期使用没有清洗。

表3 样品测定结果
3 讨论
3.1 流动相本实验所用流动相为甲醇:水=55:45,流速为0.8ml/min,黄曲霉毒素B1保留时间为9min,且黄曲霉毒素G2、G1、B2、B1之间达到所需分离度要求,主要是B1与相邻的B2分离度达到要求(图1、图2)。在大批量检测的时候,可以大量节约时间,保证结果的准确和及时性。
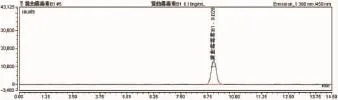
图1 黄曲霉毒素B1液相色谱图
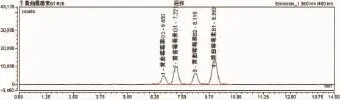
图2 黄曲霉毒素G2、G1、B2、B1液相色谱图
3.2 检测波长在GB/T 17909-2003中选择荧光检测器具有激发波长为360nm,发射波长为420nm以上;在《中国药典》中黄曲霉毒素检测中选择激发波长为360nm,发射波长为450nm,通过实验,发射波长对测定结果数据影响不大。
3.3 实验创新首先对照品溶液的配置及洗脱液选择以甲醇代替苯乙腈,减少了对实验人员的危害,净化过程选择全自动固相萃取装置,可以提高效率,同时也减少试剂对实验人员的危害。最后,在得到的流动相配比条件下黄曲霉毒素B1的保留时间为9min,可以快速准确测定样品中黄曲霉毒素B1的含量。
最后,通过对多批次的花生油中黄曲霉毒素B1的测定,及结果数据分析,黄曲霉毒素B1的检出率及不合格率是相对较低的,对于大多数市场生产和流通的花生油,可以放心食用,不必要对花生油中存在黄曲霉毒素B1产生恐慌。同时花生油的生产厂家应该做好花生油原材料的选择、保存和压榨器皿的卫生清洁工作。
[1]徐州,谭书明,焦彦朝,等.酶联免疫法测定干辣椒中的黄曲霉毒素B1[J].食品科学,2009,30(10):245-247.
[2]李万福,李一聪.花生油黄曲霉毒素B1的危害及其检测的研究进展[J].四川农业科技,2015,3:35-36.
[3]方宁烨,刘丹丹,肖德强,等.黄曲霉毒素B1至体外人胚肝细胞损伤的研究[J].广西医学,2015,37(3):300-301,316.
[4]苏浩.广西原发性肝细胞癌黄曲霉毒素B1-DNA加合物水平及生物转化酶CYP3A4的表达分析[D].南宁:广西医科大学,2009:9-41.
[5]韩春卉,江涛,李燕俊,等.黄曲霉毒素B1酶联免疫试剂盒稳定性研究[J].食品科学,2013,34(14):315-318.
[6]谢昕,李红艳.免疫亲和柱净化-光化学柱后衍生-高效液相色谱法测定柏子仁中的黄曲霉毒素[J].理化检验-化学分册,2016,52(5):541-544.
[7]郭爱华,王玮,李小丽.柱前衍生-高效液相色谱法测定茶叶中的黄曲霉毒素B1[J].理化检验-化学分册,2014,50(9):1124-1126.
[8]王浩,杨红梅,郭启雷,等.高效液相色谱-串联质谱法同时测定植物油中苯并芘与黄曲霉毒素B1,B2,G1,G2[J].分析测试学报,2014,33(8):911-916.
[9]Al-Taher F,Cappozzo J,Zweigenbaum J,et al.Detection and quantitation of mycotoxins in infant cereals in the U.S.market by LCMS/MS using a stable isotope dilution assay[J].Food Control,2017,72:27-35.
[10]Shao D,Imerman P,Schrunk D,et al.Intralaboratory development and evaluation of a high-performance liquid chromatography-fluorescence method fordetection and quantitation of aflatoxins M1,B1,B2,G1,and G2 in animal liver[J].Full Scientific Report,2016,28(6):646-655.
[11]Chen L,Wen F,Li M,et al.A simple aptamer-based fluorescent assay for the detection of Aflatoxin B1 in infant rice cereal[J]. Food Chemistry,2017,215:377-382.
[12]Sun C,Li H,Koidis A,et al.Quantifying Aflatoxin B1 in peanut oil using fabricating fluorescence probes based on upconversion nanoparticles[J].Spectrochimica Acta,2016,165:120-126.
[13]全国食品工业标准化技术委员会,食品中黄曲霉毒素的测定免疫亲和层析净化高效液相色谱法和荧光光度法:GB/T 18979-2003[S].北京:国家质量监督检验检疫总局,2003:1-4.
[14]全国食品工业标准化技术委员会,食品安全国家标准食品中真菌毒素限量:GB 2761-2011[S].北京:中华人民共和国卫生部,2011:1-2.
[15]李俊霞,梁志宏,关舒,等.黄曲霉毒素B1降解菌株的筛选及鉴定[J].中国农业科学,2008,41(5):1459-1463.
[16]李超波.黄曲霉毒素B1降解菌的分离鉴定及其降解特性[J].南昌大学,2012,52(9):1129-1136.
Determination of Aflatoxin B1 in Peanut Oil by High Performance Liquid Chromatography With Automated Solid Phase Extraction Apparatus
LIU Lan,ZHOU Peihua.
Yulin Institute for Food and Drug Contorl,Yulin Guangxi 537000,China.
Objective To establish a rapid and accurate method for detection of aflatoxin B1 in peanut oil.Methods This paper mainly introduces purifying aflatoxin B1 in the samples with the ASPEA(automated solid phase extraction apparatus).Then,test AFB1 with HPLC(high performance liquid chromatography),the detector of HPLC is fluorescence detector which is linked with a post column derivatization which was installed before the detector.Results The results show the working curve of this experiment was as follows:Y=531.92x-387.02;r=0.9991.The repeatability and the precision expressed as RSD values were 2.18%and 1.58%.The concentration of AFB1 in the samples was range from 1.632μg/kg to 81.6μg/kg;rates of recovery were in the range of 90.3%to 110.8%for AFB1 in food.Conclusions This method can complete analysis within 9 min,and is suitable for fast,accurate and environmental friendly determination of AFB1 in multi-batch food.
∶Automated solid phase extraction;Aflatoxin B1;Repeatability;Precision;Rate of recovery
R155.5,TS207.3
A
1674-1129(2017)03-0312-03
2017-02-15;
2017-04-28)
10.3969/j.issn.1674-1129.2017.03.006
刘兰,女,1986年生,工程师,工学硕士,主要从事食品药品检验研究分析。E-mail:ll43091003@126.com
