右美托咪定对缺血缺氧性脑损伤新生大鼠的神经保护作用及机制
2017-06-15姜卫荣蒋士新孙永梅
姜卫荣 蒋士新 孙永梅
(山东省医学科学院附属医院麻醉科,山东 济南 250031)
右美托咪定对缺血缺氧性脑损伤新生大鼠的神经保护作用及机制
姜卫荣 蒋士新1孙永梅2
(山东省医学科学院附属医院麻醉科,山东 济南 250031)
目的 探讨右美托咪定(DEX)对缺血缺氧性脑损伤(HIBD)新生大鼠神经功能的影响。方法 36只健康雄性SD大鼠,按照随机数字法分为假手术组(S组)、模型组(M组)和DEX组(D组),每组12只。D组大鼠腹腔注射100 μg/kg盐酸右美托咪定注射液,而S组和M组大鼠按照相同的剂量注射等量的生理盐水。每组随机取8只大鼠进行神经功能缺损程度评分(NDS),应用酶联免疫吸附测定法检测脑组织匀浆液中的炎症因子白细胞介素(IL)-6、IL-8、IL-10和肿瘤坏死因子(TNF)-α,采用分光光度法测量谷氨酸(Glu)和γ-氨基丁酸(GABA)水平,采用氯化三苯基四氮唑(TTC)染色法计算大脑的梗死体积和脑梗死体积百分比。结果 与S组相比,M组和D组NDS评分及脑梗死相关指标均明显升高,且D组各指标明显低于M组(P<0.05);M组和D组脑组织匀浆中IL-6、IL-8和TNF-α水平明显高于S组,而IL-10水平显著低于S组,且D组炎症因子水平改善情况明显优于M组(P<0.05);与D组相比,其他两组Glu水平明显升高,而GABA水平显著下降,另外,与M组相比,D组脑组织中氨基酸水平的改善情况更明显(均P<0.05)。结论 DEX可以改善HIBD新生大鼠的神经功能,减少脑梗体积和脑梗死体积百分比,降低脑组织中的炎症因子和兴奋性氨基酸的水平,从而发挥神经保护功能,为临床用药提供理论依据。
右美托咪定;缺血缺氧性脑损伤;神经保护
大脑对缺血和缺氧最敏感。一旦出现缺血缺氧损伤,可能会导致脑神经功能受到损伤,且损伤不可逆,甚至导致死亡〔1〕。缺血缺氧性脑损伤(HIBD)发病率高,尤其是多发于新生儿的缺血缺氧性脑病(HIE)〔2〕。HIE发病过程中释放大量的兴奋性氨基酸、炎症因子参与神经功能损伤的过程,从而诱发一系列的脑功能障碍疾病〔3〕。右美托咪定(DEX)是美托咪定的右旋异构体,对于α2肾上腺素受体具有较高的选择性激活能力,并作用于哺乳动物的大脑组织,虽然其作为可乐定的同类药物,但是其活性是可乐定的8倍,可以在极低浓度下产生作用〔1〕。另外研究发现DEX还是一种麻醉药,通过激活突触后膜的α2肾上腺素受体,从而产生交感神经阻滞和镇静镇痛的作用〔4〕。本文旨在探讨DEX对HIBD新生大鼠神经功能的影响。
1 材料与方法
1.1 实验动物 清洁级健康雄性SD大鼠36只,7日龄,体重13~15 g,由华中科技大学动物同济医学院实验动物中心提供,所有大鼠均于清洁级饲养室内适应性饲养1 w,自由饮食,温度控制在(25±2)℃,相对湿度为40%~60%,自由饮食,每隔8 h进行通风换气,自然光照。按照随机数表法将分为假手术组(S组)、模型组(M组)和DEX组(D组),每组12只。
1.2 方法
1.2.1 建模 所有大鼠均采用无水乙醚麻醉,S组大鼠仅分离左侧颈总动脉,并不进行结扎和缺氧处理,而M组和D组大鼠均按照樊书娟等〔5〕描述的方法建立HIBD动物模型:在大鼠的颈部正中做1个约1 cm的切口,使用手术镊子分离出左侧颈总动脉,随后使用手术线结扎,之后逐层缝合颈部切口,半个小时后将大鼠置于37℃恒温缺氧仓中,缺氧仓中的气体组成为92%的氮气和8%的氧气,气体流量为2 L/min,2 h后将大鼠取出。D组大鼠于造模成功后腹腔注射盐酸右美托咪定注射液(江苏恒瑞医药股份有限公司,生产批号:20150705,规格200 μg/2 ml),100 μg/kg,S组和M组大鼠按照相同的剂量注射等量的生理盐水。
1.2.2 取材 缺氧24 h后,给每组存活的大鼠腹腔注射10%水合氯醛(400 mg/kg),完全麻醉后,断头处死,开颅取出左侧脑组织,用预冷的磷酸盐缓冲液(PBS)清洗表面,滤纸吸干后称重,剪碎,加入9 ml/g PBS后高速匀浆,5 000 r/min离心10 min,吸取上清液,并用生理盐水稀释。
1.3 观察指标 每组随机取8只大鼠于取材前进行神经功能缺损程度评分(NDS),评分标准参考Bederson等〔6〕的方法:0分,无神经缺损症状;1分,左前肢不能内向屈曲;2分,向左旋转或左侧行走;3分,追尾状向左转圈。应用酶联免疫吸附测定法,严格按照说明书检测炎症因子白细胞介素(IL)-6、IL-8、IL-10和肿瘤坏死因子(TNF)-α。采用分光光度法测量谷氨酸(Glu)和γ-氨基丁酸(GABA)水平。
采用氯化三苯基四氮唑(TTC)染色法计算大脑的梗死面积:断头处死大鼠后,摘除小脑及脑干,置于-20℃冰箱中冷冻10 min后,将脑组织切成厚度为2 mm的脑片,并置于新配制的2%TTC溶液中,在37℃水浴中,避光孵育30 min,完全显色后置于10%甲醛中至少固定24 h,保存于黑暗处。正常组织经过TTC染色后呈现红色,梗死组织呈现白色。对固定好的脑片拍照后输入计算机,应用IBAS 2.7型全自动图像分析系统分析图像,脑梗死体积的近似值=脑片缺血面积×厚度,脑梗死面积百分比=(脑梗死体积/脑组织体积)×100%。
1.4 统计学方法 应用SPSS19.0软件进行方差分析、t检验和χ2检验。
2 结 果
2.1 3组NDS评分及脑梗死相关指标对比 3组NDS评分、脑梗死体积及梗死面积百分比差异有统计学意义(P<0.05)。与S组相比,M组和D组NDS评分及脑梗死相关指标均明显升高,D组各指标明显低于M组(均P<0.05)。见表1。
2.2 3组炎症因子水平比较 3组炎症因子水平差异有统计学意义(P<0.05)。M组和D组IL-6、IL-8和TNF-α水平明显高于S组,而IL-10水平显著低于S组,D组炎症因子水平改善情况明显优于M组(均P<0.05)。见表2。
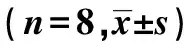
表1 3组NDS评分及脑梗死相关指标对比
与S组比较:1)P<0.05;与M组比较:2)P<0.05;下表同
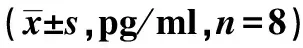
表2 3组炎症因子水平比较
2.3 3组Glu和GABA水平比较 3组Glu和GABA水平差异有统计学意义(P<0.05)。与S组相比,M组和D组Glu水平明显升高,而GABA水平显著下降,与M组相比,D组氨基酸水平的改善情况更明显(均P<0.05)。见表3。

表3 3组Glu和GABA水平比较
3 讨 论
脑部出现缺血缺氧是一个复杂的病理过程,如果不能进行及时治疗,可能会导致脑损伤加重。目前临床疗效突出的药物主要为DEX,于2009年引入我国,具有镇静、抗焦虑和稳定血流动力学等作用,并且通过动物实验和临床研究证实其对HIBD具有良好的临床疗效〔7〕。DEX的作用部位为中枢的α2-肾上腺素受体而发挥作用,同时α2受体亲和力是α1的1 640倍,其药效是可乐定的8倍〔8〕。发挥神经保护作用机制可以多方面的〔9,10〕:①抑制儿茶酚胺的释放;②营养神经元并抑制神经元凋亡;③抗氧化作用;④降低炎症因子水平;⑤减少脑内兴奋性神经递质的释放。
在脑部缺血缺氧发生的过程中往往会引起运动、认知等方面的损伤,因此需要通过Bederson法对肢体神经功能障碍进行评分,并对其严重程度进行分析,而脑部梗死体积可以用于评价脑缺血缺氧程度,此次研究中采用TTC染色法对脑部梗死区域进行检测,并采用专业的图像分析软件分析,可以最大限度地保证图片的客观性,并降低实验误差〔11〕。本研究结果提示DEX可以改善HIBD新生大鼠的神经缺损功能,并减少脑梗死面积,主要是由于DEX可以通过激活α2-肾上腺素受体,抑制腺苷酸环化酶的活化,提高磷酸化的黏着斑激酶含量,从而发挥神经保护作用,另外DEX还可以减少胞内钙离子内流,从而减少脑梗死面积,继而发挥大脑保护作用〔4〕。
脑组织出现缺血缺氧时能够产生大量损伤因子,诱发脑水肿,进而弱化血脑屏障功能,加速炎症因子进入脑组织的进程,加剧对脑部的损伤〔12〕。其中IL-6是脑部缺血缺氧过程产生的重要炎症因子之一,能够诱发脑部炎性损伤;IL-10作为一种抗感染因子,可以在脑缺血损伤过程中发挥抗感染、抗氧化等多种脑保护作用,并能降低TNF-α的分泌;TNF-α是一种前炎症因子,主要来源于活化的小胶质细胞,作为炎症反应的触发因子可促进脑组织的神经病变。IL-8主要发挥炎症趋化作用,通过激活脑部中性粒细胞释放大量的氧自由基,加重脑部区域的损伤〔13〕。本研究结果提示DEX可以改善HIBD新生大鼠的炎症状态,主要是由于DEX通过抑制中性粒细胞的浸润和活化,加速其凋亡,从而抑制炎症反应〔12〕。另外,DEX能够激活胆碱能神经通路和抑制交感神经而起到抗感染的作用〔8〕。
氨基酸作为中枢神经系统的主要神经递质,可以分为兴奋性氨基酸和抑制性氨基酸,兴奋性氨基酸主要为Glu,可以参与兴奋性传导,同时也可以引起兴奋性中毒,机体处于正常状态时,Glu多存在于细胞内,远高于细胞外的含量〔7〕。而GABA主要分布在黑质和苍白球中,同时还分布在海马或小脑皮质中,作为一种抑制性氨基酸,可以阻断Glu的兴奋性。本研究结果表明,DEX可以通过抑制电压门控件钙离子通道而抑制Glu的释放,或者是选择性作用于星型胶质细胞上的α2受体,加速星型胶质细胞对Glu的摄取和降解。但是DEX升高GABA的作用机制尚未明确,有待于进一步研究。
1 侯冠峰.不同剂量右美托咪定对大鼠脑缺血再灌注损伤的影响〔D〕.合肥:安徽医科大学,2013.
2 赵 彬,程江霞,胡锦涛,等.右美托咪定联合浅低温对脑缺血损伤大鼠神经保护作用中炎症因子的影响〔J〕.武汉大学学报(医学版),2013;34(5):654-6.
3 Zalewska T,Jaworska J,Ziemka-Nalecz M.Current and experimental pharmacological approaches in neonatal hypoxic-ischemic encephalopathy〔J〕.Curr Pharm Des,2015;21(11):1433-9.
4 崔 敏,叶 红,孟丽巍,等.右美托咪定在血管外科介入手术麻醉中的应用〔J〕.现代生物医学进展,2015;15(23):4487-9.
5 樊书娟,余 玲,艾 婷,等.缺血后处理对新生大鼠缺氧缺血性脑损伤的影响〔J〕.中国新生儿科杂志,2015;30(2):132-7.
6 Bederson JB,Pitts LH,Tsuji M,etal.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination〔J〕.Stroke,1986;17(3):472-6.
7 贾建丽,蔡劲松,戚 翔,等.右美托咪定预先给药对大鼠全脑缺血再灌注损伤的影响〔J〕.河北医药,2015;37(17):2565-9.
8 刘晓云.盐酸右美托咪定对颅内手术患者的脑保护作用〔D〕.唐山:河北联合大学,2015.
9 陈丽娇,薛庆生,于布为,等.右美托咪定的神经保护作用及其相关机制〔J〕.中国药理学通报,2015;31(11):1493-5,1496.
10 李志鹏,王 飞.右美托咪啶对脑神经保护机制的研究进展〔J〕.医学综述,2014;20(21):3947-9.
11 顾 琴.右美托咪定改善大鼠局灶性脑缺血再灌注损伤的实验研究〔D〕.苏州:苏州大学,2014.
12 李 霞,程江霞,鲍 磊,等.右美托咪定对缺血缺氧性脑损伤新生大鼠脑组织中TNF-α、IL-1β、NGF、BDNF表达的影响〔J〕.实用临床医药杂志,2016;20(1):13-5.
13 Granica S,Piwowarski JP,Kiss AK.Ellagitannins modulate the inflammatory response of human neutrophils ex vivo〔J〕.Phytomedicine,2015;22(14):1215-22.
〔2016-11-22修回〕
(编辑 袁左鸣/滕欣航)
姜卫荣(1972-),女,主治医师,主要从事麻醉学研究。
R742
A
1005-9202(2017)10-2407-03;
10.3969/j.issn.1005-9202.2017.10.025
1 济南市槐荫人民医院内科 2 山东省交通医院麻醉科
