洛伐他汀上调体外培养神经细胞毒蕈碱型乙酰胆碱受体及对抗β-淀粉样肽对该受体表达的抑制作用
2017-06-15谭龙春邓成敏刘仙红官志忠
谭龙春 赵 亮 邓成敏 刘仙红 官志忠,
(贵州医科大学医学分子生物学重点实验室,贵州 贵阳 550004)
洛伐他汀上调体外培养神经细胞毒蕈碱型乙酰胆碱受体及对抗β-淀粉样肽对该受体表达的抑制作用
谭龙春1赵 亮2邓成敏1刘仙红3官志忠1,3
(贵州医科大学医学分子生物学重点实验室,贵州 贵阳 550004)
目的 观察洛伐他汀是否对毒蕈碱型乙酰胆碱受体(mAChRs)有上调作用,探讨其是否具有抗β-淀粉样肽(Aβ)的作用。方法 选择原代培养的大鼠海马神经细胞和SH-SY5Y细胞,采用洛伐他汀和Aβ寡聚体(AβOs)分别或联合处理培养细胞24~48 h后,采用蛋白印迹法和实时荧光定量PCR(Real-time PCR)检测细胞中M1 mAChR和M3 mAChR蛋白及mRNA表达水平。结果 免疫荧光染色显示原代大鼠海马神经细胞的体外培养纯度达85%以上;不同浓度洛伐他汀处理神经细胞24 h后,M1 mAChR和M3 mAChR蛋白及mRNA表达水平均明显高于对照组(P<0.05);0.5 μmol/L AβOs处理神经细胞48 h后,其M1 mAChR和M3 mAChR蛋白及mRNA表达水平均明显下降(P<0.05);但预先用0.1 μmol/L洛伐他汀处理神经细胞24 h,可减轻AβOs导致的M1 mAChR和M3 mAChR表达水平下降。结论 洛伐他汀可能具有上调mAChRs表达水平的作用,对抗Aβ对该受体的作用。
洛伐他汀;毒蕈碱型乙酰胆碱受体;β淀粉样肽
阿尔茨海默病(AD)主要的病理学特征是β-淀粉样肽(Aβ)沉积形成的老年斑(SPs) 和tau蛋白过度磷酸化形成的神经原纤维缠结(NFTs)〔1〕,Aβ沉积和tau蛋白过度磷酸化也是导致神经元功能障碍的两个原因〔2〕。解剖学研究显示,AD患者基底前脑的胆碱能神经元特异性减少〔3〕。毒蕈碱型乙酰胆碱受体(mAChRs,简称M受体)属于胆碱能神经递质性受体,参与认知功能的调节,与AD的发生密切相关〔4,5〕。Aβ可引起胆碱能神经系统损害,其机制主要有:抑制神经内源性乙酰胆碱(Ach)的释放和细胞对高亲和力胆碱的摄取,损害M受体与G蛋白的耦联,阻断M受体激动后的信号转导,使AChE降解速度减慢〔6〕。他汀类药物是胆固醇合成限速酶羟甲基戊二酸单酰辅酶A还原酶(HMG-CoA)抑制剂,能抑制胆固醇的合成,降低Aβ的生成〔7,8〕。本课题组之前的研究显示,低浓度的洛伐他汀处理SH-SY5Y细胞和星形胶质细胞,可上调α7 nAChR的表达〔9~11〕,但洛伐他汀是否也能上调mAChRs的表达并不清楚。本研究拟进一步分析洛伐他汀对抗Aβ的作用。
1 材料与方法
1.1 材料
1.1.1 动物及细胞 Sprague Dawley(SD)大鼠新生仔鼠(新生24 h 内),由贵州医科大学实验动物中心提供,获得贵州医科大学伦理委员会批准进行实验(No.1311018)。原代大鼠海马神经细胞和人神经母细胞瘤细胞SH-SY5Y(由课题组保存)。
1.1.2 主要试剂 洛伐他汀、多聚赖氨酸、Aβ1~42购自Sigma公司(美国);胎牛血清、Neurobasal-A 培养基、Hibernate-A培养基、B-27 添加剂、GlutaMAX添加剂购自Gibco公司(美国);DMEM-F12培养基、0.25%胰蛋白酶、青霉素及链霉素购自Hyclone公司(上海);BCA蛋白定量试剂盒、逆转录试剂盒、Trizol试剂、CY-3标记的羊抗小鼠IgG抗体和488标记的羊抗兔IgG抗体购自Thermo公司(美国);SYBR green master 购自Roche公司(瑞典);CCK-8试剂盒购自Dojindo公司(日本);裂解液、RIPA、5倍蛋白上样缓冲液、SDS-PAGE 凝胶配制试剂盒、显影定影试剂盒购自碧云天生物技术公司(上海);山羊血清购自中杉金桥生物技术有限公司(北京);M1 mAChR、M3 mAChR和β-actin引物序列购自生工公司(上海);兔抗GFAP抗体购自Dako(丹麦);鼠抗NeuN抗体、ECL试剂盒购自Millpore(美国);兔抗M1 mAChR、M3 mAChR抗体购自Santa Cruz公司(美国);兔抗β-actin购自Abmart公司(上海);辣根过氧化物酶(HRP)标记的抗兔二抗购自Cell Signaling(美国)。
1.2 方法
1.2.1 原代大鼠海马神经细胞的培养 原代大鼠海马神经细胞培养参考Nunez〔12〕的方法,并根据实验室具体情况做了适当改动。新生SD乳鼠数只,75%酒精浸泡5 min,无菌条件下取头部,取出大脑,放入预冷的Hibernate-A培养基中,分离海马,并去除脑膜及血管。海马以D-Hank缓冲盐液清洗3次后,加入0.25% 胰蛋白酶37℃消化15 min,期间振摇3次;用含10%胎牛血清的DMEM-F12培养基终止消化1 min,弃培养基,D-Hank平衡盐液洗2次;加入2 ml含2%B27的Neurobasal-A完全培养基(含Neurobasal-A培养基、2%B27、1%GlutaMAX添加剂、100 U/ml青霉素及100 mg/ml链霉素),轻轻吹打细胞,避免产生气泡,自然沉淀后取上清;再加入 2 ml含2%B27的Neurobasal完全培养基,重复上述操作2次,得到细胞悬液,再用70 μm的滤网将细胞悬液过滤。吸取过滤后的细胞悬液,进行细胞计数。计数后用含2% B27的Neurobasal-A完全培养基稀释细胞,以5×105个/ml密度接种在经左旋赖氨酸(PLL)包被(用滤过除菌的0.01 mg/ml多聚赖氨酸室温包被过夜,PBS洗3次,晾干备用)过的6孔板内,于37℃,5% CO2培养箱中培养。每隔3 d以含2%B27的Neurobasal-A完全培养基半量换液。
1.2.2 原代大鼠海马神经细胞的鉴定 神经细胞培养至第7天时,弃培养液,加入PBS洗2次×3 min。每孔加入1 ml预冷4%多聚甲醛室温固定20 min,弃多聚甲醛,PBS洗3次×5 min,室温晾干;0.5%Triton X-100室温透膜处理20 min,PBS洗3次×5 min,晾干;10%山羊血清室温封闭30 min,弃山羊血清,每孔加500 μl PBS稀释一抗,含有小鼠抗NeuN抗体(1∶50)及兔抗GFAP抗体(1∶200),阴性对照以PBS代替一抗,4℃过夜。吸出一抗,PBS洗3次×2 min,每孔加500 μl稀释二抗,含有Cy3(红光)标记抗小鼠IgG和488(绿光)标记抗兔IgG,室温避光孵育1 h,PBS洗2次×5 min;置于荧光倒置显微镜下观察,采集图片,计数10个视野内NeuN阳性及GFAP阳性细胞个数,计算神经细胞的纯度。
1.2.3 SH-SY5Y细胞的培养 从液氮罐中取出冻存的SH-SY5Y细胞,快速放入37℃水浴箱中摇动1~2 min使其快速融化,迅速转入含10 ml培养液的15 ml离心管中,1 000 r/min离心5 min,弃上清,加入含有10%胎牛血清和1%双抗(青霉素100 U/ml,链霉素100 U/ml)的DMEM高糖培养基,用滴管轻轻吹打,使细胞重悬,然后把细胞悬液转入底面积为25 cm2(T25)的细胞培养瓶中,并放入37℃ 、5% CO2培养箱中培养。当细胞贴壁生长到80%后用0.25%胰蛋白酶消化传代。另外,可用细胞冻存液(90%胎牛血清,10%DMSO,现用现配)冻存细胞,然后将冻存细胞置于细胞梯度冻存盒内,放至-80℃过夜,次日转入-196℃液氮中保存。
1.2.4 细胞活性实验 采用CCK-8法检测细胞活性。原代培养神经细胞及SH-SY5Y细胞分别以1×105个/ml2浓度接种于96孔板中,不同浓度药物处理细胞,每个浓度设5个复孔,每孔加100 μl细胞悬液;培养至计划时间后,将每孔原始培养基取出,置换为不含血清及药物的纯培养基100 μl,空白对照组加入100 μl无细胞纯培养基,于每孔中加入10 μl CCK-8试剂,37℃孵育2 h,450 nm波长测定吸光度。
1.2.5 洛伐他汀处理细胞 SH-SY5Y细胞于6孔板中培养,生长至80%~90%,更换成无血清培养基培养12 h。原代大鼠海马神经细胞培养至第10天,弃B27培养2 h,分别加入不同浓度洛伐他汀(0.01 μmol/L和0.1 μmol/L)处理,24 h后加入0.5 μmol/L Aβ寡聚体(AβOs);48 h后收集细胞,强效裂解液提取细胞总蛋白,BCA法进行蛋白定量。
1.2.6 蛋白印迹法检测M1 mAChR和M3 mAChR蛋白表达水平 经10%聚丙烯酰胺凝胶电泳、转膜、封闭后,分别用抗M1 mAChR(1∶1 000)、抗M3 mAChR(1∶1 000)抗体室温孵育1 h后4℃过夜。再加入HRP标记的抗兔二抗(1∶5 000),室温振摇孵育1 h。将膜与ECL试剂反应后胶片曝光,所得胶片用扫描仪扫描,Image J软件分析结果。以β-actin蛋白条带灰度值作为内参,以目的蛋白和β-actin蛋白条带灰度值的比值进行校准,计算实验组与对照组相对蛋白表达水平差异。
1.2.7 实时荧光定量PCR(Real-time PCR)检测M1 mAChR、M3 mAChR mRNA表达水平 采用一步法提取细胞总RNA,逆转录合成cDNA,再以cDNA为模板进行Real-time PCR。M1 mAChs、M3 mAChR及β-actin引物序列见表1。分析结果时以β-actin为内参照,应用RQ值(RQ=2-ΔΔCT)计算M1 mAChR、M3 mAChR基因在实验组与对照组的相对表达水平。
1.3 统计学处理 应用SPSS13.0软件行单因素方差分析(One-Way ANOVA);进一步多重比较,方差齐性采用LSD-t检验,方差不齐采用DunnettT3分析。
2 结 果
2.1 原代大鼠海马神经细胞纯度鉴定 相差显微镜下原代大鼠海马神经细胞(图1),经NeuN和GFAP免疫荧光双染后,可见NeuN阳性细胞,即神经细胞,激发后细胞核显红色荧光(图1);GFAP阳性细胞,即星形胶质细胞,激发后,胞质显绿色荧光,胞核无色透明(图1);未加抗体的阴性对照未观察到荧光(图1)。计数统计后,神经细胞纯度达到85%以上。
2.2 洛伐他汀细胞活性试验 1 μmol/L洛伐他汀作用于原代大鼠海马神经细胞及SH-SY5Y细胞24 h,可见细胞存活率显著低于对照组(设为100)(P<0.01)。所以在后面的研究中,选择0.01 μmol/L和0.1 μmol/L洛伐他汀,该浓度不影响细胞的存活率。见图2。
2.3 AβOs细胞毒性试验 0.5 μmol/L AβOs作用于原代大鼠海马神经细胞及SH-SY5Y细胞48 h,可见细胞存活率(设为100)显著低于对照组(P<0.01)。故在后面的研究中,选择0.5 μmol/L AβOs处理细胞。见图3。
2.4 洛伐他汀对M1 mAChR和M3 mAChR蛋白表达水平的影响 0.01和0.1 μmol/L洛伐他汀作用于原代大鼠海马神经细胞和SH-SY5Y细胞24 h后,M1 mAChR和M3 mAChR蛋白表达水平均明显高于对照组(P<0.05),见图4,表2。
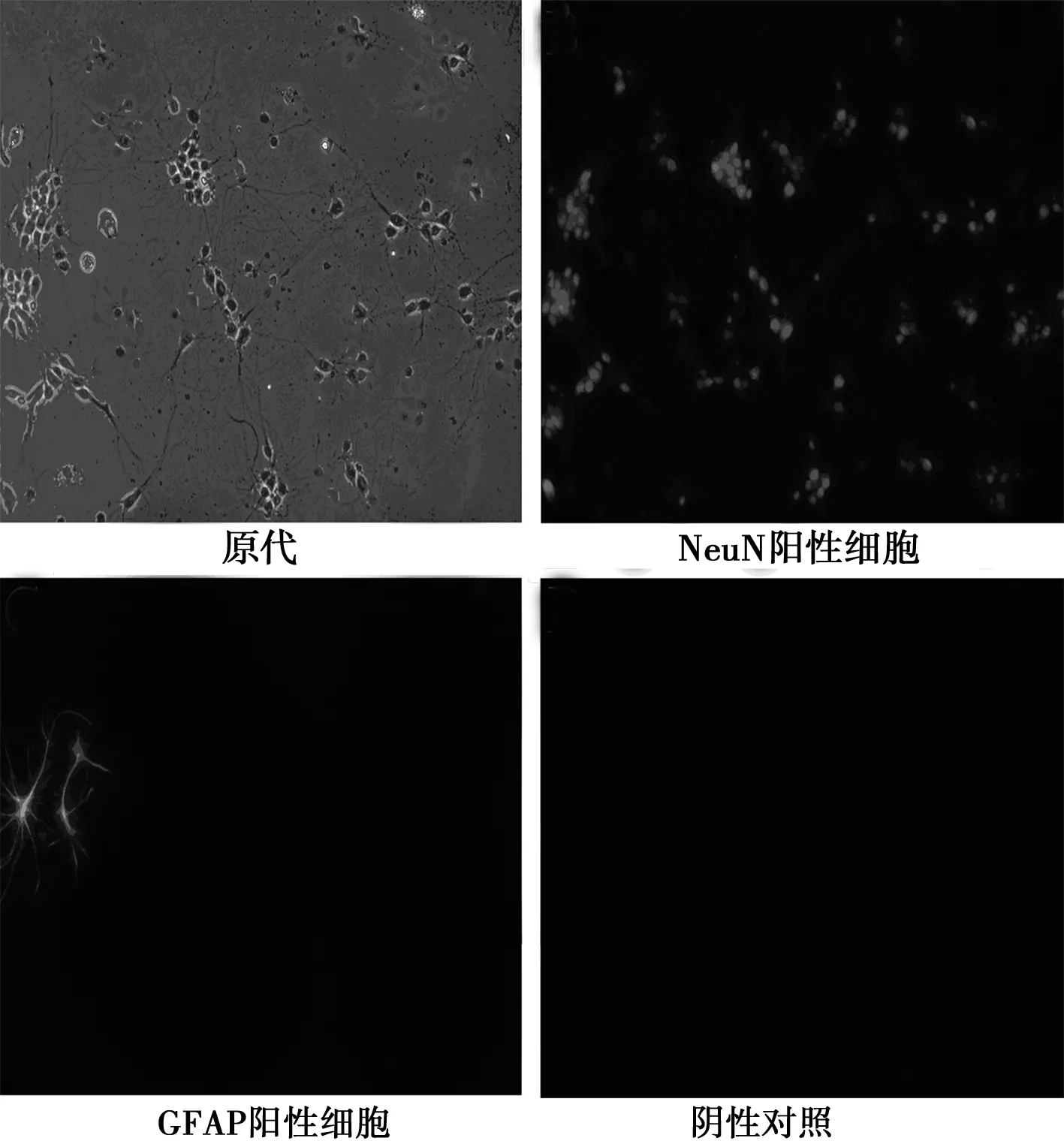
图1 原代大鼠海马神经细胞免疫荧光染色(×200)
2.5 洛伐他汀对抗AβOs对M1、M3 mAChR蛋白表达水平的影响 0.5 μmol/L AβOs处理原代大鼠海马神经细胞和SH-SY5Y细胞48 h,与对照组相比,M1 mAChR及M3 mAChR蛋白表达水平均明显下降(P<0.05);用0.1 μmol/L洛伐他汀预处理原代大鼠海马神经细胞和SH-SY5Y细胞24 h,可减轻AβOs导致的mAChRs蛋白表达水平下降。见图5,表3。
2.6 洛伐他汀对M1 mAChR及M3 mAChR mRNA表达水平的影响 0.01和0.1 μmol/L洛伐他汀作用于原代大鼠海马神经细胞24 h后,M1 mAChR及M3 mAChR mRNA表达水平均明显高于对照组(P<0.05)。见表4。
2.7 洛伐他汀对抗AβOs对M1 mAChR及M3 mAChR mRNA表达水平的影响 0.5 μmol/L AβOs处理原代大鼠海马神经细胞48 h,与对照组相比,M1 mAChR、M3 mAChR mRNA表达水平明显下降(P<0.05);用0.1 μmol/L洛伐他汀预处理原代大鼠海马神经细胞,可减轻AβOs导致的M1 mAChR、M3 mAChR mRNA表达水平下降。见表5。
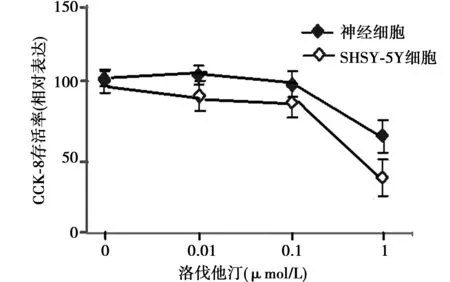
图2 不用浓度洛伐他汀对原代大鼠海马神经细胞及SH-SY5Y细胞存活率的影响
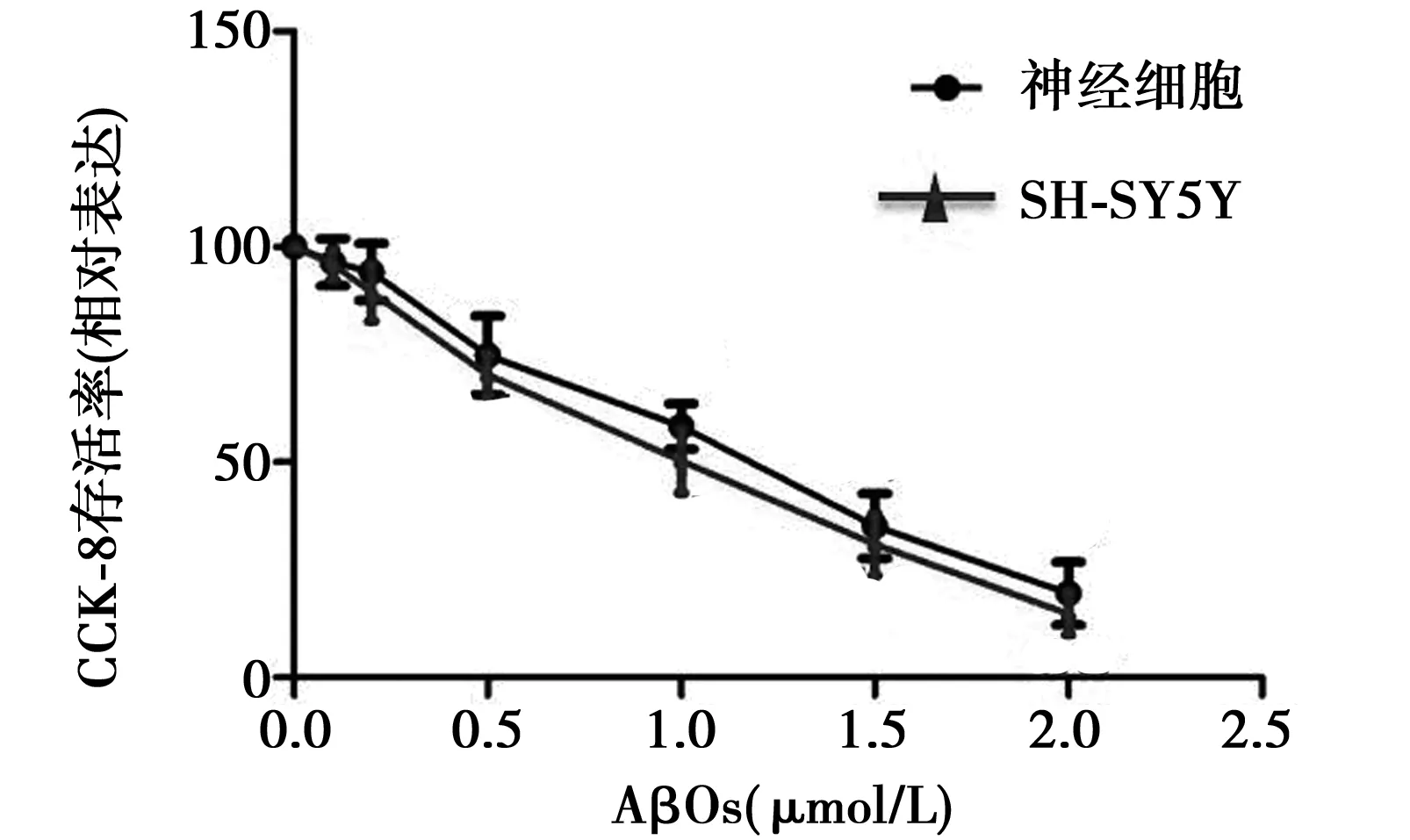
图3 不用浓度AβOs对原代大鼠海马神经细胞及SH-SY5Y细胞存活率的影响
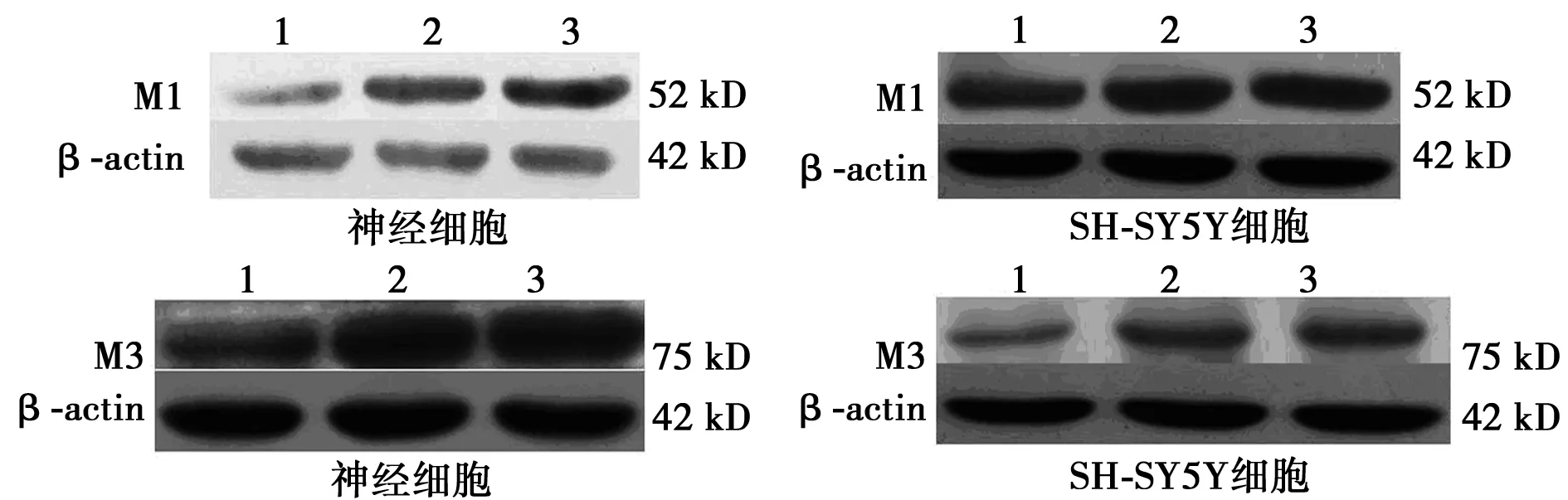
1、2、3分别为洛伐他汀0、0.01、0.1 μmol/L组图4 洛伐他汀对M受体蛋白表达水平的影响
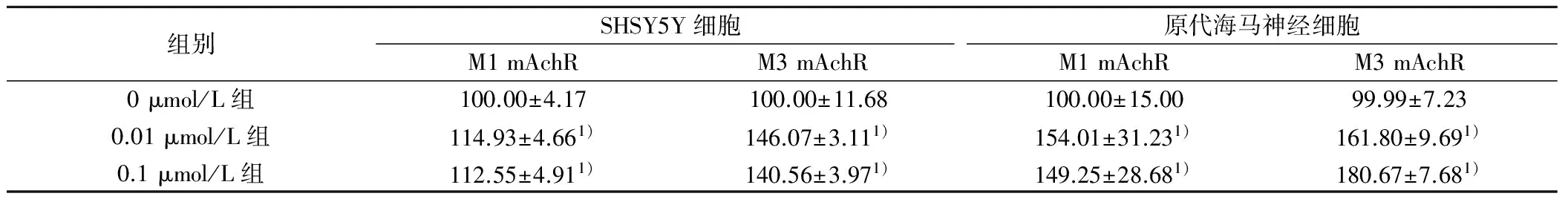
组别SHSY5Y细胞M1mAchRM3mAchR原代海马神经细胞M1mAchRM3mAchR0μmol/L组100.00±4.17100.00±11.68100.00±15.0099.99±7.230.01μmol/L组114.93±4.661)146.07±3.111)154.01±31.231)161.80±9.691)0.1μmol/L组112.55±4.911)140.56±3.971)149.25±28.681)180.67±7.681)
与0 μmol/L组比较:1)P<0.05
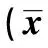
表3 洛伐他汀对抗AβOs对SHSY5Y细胞及原代海马神经细胞中M1、M3 mAChR蛋白表达水平的影响±s)
与0 μmol/L组比较:1)P<0.05;与Aβ组比较:2)P<0.05
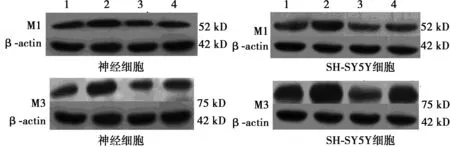
1:0 μmol/L洛伐他汀组;2:0.1 μmol/L洛伐他汀组;3:Aβ组;4:0.1 μmol/L洛伐他汀+Aβ组图5 洛伐他汀对抗AβOs对M受体蛋白表达水平的影响
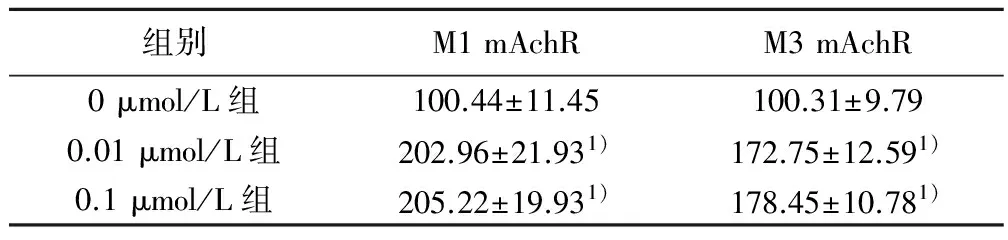
组别M1mAchRM3mAchR0μmol/L组100.44±11.45100.31±9.790.01μmol/L组202.96±21.931)172.75±12.591)0.1μmol/L组205.22±19.931)178.45±10.781)
与0 μmol/L组比较:1)P<0.05
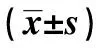
表5 洛伐他汀对抗AβOs对原代海马神经细胞M1、M3 mAChR mRNA表达水平的影响
与0 μmol/L组比较:1)P<0.05;与Aβ组比较:2)P<0.05
3 讨 论
他汀类药物作为一种降脂药,广泛用于降低血液中胆固醇水平;除此之外,他汀类药物也被认为是治疗和预防AD的潜在药物〔13〕。流行病学研究显示,服用他汀类药物治疗高血压和心脏病的老年人,痴呆和认知损害的发生率低于未服药人群,他汀类药物能够降低AD的发病风险〔14〕。动物模型研究显示,他汀类药物预防AD中作用机制可能包括减少Aβ〔15〕、β-位点APP切割酶(BACE1)水平及氧化应激〔16,17〕。
对于AD早期患者,连续1年给予胆碱酯酶抑制剂后发现,患者脑内的海马萎缩速率减半,表明胆碱能系统与神经退行性疾病关系密切〔18〕。影像学显示胆碱功能障碍与AD的病理过程及认知障碍有关〔19,20〕。长期使用抗胆碱能药物,特别是抗毒蕈碱药物,可以显著增加痴呆的发病风险〔21〕。G蛋白耦联受体能够调节与APP代谢有关的3种分泌酶的活性,从而调节APP代谢,影响Aβ生成;同时,Aβ通过负反馈机制也可以调节G蛋白耦联受体的活性〔22〕。mAChRs 属于G蛋白耦联受体,与胆碱功能失调、Aβ和Tau神经病理学等密切相关,选择性激活M1受体可延缓AD的发生和进展〔23〕。文献报道M1 mAChR与SPs和过度磷酸化的Tau蛋白的积累有关联〔24〕。此外,M1 mAChR阳性变构调节剂可以改善由于胆碱功能障碍引起的AD患者认知缺陷〔25〕。由于M1 mAChR与AD的发生发展有关,所以它被认为是AD治疗中的关键靶点。本实验发现洛伐他汀可显著提高M1 mAChR和M3 mAChR的蛋白及mRNA表达水平,提示洛伐他汀可刺激mAChRs的表达。上调mAChRs表达水平可改善AD患者的认知功能,对抗细胞凋亡,起到神经保护作用,同时也减少Aβ产生和tau蛋白过度磷酸化,从而延缓AD病程〔26,27〕。
Aβ是AD患者神经元细胞外淀粉样斑块的主要成分,是由APP经分泌酶剪切产生的一系列包括39~43个氨基酸的短肽,主要是Aβ40和Aβ42,其中Aβ42聚集性最强,有很强的神经毒性〔28〕。少量的Aβ能保护脑细胞,促进神经元的生长,但是过量的Aβ则会对神经元产生毒性,引起AD等神经性疾病的发生〔29〕。细胞内的Ca2+对细胞功能有极重要的作用,它是重要的细胞内第二信使,调节许多细胞反应和活动,参与神经递质释放、突触的可塑性等。Aβ可以增加细胞内Ca2+浓度,损害线粒体功能和细胞骨架,导致细胞损伤〔29〕。此外,Aβ可引起炎症反应,导致突触功能障碍和神经毒性作用,最终导致神经元变性或死亡〔30,31〕。这些研究均表明,Aβ可降低M1 mAChR、M3 mAChR蛋白和mRNA的表达水平。M1 mAChR、M3 mAChR表达减少,其与G蛋白的耦联作用和介导生成第二信使的能力下降,钙离子内流减少,抑制了神经递质的释放,进一步导致学习记忆能力减弱。此外,Aβ引起的胆碱能功能下降可减少APP营养分泌,增加Aβ分泌,影响M1受体的信号转导,抑制乙酰胆碱的合成和释放,进一步加剧了胆碱能缺乏〔32〕。而且洛伐他汀对于Aβ引起的M1 mAChR、M3 mAChR表达下降有缓解作用。综上所述,洛伐他汀可能具有上调mAChRs对抗Aβ的作用,这对寻找治疗AD的药物靶点提供了一定的理论依据。
1 Faivre E,Hölscher C.Neuroprotective effects of D-Ala 2 GIP on Alzheimer's disease biomarkers in an APP/PS1 mouse model〔J〕.Alzheimers Res Ther,2013;5(2):20.
2 Yang HQ,Sun ZK,Chen SD.Current advances in the treatment of Alzheimer's disease:focused on considerations targeting Aβ and tau〔J〕.Transl Neurodegener,2012;1(1):1-12.
3 Kim HJ,Moon WJ,Han SH.Differential cholinergic pathway involvement in Alzheimer's disease and subcortical ischemic vascular dementia〔J〕.J Alzheimers Dis Jad,2013;35(1):129-36.
4 Lombardo S,Maskos U.Role of the nicotinic acetylcholine receptor in Alzheimer's disease pathology and treatment〔J〕.Neuropharmacology,2014;96(Pt B):255-62.
5 Sarter M,Paolone G.Deficits in attentional control:cholinergic mechanisms and circuitry-based treatment approaches〔J〕.Behav Neurosci,2011;125(6):825-35.
6 胡海燕.β-淀粉样蛋白在阿尔茨海默病中的作用及中药多靶点对抗研究进展〔J〕.中华中医药学刊,20123;30(3):488-92.
7 刘 洁,石如玲,姜玲玲.阿尔茨海默病与他汀类药物〔J〕.中国老年学杂志,2007;27(19):1949-51.
8 Carlsson CM,Xu G,Wen Z,etal.Effects of atorvastatin on cerebral blood flow in middle-aged adults at risk for Alzheimer's disease:a pilot study〔J〕.Curr Alzheimer Res,2012;9(8):990-7.
9 Xiu J,Nordberg A,Qi X,etal.Influence of cholesterol and lovastatin on alpha-form of secreted amyloid precursor protein and expression of alpha7 nicotinic receptor on astrocytes〔J〕.Neurochem Int,2006;49(5):459-65.
10 Xiu J,Nordberg A,Shan KR,etal.Lovastatin stimulates up-regulation of alpha7 nicotinic receptors in cultured neurons without cholesterol dependency,a mechanism involving production of the alpha-form of secreted amyloid precursor protein〔J〕.J Neurosci Res,2005;82(4):531-41.
11 Roensch J,Crisby M,Nordberg A,etal.Effects of statins on alpha 7 nicotine receptor,cholinesterase and alpha-form of secreted amyloid precursor peptide in SH-SY5Y〔J〕.Neurochem Int,2007;50(6):800-6.
12 Nunez J.Primary culture of hippocampal neurons from P0 newborn rats〔J〕.J Vis Exp,2008;29(19):e895.
13 Haag MD,Hofman A,Koudstaal PJ,etal.Statins are associated with a reduced risk of Alzheimer disease regardless of lipophilicity.The Rotterdam Study〔J〕.J Neurol Neurosurg Psychiatry,2008;80(1):13-7.
14 Richardson K,Schoen M,French B,etal.Statins and cognitive function:a systematic review〔J〕.Ann Int Med,2013;159(10):688-97.
15 Kurata T,Miyazaki K,Kozuki M,etal.Atorvastatin and pitavastatin improve cognitive function and reduce senile plaque and phosphorylated tau in aged APP mice〔J〕.Brain Res,2011;1371(2):161-70.
16 Murphy MP,Morales J,Beckett TL,etal.Changes in cognition and amyloid-β processing with long term cholesterol reduction using atorvastatin in aged dogs〔J〕.J Alzheimers Dis Jad,2010;22(1):135-50.
17 Barone E,Cenini G,Di DF,etal.Long-term high-dose atorvastatin decreases brain oxidative and nitrosative stress in a preclinical model of Alzheimer's disease:a novel mechanism of action〔J〕.Pharmacol Res,2011;63(3):172-80.
18 Dubois B,Chupin M,Hampel H,etal.Donepezil decreases annual rate of hippocampal atrophy in suspected prodromal Alzheimer's disease〔J〕.Alzheimers Dement,2015;11(9):1041-49.
19 Teipel S,Heinsen H,Amaro E,etal.Cholinergic basal forebrain atrophy predicts amyloid burden in Alzheimer’s disease〔J〕.Neurobiol Aging,2014;35(3):482-91.
20 Grothe MJ,Ewers M,Krause B,etal.Basal forebrain atrophy and cortical amyloid deposition in nondemented elderly subjects〔J〕.Alzheimers Dement,2014;10(5):344-53.
21 Wein AJ.Cumulative use of strong anticholinergics and incident dementia:a prospective cohort study〔J〕.J Urol,2015;193(6):2035.
22 何 玲,王 聪,孙宝娟.针对阿尔茨海默病治疗的G蛋白耦联受体及其药物研究进展〔J〕.国际药学研究杂志,2013;40(3):255-60.
23 Fisher A.Cholinergic modulation of amyloid precursor protein processing with emphasis on M1 muscarinic receptor:perspectives and challenges in treatment of Alzheimer's disease〔J〕.J Neurochem,2012;120(Suppl 1):22-33.
24 Huang HC,Jiang ZF.Accumulated amyloid-beta peptide and hyperphosphorylated tau protein:relationship and links in Alzheimer's disease〔J〕.J Alzheimers Dis Jad,2009;16(1):15-27.
25 Kolisnyk B,Al-Onaizi MA,Xu J,etal.Cholinergic regulation of hnRNPA2/B1 translation by M1 muscarinic receptors〔J〕.J Neurosci,2016;36(23):6287-96.
26 Eglen RM.Muscarinic receptor subtypes in neuronal and non-neuronal cholinergic function〔J〕.Auton Autacoid Pharmacol,2006;26(3):219-33.
27 Budd DC,Spragg EJ,Ridd K,etal.Signalling of the M3-muscarinic receptor to the anti-apoptotic pathway〔J〕.Biochem J,2004;381(Pt 1):43-9.
28 王玉香,曾爱源,李清华.β-淀粉样蛋白在阿尔茨海默病中的作用研究进展〔J〕.中国老年学杂志,2014;34(12):3495-7.
29 郑玲艳,韩瑞兰,曹俊彦.β-淀粉样蛋白在阿尔茨海默病中的作用〔J〕.内蒙古医科大学学报,2016;38(2):147-50.
30 陈 红,赵 鹏,樊 星,等.Tau 蛋白过度磷酸化和β淀粉样蛋白对阿尔茨海默病发生的影响〔J〕.大家健康旬刊,2016;10(5):1-2.
31 Rebeck GW,Hoe HS,Moussa CE.Beta-amyloid1-42 gene transfer model exhibits intraneuronal amyloid,gliosis,tau phosphorylation,and neuronal loss〔J〕.J Biol Chem,2010;285(10):7440-6.
32 Doležal V,Kašparová J.β-Amyloid and cholinergic neurons〔J〕.Neurochem Res,2003;28(3):499-506.
〔2016-11-19修回〕
(编辑 曲 莉)
Lovastatin may up-regulate expression of muscarinic acetylcholine receptors and against the neurotoxicity of β-amyloid peptide on the receptors
TAN Long-Chun,ZHAO Liang,DENG Cheng-Min,etal.
The Key Laboratory of Molecular Biology,Guizhou Medical University,Guiyang 550004,Guizhou,China
Objective To investigate the influence of lovastatin on muscarinic acetylcholine receptors (mAChRs),and reveal whether the drug attenuate the inhibited effect of -amyloid peptide (Aβ) on the receptors.Methods The primary cultured rat hippocampal neurons and SH-SY5Y cells were exposed to lovastatin and Ab oligomers (AβOs) with alone or both treatments for 24~48 h. The protein levels of M1 and M3 mAChR were examined by Western blot,and the mRNA levels were tested by Real-time PCR.Results The purity of primary cultured rat hippocampal neurons was over 85%;by exposures of different concentrations of lovastatin for 24 h,the protein and mRNA levels of M1 and M3 mAChR were higher than those of control group,respectively (P<0.05);as compared with those of control group,the protein and mRNA levels of M1 and M3 mAChR were obviously decreased in the treatment with 0.5 μmol/L AβOs for 48 h (P<0.05); while the cells were pretreated with 0.1 μmol/L lovastatin for 24 h before the treatments by AβOs,the decreased protein and mRNA levels of M1 and M3 mAChR were all alleviated.Conclusions Lovastatin might up-regulate expression of mAChRs and attenuate the inhibited effect of Aβ on the receptors.
Lovastatin;Muscarinic acetylcholine receptors;β-amyloid peptide
国家自然科学基金( 81260173);教育部“长江学者和创新团队发展计划资助”(IRT13058);贵州省科技计划(黔科合重大专项字〔2014〕6008号);贵州省创新计划项目(黔教合协同创新中心〔2014〕06)
官志忠(1951-),男,博士,教授,博士生导师,主要从事阿尔茨海默病分子神经病理学研究。
谭龙春(1990-),女,在读硕士,主要从事阿尔茨海默病分子神经病理学研究。
R741
A
1005-9202(2017)10-2363-05;
10.3969/j.issn.1005-9202.2017.10.008
1 省部共建地方病与少数民族性疾病教育部重点实验室
2 贵州医科大学微生物学教研室 3 贵州医科大学附属医院病理科
