人参皂苷Rb1对H9c2细胞缺氧复氧的作用
2017-06-15左长鹏李芳芳徐路红刘加立钱文浩
左长鹏 王 芳 纵 静 李芳芳 雍 辉 梁 凯 徐路红 刘加立 钱文浩
(徐州医科大学心血管病研究所,江苏 徐州 221000)
·基础研究·
人参皂苷Rb1对H9c2细胞缺氧复氧的作用
左长鹏 王 芳 纵 静1李芳芳1雍 辉 梁 凯 徐路红1刘加立1钱文浩1
(徐州医科大学心血管病研究所,江苏 徐州 221000)
目的 观察人参皂苷Rb1对H9c2细胞缺氧复氧的作用。方法 采用人参皂苷Rb1对H9c2细胞缺氧复氧进行预处理,通过检测氧化应激、凋亡指标观察人参皂苷Rb1的作用。将细胞随机分为对照组、缺氧复氧组、缺氧复氧加人参皂苷Rb1(50、100、200 μmol/L),按实验设计因素处理后,通过蛋白电泳检测凋亡相关蛋白caspase-3,检测氧化应激指标丙二醛(MDA)、超氧化物歧化酶(SOD)、活性氧(ROS),TUNEL法检测细胞凋亡。结果 缺氧复氧处理可使H9c2心肌细胞的ROS 和MDA 水平显著增加,SOD 活性显著下降,上调caspase-3的表达,增加H9c2心肌细胞的凋亡。人参皂苷Rb1预处理可减少缺氧复氧H9c2细胞MDA表达量,增加SOD活性,降低ROS水平,且人参皂苷Rb1预处理可减少缺氧复氧H9c2细胞caspase-3的表达量及凋亡细胞数量。结论 人参皂苷Rb1可降低缺氧复氧对H9c2心肌细胞的氧化应激损伤及凋亡,从而对缺氧复氧H9c2心肌细胞起保护作用。
人参皂苷Rb1;缺氧复氧;氧化应激;凋亡
目前,降低心肌缺血患者死亡率最有效的方法是通过溶栓或者机械打通闭塞血管实现快速灌注。然而,再灌注本身也可以损害心肌,这一过程称为“再灌注损伤”,长时间心肌缺血以后,再灌注会引起心肌细胞凋亡、坏死以及存活心肌细胞可逆的收缩功能障碍〔1,2〕。人参皂苷Rb1主要存在于人参、三七、西洋参等植物中,是其主要活性成分〔3〕。人参皂苷Rb1可清除氧自由基、抑制钙过度内流、改善能量代谢等,人参皂苷Rb1预处理具有抗心肌缺血/再灌注损伤的保护作用〔4,5〕。本实验在体外建立心肌细胞缺氧复氧(I/R)模型,观察I/R对H9c2心肌细胞凋亡的影响,以及人参皂苷Rb1的干预效应。
1 材料和方法
1.1 药品和试剂 人参皂苷Rb1(Vicmed,纯度>95%),胎牛血清、培养基(Gibco公司),胰蛋白酶青霉素链霉素双抗溶液(Sigma公司),CCK8试剂盒、超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒、二喹啉甲酸(BCA)蛋白浓度测定试剂盒(碧云天生物技术研究所),Annexin Ⅴ-APC 凋亡检测试剂盒(eBioscience公司),牛血清白蛋白(Amresco公司),TUNEL试剂盒(Chemicon,Temecula,CA公司),聚偏氟乙烯(PVDF)膜(Amersham公司),二氧化碳培养箱(Heraeus公司),三气培养箱(Thermo公司),酶标仪(美国伯乐公司),蛋白电泳及电转装置(Bio-Rad公司)。
1.2 细胞培养 用含10%胎牛血清,1%青霉素链霉素双抗溶液的DEME培养基于37℃、5% CO2的二氧化碳培养箱内培养。传3~5代,待状态稳定后用0.25%胰蛋白酶消化制成单细胞悬液,每次传代时细胞密度控制在1×105/ml,进行分组实验。
1.3 实验分组 ①空白对照(CON)组:细胞于二氧化碳培养箱(5% CO2、37℃)培养48 h。②缺氧复氧(H/R)组:细胞于二氧化碳培养箱预培养32 h后,三气培养箱(N294%、CO25%、O21%,37℃)经历4 h缺氧培养,然后在二氧化碳培养箱复氧12 h。③人参皂苷Rb1 低、中、高(L、M、H)组:细胞在二氧化碳培养箱预培养32 h后,分别加入50、100、200 μmol/L人参皂苷Rb1预处理1 h,然后在三气培养箱经历4 h缺氧,再在二氧化碳培养箱复氧12 h。
1.4 CCK8检测 将100 μl的H9c2单细胞悬液加入96孔板中,二氧化碳培养箱中预培养24 h后,向培养板中分别加入50、100、200、400 μmol/L不同浓度的人参皂苷Rb1,在培养箱继续培养12 h,然后向培养板中加入10 μl CCK8溶液,再孵育2 h,最后用酶标仪测定在450 nm处的吸光度。
1.5 酶标仪检测活性氧(ROS) 将细胞等密度接种于96孔板中,每孔约2×105/ml,用各组实验因素处理2 h后加入DCFA-DA探针,在37℃孵育30 min,用磷酸盐缓冲液(PBS)洗3遍后,检测DCF荧光强度(激发光波长485 nm,发射光波长525 nm),以每次实验组荧光强度作为100%计算ROS含量。
1.6 MDA含量和SOD活性检测 MDA含量测定取100 μl细胞匀浆;SOD活性检测取20 μl细胞匀浆。用BCA蛋白浓度测定试剂盒测定蛋白浓度。分别按照试剂盒说明进行MDA含量及SOD活性检测。
1.7 TUNEL检测 将H9c2细胞传代于24孔板,培养12 h后,按照上述分组进行加药,12 h后PBS洗涤3遍,用1%多聚甲醛进行固定,按照TUNEL试剂盒说明进行染色,用DAPI进行染核并封片。倒置显微镜拍照,用IPP6.0软件进行合并(Merge),并进行数量统计分析。
1.8 Western印迹检测Procaspase-3、酶切caspase-3表达 使用Bradford法测定蛋白后,经十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳后将蛋白转至PVDF膜上,经封闭、一抗二抗孵育后,扫描并分析。
1.9 统计学分析 采用GraphPad Prism5.0统计软件,多样本均数比较采用单因素方差分析(one-way ANOVA);组内数据不符合正态分布或者组间方差不齐,采用秩和检验。
2 结 果
2.1 人参皂苷Rb1对H9c2细胞毒性的影响 对照组细胞存活率为100%(OD450 nm为1.15±0.06),人参皂苷Rb1在50、100、200、400 μmol/L浓度细胞存活率分别为97.4%、93.9%、90.4%、82.6%(OD450 nm分别为1.12±0.12,1.08±0.04,1.04±0.08,1.04±0.08),因此本实验设计的人参皂苷Rb1浓度具有低毒性。为了排除人参皂苷Rb1对H9c2细胞毒性损伤引起细胞存活率改变及影响其他实验结果,本实验采用50、100、200 μmol/L为药物浓度。
2.2 各组MDA、ROS含量和SOD 活性比较 H/R 处理心肌细胞后SOD活性较CON组下降(P<0.05),但其MDA、ROS含量显著增高(P<0.05)。人参皂苷Rb1预处理细胞后,L、M、H各组MDA、ROS含量较H/R组明显降低(P<0.05 ),但M组与H组间MDA、ROS含量差异无统计学意义(P>0.05);L、M、H各组SOD活性较H/R组显著增高(P<0.05),Rb1各组间SOD活性均有统计学差异(P<0.05)。表明人参皂苷Rb1预处理可以减少I/R H9c2细胞的氧化应激损伤,呈浓度依赖性。见表1 。
2.3 TUNEL染色结果 见图1。H/R处理使H9c2心肌细胞TUNEL阳性细胞增多〔CON组(1.33±0.58)%,H/R(15.33±3.06)%,P<0.05〕,凋亡加重;L、M、H组与H/R组相比,TUNEL阳性细胞减少〔L、M、H组分别为(11.00±1.00)%,(6.67±1.16)%,(4.67±1.16)%,均P<0.05〕;M组与H组相比,TUNEL阳性细胞数变化无统计学差异(P>0.05);人参皂苷Rb1预处理能降低H9c2细胞TUNEL阳性细胞,改善心肌细胞的凋亡,呈浓度依赖性。
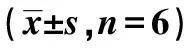
表1 各组SOD、MDA、ROS的表达量比较
与CON组比较:1)P<0.05;与H/R组比较:2)P<0.05;与L组比较:3)P<0.05;与M组比较:4)P<0.05

图1 各组TUNEL染色阳性细胞数(×400)
2.4 Western印迹法检测结果 H/R处理H9c2心肌细胞后,酶切caspase-3蛋白水平上调(P<0.05),L、M、H组与H/R组相比酶切caspase-3蛋白表达量均降低(P<0.05),但M组与H组间酶切caspase-3蛋白表达量无统计学差异(P>0.05)。H/R处理H9c2心肌细胞后,Procaspase-3蛋白水平下调(P<0.05),人参皂苷Rb1预处理能够上调Procaspase-3凋亡蛋白的表达(P<0.05),但M组与H组之间Procaspase-3凋亡蛋白的表达无统计学差异(P>0.05)。表明人参皂苷Rb1预处理可减少H9c2细胞凋亡相关蛋白caspase-3的表达,呈浓度依赖性。见图2,表2。

图2 各组Procaspase-3、酶切caspase-3的蛋白表达量比较

组别Procaspase⁃3Cleavedcaspase⁃3CON组1.00±0.101.00±0.12H/R组0.13±0.031)6.58±0.591)L组0.33±0.091)2)4.11±0.601)2)M组0.62±0.131)2)3)3.24±0.551)2)3)H组0.64±0.131)2)3)2.94±0.211)2)3)
与CON组比较:1)P<0.05;与H/R组比较:2)P<0.05;与L组比较:3)P<0.05
3 讨 论
本研究证实I/R诱导的心肌细胞损伤与氧化应激反应密切相关。人参皂苷Rb1预处理可以降低I/R H9c2细胞内的ROS 和MDA水平,使SOD活力升高,从而提示人参皂苷Rb1可能通过减轻氧化应激反应发挥对H9c2心肌细胞的保护作用。细胞接受来自胞外的刺激后,可以通过死亡受体和线粒体介导的途径两个方面触发凋亡。作为凋亡瀑布的重要组成部分,caspase-3的级联活化是调节细胞凋亡的重要机制〔6〕,而caspase-3为凋亡瀑布的最终共同通路,其活化是凋亡的重要标志〔7〕。Western印迹结合TUNEL染色结果显示,H/R可明显增加H9c2心肌细胞的凋亡细胞数,人参皂苷Rb1具有减少H9c2 H/R细胞凋亡的作用。人参皂苷Rb1可清除氧自由基,拮抗钙通道,改善能量代谢,促进血管再生,抑制心肌细胞凋亡等。研究证明人参皂苷Rb1对神经系统和心血管系统均有保护作用。人参皂苷Rb1对缺血性心脏病、心律失常、心力衰竭等方面均有临床意义〔8,9〕。已有的研究证实人参皂苷Rb1对缺血再灌注心肌细胞有明显的抑制作用,根据研究,Rb1能显著减少肥厚心肌细胞H/R的损伤〔10,11〕。H9c2细胞株来源于大鼠胚胎的心肌细胞,具有原代心肌细胞的一般生理生化特性,且能传代培养,而广泛用于细胞学和药理学等研究。从细胞水平研究药物的心肌保护效应目的就在于排除在体心脏、离体心脏等模型中全身神经体液和局部不同类型细胞间的相互影响,从而更好地研究药物对单个细胞的直接作用及其机制〔12~15〕。作为体外模拟,H9c2细胞系缺氧后复氧模型,能很好地用于体内环境心肌I/R损伤的研究。Sheng等〔16〕的研究提示,抑制心肌细胞凋亡可以逆转心肌肥厚并抑制心肌重构,明显改善心脏正常代谢,提高心血管疾病患者的生存率。本课题组先前已在动物在体水平证实人参皂苷Rb1可通过P38-MAPK通路对大鼠I/R损伤起保护作用〔17〕,本实验只是检测了氧化应激、凋亡指标,未涉及动物在体实验的部分及对信号通路的进一步研究,因此存在一定的局限性。
1 Wu Y,Xia Z,Dou J,etal.Protective effect of ginsenoside Rb1 against myocardial ischemia/reperfusion injury in streptozotocin-induced diabetic rats〔J〕.Mol Biol Rep,2011;38(7):4327-35.
2 刘俊伟,任治龙,刘旭玲,等.人参皂苷Rb1对大鼠局灶性脑缺血再灌注损伤后脑梗死体积及脑组织和血清IL-1β的影响〔J〕.中国中西医结合杂志,2013;33(12):1696-700.
3 刘晓晖,朱鲲鹏,许 立,等.人参皂苷Rb1的研究进展〔J〕.武警医学院学报,2006;15(1):82.
4 谢 薇,方 竣,夏凌辉,等.人参皂苷Rb1对白消安诱导脐静脉内皮细胞凋亡的抑制作用〔J〕.临床血液学杂志,2007;20(3):162.
5 Xia R,Zhao B,Wu Y,etal.Ginsenoside Rb1 preconditioning enhances eNOS expression and attenuates myocardial ischemia/reperfusion injury in diabetic rats〔J〕.Bio Med Res Int,2011;2011(1):767930.
6 Scarabelli TM,Stephanou A,Pasini E,etal.Different signaling pathways induce apoptosis in endothelial cells and cardiac myocytes during ischemia/reperfusion injury〔J〕.Circ Res,2002;90(7):745-8.
7 Moorjani N,Westaby S,Narula J.Effects of left ventricular volume overload on mitochondrial and death-receptor-mediated apoptotic pathways in the transition to heart failure〔J〕.Am J Cardiol,2009;103:1261-8.
8 Wang X,Liu X,Zhou Q,etal.Ginsenoside Rb1 reduces isoproterenol-induced cardiomyocytes apoptosis in vitro and in vivo〔J〕.Evid Based Complement Alternat Med,2013;2013(1):454389.
9 贾继明,王宗权,吴立军,等.人参皂苷 Rb1 的药理活性研究进展〔J〕.中国中药杂志,2008;33(12):1371-7.
10 Li Y,Li Y,Fan G,etal.Cardioprotection of ginsenoside Rb1 against ischemia/reperfusion injury is associated with mitochondrial permeability transition pore opening inhibition〔J〕.Chin J Inteqr Med,2016:〔Epub ahead of print〕.
11 Liu Z,Chen J,Huang W,etal.Ginsenoside Rb1 protects rat retinal ganglion cells against hypoxia and oxidative stress〔J〕.Mol Med Rep,2013;8(5):1397-403.
12 余 杰,屠伟峰,王 婕,等.利多卡因预处理对H9c2心肌细胞缺氧复氧性损伤的保护作用〔J〕.广东医学,2010;31(9):1077-80.
13 刘 源,唐其柱,胡哲夫,等.番茄红素可改善血管紧张素Ⅱ诱导的 H9c2 细胞氧化应激〔J〕.中华心血管病杂志,2015;(4):341-6.
14 王瑞霞.苦参碱对 H9c2 细胞缺氧复氧损伤的保护作用及机制〔J〕.中国心血管杂志,2015;20(4):290-4.
15 储倩雯,李伟秋,鲁诗史,等.利用低氧/厌氧工作站建立 H9c2 细胞缺氧复氧模型的探讨〔J〕.中国生化药物杂志,2015;(11):11-4.
16 Sheng R,Gu ZI.Cardiomyocyte apoptosis and regeneration in overload cardiac hypertrophy〔J〕.Chin Pharmacol Bull,2005;21(4):531-5.
17 Li G,Qian W,Zhao C.Analyzing the anti-ischemia-reperfusion injury effects of ginsenoside Rb1 mediated through the inhibition of p38α MAPK〔J〕.Canad J Physiol Pharmacol,2015;94(1):97-103.
〔2016-11-15修回〕
(编辑 徐 杰)
Effects of ginsenoside Rb1 on hypoxia-reoxygenation H9c2 cells
ZUO Chang-Peng,WANG Fang,ZONG Jing,etal.
Institute of Cardiovascular Disease Research,Affiliated Hospital of Xuzhou Medical College, Xuzhou 221000,Jiangsu,China
Objective To observe the effects of ginsenoside Rb1 on hypoxia-reoxygenation H9c2 cells.Methods Ginsenoside Rb1 was used to pretreat hypoxia-reoxygenation H9C2 cells,and the effects of ginsenosides Rb1 on oxidative stress and apoptosis were observed. H9C2 cells were divided into normal control,hypoxia/reoxygenation(H/R),H/R plus low,medium and high dose Ginsenoside Rb1 (L,M,H)groups. The apoptosis-related protein caspase-3 was detected by electrophoresis,superoxide dismutase (SOD),malondialdehyde (MDA),reactive oxygen species(ROS). TUNEL staining were used to detect.Results With treatment of hypoxia-reoxygenation ,the levels of ROS and MDA in H9c2 cardiomyocytes were significantly increased,the activity of SOD was decreased,the expression of apoptosis protein was increased and the apoptosis of H9c2 cardiomyocytes was increased. Ginsenoside Rb1 decreased the content of MDA and increased the activity of SOD and decreased the level of ROS,while Ginsenoside Rb1 reduced the amount of apoptotic protein and the number of apoptotic cells in hypoxia-reoxygenation H9C2 cells.Conclusions Ginsenoside Rb1 could reduce the oxidative stress injury and apoptosis of H9c2 cardiomyocytes induced by H/R,and protect H9c2 cardiomyocytes from H/R.
Ginsenoside Rb1;Hypoxia and reoxygenation;Oxidative stress;Apoptosis
国家自然科学基金(81400178);江苏省自然科学基金青年基金(BK20160231)
钱文浩(1967-),男,主任医师,教授,硕士生导师,主要从事冠心病临床及基础研究。
左长鹏(1990-),男,硕士,主要从事冠心病与心肌缺血再灌注基础研究。
R541.4
A
1005-9202(2017)10-2341-04;
10.3969/j.issn.1005-9202.2017.10.001
1 徐州医科大学附属医院心血管内科
