环己酮肟水解法合成硫酸羟胺的反应新工艺
2017-06-12徐元媛张东升王晓曼李志会丁晓墅王淑芳王延吉
徐元媛,张东升,王晓曼,李志会,丁晓墅,王淑芳,王延吉
绿色化工与高效节能河北省重点实验室,河北工业大学化工学院,天津 300130
羟胺及其盐是一种重要的化工原料。羟胺盐的工业合成方法主要有拉西法、NO催化还原法、硝酸根离子还原法和硝基烷烃水解法等[1],而以环己酮肟为原料,在酸性条件下进行水解反应,也可以生成羟胺产物,但环己酮肟酸性水解反应通常被作为脱肟[2]的有效方法之一进行研究。长久以来,工业上生产环己酮肟,都是以羟胺盐为原料进行的[3],环己酮肟水解反应制取羟胺的过程,被认为是不经济的。然而,随着TS-1钛硅分子筛的问世及其合成技术不断进步,以氨水、双氧水为氨氧化剂,TS-1钛硅分子筛催化环己酮一步合成环己酮肟的工艺过程逐渐走向成熟,并已工业化,从而打破了传统羟胺法生产环己酮肟的单一局面[4]。探索环己酮肟的水解反应,并以其作为合成羟胺的潜在路线,便具备了合理性和可行性。陈林[5]基于该思路考察了丁酮肟水解制备羟胺的路线,并获得了盐酸羟胺固体产品,产物收率为 7%左右。陈武威[6]改进了丁酮肟水解制备盐酸羟胺的反应过程,边滴加盐酸边蒸出产物丁酮,可得到盐酸羟胺固体的收率90%左右。卢福军[7]采用反应-蒸馏法,研究了苯乙酮肟水解制备盐酸羟胺,盐酸羟胺的收率为 97%,苯乙酮的回收率为 96%。吴井龙[8]采用反应-分离耦合法,改进了丁酮肟水解制备盐酸羟胺,盐酸羟胺的纯度为99.8%。Xu等[9]利用环己酮(肟)循环,构建了以氨水、双氧水合成盐酸羟胺的绿色组装过程,固体盐酸羟胺的收率为64.2%。李瑞歌[10]采用硫酸催化丙酮肟减压蒸馏水解的方法,硫酸羟胺的固体收率为31%左右。Zhao等[11]研究了环己酮肟水解的热力学平衡和反应机理等相关问题,从理论上分析了环己酮肟水解反应过程,氧化还原滴定分析硫酸羟胺水溶液中羟胺的收率30%左右。
前期的研究工作表明[12],以氯化铵为氮源,TS-1钛硅分子筛为催化剂,通过环己酮氨肟化反应合成环己酮肟,取得了比较满意的反应效果,此外还构建了以氨水、双氧水为原料,借助环己酮(肟)的相互转化,合成盐酸羟胺的组装过程[9]。本工作将在前期研究的基础上,综合羟胺盐的研究现状,拟开展以自制环己酮肟为原料,硫酸为催化剂,酸性水解制备固体硫酸羟胺盐的研究。基于此,拟构建如下所示,以氯化铵为氮源、通过环己酮氨肟化反应制备环己酮肟[12]、环己酮肟再水解合成羟胺的循环反应过程,旨在为硫酸羟胺的合成提供一种新的思路,也为己内酰胺生产过程中剩余的环己酮肟提供一种新的利用思路,更为资源利用低值氯化铵提供借鉴。
1 实验部分
1.1 环己酮肟水解合成硫酸羟胺反应
在装有机械搅拌和冷凝的玻璃三口瓶中分别加入88.5 mmol自制环己酮肟[12]、1 111 mmol去离子水和165.5 mmol硫酸,反应装置升温至60 ℃,反应1 h后,用甲苯萃取反应液三次,萃取相混合均匀后经气相色谱分析环己酮肟的转化率(XCyo-O);萃余水相置于5 ℃左右的低温恒温搅拌反应浴中,用氢氧化钡中和,中和过程中不断用酸度计测量萃余水相的pH值。pH值至6.0~7.0后,减压过滤除去白色硫酸钡沉淀,去离子水洗涤滤饼三次,所得滤液经旋蒸(0.1 MPa,50 ℃),即可得到硫酸羟胺粗品。粗品硫酸羟胺经洗涤、真空干燥(0.1 MPa,50 ℃,12 h),即可得到白色固体产品硫酸羟胺。
1.2 产物表征
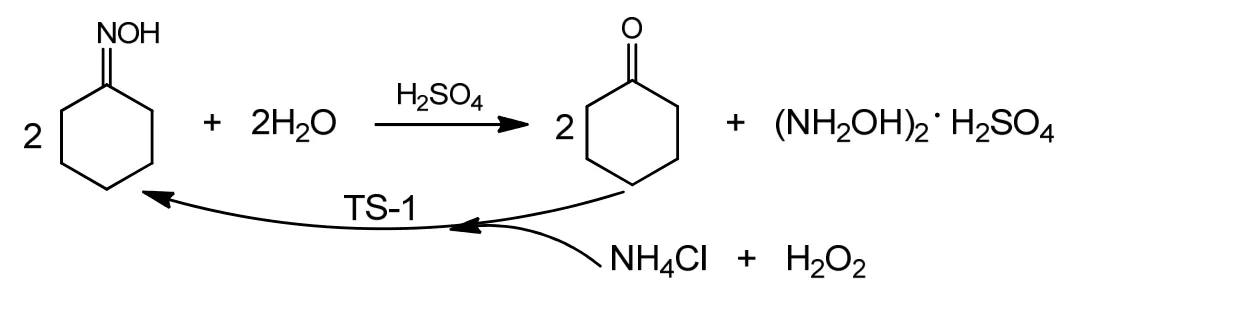
产物定性分析采用纯物质色谱的保留值定性法以及色谱-质谱联用法。气相色谱采用安捷伦科技有限公司生产的7890B气相色谱仪。气-质联用仪是安捷伦科技有限公司的 7890B-5977A气相色谱-质谱联用仪,质谱分析条件为EI源温度320 ℃,质量数(m/z)为20~550,倍增器电压为70 eV。气相色谱为氢火焰检测器,Agilent 123-7032 DB-WAX色谱柱,柱温90~225 ℃;程序升温,升温速率15 ℃/min;检测器温度250 ℃;汽化室温度260 ℃;载气流速为30 mL/min。图1为典型的气相色谱图,如图1所示的气相色谱图中只有甲苯、环己酮、环己酮肟三个物质的峰,无其他副产物。采用归一化方法定量计算环己酮肟的转化率(XCyo-O)。产品硫酸羟胺的收率YHAS计算如下:

其中,vCyo-O和vHAS分别为环己酮肟和硫酸羟胺的化学计量系数的绝对值;nCyo-O为环己酮肟初始加入量,mol;nHAS为硫酸羟胺生成量,mol。
图1 反应产物的气相色谱Fig.1 Gas chromatography of the reaction products
采用Nicolet Nexus 470型傅里叶变换红外光谱仪分析物质的官能团信息,KBr压片。元素组成分析采用美国热电公司生产的Flash EA 1112型全自动元素分析仪。熔点测定采用上海仪电物理光学仪器有限公司生产的WRS-3型熔点仪。
2 结果与讨论
2.1 环己酮肟水解反应随时间的变化
在环己酮肟88.5 mmol,去离子水、硫酸和环己酮肟物质的量之比为18.83:1.25:1,反应温度60 ℃的条件下,考察了环己酮肟水解反应性能随反应时间的变化情况,结果如图2所示。由图2可见,环己酮肟的转化率随反应时间的延长呈现先快速增加后趋于稳定的趋势。在反应时间为1 h时,环己酮肟的转化率为90.1%;继续延长反应时间,环己酮肟的转化率没有明显变化。综上所述,环己酮肟水解的适宜反应时间为1 h。
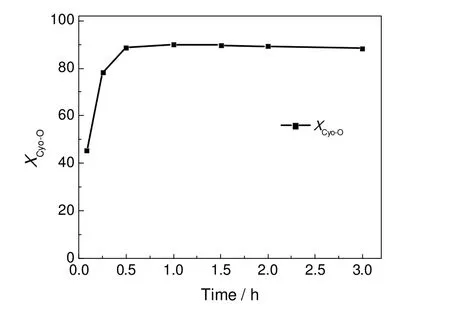
图2 不同反应时间下的环己酮肟水解反应性能Fig.2 The hydrolysis of cyclohexanone oxime under different reaction time
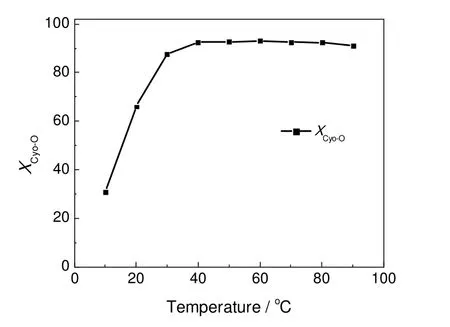
图3 不同反应温度下的环己酮肟水解反应性能Fig.3 The hydrolysis of cyclohexanone oxime under different reaction temperature
2.2 环己酮肟水解反应随温度的变化
在环己酮肟为88.5 mmol,去离子水、硫酸和环己酮肟物质的量之比为12.55:1.25:1,反应时间1 h的条件下,考察了环己酮肟水解反应性能随反应温度的变化情况,结果如图3所示。由图3可知,随着反应温度的升高,环己酮肟的转化率逐渐增加并趋于稳定。当反应温度为60 ℃时,环己酮肟的转化率即可达到92.9%。继续升高反应温度,环己酮肟的转化率变化不明显。因此,环己酮肟水解的适宜反应温度为60 ℃。

图4 不同去离子水用量下的环己酮肟水解反应性能Fig.4 The hydrolysis of cyclohexanone oxime under different amount of water
2.3 环己酮肟水解反应随水量的变化
在环己酮肟88.5 mmol,硫酸和环己酮肟物质的量之比1.25:1,反应温度60 ℃,反应时间1 h的条件下,考察环己酮肟水解反应性能随水量的变化情况,结果如图4所示。由图4可见,随着水和环己酮肟物质的量之比不断增大,环己酮肟的转化率先增加后略有降低。水和环己酮肟比为12.55:1时,环己酮肟的转化率达到 92.9%。水作为环己酮肟水解反应的原料,理论上,水与环己酮肟比为 1:1时,水解反应即可进行。由于环己酮肟是固体、水为液体,水与环己酮肟比为1:1时,水量(约1.6 mL)太少,不易形成均匀的反应体系,且不便于实际操作,故水的加入量通常是过量的。从这方面来说,水又充当了反应介质。但是,水量过多,不仅会增大后续产物分离提纯的能耗,且会导致反应体系中产物羟胺的浓度降低,使得羟胺更易发生分解[13]。此外,由于实验中萃取剂的用量是不变的,故水量增大会导致萃取效果变差,因而水和环己酮肟物质的量之比为12.55:1~31.4:1,环己酮肟的转化率略微降低。因此,较适宜的去离子水和环己酮肟物质的量之比为12.55:1。
2.4 环己酮肟水解反应随硫酸量的变化
在环己酮肟为88.5 mmol,去离子水和环己酮肟物质的量之比为12.55:1,反应温度60 ℃,反应时间1 h的条件下,考察环己酮肟水解反应性能随硫酸用量的变化情况,结果如图5所示。由图5可以看出,硫酸和环己酮肟物质的量之比不断增大,环己酮肟的转化率先快速上升后缓慢增加,最后趋于稳定。加入稍过量的硫酸,有利于水解反应;而且,硫酸可与产物羟胺结合生成硫酸羟胺,过量的硫酸还有利于抑制羟胺分解。但是,硫酸用量过多,则增加后续产物分离的困难,实际操作中要选择适宜的硫酸用量。综上,该反应适宜的硫酸和环己酮肟物质的量之比为1.87:1。

图5 不同硫酸用量下的环己酮肟水解反应性能Fig.5 The hydrolysis of cyclohexanone oxime under different amount of sulfuric acid
2.5 产物硫酸羟胺的实际收率
表1为实验所得的硫酸羟胺收率。可以看到,尽管硫酸羟胺的理论收率均高于99%,但是硫酸羟胺的实际收率约40%。实际收率不高的原因可能有以下两点:一是环己酮肟水解反应过程中羟胺会随着反应进行而少量分解[14];二是由反应液处理得到硫酸羟胺固体产品的过程中,经过萃取、中和、抽滤、旋蒸、洗涤和干燥等步骤,操作过程中可能会造成产品分解[15],或无法避免的损失。因此,今后仍需进一步研究反应参数、简化操作过程,以提高羟胺盐产品实际收率。

表1 环己酮肟水解反应制备硫酸羟胺的结果Table 1 Results of hydrolysis of cyclohexanone oxime to hydroxylamine sulfate
2.6 硫酸羟胺的表征
将上述分离得到的固体产品进行相关表征分析,结果见图6和表2。

表2 硫酸羟胺的元素分析和熔点分析结果Table 2 Chemical compositions and melting point of hydroxylamine sulfate
图6为固体样品与市售硫酸羟胺的红外谱图,可以看出,两者的红外谱图基本一致。从表2可以看出,N,H和S元素的实测值与市售硫酸羟胺的测量值比较接近,但是自制固体样品中还含有少量C元素。因为理论上硫酸羟胺不应含有C元素,所以这少量的 C元素应该归属于自制样品中的杂质。结合表2中的熔点数据,市售硫酸羟胺熔点为168.1~173.8 ℃,自制硫酸羟胺熔点 167.3~172.6 ℃。相对于市售硫酸羟胺,自制硫酸羟胺的熔程缩短,熔点降低,可能原因是硫酸羟胺制备和分离过程中,引入的杂质没有完全除去。后续工作将进一步提高硫酸羟胺的产品纯度。综上所述,可以确认所制备的固体为硫酸羟胺。
为了进一步验证所制备的固体产品硫酸羟胺的纯度,取等物质的量的自制硫酸羟胺和市售硫酸羟胺各5.0 mmol,分别与定量的环己酮10.0 mmol,60 ℃下反应1 h。根据环己酮的转化率来判断固体的纯度,理论上环己酮的转化率为 100%。自制硫酸羟胺的实际反应结果为 99.0%,与市售硫酸羟胺的99.2%相差不大,因此,固体为纯度较高的硫酸羟胺。

图6 硫酸羟胺的红外图谱Fig.6 FT-IR spectra of hydroxylamine sulfate
2.7 产物环己酮的循环使用性
另外,该反应过程的产物是硫酸羟胺和环己酮,绝大部分环己酮存在于萃取相中。经减压蒸馏可将环己酮和甲苯分离。甲苯可继续用作萃取剂,环己酮则用于生产环己酮肟。以联合制碱法的重要副产物-氯化铵为氮源,以环己酮肟水解制备硫酸羟胺的副产物环己酮为原料,以TS-1钛硅分子筛为催化剂,借助环己酮氨肟化反应合成环己酮肟,产物环己酮肟的选择性为99.3%,原料环己酮的转化率为99.0%。从而借助环己酮和环己酮肟的循环转化,实现了以氯化铵制备羟胺盐的组装过程,如图7所示。该项工作还在进一步的深入研究中。
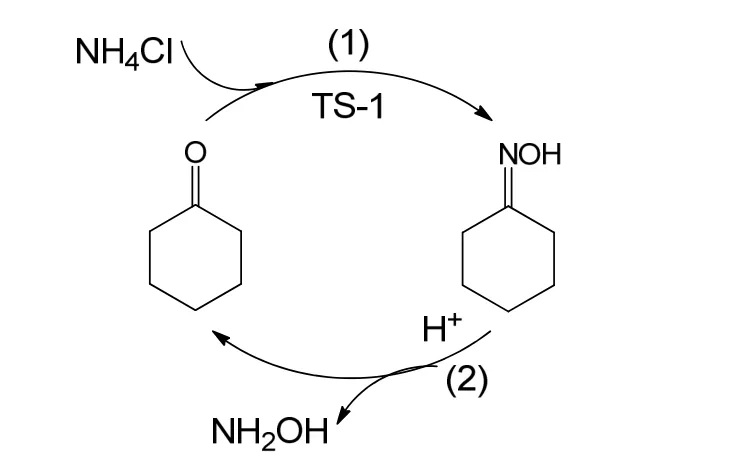
图7 以氯化铵为原料制备羟胺盐的反应过程Fig.7 Schematic of preparation of hydroxylamine salt using ammonium chloride as raw material
3 结 论
以自制环己酮肟为原料,在环己酮肟88.5 mmol,去离子水、硫酸和环己酮肟的物质的量之比为12.55:1.87:1,反应温度60 ℃的条件下反应1 h,环己酮肟的转化率接近100%,可得纯度较高的硫酸羟胺固体产品,收率为 41.7%。在此基础上,构建了以低附加值氯化铵为氮源的环己酮肟合成过程,并借助环己酮和环己酮肟的互相转化,实现以氯化铵制备羟胺盐的新工艺过程。该工艺路线,不仅改进了羟胺盐的合成方法,而且为合理利用氯化铵提供了新思路,间接促进了纯碱工业的健康发展。
[1]高丽雅, 檀学军, 张东升, 等.羟胺(盐)的合成及其应用研究进展 [J].化工进展, 2012, 31(9):2043-2048.Gao Liya, Tan Xuejun, Zhang Dongsheng, et al.Progress of synthesis and application of hydroxylamine (salts) [J].Chemical Industry and Engineering Progress, 2012, 31(9): 2043-2048.
[2]张国富, 温 馨, 王 涌, 等.氧化脱肟研究新进展 [J].化学进展, 2012, 24(2/3):361-369.Zhang Guofu, Wen Xin, Wang Yong, et al.Recent advances in oxidative deoximation [J].Progress in Chemistry, 2012, 24(2/3):361-369.
[3]Bars JL, Dakka J, Sheldon RA.Ammoximation of cyclohexanone and hydroxyaromatic ketones over titanium molecular sieves [J].Appl Catal A: Gen, 1996, 136(1): 69-80.
[4]Chu C Q, Zhao H T, Qi Y Y, et al.Density functional theory studies on hydroxylamine mechanism of cyclohexanone ammoximation on titanium silicalite-1 catalyst [J].J Mol Model, 2013, 19(6):2217-2224.
[5]陈 林.酮肟水解制备羟胺盐工艺 [D].湖南: 湘潭大学, 2009.
[6]陈武威.酮肟及其应用于盐酸羟胺的合成工艺研究 [D].浙江: 浙江大学, 2013.
[7]卢福军.肟的合成及其水解制备盐酸羟胺的新工艺研究 [D].山东: 青岛科技大学, 2016.
[8]吴井龙.肟水解反应—分离耦合技术的研究 [D].北京: 北京化工大学, 2016.
[9]Xu Y, Li Z, Gao L, et al.An Integrated Process for the Synthesis of Solid Hydroxylamine Salt with Ammonia and Hydrogen Peroxide as Raw Materials [J].Ind Eng Chem Res, 2015, 54(3):1068-1073.
[10]李瑞歌.酮肟酸催化水解制备硫酸羟胺及羟胺工艺研究 [D].湖南: 湘潭大学, 2015.
[11]Zhao F, You K, Peng C, et al.A simple and efficient approach for preparation of hydroxylamine sulfate from the acid-catalyzed hydrolysis reaction of cyclohexanone oxime [J].Chem Eng J, 2015, 272:102-107.
[12]Xu Y, Yang Q, Li Z, et al.Ammoximation of cyclohexanone to cyclohexanone oxime using ammonium chloride as nitrogen source [J].Chem Eng Sci, 2016, 152:717-723.
[13]Wei C, Saraf SR, Rogers WJ, et al.Thermal runaway reaction hazards and mechanisms of hydroxylamine with acid/base contaminants[J].Thermochimi Acta, 2004, 421(1): 1-9.
[14]Pitsadioti I, Lapouridis K, Georgopoulos S, et al.Thermal decomposition of hydroxylamine in aqueous solutions in the presence of NaCl,KCl or Na2SO4in the temperature range 120 ℃-140 ℃ [J].Journal of Loss Prevention in the Process Industries, 2017, 49, 177-182.
[15]张蒙蒙, 姬月萍, 刘卫孝, 等.羟胺稳定化研究进展 [J].化学推进剂与高分子材料, 2013, 11(2):12-17.Zhang Mengmeng, Ji Yueping, Liu Weixiao, et al.Research Progress in Stabilization of Hydroxylamine [J].Chemical Propellants &Polymeric Materials, 2013, 11 (2):12-17.
