普通小麦近缘种低分子量麦谷蛋白亚基Glu-A3基因的分离和鉴定
2017-06-05赵献林冯玉梅
董 雪 刘 梦 赵献林 冯玉梅 杨 燕,*
普通小麦近缘种低分子量麦谷蛋白亚基基因的分离和鉴定
董 雪1刘 梦1赵献林2,*冯玉梅1杨 燕1,*
1内蒙古农业大学生命科学学院植物生物技术功能实验室, 内蒙古呼和浩特 010018;2河南省农业科学院小麦研究所 / 河南省小麦生物学重点实验室 / 小麦国家工程实验室 / 农业部黄淮中部小麦生物学与遗传育种重点实验室, 河南郑州450002
低分子量麦谷蛋白约占小麦种子贮藏蛋白的三分之一, 对面团延展性和食品加工品质有重要影响。普通小麦近缘种是小麦遗传改良的重要基因资源。本研究利用位点特异性引物对野生二粒小麦、栽培二粒小麦、硬粒小麦及野生一粒小麦共计9份材料进行、、基因扩增和鉴定, 各发现5个等位变异, 共计15个单元型; 其中, 有2个等位变异含有9个半胱氨酸残基, 可能属于优良品质亚基。对小麦近缘种中这些位点等位变异的鉴别, 进一步完善了小麦低分子量麦谷蛋白亚基的构成, 并为小麦品质育种中亲本的选择提供了相应依据。
普通小麦近缘种; 低分子量麦谷蛋白亚基;基因; 等位变异
普通小麦近缘种植物是指小麦属中的其他物种和小麦族中的其他各属物种, 包括山羊草属(L.)、黑麦属(L.)、大麦属(L.)等38个属[1], 一粒小麦和二粒小麦被认为是普通小麦的祖先。近年来, 对小麦品质的改良越来越受到重视, 而蛋白质的含量和质量对小麦加工品质具有决定性作用。小麦贮藏蛋白主要包括麦谷蛋白和醇溶蛋白, 麦谷蛋白的含量对面筋强度有着重要影响。根据分子量大小的不同, 可将麦谷蛋白分为高分子量麦谷蛋白亚基(HMW-GS)和低分子量麦谷蛋白亚基(LMW-GS)[2], 其中LMW-GS约占麦谷蛋白的60%。大部分LMW-GS通过第一组染色体短臂上的(、和)位点编码[3]。在小麦中已报道的编码LMW-GS 家族的、和基因位点约有70个[2,4]; 在其他位点上也相继有过报道, 例如在染色体1B上的和[5], 在染色体1D上的和7D上的[6-7]。目前无论是在普通小麦或是近缘种材料中, 在D染色体上的LMW-GS基因要比在A和B染色体上的研究多一些。但是3个位点中不同等位基因的亚基间分子量很接近, 且有的亚基的鉴定需要依赖其表达量来区分[7-8], 所以很难发现新的亚基。由于低分子量麦谷蛋白亚基拷贝数较多, 其分子量与醇溶蛋白分子量相似, 用传统分离方法SDS-PAGE很难将其区分开来, 对LMW-GS的分析、分离以及鉴定技术还不够完善; 因此对LMW-GS远不及对HMW-GS研究得那么深入。近年来, 采用基因特异性引物已经从普通小麦品种、近等基因系和近缘种中获得了很多LMW-GS的编码基因及相应的单元型[8-11]。Wang等[12]从位点分离出3个LMW-GS基因,和, 共包含有6个等位基因(a, b, c, d, e, f), 并从位点分离出4个LMW-GS基因、、和以及相应的9个等位变异类型[12]; Zhao等[13]从位点分离出6个LMW-GS基因12个等位变异。许多研究认为, 在位点编码的LMW-GS等位基因对小麦品质有重要影响, 其中位点上的和等位基因对增加面团筋度和改善烘烤品质有重要贡献[14-17]。LMW-GS不仅存在于普通小麦品种中, 也存在于其近缘种中; 例如, Qin等[18]在野生二粒小麦位点鉴定出5个LMW-GS基因; Zhao等[13]证明节节麦也含有6个与普通小麦相对应的编码基因。目前, 从普通小麦及其近缘种中发现的LMW-GS基因、片段基因和假基因已经超过200个[2,4]。由于LMW-GS对小麦加工品质的重要性, 鉴定LMW-GS基因的等位变异, 开发出相应的分子标记, 对小麦品质育种具有重要意义[19]。目前为止, 已经研发出了一些LMW-GS基因的功能标记,如Zhang 等[20]根据位点的1个LMW-GS 基因的等位变异, 开发出一套位点等位基因的PCR标记, 可以有效地鉴定出该位点的等位基因类型, 并在小麦资源及育种材料的筛选中加以利用[21-23]; Zhao等[13]从位点扩增出6个LMW-GS基因的12个等位变异, 并根据各基因等位变异之间的SNP或InDel开发出7个单元型的STS标记; Wang等[12,23]对和位点的基因进行了鉴定, 开发出相应的特异性STS标记, 并利用CIMMYT小麦材料进行了验证。
鉴于普通小麦近缘种在小麦育种中的重要价值, 本研究利用特异性引物[23]对9份材料进行、、基因扩增和鉴定, 拟发现新的等位变异, 为小麦品质育种中的亲本选择提供理论依据。
1 材料及方法
1.1 植物材料及其DNA提取
供试材料包括9份含A组染色体的小麦近缘种, 其中野生一粒小麦3份(B01、B03和B04, AA), 野生二粒小麦3份(DS1、DS3和15, AABB), 栽培二粒小麦2份(DM2和DM3, AABB), 硬粒小麦1份(Langdon, AABB), 均由河南农业科学院小麦研究所提供。
选取每个供试材料3~5粒种子, 在洁净培养皿中25℃下培养5~7 d后, 取1~2 g叶片经液氮冷冻。采用CTAB法[24]提取基因组DNA。
1.2 引物筛选和PCR扩增
LMW-GS基因位点的特异性引物选自王林海文章[23], 引物序列及其他信息见表1。PCR扩增体系含模板 DNA 100 ng, 上、下游引物各1 μL (20 μmol L–1),DNA聚合酶(5 U µL–1, TaKaRa Ex) 1 µL, 10× PCR buffer 5 μL, dNTP Mix (2.5 mmol L-1) 4 μL, 加无菌水补充反应体系至50 μL。PCR扩增程序为: 94℃预变性5 min; 94℃变性45 s, 57~58℃退火45 s, 72℃延伸1 min, 共32个循环; 最后72℃延伸10 min, 4℃保存。
1.3 PCR产物纯化与克隆
采取两种方法测序, 一是直接测序, 二是克隆(利用北京全式金生物技术有限公司的pEASY-T1载体)后测序, 每个样品重复测序3~6次, 由南京金斯瑞生物技术有限公司完成。
1.4 核苷酸及推导氨基酸序列分析
核苷酸序列比对、推导氨基酸序列分析以及相关基因的序列比对, 均用DNAMAN和Vector NTI Advance软件完成。
2 结果与分析
2.1 普通小麦近缘种的等位变异检测
利用引物LA1F/LA1R对9份普通小麦近缘种进行基因扩增, 共获得6个目标条带(图1-A),测序分析后检测到6个等位变异类型。其中在硬粒小麦Langdon中扩增的核苷酸序列与GenBank中单元型(GenBank登录号为FJ549934.1)相同。另5个新的单元型分别来自栽培二粒小麦DM2, 野生二粒小麦DS3, 野生二粒小麦15、栽培二粒小麦DM3和野生一粒小麦B03, 其序列长度在1438~ 1537 bp之间, 编码区长度为1065~1164 bp, 分别命名为、、、和(GenBank登录号分别为KX879094、KX879095、KX879096、KX879097和KX879098)。将5个新的单元型与进行核苷酸序列比对, 发现在编码区第951 nt处碱基C替换为T, 使得对应的精氨酸(R)替换为半胱氨酸(C) (见附图1-A);在213–236 nt和990–998 nt处分别有24 bp和9 bp的缺失, 其推导的氨基酸序列AP1-9在对应位置分别有8个氨基酸和3个氨基酸的缺失, 另外有9个SNP为错义突变, 7个SNP为同义突变;在279~302 nt、621~623 nt和984~998 nt处, 分别有24、3和15 bp的缺失, 这些缺失并没有引起翻译阅读框架的改变, 另在编码区内有19个SNP, 包括8个错义突变, 8个同义突变和3个无义突变(编码终止密码子, 形成假基因);在编码区的213~236 nt和993~1001 nt处, 分别有24 bp和9 bp的碱基缺失, 另有19个SNP, 包括12个错义突变和7个同义突变, 在620 nt后有一个3 bp的插入。在编码区的300~302 nt、540~620 nt和990~1004 nt处分别有3、81和15 bp的缺失, 这些缺失并没有引起翻译阅读框架的改变, 另有35个SNP, 包括15个错义突变和20个同义突变。

表1 Glu-A3位点基因特异性引物
引物位置从参考基因的第一个核苷酸计算。引物序列来自王林海[23]。
Primer location counted from the first nucleotide of the available gene fragments. Primersequences are from Wang[23].
利用引物LA2F/LA2R扩增基因(图1-B), 共获得8个目标条带, 测序分析后共检测到6个等位变异类型。其中, 在野生一粒B01中扩增的序列与单元型(FJ549937.1)相同, 其他5个为新发现的等位变异类型, 分别命名为(KX879101, 来自野生二粒小麦DS1)、(KX879102, 来自野生二粒小麦DS3、栽培二粒小麦DM3以及硬粒小麦Langdon)、(KX879103, 来自栽培二粒小麦DM2)、(KX879104, 来自野生一粒小麦B03)和(KX879105, 来自野生一粒小麦B04), 其核苷酸序列长度在1070~1100 bp之间, 完整编码区长度为882~912 bp。在编码区内, 与单元型(FJ549937.1)相比, 等位变异类型、、和在320 nt后有3个CAA重复序列的缺失。另外,在368 nt后有21 bp的缺失, 使对应肽链的N-末端重复区缺少PFSQQQP序列(见附图1-B), 在728 nt处C碱基替换为A碱基, 使得编码酪氨酸的密码子UAC变为终止密码子UAA;包含4个错义突变和5个同义突变;和在485 nt后有一个3 bp (CAA)的插入序列, 且含有8个SNP;有3个错义突变和2个同义突变。
利用引物LA3F/LA3R扩增基因获得8个目标条带(图1-C), 测序分析检测到6个等位变异类型。从栽培二粒小麦DM2和DM3以及硬粒小麦Langdon中扩增得到的单元型(GenBank登录号为FJ549944.1)与王林海[23]报道的基因相同。另外5个为新的等位变异, 分别命名为(来自野生二粒小麦DS1, GenBank登录号为KX879108)、(来自野生二粒小麦15, GenBank登录号为KX879109)、(来自野生一粒小麦B01, GenBank登录号为KX879110)、(来自野生一粒小麦B03, GenBank登录号为KX879111)和(来自野生一粒小麦B04, GenBank登录号为KX879112), 它们的序列长度在1348~1420 bp之间, 其完整编码区序列长度为972~1044 bp。与单元型编码区相比, 等位变异有15个错义突变、17个同义突变和1个无义突变, 其中无义突变在第414个碱基处C替换成T, 形成终止密码子UAA。等位变异有7个错义突变, 12个同义突变和2个无义突变, 无义突变分别发生在第516 bp和921 bp处, 分别形成终止密码子UAA和UAG, 使得翻译终止(见附图1-C);中, 含有19个错义突变、18个同义突变和2个无义突变, 其中无义突变在345 nt和1012 nt处, 均为C替换T, 翻译成终止密码子; 等位变异共有45个SNP, 在230 nt后有2个CAA重复序列的插入, 该插入并没有引起翻译阅读框架的移动; 等位变异有17个错义突变, 21个同义突变及2个无义突变, 无义突变分别发生在612 nt和759 nt处, 均为C替换T, 导致翻译终止, 形成假基因。
A: LA1F/LA1R扩增产物(1438~1537 bp); B: LA2F/LA2R扩增产物(1070~1100 bp); C: LA3F/LA3R扩增产物(1348~1420 bp)。M: DL2000 marker; 1: 野生二粒小麦DS1; 2: 野生二粒小麦DS3; 3: 野生二粒小麦15; 4: 栽培二粒小麦DM2; 5: 栽培二粒小麦DM3; 6: 硬粒小麦Langdon; 7: 野生一粒小麦B01; 8: 野生一粒小麦B03; 9: 野生一粒小麦B04。
A: PCR products amplified with the primer set LA1F/LA1R (1438–1537 bp); B: PCR products amplified with the primer set LA2F/LA2R (1070–1100 bp); C: PCR products amplified with the primer set LA3F/LA3R (1348–1420 bp). M: DL2000 marker; 1:DS1; 2:DS3; 3:15; 4:DM2; 5:DM3; 6:Langdon; 7:accession B01; 8:B03; 9:B04.
2.2 普通小麦近缘种基因的等位变异推导氨基酸特征
本研究获得的3个基因、和的每一个单元型在起始密码子上游区域都含有TATA结构和起始密码子ATG; 其中和含有双联体终止密码子TGATAA; 而中的单元型和含有单个终止密码子;和编码区的下游区域有多个多聚腺苷酸AATAAA结构。
从基因推导氨基酸序列可以看出,的等位变异、、和,的等位变异、、和以及的等位变异都含有完整的开放阅读框, 可以编码完整的氨基酸序列; 而其他等位变异(、、、、和)在编码区内各含有1~2个终止密码子, 属于假基因。其中编码的肽链AP1-8和编码的肽链AP3-12均含有9个半胱氨酸残基(见附图1-A), AP1-8多出的半胱氨酸位于半胱氨酸富集区, AP3-12多出的半胱氨酸则位于谷酰胺富集区; 其余新发现的单元型编码的肽链则具有典型的8个半胱氨酸残基。
2.3 在普通小麦近缘种中新扩增基因与GenBank相关基因的相似性
与GenBank中普通小麦基因比对, 本研究从近缘种中得到的、和与相应的普通小麦基因之间的相似性依次为96.5%~99.9%、98.9%~99.7%和95.8%~99.4% (表2), 其中不同来源的相似性最高, 而不同来源的相似性最低。将本研究扩增的3个基因的15个单元型与GenBank中的序列比对, 基因序列之间的相似性在67.7%~99.9%之间(表2); 其中, 本研究扩增的和单元型与GenBank中部分基因序列的相似性分别达到99%以上, 而在的5个新等位变异中, 只有与的相似性达到99.4%, 其余的相似度均在99%以下, 说明基因的碱基序列变化大于其他2个基因。
由于在GenBank中注册的这些普通小麦基因序列的长度差别较大, 有的序列只包括编码区, 而有的不止有编码区还包含了调控区的序列。为了更进一步地探讨基因在进化上与普通小麦的关系, 我们把本研究中发现的15个特有的单元型与GenBank中搜索到的32个普通小麦和1个硬粒小麦的基因(AY146587)的编码区进行了亲缘关系分析, 保证了这些基因序列之间的比较区域都是从起始密码子开始到终止密码子结束(图2)。进化树显示, 所有序列分属于3个分支, 其中有20个序列和基因的序列聚为一类, 7个序列和基因的序列聚为一类, 6个序列和基因的序列聚为一类。可以看出, 在普通小麦和硬粒小麦中大部分序列和基因有更近的亲缘关系, 说明基因比和基因更多地参与到小麦的进化过程中。
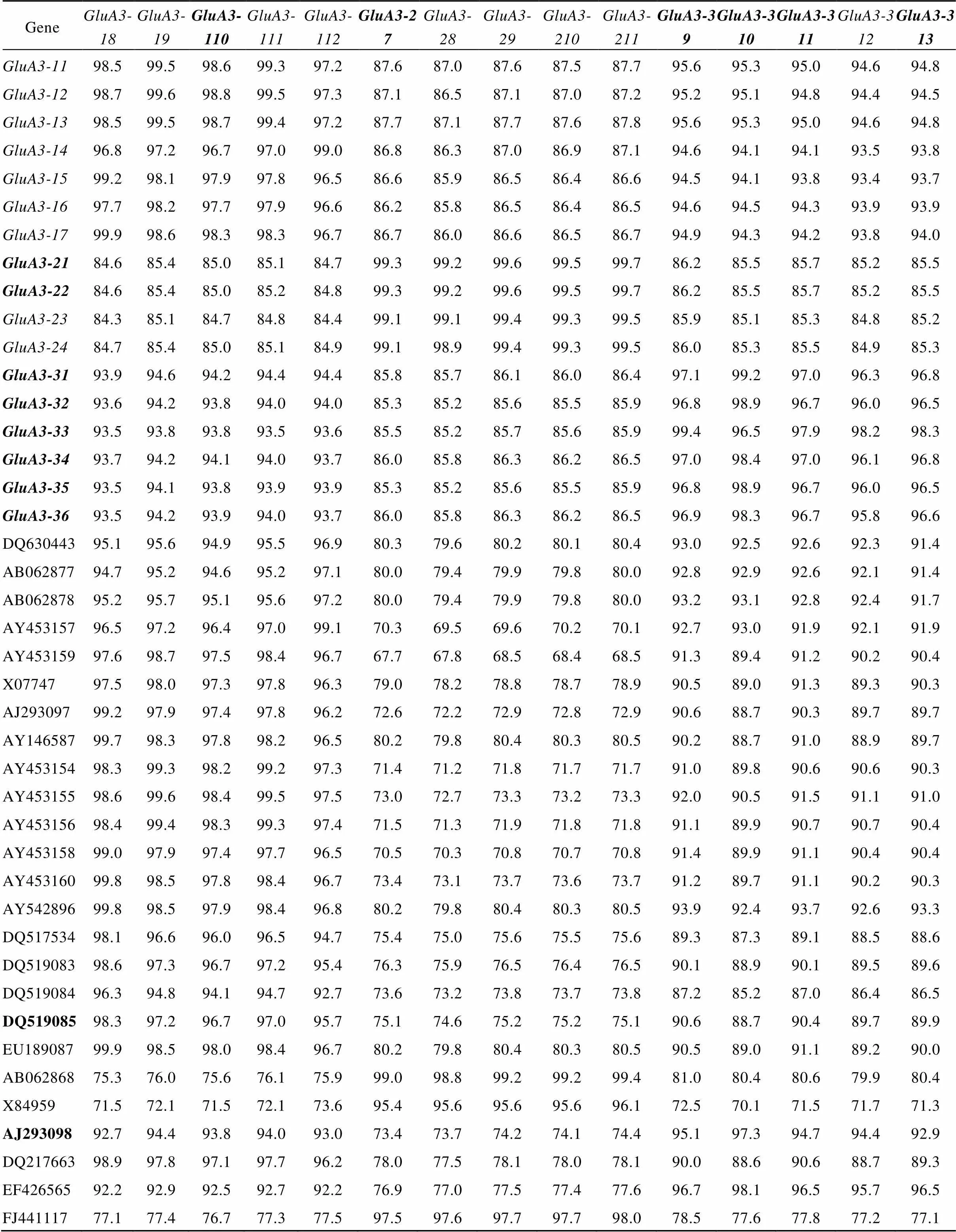
表2 本研究鉴定的Glu-A3位点新单元型与GenBank中相关序列的同源性比较
不考虑序列长度。加粗体表示假基因。Irrespective of the sequence length. Pseudogenes are in bold font.
3 讨论
低分子量麦谷蛋白亚基基因核苷酸序列的长短, 主要是由重复区内重复序列的多少决定的, 不同等位变异之间的差别则取决于核苷酸序列间SNP和InDel的数目。本研究在9份小麦近缘种中发现、和的18个单元型, 其中3种单元型(、和)曾在普通小麦中报道过[23], 分别来自硬粒小麦Langdon、野生一粒B01及栽培一粒小麦DM2、DM3和硬粒小麦Langdon, 据此推测, 这些近缘种很可能与普通小麦的起源有关。另外15个单元型以前未见报道, 属于新的等位变异类型, 分别是等位变异、、、和,等位变异、、、和, 以及等位变异、、和。、和基因间的相似性约为83.5%~95.6%, 而这3个基因各自的等位变异之间的相似性分别为96.4%~99.9%、98.9%~99.8%和95.8%~99.4% (表2和表3)。在每一基因的等位变异之间存在着较大的碱基序列和氨基酸序列差异, 充分证明在普通小麦近缘种中有广泛的LMW-GS基因多样性, 是小麦品质遗传改良不可忽视的基因资源。同时发现,基因的等位变异类型多数为假基因, 只有在野生一粒小麦B03中得到的单元型在理论上能够表达, 这一证据支持一粒小麦是普通小麦的祖先的结论[25]。
根据N末端起始氨基酸的不同(甲硫氨酸、丝氨酸或异亮氨酸), 又可将低分子量麦谷蛋白亚基分为LMW-m、LMW-s和LMW-i 3种类型[26-27]。据此可以确定, 本研究获得的氨基酸序列AP1和AP3的N末端为 ISQQQQ-, 属于LMW-i类型, AP2的N-末端为MDTSYIP-和 MDTSCIP-, 属于LMW-m类型。编码的AP1的分子量范围为40.8~44.7 kDa,编码的AP2的分子量为32.8~34.2 kDa,编码的AP3的分子量为36.7~39.9 kDa, 与前人报道基本一致[12,23]。
最难得的是, 在栽培二粒小麦DM2和野生一粒小麦B03中获得含有9个半胱氨酸残基的LMW-GS。而大多数LMW-GS含有8个半胱氨酸残基, 在第1和第7位上的半胱氨酸残基形成分子间二硫键, 其余6个形成分子内二硫键。AP1-8和AP3-12都是在第6位和第7位半胱氨酸残基之间多出一个半胱氨酸残基。Zhao等[28]在小麦品种小偃6号的1D染色体上发现含有9个半胱氨酸残基的LMW-GS, 其多出的半胱氨酸残基在第3和第4位半胱氨酸残基之间; 另外, 李黎等[9]在小麦品种豫麦50的1D染色体上也发现了含有9个半胱氨酸残基的LMW-GS, 其多出的半胱氨酸残基在C末端I区内。Si等[11]在1B染色体上也发现含有9个半胱氨酸残基的LMW-GS, 其多出的半胱氨酸残基在第7和第8位半胱氨酸残基之间。根据Zhao等[28]和Xu等[29]的报道, 与含有8个半胱氨酸残基LMW-GS材料的面粉相比, 含有9个半胱氨酸残基的LMW-GS更有助于形成分子间二硫键, 进而提高和面时间、显著增强面团强度、增多蛋白聚合体, 减弱抗延阻力。进一步对栽培二粒小麦DM2和野生一粒小麦B03获得含有9个半胱氨酸残基的LMW-GS的二级结构预测发现, AP3-12蛋白二级结构中α-螺旋和β-折叠所占的比例之和为22.8%, 明显低于位点的其他LMW-GS中α-螺旋和β-折叠的比例之和(25.2%~29.3%), 这种二级结构的变化可能与多出的一个半胱氨酸残基有关, 使得该LMW-GS更有利于形成分子间二硫键, 从而影响其三级结构的构型, 进而会影响蛋白的功能及面粉品质。据此推测, 栽培二粒小麦DM2和野生一粒小麦B03有可能是小麦优质育种的基因资源, 这有待进一步深入研究。

表3 3个Glu-A3基因的15个新单元型(下对角线)及其推导氨基酸(上对角线)序列的相似性比较
下对角线为新单元型, 上对角线为推导氨基酸, 不考虑序列长度。加粗体表示假基因。
New haplotypes are below diagonal; new haplotypes deduced amino-acid sequences are above diagonal; irrespective of the sequence length. Pseudogenes are in bold font.
4 结论
普通小麦近缘种中LMW-GS的基因存在着丰富的等位变异。在野生二粒小麦、栽培二粒小麦、硬粒小麦和野生一粒小麦共9份材料中, 发现、和基因的15个新的等位变异; 其中在栽培二粒小麦DM2和野生一粒小麦中鉴定出的2个LMW-GS基因各含有9个半胱氨酸残基, 有可能是小麦优质育种不可多得的基因资源。
References
[1] Löve Á. Conspectus of the Triticeae., 1984, 95: 425–521
[2] Luo C, Griffin W B, Branlard G, Mcneil D L. Comparison of low- and high molecular-weight wheat glutenin allele effects on flour quality., 2001, 102: 1088–1098
[3] Zhen S M, Han C X, Ma C Y, Gu A Q, Zhang M, Shen X X, Li X H, Yan Y M. Deletion of the low-molecular-weight glutenin subunit alleleof wheat (L) significantly reduces dough strength and breadmaking quality., 2014, 14: 367
[4] McIntosh R A,Yamazaki Y, Devos K M, Dubcovsky J, Rogers W J, Appels R. Catalogue of gene symbols for wheat.Proceedings of the 10th international wheat genetics symposium, Paestum, Italy, 2003
[5] Liu C Y, Shepherd K W. Inheritance of B subunits of glutenin and ω-and γ-gliadins in tetraploid wheats., 1995, 90: 1149–1157
[6] Sreeramulu G, Singh N K. Genetic and biochemical characterization of novel low molecular weight glutenin subunits in wheat., 1997, 40: 41–48
[7] D'Ovidio R, Masci S. The low-molecular-weight glutenin subunits of wheat gluten., 2004, 39: 321–339
[8] Luo G B, Zhang X F, Zhang Y L, Yang W L, Li Y W, Sun J Z, Zhan K H, Zhang A M, Liu D C. Composition, variation, expression and evolution of low-molecular-weight glutenin subunit genes in., 2015, 15: 68
[9] 李黎, 李锁平, 李玉阁. 豫麦50低分子量麦谷蛋白亚基基因的克隆与序列分析. 麦类作物学报, 2015, 35: 1215–1221Li L,Li S P,Li Y G.Cloning and sequence analysis ofLMW-GS genes from common wheat (L.) cultivar Yumai 50., 2015, 35: 1215–1221 (in Chinese with English abstract)
[10] Wang Y P, Zhen S M, Luo N N, Han C X, Lu X B, Li X H, Xia X C, He Z H, Yan Y M. Low molecular weight glutenin subunit geneconfers superior dough strength and breadmaking quality in wheat (L)., 2016, 6: 27182
[11] Si H Q, Zhao M L, Zhang X, Yao Guo L, Sun G L, Ma C X. Cloning and characterization of low-molecular-weight glutenin subunit alleles from Chinese wheat landraces (L.).2014, 2014: 371045
[12] Wang L H, Zhao X L, He Z H, Ma W, Appels R, Peña R J, Xia X C. Characterization of low-molecular-weight glutenin subunitgenes and development of STS markers in common wheat (L.)., 2009, 118: 525–539
[13] Zhao X L, Yang Y, He Z H, Lei Z S, Ma W, Sun Q X, Xia X C. Characterization of novel LMW-GS genes atlocus of chromosome 1D in., 2008, 145: 238–250
[14] 程西永, 吴少辉, 李海霞, 董中东, 任妍, 詹克慧, 许海霞. 小麦高、低分子量麦谷蛋白亚基对品质性状的影响. 麦类作物学报, 2014, 34: 482–488 Cheng X Y, Wu S H, Li H X, Dong Z D, Ren Y, Zhan K H, Xu H X. Effects of HMW and LMW glutenin subunits on wheat quality traits., 2014, 34: 482–488 (in Chinese with English abstract)
[15] Ito M, Fushie S, Funatsuki W M, Ikeda T M, Nishio Z, Nagasawa K, Tabiki T, Yamauchi H. Effect of allelic variation in three glutenin loci on dough properties and bread-making qualities of winter wheat., 2011, 61: 281–287
[16] Jin H, Zhang Y, Li G, Mu P, Fan Z, Xia X, He Z. Effects of allelic variation of HMW-GS and LMW-GS on mixograph properties and Chinese noodle and steamed bread qualities in a set of Aroona near-isogenic wheat lines., 2013, 57: 146–152
[17] Zhang X, Jin H, Zhang Y, Liu D, Li G, Xia X, Zhang A. Composition and functional analysis of low-molecular-weight glutenin alleles with Aroona near-isogenic lines of bread wheat., 2011, 12: 1–16
[18] Qin L M, Liang Y, Yang D Z, Sun L, Xia G G, Liu S W. Novel LMW glutenin subunit genes from wild emmer wheat (ssp.) in relation toevolution., 2015, 225: 31–37
[19] Andersen J R, Lübberstedt T. Functional markers in plants., 2003, 8: 554–560
[20] Zhang W, Gianibelli M C, Rampling L R, Gale K R. Characterisation and marker development for low molecular weight glutenin genes fromalleles of bread wheat (L.)., 2004, 108: 1409–1419
[21] 孙学永, 马传喜, 司红起, 张琪琪, 乔玉强. 中国小麦微核心种质低分子量麦谷蛋白位点等位基因的PCR检测. 分子植物育种, 2006, 4: 477–482 Sun X Y, Ma C X, Si H Q, Zhang Q Q, Qiao Y Q. Screeningalleles of LMW-GS genes from mini-core collections of Chinese wheat varieties using alleles-specific PCR markers., 2006, 4: 477–482 (in Chinese with English abstract)
[22] 赵曼丽. 低分子量麦谷蛋白亚基基因的克隆及序列分析. 安徽农业大学硕士学位论文, 安徽合肥, 2014 Zhao M L. Cloning and Sequence Analysis of Low Molecular Weight Glutein Subunit Gene. MS Thesis of Anhui Agricultural University, Hefei, China, 2014 (in Chinese with English abstract)
[23] 王林海. 普通小麦及其近缘种低分子量麦谷蛋白基因克隆与STS标记开发. 中国农业科学院博士学位论文, 北京, 2009 Wang L H. Characterisation of Low-Molecular-Weight Glutenin Genes and Development of STS Markers in Common Wheat and Its Relatives. PhD Dissertation of Chinese Academy of Agricultural Sciences, Beijing, China, 2009 (in Chinese with English abstract)
[24] Gale K R, Ma W, Zhang W, Rampling L, Hill A S, Appels R, Morris P, Morrel M. Simple high-throughput DNA markers for genotyping in wheat. In: Eastwood R, Hollamby G, Rathjen T, Gororo N, eds. Proceedings of 10th Australian Wheat Breeding Assembly. Mildura VIC: Wheat Breeding Society of Australia, 2001. pp 26–31
[25] Stepien L, Holubec V. Chelkowski J. Resistance genes in wild accessions of Triticeae-inoculation test and STS marker analyses., 2002, 43: 423–435
[26] Qin L M, Liang Y, Yang D Z, Sun L, Xia G M, Liu S W. Novel LMW glutenin subunit genes from wild emmer wheat (ssp.) in relation toevolution., 2015, 225: 1–7
[27] Long H, Wei Y M, Yan Z H, Baum B, Nevo E, Zhen Y L. Classification of wheat low-molecular-weight glutenin subunit genes and its chromosome assignment by developing LMW-GS group-specific primers., 2005, 111: 1251–1259
[28] Zhao H X, Wang R J, Guo A G, Hu S W, Sun G L. Development of primers specific for LMW-GS genes located on chromosome 1D and molecular characterization of a gene fromcomplex locus in breed wheat., 2004, 141: 193–198
[29] Xu H, Wang R J, Shen X, Zhao Y L, Sun G L, Zhao H X, Guo A G. Functional properties of a new low-molecular-weight glutenin subunit gene from a bread wheat cultivar., 2006, 113: 1295–1303
(附图1)
附图1位点推导氨基酸序列比对
Supplementary figure 1 Alignments of deduced amino-acid sequences onloci
(A): AP1-7与5个单元型推导氨基酸的序列比对; (B): AP2-3与5个单元型推导氨基酸的序列比对; (C): AP3-6与 5个单元型推导氨基酸的序列比对。带下画线的加粗体字母表示半胱氨酸残基, 灰色背景显示突变位点。黑色和白色倒三角分别指示N末端保守区和重复区的起始点; 箭头指表示C末端的3个亚区, 包括半胱氨酸富集区、谷酰胺富集区和末端保守区的起始点。
(A): Alignments of deduced amino-acid sequences (AP1-7) of onehaplotype and those (AP1-8 to AP1-12) of fivegenes; (B):Alignments of deduced amino-acid sequences (AP2-3) of onehaplotype and those (AP2-7 to AP2-11) of fivegenes; (C):Alignments of deduced amino-acid sequences (AP3-6) of onehaplotype and those (AP3-9 to AP3-13) of fivegenes. The positions of the cysteine residues are bold and underlined, and mutation loci are shadowed. Filled nabla the beginning of short N-terminal conserved region; open nabla shows the beginning of N-terminal repetitive domain; down arrow shows the beginning of the three subregions of C-terminal part of the protein, including a cysteine-rich region, a glutamine-rich region and shows the final conserved part of proteins, respectively.
Isolation and Characterization of LMW-GSin Common Wheat Related Species
DONG Xue1, LIU Meng1, ZHAO Xian-Lin2,*, FENG Yu-Mei1, and YANG Yan1,*
1The functional Laboratory of Plant Biotechnology, College of Life Sciences, Inner Mongolia Agricultural University, Huhhot 010018, China;2Wheat Research Institute, Henan Academy of Agricultural Sciences / Henan Key Laboratory of Wheat Biology / National Engineering Laboratory for Wheat / Key Laboratory of Wheat Biology and Genetic Breeding in Central Huang-Huai Region, Ministry of Agriculture, Zhengzhou 450002, China
Low-molecular-weight glutenin subunits (LMW-GS) account for about one-third of wheat seed storage proteins and have great effects on dough extensibility and food processing quality. Common wheat relative species are important genetic resources for wheat improvement. In this study, the specific primers ofgenes were used to identify the allelic variations of,,andfrom nine accessions of,,, and. A total of 15new haplotypes were identified, including five in, five in, and five in. Among them, two haplotypes each contained nine cysteines that might be good for improvement of wheat quality. The results aboutgenes in wheat further made clear composition of LMW-GS and provide a basis for selection of parents in wheat quality breeding.
Common wheat related species; LMW-GS;gene; Allelic variation
本研究由国家自然科学基金项目(31271726), 内蒙古自治区自然科学基金项目(2014MS0338), 内蒙古农业大学优秀青年科学基金项目(2014XYQ-18)和教育部春晖计划项目(Z2009-1-01060)资助。
This study was supported by the National Natural Science Foundation of China (31271726), the Natural Science Foundation of Inner Mongolia (2014MS0338), the Excellent Young Scientist Foundation of Inner Mongolia Agricultural University (2014XYQ-18), and the Chunhui Project funded by the Ministry of Education (Z2009-1-01060).
(收稿日期): 2016-10-02; Accepted(接受日期): 2017-01-21; Published online(网络出版日期): 2017-02-17.
10.3724/SP.J.1006.2017.00829
(Corresponding authors):杨燕, E-mail: yangyanchutao@126.com; 赵献林, E-mail: xlin918@126.com
E-mail: dongxue225@126.com
URL: http://www.cnki.net/kcms/detail/11.1809.S.20170217.1009.018.html
