PCR检测方法在多杀性巴氏杆菌定种中的应用
2017-06-05张媛李建李伟杰魏财文蒋玉文
张媛,李建,李伟杰,魏财文,蒋玉文
(中国兽医药品监察所,北京 100081)
PCR检测方法在多杀性巴氏杆菌定种中的应用
张媛,李建,李伟杰,魏财文,蒋玉文*
(中国兽医药品监察所,北京 100081)
为修订行业标准《猪巴氏杆菌病诊断技术》(NY/T 564-2002),改进多杀性巴氏杆菌定种方法,采用16S rDNA基因序列分析法对中国兽医微生物菌种保藏管理中心(CVCC)保藏的63株猪源多杀性巴氏杆菌进行复核鉴定。63株猪源多杀性巴氏杆菌中有60株菌种与原鉴定结果一致。建立多杀性巴氏杆菌基于kmtΙ基因的PCR定种方法,对经16S rDNA PCR方法确认为多杀性巴氏杆菌的60株菌进行定种。结果表明,60株菌均扩增出了预期片段,基于kmtΙ基因的PCR定种方法与16S rDNA PCR方法试验结果相一致。研究结果显示,可将基于kmtΙ基因的PCR定种方法增添至行业标准中,作为原有生化鉴定方法的补充进行多杀性巴氏杆菌的定种。
多杀性巴氏杆菌;16S rDNA基因;kmtΙ基因;序列分析
行业标准《猪巴氏杆菌病诊断技术》(NY/T 564-2002)[1]于2002年予以实施,其中病原鉴定、血清学试验等均通过菌株表型特征予以确定,广大兽医工作者参照此标准进行猪巴氏杆菌病的诊断[2-5]。但十余年来,分子生物学技术发展迅猛,许多新的分子生物学技术已经在巴氏杆菌病诊断中得以应用[6-8],这些新技术相比传统诊断技术更加快速便捷。为此,本课题组承担了《猪巴氏杆菌病诊断技术》(NY/T 564-2002)行业标准的修订工作,拟以中国兽医微生物菌种保藏管理中心(CVCC)保藏的猪源多杀性巴氏杆菌为研究对象,对多杀性巴氏杆菌定种方法开展研究。为了确保研究对象的准确性,本课题组采用16S rDNA基因序列分析法对CVCC保藏的63株猪源多杀性巴氏杆菌进行复核鉴定。鉴定结果表明,63株猪源多杀性巴氏杆菌中有60株菌种与原鉴定结果一致,可用于《猪巴氏杆菌病诊断技术》修订的研究工作。本课题组建立了基于kmtΙ基因的PCR定种方法,对经16S rDNA PCR方法确认为多杀性巴氏杆菌的60株菌进行定种,并将此结果与16S rDNA PCR结果相比,两种方法的定种结果完全吻合。这一结果为把基于kmtΙ基因的PCR定种方法增添至行业标准中提供了依据。
1 材料与方法
1.1 菌株 实验所用菌株为63株,均为CVCC保藏[9]。各菌株相关信息如表1所示。
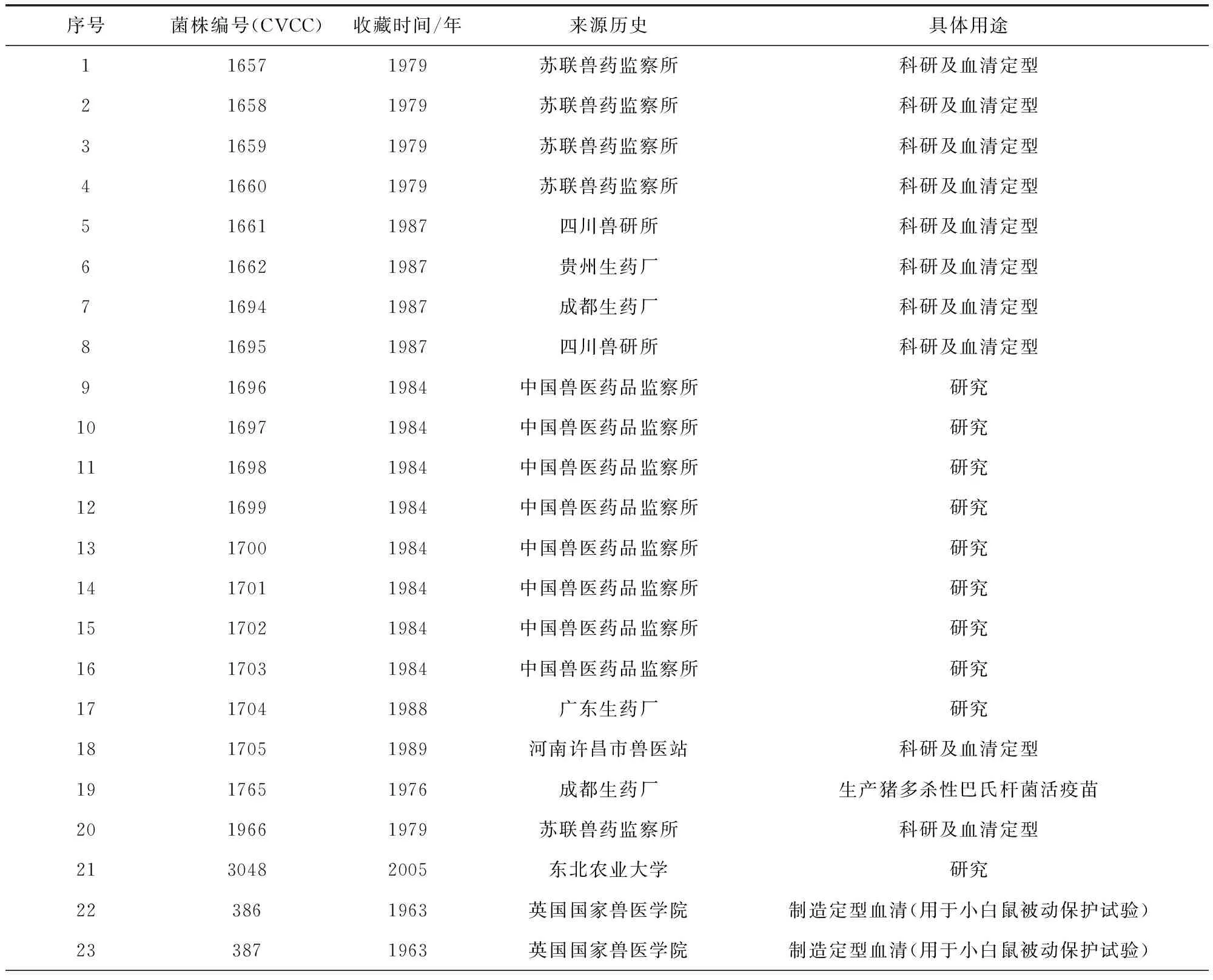
表1 实验所用菌株Tab 1 Strains in the test
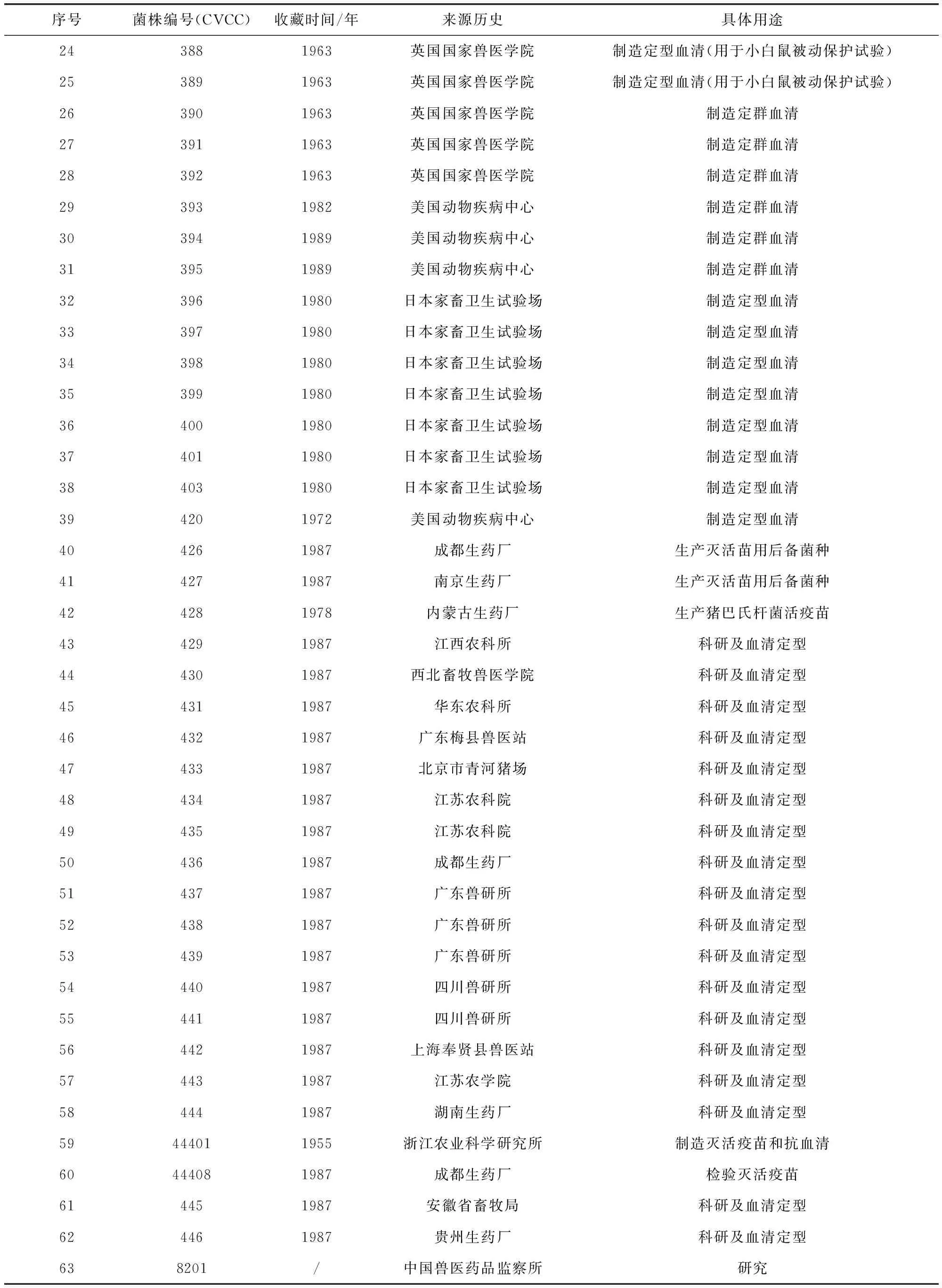
续表
1.2 培养基及试剂 马丁肉汤培养基、改良马丁琼脂培养基均购自北京中海动物保健科技公司。TaqDNA聚合酶、10×PCR缓冲液、dNTP、DL2000 DNA Marker和琼脂糖均购自宝生物工程(大连)有限公司。染料Goldview购自北京赛百盛基因技术有限公司。PCR阴性对照品和阳性对照品均由中国兽医药品监察所细菌制品检测室制备。
1.3 PCR引物 16S rDNA基因序列扩增引物:上游引物为5′-AGA GTT TGA TCC TGG CTC AG-3′,下游引物为5′-ACG GCT ACC TTG TTA CGA CTT-3′(表2)。kmtΙ基因序列扩增引物:上游引物为5′- ATC CGC TAT TTA CCC AGT GG -3′,下游引物为5′- GCT GTA AAC GAA CTC GCC AC -3′(表2)。引物均由上海Invitrogen公司合成。

表2 多杀性巴氏杆菌基因扩增用引物Tab 2 Primers for amplifying P. multocida genes
1.4 菌体培养 开启菌种,用含0.1%绵羊裂解血细胞全血及4%新生牛血清的马丁肉汤溶解菌种,划线接种含0.1%绵羊裂解血细胞全血及4%新生牛血清的改良马丁琼脂平板,37 ℃培养24 h。挑取单菌落接种含0.1%绵羊裂解血细胞全血及4%新生牛血清的马丁肉汤,37 ℃ 200 r/min培养15 h。
1.5 基因组DNA提取 取1 mL菌液12000 r/min离心1 min,尽弃上清,加入100 μL超纯水,混匀,沸水浴10 min,冰浴5 min,12000 r/min离心1 min,吸取上清作为16S rDNA PCR及基于kmtΙ基因PCR的模板。
1.6 PCR扩增及电泳检测 16S rDNA PCR反应体系为50 μL,依次加入超纯水36.75 μL,10×PCR缓冲液(含MgCl215 mmol/L及KCl 500 μmol/L) 5 μL,dNTP (2.5 mmol/L) 4 μL,上、下游引物(20 μmol/L)各1 μL,Taq DNA聚合酶(5 U/μL) 0.25 μL,模板2 μL。基于kmtΙ基因PCR反应体系亦为50 μL,依次加入超纯水36.75 μL,10×PCR缓冲液(含MgCl215 mmol/L及KCl 500 μmol/L) 5 μL,dNTP (2.5 mmol/L) 4 μL,上、下游引物(10 μmol/L)各1 μL,Taq DNA聚合酶(5 U/μL) 0.25 μL,模板2 μL。PCR反应条件均为95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30个循环,72 ℃延伸10 min。取10 μL 16S rDNA PCR产物用2%琼脂糖凝胶进行电泳,140 V电泳30 min。显色剂为Goldview。
1.7 序列测定及分析 取16S rDNA PCR产物送交上海基康生物工程有限公司测序。取测序结果进行序列拼接,根据峰值图修正重叠序列中几次测序结果不一致位置的核苷酸,选择测序峰较好区域的序列与GenBank上的DNA序列进行比对。
2 结 果
2.1 PCR扩增结果 16S rDNA PCR产物电泳条带1505 bp,部分菌株的16S rDNA基因扩增结果见图1。基于kmtΙ基因PCR产物电泳条带457 bp,部分菌株的基于kmtΙ基因扩增结果见图2。
2.2 16S rDNA序列比对分析结果 经核酸序列比对确定63株菌中有60株为多杀性巴氏杆菌,60株多杀性巴氏杆菌与GenBank公布的多杀性巴氏杆菌对应DNA序列的同源性均大于97%,比对结果见表3。
2.3 基于kmtΙ基因PCR定种结果 用多杀性巴氏杆菌基于kmtΙ基因种特异性PCR方法对经16S rDNA PCR方法确定为多杀性巴氏杆菌的60株菌进行种鉴定,符合率100%。
3 讨 论
原核生物的核糖体是由50S和30S两个亚基所组成,而30S亚基进一步由3种类型组成,即23S、16S和5S,它们分别含有约2900、1500和120个编码核苷酸[10]。目前由于分子量适中,又具有保守性和存在的普遍性等特点,一般采用16S rDNA对微生物进行测序分析。
一般来讲,在种分类等级上,如果2个分类单位间的16S rDNA序列同源性大于97%,则认为属于同一个种[11]。本课题组以多杀性巴氏杆菌16S rDNA的一段保守区序列设计了一对通用引物,对CVCC保藏的63株多杀性巴氏杆菌的一段16S rDNA序列进行扩增,并将扩增产物的核苷酸序列与GenBank上的标准序列进行比较,其中有60株菌与标准株核苷酸序列的同源性都大于97%,可以确认为多杀性巴氏杆菌。
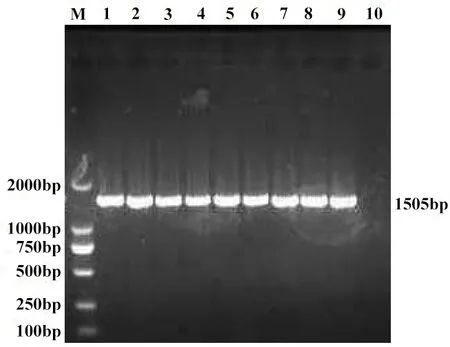
M:DNA分子质量标准;1:菌株CVCC1657;2: 菌株CVCC1658;3: 菌株CVCC1659;4:菌株CVCC1660;5:菌株CVCC1661;6:菌株CVCC1662;7:菌株CVCC1694;8:菌株CVCC1695;9:菌株CVCC1696;10:阴性对照:无菌超纯水M: DNA marker; 1: CVCC1657 strain; 2: CVCC1658 strain;3: CVCC1659 strain; 4: CVCC1660 strain; 5:CVCC1661 strain; 6: CVCC1662 strain; 7: CVCC1694 strain; 8: CVCC1695 strain;9: CVCC1696 strain; 10: Negative control: sterile ultrapure water图1 9株多杀性巴氏杆菌16S rDNA PCR产物的电泳图Fig.1 Electrophoresis of 16S rDNA PCR products from 9 strains P. multocida
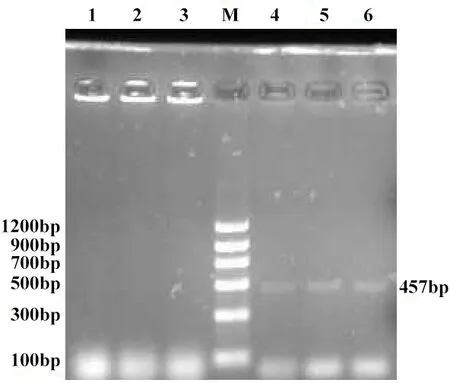
M:DNA分子质量标准;1:胸膜肺炎放线杆菌;2: 副猪嗜血杆菌;3:波氏杆菌;4:菌株CVCC1657;5:菌株CVCC1658;6:菌株CVCC1659M: DNA marker; 1: Actinobacillus pleuropneumoniae; 2: Haemophilus suis; 3: bordetella bacilli; 4: CVCC1657 strain; 5: CVCC1658 strain; 6: CVCC1659 strain图2 3株多杀性巴氏杆菌kmtΙ PCR产物的电泳图Fig.2 Electrophoresis of kmtΙ PCR products from 3 strains P. multocida

菌株编号鉴定结果菌株编号鉴定结果菌株编号鉴定结果CVCC44401多杀性巴氏杆菌CVCC1966多杀性巴氏杆菌CVCC429多杀性巴氏杆菌CVCC44408多杀性巴氏杆菌CVCC3048BacteriumNLAECVCC430多杀性巴氏杆菌CVCC1657多杀性巴氏杆菌CVCC386多杀性巴氏杆菌CVCC427多杀性巴氏杆菌CVCC1658多杀性巴氏杆菌CVCC387多杀性巴氏杆菌CVCC428多杀性巴氏杆菌CVCC1659多杀性巴氏杆菌CVCC388多杀性巴氏杆菌CVCC431多杀性巴氏杆菌CVCC1660多杀性巴氏杆菌CVCC389多杀性巴氏杆菌CVCC432多杀性巴氏杆菌CVCC1661多杀性巴氏杆菌CVCC390多杀性巴氏杆菌CVCC433多杀性巴氏杆菌CVCC1662多杀性巴氏杆菌CVCC391多杀性巴氏杆菌CVCC434多杀性巴氏杆菌CVCC1694多杀性巴氏杆菌CVCC392多杀性巴氏杆菌CVCC435多杀性巴氏杆菌CVCC1695多杀性巴氏杆菌CVCC393多杀性巴氏杆菌CVCC436多杀性巴氏杆菌CVCC1696多杀性巴氏杆菌CVCC394多杀性巴氏杆菌CVCC437多杀性巴氏杆菌CVCC1697多杀性巴氏杆菌CVCC395多杀性巴氏杆菌CVCC438多杀性巴氏杆菌CVCC1698多杀性巴氏杆菌CVCC396多杀性巴氏杆菌CVCC439多杀性巴氏杆菌CVCC1699多杀性巴氏杆菌CVCC397多杀性巴氏杆菌CVCC440BisgaardTassonCVCC1700多杀性巴氏杆菌CVCC398多杀性巴氏杆菌CVCC441多杀性巴氏杆菌CVCC1701多杀性巴氏杆菌CVCC399多杀性巴氏杆菌CVCC442多杀性巴氏杆菌CVCC1702多杀性巴氏杆菌CVCC400多杀性巴氏杆菌CVCC443多杀性巴氏杆菌CVCC1703多杀性巴氏杆菌CVCC401多杀性巴氏杆菌CVCC444多杀性巴氏杆菌CVCC1704多杀性巴氏杆菌CVCC403多杀性巴氏杆菌CVCC445多杀性巴氏杆菌CVCC1705多杀性巴氏杆菌CVCC420多杀性巴氏杆菌CVCC446多杀性巴氏杆菌CVCC1765多杀性巴氏杆菌CVCC426多杀性巴氏杆菌CVCC8201Enterococcusfaecalis
2001年国外学者Townsend通过消减杂交确定了多杀性巴氏杆菌种特异性基因kmtΙ,针对该特异性DNA序列设计引物,所有的多杀性巴氏杆菌都可以扩增出一个460 bp的片段,由此建立了多杀性巴氏杆菌定种的PCR鉴定方法[12]。Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2014已将kmtΙ作为靶基因建立多杀性巴氏杆菌的PCR诊断技术,用于出血性败血症的病原鉴定。虽然基于kmtΙ基因种特异性PCR方法与16S rDNA PCR方法试验结果的符合率为100%,但鉴于采用基于kmtΙ基因种特异性PCR方法对多杀性巴氏杆菌定种无需测序及序列分析,较16S rDNA PCR方法在应用上更加快捷,故拟将基于kmtΙ基因种特异性PCR方法增添至行业标准中以实现猪巴氏杆菌病病原的快速鉴定,从而满足猪巴氏杆菌病快速诊断的需求。
[1] NY/T 564-2002. 猪巴氏杆菌病诊断技术[S].
NY/T 564-2002. Diagnostic Techniques of swine Pasteurellosis[S].
[2] 岛明康, 李进涛. 猪巴氏杆菌病的诊治及其预防[J]. 云南畜牧兽医, 2013(6): 2-4.
DAO M K, LI J T. Diagnosis and prevention of swine pasteurellosis[J].Yunnan Journal of Animal Science and Veterinary Medicine,2013(6):2-4.
[3] 任士飞, 张林吉. 一例猪巴氏杆菌病的实验室诊断及治疗[J]. 上海畜牧兽医通讯, 2013(6): 94-95.
REN S F, ZHANG J L. Laboratory diagnosis and treatment of one case of swine pasteurellosis[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine,2013(6):94-95.
[4] 郑书森. 猪巴氏杆菌病的诊断及防治[J]. 湖北畜牧兽医,2013, 34(8).
ZHENG S S. Diagnosis, prevention and cure of swine pasteurellosis[J]. Hubei Journal of Animal and Veterinary Sciences,2013,34(8).
[5] 李宝林, 金海林. 猪巴氏杆菌病的诊断与防治[J]. 甘肃畜牧兽医, 2013(10): 34-35.
LI B L, JIN H L. Diagnosis, prevention and cure of swine pasteurellosis [J]. Gansu Animal and Veterinary Sciences,2013(10):34-35.
[6] 黄海燕, 王印, 彭娟, 等. 猪源多杀性巴氏杆菌PCR鉴定方法的建立[J]. 畜牧兽医学报, 2012, 43(7): 1111-1116.
HUANG H Y, WANG Y, PENG J,etal. Development of PCR identification method forPasteurellamultocidafrom porcine[J]. Acta Veterinaria Et Zootechnica Sinica,2012,43(7):1111-1116.
[7] 李鹏, 马艳娇, 夏伟, 等. 猪肺炎支原体、多杀性巴氏杆菌和猪胸膜肺炎放线杆菌三重PCR检测方法的建立[J]. 中国预防兽医学报,2010,32(8):607-610.
LI P, MA Y J, Xia W,etal. Development of multiplex PCR for detection of swineMycoplasmalpneumonia,PasteurellamultocidaandActinobacillus[J]. Chinese Journal of Preventive Veterinary Medicine,2010,32(8):607-610.
[8] 贺 英, 赵萍, 储岳峰, 等. 复合PCR鉴定巴氏杆菌和副猪嗜血杆菌的方法[J]. 江苏农业学报,2009,25(6):1315-1319.
HE Y, ZHAO P, Chu Y F,etal. Method of multiplex-PCR for identification ofPasteurellamultocidaandHaemophilusparasuis[J]. Jiangsu Journal of Agricultural Sciences,2009,25(6):1315-1319.
[9] 中国兽医药品监察所.中国兽医菌种目录[M]. 2版. 北京:中国农业科学技术出版社, 2002: 94 -95.
China Institute of Veterinary Drugs Control. China Veterinary Species Catalogue[M]. 2nd ed . Beijing: Chinese Agricultural Science and Technology Press, 2002: 94-95.
[10]冯瑞华. 用AFLP技术和16S rDNA PCR-RFLP 分析毛苜蓿根瘤菌的遗传多样性[J]. 微生物学报,2000,40(4):339-345.
FENG R H. Genetic diversity of rhizobia ofMedicagoedgeworthiiby AFLP and RFLP analysis[J]. Acta Microbiologica Sinica,2000,40(4):339-345.
[11]Stackebrandt E, Goebel B M. Taxonomic note: a place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology[J]. Int J Syst Bacteriol, 1994, 44: 842-849.
[12]Townsend K M, Boyce J D, Chung J Y,etal. Genetic organization ofPasteurellamultocidacap loci and development of a multiplex capsular PCR typing system[J]. J Clin Microbiol, 2001, 39: 924-929.
(编辑:李文平)
Application of PCR for Identification ofPasteurellamultocida
ZHANG Yuan, LI Jian, LI Wei-jie, WEI Cai-wen, JIANG Yu-wen*
(China Institute of Veterinary Drug Control, Beijing 100081, China)
JIANG Yu-wen, E-mail: jiangyuwen@ivdc.org.cn
In order to revise the industry standard Diagnostic Techniques of Swine Pasteurella (NY/T 564-2002), 16S rDNA sequence analysis was added to identifyPasteurellamultocida. 63 strains ofPasteurellamultocidafrom swine in China Veterinary Culture Collection Center(CVCC) were check identified with 16S rDNA sequence analysis. 60 strains of 63 strains suspectedPasteurellamultocidawere identified asPasteurellamultocida.PasteurellamultocidakmtΙPCR identification method was constructed and applied to identify the above 60 strains ofPasteurellamultocida. As a result, expected size DNA was amplified.The result is accordant with data of 16S rDNA sequence analysis. The result indicates thatPasteurellamultocidakmtΙPCR identification method can be added to the industry standard Diagnostic Techniques of SwinePasteurellaasPasteurellamultocidaidentification method besides original biochemical identification method.
Pasteurellamultocida;16S rDNA;kmtΙ; sequence analysis
10.11751/ISSN.1002-1280.2017.5.04
农业行业标准制定和修订(农产品质量安全)项目(572-2014)
张媛,副研究员,从事需氧菌类生物制品的检测工作。李建,助理研究员,从事需氧菌类生物制品的检测工作,为共同第一作者。
蒋玉文。E-mail:jiangyuwen@ivdc.org.cn
2016-11-29
A
1002-1280 (2017) 05-0016-06
S852.612
