人牙周膜干细胞与人牙髓干细胞的表型及生长特性比较*
2017-06-05蔡洪桢贺慧霞王飞翔张绍清
蔡洪桢 贺慧霞 王飞翔 张绍清
人牙周膜干细胞与人牙髓干细胞的表型及生长特性比较*
蔡洪桢 贺慧霞 王飞翔 张绍清
目的:比较人牙周膜干细胞(human Periodontal ligament stem cells, hPDLSCs)和牙髓干细胞(human Dental pulp stem cells, hDPSCs)的表型及生长特性,为深入研究这两种细胞生物学特性提供依据。方法:组织块法培养获得原代人牙周膜细胞和牙髓细胞,采用有限稀释法分别对两者克隆化培养、分离纯化得到hPDLSCs和hDPSCs,采用倒置相差显微镜观察细胞形态、CCK8法检测细胞生长活性并绘制两者生长曲线、流式细胞技术检测干细胞表面标志物,分析比较两种细胞集落形成率(colony formation ratio,CFR)。结果:hPDLSCs和hDPSCs镜下形态相似,生长曲线均呈“S”形,牙周膜细胞中STRO-1表达hPDLSCs阳性率为15.88±0.48%,牙髓细胞中STRO-1表达hDPSCs阳性率为11.86±0.43%,两者无显著性差异。两种干细胞均阳性表达间充质干细胞( M esenchymal stem cells,MSCs)表面标志物STRO-1、CD29、CD 44、CD90、CD73和血管内皮标志物CD105,其中STRO-1、CD29、CD 90、CD 73、CD 105及CD166百分率达90%以上,阴性表达造血干细胞表面标志物CD34和CD45。hDPSCs的集落形成率(4.31±0.08%)显著高于hPDLSCs的集落形成率(2.68±0.06%) (P<0.05)。结论:hPDLSCs和hDPSCs细胞的形态相似,均高表达MSCs表面特异性标志物,hDPSCs的集落形成率显著高于hPDLSCs,说明hDPSC自我更新能力较hPDLSCs强,可为深入研究这两种干细胞提供实验依据。
人牙周膜干细胞;人牙髓干细胞;表型
人牙周膜干细胞(human Periodontal ligament stem cells, hPDLSCs)和牙髓干细胞(human Dental pulp stem cells, hDPSCs)均具有间充质干细胞(Mesenchym al stem cells,MSCs)的生物学特性,有自我更新和多向分化潜能[1,2],可向成骨样细胞、成软骨样细胞及成脂样细胞等多种细胞分化[3,4],这种特性使hPDLSCs或hDPSCs替代骨髓基质干细胞修复组织缺损成为可能,从而为干细胞的临床应用提供更多选择,在口腔再生医学研究中有很大的应用前景。
本实验培养克隆hPDLSCs和hDPSCs,并对它们的形态、生长曲线、干细胞表面标志物及细胞集落形成率(colony form ation ratio, CFR)进行分析比较,为后续实验选择理想干细胞来源时提供实验依据。
1.材料和方法
1.1 样本收集经患者或监护人的知情同意,收集18-25岁因正畸需要拔除的完整双尖牙或第三磨牙,排除龋坏、根尖病和牙周病的患牙。
1.2 主要仪器及试剂胎牛血清、牛血清白蛋白(Diagnostic Grade,BSA)、DMEM培养基、胰蛋白酶、双抗及PBS(均购自Hyclone公司,美国),CCK-8试剂盒(北京碧云天生物技术有限公司),试剂盒STRO-1、IgM-FITC、CD29-PE、CD44-APC、CD34-PE、CD73-PE、CD90-PE、CD105-PE、CD146-PE、CD166-PE和CD45-PE (均购自BD公司,美国),4%多聚甲醛(Solarbio);酶标仪(M 5,MDS,美国),倒置相差显微镜(Leica,德国),图像采集系统(OLYMPUS,日本);流式细胞仪(FACSCalibur,BD Bioscience,美国),无菌细胞培养室标配(超净台,离心机,培养箱等)。
1.3 实验方法
1.3.1 细胞培养及干细胞纯化扩增
hPDLCs培养:取18-25岁拔除的第三磨牙,参照文献[5,6]采用组织块法原代培养,简述如下:清理牙结石及清除牙龈组织,牙冠朝下用含1%双抗的PBS液反复冲洗,无菌条件下刮取根中三分之一牙周膜,剪碎,离心弃上清液,铺T25培养瓶,倒置加含20%胎牛血清的DMEM培养基,在37℃、5%CO2、饱和湿度条件下培养4h翻瓶,继续培养,待细胞汇合达80%时传代。
hDPCs培养:取前述已刮除牙周膜组织的牙齿,参照文献[2,7]方法原代培养hDPCs,操作要点如下:无菌条件下劈开牙冠,取出牙髓,用含1%双抗的PBS液反复漂洗后剪碎,后续步骤同hPDLCs原代培养。
有限稀释法克隆化培养纯化、扩增hPDLSCs和hDPSCs:参见文献[8]分别收集的对数生长期人牙周膜细胞和牙髓细胞培养的上清液制作适应性培养基;分别对人牙周膜细胞和牙髓细胞进行消化离心去上清液,加适量适应性培养基吹打后过细胞筛制备成单个细胞占细胞悬液的90%以上的细胞悬液,调整细胞密度并计数,使其为10-15个/m l,以100μl/孔接种于96孔培养板中,培养24h及48h后标记单个细胞孔,并补液至200μl/孔,接种第6天半量换液,此后3 天换一次液,光镜下观察克隆形成情况。培养7-14d,至出现细胞克隆(细胞数≥50为判定标准),待细胞克隆至孔底1/2-2/3后用0.25%不含EDTA的胰酶消化离心去上清液,转移至48孔板扩大培养,如是扩到24、12、6孔板,后转入6cm、10cm培养皿、T25培养瓶继续培养,待细胞铺至瓶底80%左右时胰酶消化离心去上清液,再转入T75培养瓶培养,至此得到第8代干细胞,按实验所需,如前制备成单细胞悬液,细胞计数,使其细胞总量大于1×107/m l,后续实验备用。另各取hPDLSCs和hDPSCs两珠继续传代培养,观察10余代。余下消化转入冻存管梯度降温进液氮冻存备用。
1.3.2 细胞生长增殖曲线测定分别将hPDLSCs和hDPSCs细胞悬液,调整密度为1× 104/ m l接种于96孔板中,分12组,每组设4个复孔;24h后每天取一组,吸弃待检测孔内培养液,每孔加含10%CCK-8液的基础培养基0.1m l,继续在37℃、5%CO2条件下避光孵育4h后,于酶标仪450nm波长处测吸光度(OD)值,重复4次,取均值。连续检测10d以上,分别以细胞培养时间为横轴,OD值为纵轴绘制细胞生长曲线。
1.3.3 流式细胞仪(flow cy tometry,FCM)分析Stro-1阳性hPDLSCs和hDPSCs:分别取备用h PDLSCs和hDPSCs细胞悬液,细胞计数,使其细胞总量大于5×106,分别加入含5%BSA、20μl纯化stro-1一抗体孵育液300μl,4℃避光孵育30m in, PBS清洗3次,去除残留的抗体,重悬后避光条件下加入1∶32稀释的异硫氰酸盐荧光素(FITC)结合的IgM二抗(即IgM-FITC)在4℃条件下避光孵育30m in,然后进流式细胞仪进行检测。
另取备用hPDLSCs和hDPSCs细胞悬液,调整密度至1×106/ m l,重悬并计数,按测试每种抗体需要1×105个细胞的要求将细胞悬液分装EP管中,依次标记,每组4管;严格按照试剂盒操作说明分别与CD29、CD34、CD44、CD45、CD73、CD90、CD105、CD146及CD166相应同型抗体浓度为0.2mg/m l的CD29-PE-A、CD34-PE、CD44-APC-H 7、CD45-PE、CD73-PE、CD90-PE、CD105-PE-A、CD146-PE、CD166-PE。盖紧EP管,封口膜封口;放入转盘中4℃条件下避光孵育50m in,PBS洗涤重悬,1600r/m in离心5m in,弃上清;重加PBS重悬过滤后采用流式细胞仪进行细胞表面标志物鉴定分析。
1.3.4 细胞集落形成率(colony form ation ratio,CFR)检测
取对数生长期人PDLSCs和DPSCs细胞,常规消化传代方法,制成细胞悬液并反复吹打,充分分散细胞使单个细胞百分率在95%以上,各按照每皿5u l含50、100、200个细胞的浓度将细胞悬液接种到直径为6cm的培养皿中,水平方向轻轻晃动培养皿使细胞分散均匀。置于37℃,5% CO2孵箱中培养,每日镜下观察培养板中细胞集落形成情况,期间根据培养液pH变化适时更换新鲜培养液,3周终止培养,弃原液,PBS洗2遍,以4%多聚甲醛液固定20m in,弃之,PBS洗3遍,加适量甲苯胺蓝染色液染色15m in,PBS洗去染色液,空气干燥后,进行细胞克隆集落计数,以≥50个细胞为一个集落计数,集落形成率计算方法:
集落形成率(%)=(集落数/接种细胞数)×100%
1.4 统计学分析实验结果用SPSS22.0 对数据进行统计学处理分析,检测结果以x±s 表示,STRO-1干细胞阳性表达及CFR检测结果组间比较,采用独立样本t检验,P<0.05为差异有统计学意义。
2.结果
2.1 倒置相差显微镜下观察
2.1.1 细胞原代培养原代培养第4d,见hPDLCs从组织块周边爬出,多呈纺棰形或长梭形,放射状排列,胞突细长,胞体丰满,胞质均匀、丰富,彼此间成星网状形连接排列(图1);原代培养的hDPCs第6d始见组织块周边爬出,呈短梭形或三角形,散布于组织块周围,胞突钝圆,胞体丰满,胞浆均匀、丰富,彼此间相对分散排列(图2)。
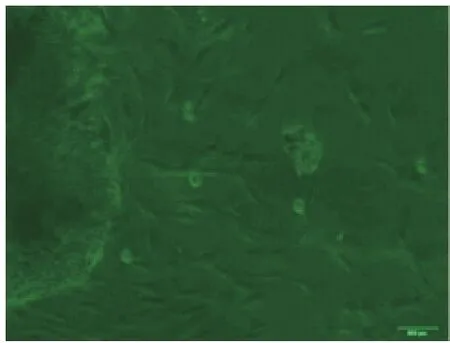
图1 原代培养4d的hPDLCs(×40)
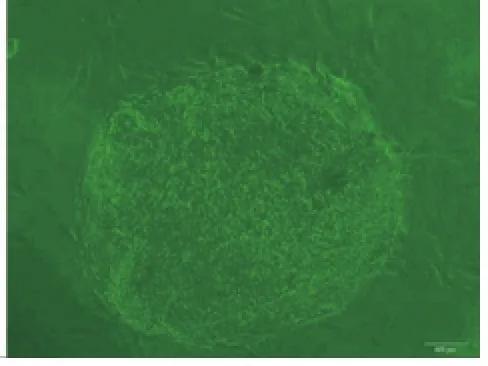
图2 原代培养6d的hDPSCs(×40)
2.1.2 有限稀释法克隆化纯化培养、扩增干细胞hPDLSCs在镜下呈长梭形或三角形,呈放射状排列,细胞之间排列疏密结合(图3);hDPSCs短三角形或纺棰形,旋涡状排列,细胞间排列紧致(图4)。第二代后h PDLSCs和hDPSCs增殖速度快,7-14d部分细胞汇成小集落,10-15d达到汇合,见细胞胞体丰满,胞浆丰富,状态良好。两干细胞各传10余代,见其传代能力皆十分旺盛和稳定,各代细胞形态和生长状态大体趋一致,胞体丰满、胞浆丰富、胞质均匀清晰,生长状况良好。
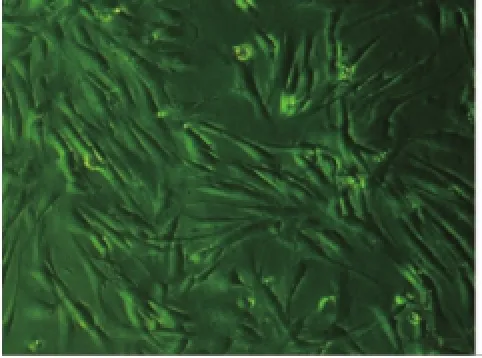
图3 分离纯化中的hPDLSCs (×100)
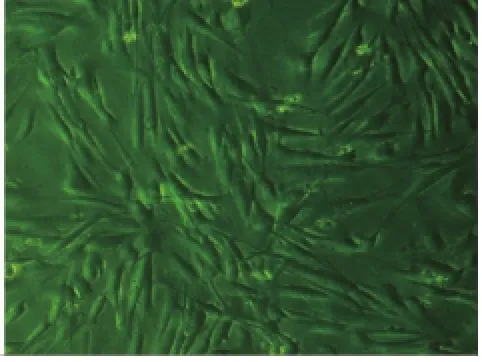
图4 分离纯化中的hDPSCs (×100)
2.2 细胞生长增殖曲线CCK-8检测结果显示分离的h PDLSCs 的生长曲线呈S形,包含潜伏期、对数生长期和平台期,细胞对数生长期在第2-7d,吸光度值近7.54,其后进入平台期(图5);hDPSCs生长曲线也呈S形,同样包含潜伏期、对数生长期和平台期,开始的时2d为潜伏期,细胞生长缓慢,细胞增殖从第3d开始加速,进入对数生长期,至第7d后细胞增殖减缓,约2d时间,吸光度值达7.63,其后细胞增殖进入平台期。
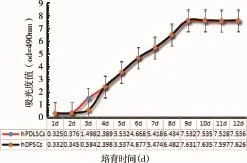
图5 人PDLSCs与DPSCs生长增殖曲线比较(两组细胞相同时间点的吸光度值比较P>0.05,无统计学差异)
2.3 FCM分析经组织块法培养所得人牙周膜细胞中STRO-1表达hPDLSCs的阳性率为15.88±0.48%,人牙髓细胞中STRO-1表达hDPSCs阳性率为11.86±0.43%,两者无显著性差异(P>0.05)。流式细胞分析图中,两种干细胞STRO-1表达均为阳性,对间充质干细胞(Mesenchymal stem cells,MSCs)表面标志物CD29、CD44、CD73、CD90、CD146及CD166和血管内皮标志物CD105均高水平表达,低表达造血干细胞表面标志物CD34和CD45(图6),各标志物阳性表达百分率详情见(表1),与干细胞表面标志物表达一致,说明两者具有干细胞的特性。
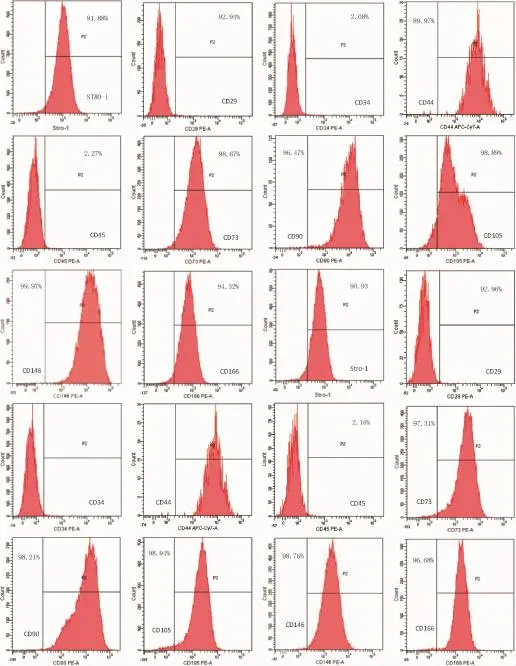
图6 人PDLSCs与DPSCs表面标志物的表达(前10图为h PDLSCs的相关表面标志物的表达,后10图为hDPSCs的相关表面标志物的表达)
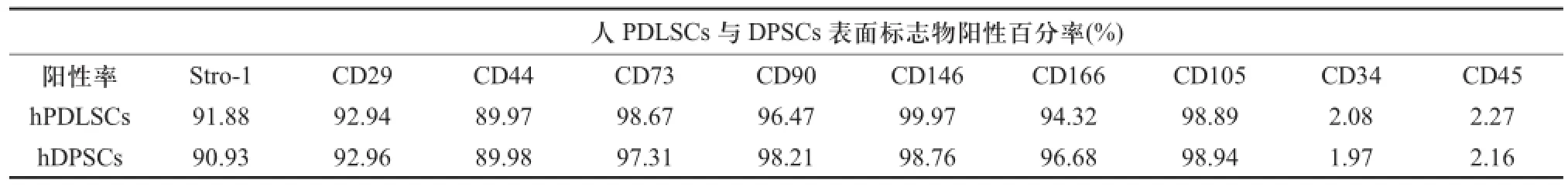
表1 两种细胞表面标志物表达
2.4 CFR测定两干细胞于7-14d有细胞集落形成,镜下观见细胞形态呈短梭形,体积较小,排列疏密相间,中心细胞界限不清,形状不规则,周边细胞呈梭形或三角形(图7)。hPDLSCs STRO-1细胞的CFR为2.68±0.08%,hDPSCs STRO-1细胞的CFR为4.31±0.08%,两者具有统计学差异(P<0.05)(图8)。
图7 细胞集落镜下观(×100)
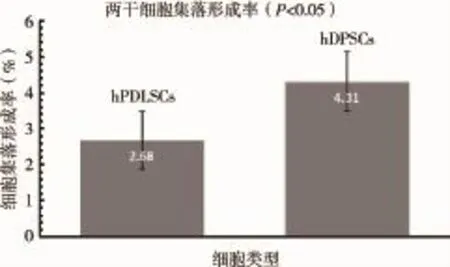
图8 人STRO-1PDLSCs与DPSCs集落形成率比较(P< 0.05,有统计学差异)
3.讨论
口腔再生医学是通过对牙周组织、牙髓等口腔颌面部组织进行再造和重生方法,来修复由牙周病、牙髓病及颌面创伤等疾病所造成的组织缺失,是一种替代治疗方法,通过组织结构具备的再生功能来改善传统治疗的缺点[9,10],组织中的干细胞具有在机体内外因素作用下不断进行自我更新和分化活动的有克隆形成能力的未分化细胞,具有对损伤组织的修复和稳定功能[11]。人牙周膜干细胞(hPDLSCs)和牙髓干细胞(hDPSCs)都是牙源性成体干细胞,具有多向分化、高度增殖及自我更新的生物学特性,可以从医疗废弃物如正畸需要拔除的牙、多生牙、埋伏牙、阻生拔除的智齿等中获得,逐渐成为组织工程和再生医学研究干细胞的重要来源,在牙周牙髓等口颌面创伤修复、组织再生及重建中表现出越来越广阔的应用前景,具有重要的转化研究价值。组织再生过程的关键是组织缺损区域有足够数量的相关功能细胞迁移并发挥干细胞招募、增殖和分化等作用来支持细胞、黏附分子和基质构成的微环境,从而实现组织重建。细胞原代培养的方法有组织块贴附法和酶消化法两种,相对酶消化法,细胞经组织块贴附法培养损伤较小。有研究[12]认为组织块贴附法更易于细胞析出贴壁,且细胞生物学特征更稳定。加之人牙周膜和牙髓组织体积小,故更合适采用贴附法进行人牙周膜细胞和牙髓细胞原代培养。但组织块贴附法培养原代细胞,易混有其他如上皮样细胞、牙髓成纤维细胞和牙周膜成纤维细胞等,因干细胞具有体外克隆化生长的特性,为进一步分离纯化人牙周膜干细胞和牙髓干细胞,本实验中,我们采用实验条件要求简单、花费少的有限稀释法分别对两细胞进行克隆化培养,从混合细胞中分离、克隆纯化干细胞,形成克隆的人牙周膜干细胞和牙髓干细胞。我们通过两细胞克隆实验观察到两种细胞均可克隆样生长,形成克隆集落,在一定程度上说明人牙髓干细胞与牙周膜干细胞类似,均表现干细胞的一些基本特性,实验结果还发现hPDLSCs和hDPSCs细胞形态表现十分相似,生长模式相近;两干细胞各传10余代,传代能力仍十分旺盛和稳定,各代细胞形态和生长状态大体趋一致,胞体丰满、胞浆丰富、胞质均匀清晰,生长状况良好,适合作为各干细胞的种子来源,能保证实验的可靠性和重复性。两者各自STRO-1干细胞表达比例无显著差异,但两者细胞集落形成率具有显著差别,说明hDPSC自我更新能力较强,内环境更稳定,这与贺慧霞等[13]研究结果一致,但两种细胞作为种子细胞在牙再生中运用的差异,尚需大量的相关实验进一步研究,本实验可为干细胞临床转化运用选择理想细胞来源时提供实验依据,同时为牙周组织工程获得理想的种子细胞提供了可靠的获取方法。
牙源性组织包含着复杂的细胞群,比如成牙骨质细胞、成纤维细胞和间充质细胞等,其中仅一小部分是具有自我更新能力的干细胞。贺慧霞等[14]经人来源的STRO- 1抗体通过免疫磁珠分离系统对犬PDLSCs进行分离并比较两种细胞的体外生长特性,结果显示人与犬PDLSCs的细胞形态、生长模式相似,同时CFR检测发现人STRO-1+细胞的CFR远高于犬STRO-1+ 细胞的CFR,表明两种细胞的基本生长特性相似,但其细胞亚群分化层次不同,不同亚群增殖能力和间充质干细胞特异性表面标志STRO-1+表达存在差异。STRO-1是间充质细胞的表面标志物,其阳性表达是血管来源干细胞的特征性标志[15],常被用作鉴定牙髓干细胞和牙周膜干细胞的标志物,同时,MSCs是一种多功能分化细胞,可高表达间充质干细胞特异的表面标记CD29、CD44、CD105、CD166和CD146(内皮细胞表面分子,中胚层标记物)等干细胞特异性标志物,但不表达造血干细胞CD14、CD34和CD45 等特异性标志物[16]。本实验分离纯化的hPDLSCs和hDPSCs具有相似的生长特性,联合使用多种抗体进行鉴定,细胞表面标志物表达结果与以往报道相似[17,18],说明两种细胞均有干细胞潜质,为深入研究两者的临床应用提供了实验依据。不足的是大多数干细胞目前尚无特异的标志分子表达,需结合如细胞克隆化培养等其它方法进行干细胞及其细胞亚群的生物学特性异同,有待进一步深入研究。
综上所述:人PDLSCs和DPSCs经诱导克隆培养,结果两细胞都具备自我更新和分化能力等干细胞潜质,但发现hDPSCs相比hPDLSCs自我更新能力较强,内环境更稳定;两者均表达间充质干细胞表面标志物,具有牙源性间充质干细胞的特点,有望成为牙周组织工程理想的种子细胞。
[1] Gronthos S,Brah im J,Li W,et al. Stem cell p roperties of human dental pulp stem cells[J].J Dent Res, 2002, 81(8): 531-535
[2] Gronthos S, Mankani M, Brahim J, et al.Postnatal human dental pulp stem cells (DPSCs)invitro and invivo[J]. Proc Natl Acad Sci USA, 2000, 97(25): 13625-13630
[3] Hilkens P, Gervois P, Fanton Y, et al. Effect of isolation methodology on stem cell properties and m ultilineage d ifferentiation potential of hum an den tal pulp stem cells[J].Cell Tissue Res, 2013, 353(1): 65-78
[4] Kanafi MM, Ramesh A, Gupta PK, et al. Dental pulp stem cells immobilized in alginate microspheres for applications in bone tissue engineering[J].Int Endod J, 2014, 47(7): 687-697
[5] 司徒镇强, 吴军正. 细胞培养[M]. 第2版. 西安:世界图书出版公司, 2007: 58-59
[6] 封艳,粱学萍,赵今,等. 人牙周膜干细胞与牙周膜细胞生物学特性的比较[J]. 中国组织工程研究,2014, 28(7): 4509-4516
[7] 张男,王伟,陈保兴,等.人体牙髓干细胞的分离与鉴定[J/CD]中华细胞与干细胞杂志:电子版,2014, 4(3): 183-188
[8] 封艳,牛巧丽,尹宏斌,等.有限稀释克隆法培养分离人牙周膜干细胞实验研究[J]. 新疆医科大学学报, 2014, 37(8): 898-994
[9] Bartold PM, M cCulloch CA, Narayanan AS, et al. T issue engineering: A new paradigm for periodontal regeneration based on molecular and cell biology[J]. Periodontol 2000, 2000, 24(10): 253-269
[10] Srisuw an T, Tilkorn DJ, W ilson JL, et al. Molecular aspects of tissue engineering in the dental field[J]. Periodon tol 2000, 2006, 41: 88-108
[11] M orrison SJ,Shah NM,Anderson DJ. Regulatory mechanism s in stem cell biology[J]. Cell, 1997, 88(3): 287-298
[12] 张玉峰, 程祥荣, 施斌, 等. 诱导成体人牙周韧带干细胞向软骨细胞分化的实验研究[J]. 中华口腔医学杂志, 2006, 41(4): 216-219
[13] 贺慧霞, 刘洪臣, 鄂玲玲, 等. 牙周膜干细胞与牙髓干细胞的生物特性比较研究[A]. 2014全国口腔生物医学学术年会暨“西湖国际”口腔医学高峰论坛论文集[C]杭州, 2014: 133-135
[14] 贺慧霞,刘洪臣,王东胜,等. 人与犬牙周膜干细胞的生长特性比较[J]. 口腔颌面修复学杂志, 2009, 10(2): 65-68
[15] Sh i S, Gronthos S. Perivascular niche of postnatal m esenchym al stem cells in hum an bone m arrow and dental pulp[J]. J Bone Res M iner, 2003, 18(4): 696-704
[16] Pittenger MF, Mackay AM, Beck SC, et al. Mu ltilineage potential of adu lt human mesenchymal stem cells[J]. Science, 1999, 284(4): 143-147
[17] Gay IC, Chen S, M acDougall M. Isolation and characterization of multipotent human periodontal ligament stem cells[J].Orthod Craniofac Res, 2007, 10(3): 149-60
[18] Lin NH, Menicanin D, M rozik K, et al. Putative stem cells in regenerating hum an periodontium[J]. J Periodon tal Res, 2008, 43(5): 514-523
The periodontal ligamentstem cellsand biological characteristicsofhuman dentalpulp stem cellsand phenotype
CAIHong-zhen,HEHui-xia,WANG Fei-xiang,ZHANG Shao-qing(Departmentof Stomatology,Chinese PLAGeneral Hospitaland Chinese PLAMedical School,Beijing 100853,China)
Objective:We aim to compare the biological characteristics and phenotypic after cultivating and separating of the human Periodontal ligament stem cells (hPDLSCs) and human Dental pulp stem cells (hDPSCs). M ethods:HPDLSCs and hDPSCs w ere respectively separated and amplificated from the original generation of cultures by magnetic-activated cell selection system (MACSS). Inverted phase contrast m icroscope was employed to observe the morphology. What is more, we make use of CCK-8 method to check and draw up the grow th curves. Moreover, the expression of stem cell surface markers were analysized by flow cytometry instrument (FCM). Finally, we analyse and compare the colony formation ratio (CFR). Results:Fusiform or triangle, the morphology of hPDLSCs and hDPSCs is similar. The grow th curvesare "S" shape. The expression ratio of STRO-1 in hPDLSCs and hDPSCs is respectively 15.88±0.48% and 11.86±0.43%. There is no significant difference between the two cells. But the hDPSCs colony formation rate (4.31±0.08%) is significantly higher than that of the hPDLSCs (2.68±0.06%)(P<0.05). Both of the tw o stem cells are positive for the CD 29, CD44, CD90 and CD105 which are characterized by the employed to distinguish hPDLSCs and hDPSCs, and we can conclude that the separated stem cells share sim ilar morphology. HPDLSCs and hDPSCs that can refresh and differentiate multi-directionally are characterized by stem cells due to the expression of stem cell markers. But the hDPSCs owns a significantly stronger colony formation rate than that of hPDLSCs, then we can make a conclusion that hDPSCs is a prom ising stem cells resource.
human periodontal ligament stem cells; human dental pulp stem cell; phenotype
R 781
A
1672-2973(2017)02-0091-06
2016-10-11)
蔡洪桢 解放军总医院口腔医学研究所硕士生北京100853
贺慧霞 通讯作者解放军总医院口腔科主任医师副教授北京100853
王飞翔 解放军总医院口腔医学研究所硕士北京100853
张绍清 解放军总医院口腔医学研究所硕士生北京100853
