口腔鳞癌患者外周血及肿瘤微环境中Treg水平关系的研究*
2017-06-05史悦怡任仪鹏张蕾步荣发
史悦怡 任仪鹏 张蕾步 荣发
口腔鳞癌患者外周血及肿瘤微环境中Treg水平关系的研究*
史悦怡 任仪鹏 张蕾步 荣发
目的:初步探索口腔鳞状细胞癌患者外周血中和肿瘤微环境中Treg免疫细胞的分布状况。方法:对我院30例未经其他治疗的60岁以上口腔鳞癌患者进行标本及外周血采集,通过流式细胞术检测相关细胞水平,采用ch iss2004软件统计分析。结果:1. OSCC患者外周血中CD4+CD25highFox P3+细胞含量与对照组无明显差异。2. OSCC患者外周血中CD4+CD25highCD127low细胞含量高于正常对照。3. Treg中CD31+Treg比例OSCC患者高于对照组。4. OSCC患者肿瘤局部微环境中存在T reg的浸润。结论:OSCC患者存在T reg的水平异常,我们推断Treg的浸润有可能抑制了全身及局部微环境中抗瘤因素的抑瘤效应。
口腔鳞癌;Treg免疫;细胞肿瘤微环境
头颈肿瘤每年发病超过100万例,约占全球成人恶性肿瘤的3%[1,2]。其中95%头颈恶性肿瘤是鳞癌[3]。而口腔鳞状细胞癌OSCC又在其中占约四分之一[4]。虽然放化疗方法一直在进步,但是近40年来OSCC的5年生存率却无很大改善[5]。于是学者们开始探索人体自身的免疫系统在头颈鳞癌中的影响和机制,并且已有的研究成果发现机体免疫系统对头颈部鳞癌的影响很大[6,7],其疾病进展机制中很重要的一项就是对抗肿瘤免疫的免疫耐受以及免疫逃逸能力[8,9]。这提示我们必然存在调整这些免疫效应的方法。
调节性T细胞Treg是近年来发现的一种抑制性T细胞,可以抑制其它T细胞的激活、增殖和效应功能[10]。既往研究已经发现其对于有效免疫的抑制可能助长了肿瘤的免疫逃逸[11,12]。鼠肿瘤的研究证明了这一点:剔除Treg细胞可以促进鼠对几种肿瘤的排斥,包括黑色素瘤、纤维肉瘤、非白血性白血病、骨髓瘤[13]。
目前对于OSCC患者的Treg分布是否存在异常还不明确。本实验的目的就在于初步探索OSCC患者外周血中和肿瘤微环境中Treg的分布状况,为明确OSCC患者免疫状态异常状况,寻找干预方法打下基础。
1.病例及标本
1.1 血液标本全部血液标本取自解放军总医院口腔颌面外科2015年10 月- 2016年4月的住院口腔鳞癌60岁以上患者。所有患者手术前均未行放射治疗、化学治疗、生物治疗及中西医结合治疗。对照组来自输血中心健康献血者。两组各30例。患者资料见表1。

表1 30例患者资料
1.2 组织标本全部肿瘤组织标本均取自上述30例患者,且经病理学确诊为鳞状细胞癌。切取肿瘤实体部分,避开肿瘤周边缘及坏死区域。所有患者手术前均未行放射治疗、化学治疗、生物治疗及中西医结合治疗。
1.3 实验方法
1.3.1 标本处理
血液样本:空腹采取静脉血5m l,保存于NH抗凝管,颠倒混匀六次,带回实验室立即进行处理,术后如病理诊断为鳞状细胞癌则纳入统计范围。
组织样本:所有组织标本取出后迅速放在含有10%新生小牛血清的1640培养基内,带回实验室立即按下列步骤处理:
(1)取下标本后立即送实验室进行细胞分离。将手术中取得的组织块用PBS冲洗,洗去残余的血液;
(2)然后用剪刀剪成0.1-0.2m c直径大小;
(3)用混合的消化酶溶液(包含0.1%Ⅳ型胶原酶、0.002%I型DNA酶和0.01%V型透明质酸酶,Sigma)在37℃下消化2小时;
(4)200目的消毒滤网过滤;
(5)用75%和100%fiacl液进行密度梯度离心(1500r/m in×15m in),离心后收集75%和100% fiacl液交界界面上的细胞,即为淋巴细胞;
(6)PBS洗涤,1000r/m in×10m in离心后去上清,共2次,收集沉淀细胞待用。
1.3.2 流式细胞术检测以血液样本为例:采用两步法标记。组织样本处理时提取组织浸润淋巴细胞后进行细胞计数,设定每管2×105个细胞进行抗体处理。
依据流式细胞仪操作说明书进行检测。检测时,标记了特异性荧光染料的单细胞悬液和鞘液,分别经硅化管进入流动室,形成鞘液包裹细胞悬液的稳态单细胞液柱,其以稳定的层流形式通过喷嘴高速射下,液柱与水平方向的高度聚焦的激光束垂直相交,单个细胞上标记的荧光染料在通过激发光光斑时被激发而产生特异性荧光,同时,由于混合细胞群中细胞大小和胞内颗粒的多少会被激发而产生不同的散射光。被接收的光电信号被放大后进入计算机系统进行数据转换、储存、分析、处理,并运用软件程序对结果进行综合分析从而获得多参数数据和图像。本研究中,每一个样本收集分析2× 105个细胞,采用CellQuest分析软件对结果进行分析并作图。
1.4 统计方法所有数据使用chiss2004软件统计分析。实验结果用表示,两组间均数比较用t检验,采用直线相关分析量指标的相关性,P<0.05 为有差异,P>0.05 无差异。
2.结果
2.1 OSCC组及正常对照组细胞检测结果经统计软件分析结果见表2。

表2 两组标本细胞中Treg含量检测结果的比较(x±s)
2.2 OSCC患者外周血中CD4+CD25highFoxP3+细胞含量与对照组无明显差异外周血中Treg细胞含量(以CD4+CD25++FoxP3+表示)OSCC患者(5.38%±1.05%)和正常对照(4.42%±0.93%)比较,P=没有统计学差异(图1)。
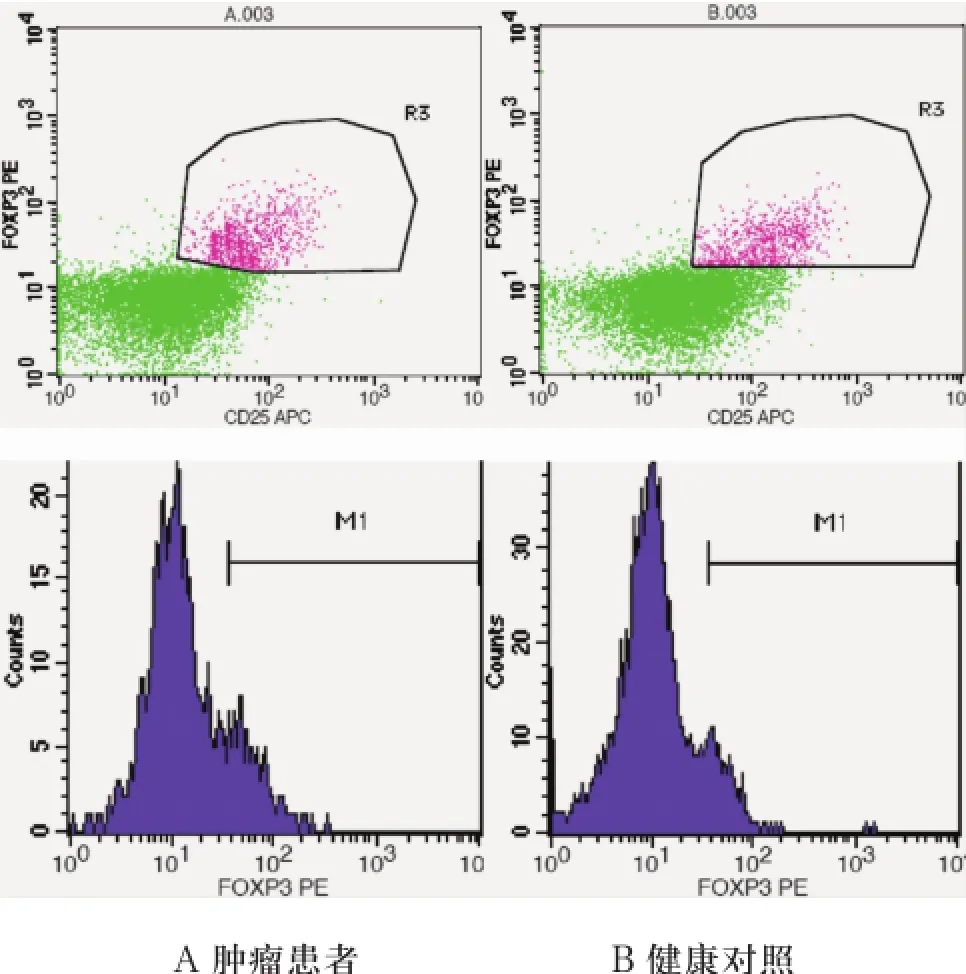
图1 以CD4+T细胞含量为100%进行流式分析
2.3 OSCC患者外周血中CD4+CD25highCD127low细胞含量高于正常对照以CD4+CD25highCD127low代表Treg,发现CD4+CD25highCD127low细胞在OSCC患者外周血中含量(7.35%±1.97%)高于对照组(5.64%±0.88%),P<0.05(图2)。
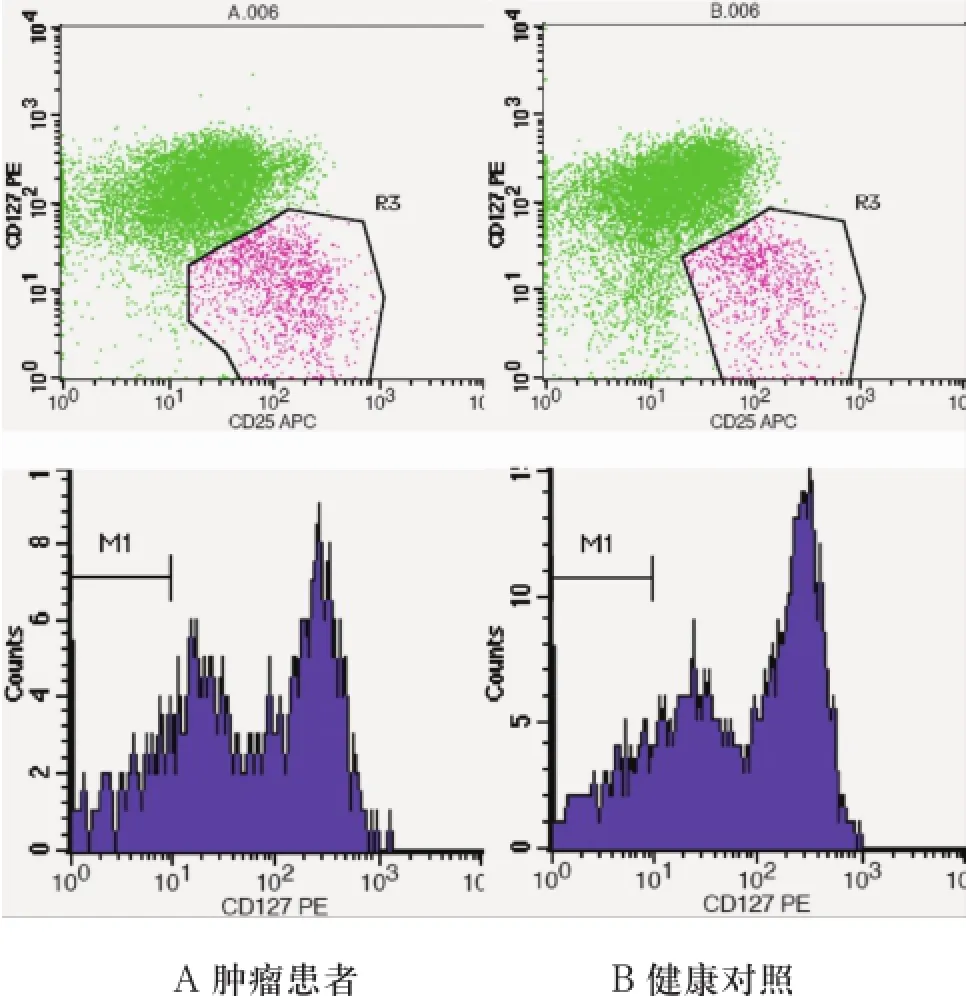
图2 以CD4+T细胞含量为100%进行流式分析
2.4 Treg中CD31+Treg比例OSCC患者高于对照组OSCC患者CD31+Treg(CD31-CD4+ CD25highCD127lowCD31+)占22.2%±1.35%,对照组CD31+Treg占16.4%±1.17%,两者差异有统计学意义,P<0.05(图3)。

图3 以T reg(CD 4+CD 25highCD127low)含量为100%进行分析
2.5 OSCC患者肿瘤局部微环境中存在Treg的浸润为了明确OSCC患者肿瘤微环境中是否存在Treg的浸润,采用流式细胞术检测了OSCC组织内Treg的含量,以CD4+FoxP3+代表Treg细胞,发现OSCC肿瘤组织内存在Treg细胞浸润的现象。以CD4+T细胞为100%,其百分含量达到20.178±5.66%(图4)。
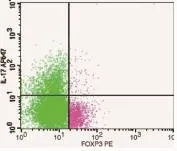
图4 以CD4+T细胞含量为100%进行流式分析
3.讨论
3.1 OSCC患者外周血中Treg含量升高试验中我们检测了OSCC患者外周血中Treg水平以确定OSCC患者外周血液中Treg是否存在异常,结果显示Treg水平较正常人升高。
我们知道Treg大概可以分为两类:直接由胸腺释放的natural Treg(nTreg)和由外周休眠CD4+T细胞受到特异性抗原刺激并在细胞因子的诱导下转化而来的induced Treg (iTreg)[14,15]。很多研究表明nTreg以细胞间接触的方式发挥抑制作用,而iTreg则是以细胞因子依赖途径发挥抑制作用[16,17]。所以进一步我们以区分Treg来源的CD31标记Treg细胞,发现OSCC患者外周血中CD31+的来自胸腺的nTreg比例比正常组要高。这说明外周血中的Treg水平升高主要是来自胸腺新近释放的nTreg增多。虽然外周血中Treg细胞含量水平还是相对较低的,但总体的Treg水平提高也许提示机体处于一种免疫抑制的状态,有效的免疫应答受到一定的抑制,这在多大程度上以及通过何种途径影响OSCC的发展还需要进一步研究。
还有一点值得提出的是Treg的检测方法。在开始实验的阶段我们采用了CD4+CD25highFoxP3+作为Treg的选择标准,结果显示OSCC患者和正常人外周Treg没有差异。但是进一步采用最近研究比较多的CD127进行标记,发现Treg水平存在差异。两种检测方法结果不同的原因在于在很多CD25低表达或不表达的CD4+ T细胞中, 甚至一定条件下的CD8+ T 细胞中也有Foxp3表达[18]。虽然不知道在其它疾病或者肿瘤中的状况如何,但是我们认为在OSCC的研究中CD4+CD25highCD127low作为筛选Treg细胞的标准,既保证了Treg细胞的完整性,又避免了效应性T细胞等非Treg细胞的干扰[19]。
3.2 OSCC肿瘤微环境中存在Treg的浸润前期研究发现了OSCC患者外周血Treg水平升高,但在总体免疫细胞中占比较低,虽然这说明了机体存在明显的免疫异常,但是在局部组织内的免疫状况如何却不清楚。毕竟局部的免疫微环境更加直接的对肿瘤生长产生影响。所以我们进一步采用流式细胞术检测了OSCC患者肿瘤组织内的浸润淋巴细胞TILs。发现局部肿瘤组织内存在明确的Treg浸润并且水平较高,达到了20%的比例水平。其原因可能是外周细胞的聚集,也可能是局部微环境利于Treg的分化。总之Treg的浸润机制还不清楚,需要进一步探索。既往研究中提示初始CD4+T在TGF-β单独作用下可以向Treg分化或许是机制之一[20]。
4.结论
综上所述,OSCC患者存在Treg的水平异常,在外周血中水平升高,在瘤组织内存在浸润现象,根据以往的研究结果我们提出Treg的浸润有可能抑制了全身及局部微环境中抗瘤因素的抑瘤效应。在后续的研究中应该着眼于这两类因素的平衡,找到适当的调控靶点,使其向着控制肿瘤生长的方向发展。参考文献
[1] Sathiyasekar AC, Chandrasekar P, Pakash A, et al. Overview of immunology of oral squamous cell carcinoma. Journal of pharmacy & bioallied sciences[J]. 2016, 8(Suppl 1):S8-s12
[2] Shin JM, Kamarajan P, Fenno JC, et al. Metabolom ics of Head and Neck Cancer:A M ini-Review[J]. Frontiers in physiology, 2016, 8(7):526
[3] 尚丹丹, 陈鹏. 头颈部鳞癌靶向治疗的研究进展[J]. 中华老年口腔医学杂志, 2016, 14(2):120-124
[4] Lau A, Li KY, Yang W F, et al. Induction chemotherapy for squam ous cell carcinom as of the oral cavity:A cumu lative meta-analysis[J]. Oral oncology,2016, 61:104-114
[5] Warnakulasuriya S. Global epidem iology of oral and oropha-ryngeal cancer[J]. Oral oncology, 2009, 45(4-5):309-316
[6] Loose D, Van de W iele C. The immune system and cancer[J].Cancer b iotherapy & radiopharmaceuticals, 2009, 24(3):369-376
[7] Dillman RO. Cancer imm unotherapy[J]. Cancer biotherapy & radiopharmaceuticals, 2011, 26(1):1-64
[8] Leibow itz MS, Nayak JV, Fer ris RL. H ead and neck cancer immunotherapy:clinical evaluation[J]. Current oncology reports, 2008, 10(2):162-169
[9] Topping KP, Fletcher LM, Agada FO, et al. Head and neck tum ou r imm unology:basic concepts and new clin ical imp lications[J]. The Journal of laryngology and otology, 2009, 123(1):9-18
[10] Ren CF, Zhao YX, H ou CF, et al. Expression of solub le programmed death-1 protein in peripheral blood regulatory T cells and its effects on rheum atoid arth ritis progression[J].Molecular medicine reports, 2016:28
[11] Chen W, Jin W, H ardegen N, et al. Conversion of peripheral CD4+CD25- naive T cells to CD4+CD25+ regu latory T cells by TGF-beta induction of transcription factor Foxp3[J]. The Journal of experimental medicine, 2003, 198(12):1875-1886 [12] W ei S, K ry czek I, Zou W. Regulatory T-cell com partm entalization and trafficking[J]. Blood, 2006, 108(2):426-431
[13] On izuka S, Taw ara I, Sh im izu J, et al. Tum or rejection by in vivo adm inistration of anti-CD25 (interleukin-2 receptor alpha) m onoclonal antibody[J]. Cancer research, 1999, 59(13):3128-3133
[14] Pank ratz S, Ruck T, M euth SG,et al CD4(+)H LA-G(+) regulatory T cells:Molecular signature and pathophysiological relevance[J]. H um an imm unology, Sep 2016, 77(9):727-733 [15] 张素欣, 刘哲敏, 段玉芹, 等. 调节性T细胞在口腔鳞癌患者外周血及癌组织中的表达和意义[J]. 肿瘤防治研究. 2013(11):1041-1045
[16] W ing K, Fehervari Z, Sakaguch i S. Emerging possibilities in the development and function of regulatory T cells[J]. International immunology, 2006, 18(7):991-1000
[17] Singh UP, Singh NP, Guan H, et al. The emerging role of leptin antagon ist as potential therapeutic option for inflamm atory bow el d isease[J]. International review s of imm unology, 2014, 33(1):23-33
[18] Seddik i N, Santner-Nanan B, M artinson J, et al. Expression of interleukin (IL)-2 and IL-7 receptors discriminates betw een hum an regulatory and activated T cells[J]. The Jou rnal of experimental medicine, 2006, 203(7):1693-1700
[19] H artigan-O'Connor DJ, Poon C, Sinclair E, et al. Human CD4+ regulatory T cells express low er levels of the IL-7 receptor alpha chain (CD127), allow ing consistent iden tification and sorting of live cells[J]. Journal of immunological m ethods, 2007, 319(1-2):41-52
[20] W an S, Xia C, Morel L. IL-6 produced by dendritic cells from lupus-prone m ice inh ib its CD4+CD25+ T cell regulatory functions[J]. Journal of immunology (Baltimore, Md.:1950), 2007, 178(1):271-279
Study on the relationship between Treg level in peripheralb lood and tumorm icroenvironment of patientsw ith oral squamouscell carcinoma
SHI Yue-yi,REN Yi-peng,ZHANG Lei,BU Rong-fa(Department of Stomatology,Chinese PLA General Hospital, Beijing 100853,China)
Objective:o investigate the distribution of Treg immune cells in peripheral blood and tumor m icroenvironment of patients with oral squamous cell carcinoma (OSCC). M ethods:30samples of primary OSCC cancer patients were analyzed w ith flow cytometry for Treg expression. Result:1. There was no significant difference in CD4+CD25highFoxP3+ cells between the venous blood groups and control groups. 2. The CD4+CD25highCD127lowcells in venous blood groups were higher than control groups. 3. The proportion of CD 31+Treg of Treg in OSCC was higher than control groups. 4. There was Treg infiltration in local m icro-environment of OSCC patients. Conclusion:OSCC patients w ith abnormal levels of Treg, w e infer that the infiltration of Treg may inhibit the anti-tumor effects of anti-tumor factors in the whole body and local m icroenvironment.
oral squamous cell carcinoma;T-cell Infiltration;tumor micro-environment
R782
A
1672-2973(2017)02-0077-05
2016-10-26)
史悦怡 解放军总医院口腔颌面外科硕士生北京100853
任仪鹏 解放军总医院口腔颌面外科主治医师北京100853
张蕾解 放军总医院口腔颌面外科副主任医师北京100853
步荣发 通讯作者解放军总医院口腔颌面外科主任医师教授北京100853
