胶南近海金乌贼生长特性、资源分布及增殖放流效果初步评价❋
2017-06-05张秀梅丁鹏伟单斌斌
牛 超, 张秀梅, 丁鹏伟, 单斌斌
(海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003)
胶南近海金乌贼生长特性、资源分布及增殖放流效果初步评价❋
牛 超, 张秀梅❋❋, 丁鹏伟, 单斌斌
(海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003)
根据2015年8—10月开展的4次金乌贼跟踪回捕调查,对灵山湾及胶南近海金乌贼的生长、分布、资源密度及增殖放流效果进行了初步评价。研究显示:在金乌贼群体资源生物量密度和尾数密度方面,8月28日平均生物量和尾数最低,10月4日平均尾数密度最高,10月26日平均生物量最高,且灵山岛西南海域的相对资源密度显著高于灵山湾海域,各航次幼乌贼出现频率均为100%;伴随幼乌贼的生长,资源高密度区由灵山湾向灵山岛西南海域的深水区逐步偏移。调查期间幼乌贼生长迅速,胴长(ML)总平均增长率为0.46 mm/d,体重(TW)总平均增长率为0.46 g/d,胴长-体重关系式为TW=8.0×10-4ML2.6642,胴长、体重与日龄均呈S型曲线关系。分子检测结果表明,在随机抽测的4个航次共288只回捕个体中,有14只个体在6个微卫星位点上可找到与其对应的亲本,判定为放流苗种,占随机抽测的回捕个体的比例约4.86%,放流初期金乌贼增殖效果显著。本研究为金乌贼增殖放流提供了基础数据,为放流后金乌贼资源的科学养护、合理开发提供了科学依据,有助于金乌贼增殖放流管理策略的制定。
金乌贼; 增殖放流; 时空分布; 生长; 分子标记; 胶南; 资源密度
金乌贼(Sepiaesculenta)隶属于软体动物门(Mollusca)头足纲(Cephalopoda)乌贼目(Sepioidea)乌贼科(Sepiidae)乌贼属(Sepia),主要分布于日本北海道以南、朝鲜西南海域、菲律宾群岛海域及中国的黄渤海、东海、南海[1-2]。金乌贼具有生命周期短,世代更新快,肉质鲜美,营养丰富的特点,是我国北方海域重要的经济头足类之一。1960—1970年代中国山东沿岸的年渔获量为500~1 000 t,是中国北方海域经济价值最大的乌贼[3]。但1980年代以来,由于过度捕捞、有害作业方式对产卵场的破坏、沿岸环境污染以及自然灾害等原因,致使金乌贼资源量明显衰退[4-5]。
1992年起金乌贼被列入山东省地方资源增殖计划[6],开展了金乌贼人工产卵附着基的投放,以保护和修复这一重要渔业资源。2010年起,金乌贼被列为青岛市地方增殖放流种类,每年增殖放流20万~30万只幼乌贼,2014年金乌贼被列为山东省增殖放流种类,放流数量达到60余万只。其中,青岛灵山湾是山东省金乌贼最主要的增殖放流区。
目前,国内外部分学者相继开展了金乌贼的形态学[7-9]、行为学[10-12]、繁殖习性[3,13]、洄游分布[1,14-15]以及增殖技术[6,13-14,16]等相关研究。但关于金乌贼增殖放流的追踪、评价等工作尚未开展。本研究跟踪监测了放流后青岛灵山湾海域以及胶南近海金乌贼群体的生长特性、分布规律和资源状况,并对增殖放流效果进行了初步评价,旨在为金乌贼资源的科学养护及合理开发提供科学依据。
1 材料与方法
1.1 增殖放流及调查方法
2015年7月28日,青岛灵山湾共放流胴长约为12 mm的金乌贼苗种约65万只,苗种由青岛金沙滩水产开发有限公司提供。放流点如图1所示的2号站位。随后于2015年8月28—29日、9月13—15日、10月3—6日、10月25—28日在灵山湾以及胶南近海开展了4次跟踪回捕调查。调查站位设置如图1所示,第1次跟踪调查为站位1~8,第2次跟踪调查为站位1~13,第3、第4次跟踪调查为站位1~18。调查船为29.4 kW的单拖渔船(鲁胶南渔69076),船长15 m,船宽3.5 m,每站拖网1 h,拖速约2 kn。调查采用底拖网,网口周长800目×40 mm,扩张网口高度约为2 m,囊网网目尺寸为16 mm。记录各站捕获金乌贼的数量,并于实验室冰鲜保存。在实验室解冻后测定胴长、体重等生物学指标,并取新鲜肌肉于95%乙醇中-20 ℃冷冻保存,用于后续的分子鉴定。胴长测量精确到1 mm,体重测量精确到0.01 g。调查和采样方法均按照《海洋调查规范》[17]进行。

图1 金乌贼放流与回捕调查站位图Fig.1 The investigation stations of releasing and recapture of Sepia esculenta
1.2 数据分析
金乌贼渔获量采用相对资源密度表示,即单位时间渔获密度:生物量(g/h)和尾数密度(ind/h)。利用Surfer12软件绘制渔业资源调查站位图和金乌贼资源密度平面分布图。
根据每次调查采集的金乌贼胴长和体重数据绘制各胴长和体重频率分布直方图;采用幂函数关系式TW=
aMLb拟合金乌贼的胴长体重关系。式中:TW表示体重(g);ML表示胴长(mm);a、b为常数,分别代表条件因子和异速生长因子。
利用SPSS19.0软件分析日龄与胴长、体重的关系,选定R2为最大值的函数关系式作为最佳曲线模式。拟合过程中以放流单位金乌贼亲体产卵盛期受精卵孵化的时间(7月8日)作为零日龄,并以每次调查的中间日期代表该航次调查计算日龄的时间节点。数据以平均值±标准差表示。
2 结果
2.1 胶南近海金乌贼群体相对资源密度与分布
2.1.1 资源密度的时间变化 金乌贼群体资源密度的数据统计见图2和表1。由图2可知,平均生物量从高至低依次为10月26日>10月4日>9月14日>8月28日,平均尾数密度从高至低依次为10月4日>10月26日>9月14日>8月28日。4次调查金乌贼平均生物量的变化趋势与平均尾数密度变化趋势不一致,8月28日平均生物量与尾数均最低,10月4日平均尾数密度最高,但10月4日平均生物量次于10月26日。由表1可知,密度(生物量和尾数密度)最高值站点出现顺序不一致,生物量最高值站点出现在10月26日,尾数密度最高值站点出现在10月4日,各航次金乌贼出现频率均为100%。
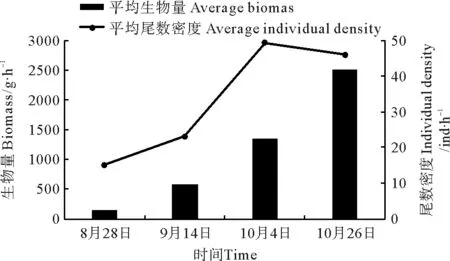
图2 金乌贼平均资源密度的时间变化Fig.2 The temporal variation of relative average resource density of Sepia esculenta表1 金乌贼资源密度的时间变化Table 1 The temporal variation of relative resource density of Sepia esculenta

类别Category生物量Biomass/g·h-18月28日9月14日10月4日10月26日尾数密度Individualdensity/ind·h-18月28日9月14日10月4日10月26日最大值Max283.371616.148017.089451.433860267175最小值Min76.1067.3021.0081.724222均值Mean136.37568.651342.102513.3715234946
2.1.2 资源密度的空间分布 2015年8月28日进行的第1次调查和2015年9月14日进行的第2次调查结果显示,金乌贼群体相对资源密度较高的区域分布在灵山湾外侧、灵山岛西北海域,最大相对资源密度均出现在8号站位,生物量分别为283.37和1 616.14 g/h,尾数密度分别为38和60 ind/h。
2015年10月4日进行的第3次调查结果显示,金乌贼群体相对资源密度分布较高的区域为灵山岛西南海域的14、15、16、18号站位,2015年10月26日进行的第4次调查结果显示,金乌贼群体相对资源密度分布较高的区域为灵山岛西南海域的13、16、17号站位,并且都显著高于灵山湾附近海域的1~5、9~11站位(P<0.01)。第3次调查最大相对资源密度出现在16号站位,生物量为8017.08 g/h,尾数密度为267 ind/h;第4次调查最大相对资源密度出现在13号站位,生物量为9451.43g/h,尾数密度为175 ind/h(见图3和4)。
2.1.3 金乌贼的移动和分布 跟踪调查发现,随着幼乌贼个体生长发育,其活动能力逐渐增强,开始移动扩散。8月末到9月中旬,灵山湾内资源高密度区呈现向灵山湾以南、以东移动扩散的趋势。10月初,金乌贼的平均胴长已达46 mm,灵山岛西南海域金乌贼的密度显著高于灵山湾内,资源高密度区分布在灵山岛西南海域,灵山湾内仍有一定数量的金乌贼分布。10月末,金乌贼的平均胴长已达60 mm,继续保持向东南方向移动的趋势,且灵山岛西南海域的金乌贼资源量较10月初呈下降趋势,但仍显著高于灵山湾内金乌贼的资源密度。
从水深分布来看,金乌贼个体较小时,在灵山湾内索饵,随着生长发育,较大个体逐渐开始向较深水域移动。到10月,灵山岛西南海域25~30 m水深处金乌贼分布较为密集,而水深10~15 m 的灵山湾海域(站位1~9)密度相对变小。从经纬度分布来看,尾数密度在经度上的分布呈现出由西向东先增加再减小的趋势,在纬度上的分布呈现出由北向南先增加再减小的趋势(见图3和4)。

图3 胶南近海金乌贼群体生物量分布Fig.3 Relative biomass distribution of Sepia esculenta in the coastal waters of Jiaonan
2.2 胴长、体重组成
4次跟踪调查分别捕获金乌贼121、300、887和828只,其胴长范围为9~121 mm,体重范围为1.00~278.00 g。调查期间,金乌贼的平均胴长和平均体重呈显著增长趋势(P<0.01),且生长离散显著增加,胴长频率分布基本呈单峰状态。其中各调查航次的优势胴长组分别为30~40、30~60、30~60和50~70 mm;各调查航次的优势体重组分别为0~15、0~40、0~40和20~80 g。各调查航次金乌贼胴长和体重的分布频率见图5,胴长与体重分布特征见表2。

图4 胶南近海金乌贼群体尾数密度分布Fig.4 Relative individual density distribution of Sepia esculenta in the coastal waters of Jiaonan表2 金乌贼胴长和体重的分布特征Table 2 Distribution characteristics of mantle length and body weight of Sepia esculenta

时间Time样本数量Samplesize胴长Mantlelength/mm范围①优势胴长范围(所占比例/%)②平均值③体重Bodyweight/g范围①优势体重范围(所占比例/%)④平均值③2015⁃08⁃2812117~6830~40(79.3)33.51.25~48.700~15(92.6)9.022015⁃09⁃143009~9030~60(86.3)45.251.00~110.500~40(84.7)24.642015⁃10⁃0488719~10930~60(82.9)46.211.52~235.000~40(81.2)27.362015⁃10⁃2682822~12150~70(71.6)59.844.58~278.0020~80(71.9)54.64
Note:①Range;②Dominant mantle length(proportion);③Mean mantle length;④Dominant body weight(proportion)
2.3 胴长-体重关系
拟合金乌贼的胴长(ML)-体重(TW)关系,得TW=8.0×10-4ML2.664 2(R2=0.953 5)(见图6),t检验结果表明该拟合方程可信。结果表明,金乌贼个体胴长与体重紧密相关,式中异速生长因子b<3,说明金乌贼为异速生长,即生长过程中3个线度方向的生长速度不等。
2.4 胴长与体重的生长变化
2.4.1 胴长与日龄的函数关系 胴长与日龄的曲线参数估计结果显示:S形函数关系式的R2值最大(0.984),因此选择S形函数来拟合胴长与日龄的关系(见表3),故幼乌贼胴长与日龄的最佳函数关系式为:ML=e4.321-37.181/D(图7)。20日龄金乌贼(放流苗种)胴长约为12 mm,111日龄(放流后91 d)胴长达到(59.84±0.52) mm,是放流苗种的5倍。调查期间,金乌贼胴长总平均增长率为0.46 mm/d。其中以各调查航次为时间节点,20~52日龄的胴长增长率为0.78 mm/d,52~69日龄的胴长增长率为0.42 mm/d,69~88日龄的胴长增长率为0.29 mm/d,88~111日龄的胴长增长率为0.20 mm/d。
2.4.2 体重与日龄的函数关系 体重与日龄的曲线参数估计结果显示:S形函数关系式的R2值最大(0.989),因此选择S形函数来拟合体重与日龄的关系(见表4)。故幼乌贼体重与日龄的最佳函数关系式为:BW= e4.85-122.39/D(见图8)。20日龄金乌贼(放流苗种)的体重约为0.30 g,111日龄时(放流后91天)体重达到(54.64±1.26) g,是放流苗种的182倍。调查期间,金乌贼体重总平均增长率为0.46 g/d,其中以各调查航次为时间节点,20~52日龄的体重增长率为0.37 g/d,52~69日龄的体重增长率为0.56 g/d,69~88日龄的体重增长率为0.53 g/d,88~111日龄的体重增长率为0.46 g/d。
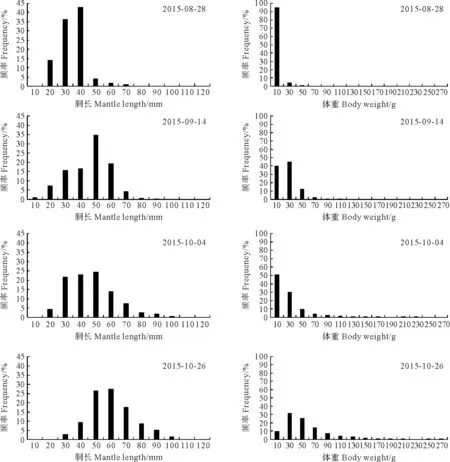
图5 金乌贼的胴长和体重分布频率Fig.5 Mantle-length and body-weight frequency distribution histogram of Sepia esculenta

图6 金乌贼的胴长-体重关系Fig.6 Relationship between Mantle length and body weight of Sepia esculenta
2.5 放流群体的分子标记检测
使用6对微卫星荧光引物对4个航次回捕金乌贼样本进行扩增、分型,并与2015年繁育亲体的基因型进行比较,分子检测结果表明随机抽测288只回捕个体,有14只与亲体的等位基因一致,且能找到唯一对应的亲本,因此可确认为放流个体,占随机抽测回捕个体的比例约为4.86%,放流初期金乌贼增殖效果显著。
3 讨论
3.1 放流后金乌贼的洄游分布及其增殖放流管理策略
中国山东青岛渔场是我国金乌贼主要渔场之一[3]。由于过度捕捞、沿岸环境污染、产卵场被破坏等原因,金乌贼资源逐渐衰退,山东自2010年开展大规模金乌贼增殖放流,放流数量逐年增加,主要放流海域为胶南灵山湾。因此,研究放流海域金乌贼的资源分布以及生长特性等,对制定其增殖放流管理策略具有重要参考价值。在本研究8—10月的4次调查中,各航次金乌贼出现频率均为100%,分子标记放流监测结果显示,放流群体在回捕样本中所占比例约为4.86%。
山东沿岸的金乌贼于冬季12月向越冬场移动,至翌年3月在越冬场越冬,越冬期多生活于70 m左右的水层。4月开始离开越冬场,成辐射型向山东沿岸各产卵场进行生殖洄游,5—7月进入山东沿海各内湾产卵[14-15],而金乌贼放流通常在7月下旬。幼乌贼的移动分布与水温、盐度、饵料、地貌条件等有密切关系[14]。跟踪调查结果显示,随着幼乌贼个体生长发育,其活动能力逐渐增强,陆续向南、向东移动扩散,到10月末水温进一步降低,资源高密度区分布在灵山岛西南海域,并继续保持向东南方向外海深水区移动趋势, 为越冬洄游做准备。这一结果与胶州湾金乌贼移动路线基本一致[18],符合山东近岸金乌贼的洄游规律[14-15]。

表3 金乌贼胴长与日龄的模型分析与参数估计
Note:①Model judgment coefficient;②Constant

图7 金乌贼胴长与日龄的拟合曲线(S)Fig.7 Fitting S between mantle length and age in days of Sepia esculenta

图8 金乌贼体重与日龄的拟合曲线(S)Fig.8 Fitting S between body weight and age in days of Sepia esculenta
根据胶南近海不同监测航次幼乌贼的资源分布特征,表明金乌贼放流海区水深不宜过浅,放流点不宜离岸过近,以水深15~20 m为宜。同时若在金乌贼越冬洄游路径上对当年补充群体进行适当保护,可以大幅增加翌年生殖群体数量,有效恢复金乌贼资源量。
3.2 放流海域金乌贼的生长特性及其增殖放流管理策略
调查发现,幼乌贼群体的个体大小不一,且随着调查时间的推移,捕获群体的胴长和体重的离散范围显著增加,主要是由于金乌贼产卵期较长以及受精卵的孵化时间不同所致[14]。金乌贼生殖期较长、个体间生长差异大,不同规格个体食性的差异,减小了种内个体间食物的竞争,有利于种群的生存[7]。唐启生等[19]、韦柳枝等[7]、郑元甲等[1]、Natsukari 等[20]对黄海、东海、日本Tachibana湾金乌贼胴长-体重的关系研究表明,胴长-体重均呈幂函数关系,且b值均小于3,为负异速增长,与本研究结果一致,仅b值略有差别。分析认为可能是由于不同群体间、或不同世代间的差异[7];同时与群体胴长组成、饵料环境和捕捞压力有关[21]。其他乌贼属的头足类如虎斑乌贼(Sepiapharaonis)[22]、针乌贼(Sepiaandreana)[23]胴长与体重的关系也是幂函数方程,均属于异速生长型。

表4 金乌贼体重与日龄的模型分析与参数估计
①Model judgment coefficient;②Constant
胶南近海金乌贼在8月末的平均胴长为33.50 mm(范围为17~68 mm),9月中旬金乌贼的平均胴长达45.25 mm(范围为9~90mm)。与李嘉泳等[14]的研究相比,其胴长小于1959年同期胶州湾野生金乌贼群体的胴长范围(8月末:30~70 mm;9月中旬:30~90 mm)。而与韦柳枝[7]等统计的2002年日照近海金乌贼野生群体相比,9月中旬金乌贼的平均胴长小于同期野生群体的平均胴长(63.50 mm)。但10月金乌贼的平均胴长接近或大于1989年东海[1]和2003年日照近海[7]同期的野生金乌贼群体的平均胴长。不同世代幼乌贼生长状况的差异,除了与各年际间金乌贼产卵时间、孵化时间密切相关外,还取决于各年际间幼乌贼的补充数量或者资源数量及其饵料基础的动态变化。
本研究中,金乌贼胴长和体重与日龄均呈S型曲线关系,即幼乌贼胴长和体重的相对增长量大[24],幼乌贼孵化约一个月后,由于各功能器官发育基本完全[25],能量主要用于肉体的生长,胴长和体重的增长率显著提高,此种生长方式是对环境的适应和提高存活率的一种生存策略[26]。Natsukari 等[20]研究表明,日本Tachibana湾6月末到9月初幼乌贼胴长的生长规律符合S型曲线,随后呈线性增长;倪正雅等[24]认为用S型曲线拟合乌贼体重和胴长的关系较符合实际生长规律;徐海洪等[27]研究拟目无贼(Sepialycidas)也得到相似结果。而雷舒涵等[26]认为室内水槽养殖金乌贼仔稚幼体的体重、胴长与日龄均呈指数关系;唐锋等[28]认为拟目乌贼仔稚幼体的体重、胴长与日龄均呈指数关系;张建设等[29]研究表明人工养殖曼氏无针乌贼(Sepiellamaindroni)在0~70日龄体重、胴长与日龄均呈指数关系,80~120日龄体重、胴长与日龄均呈线性关系;以上研究结果的分歧,可能与乌贼所处的生存环境、饵料组成及饵料密度有关,从而使其生长规律产生差异。
研究头足类等的生长规律,对于合理利用头足类资源有着十分重要的意义。当掌握某种头足类各阶段的生长规律之后,可以选择利用其快速生长期过后转入缓慢生长的时期,以达到合理利用资源的目的[30]。通过4个航次的监测调查发现,幼乌贼在自然环境中生长十分迅速,自2015年8月底至10月底,金乌贼的平均胴长在2个月内增长了1.8倍,平均体重则增加了6.1倍。金乌贼孵化后1个月内,能量主要用于优先发育对生命活动起重要作用的运动器官,如胴体和骨板等。孵化1个月后,其主要功能器官发育完全[25],能量主要用于肉体生长,胴长和体重等开始快速生长[28]。调查期间胴长总平均增长率为0.46 mm/d,体重总平均增长率为0.46 g/d,显著高于室内养殖金乌贼的平均生长速度(36~56日龄为0.086 g/d)[26],与孙峰德等[18]对2008年胶州湾幼乌贼的研究结果一致,且10月末越冬前期金乌贼体重仍保持快速增长。室内养殖条件下幼乌贼的生长速度显著小于自然环境,主要是由于目前幼乌贼的室内培育具有一定的难度,其中饵料驯化、养殖环境等是影响其生长的重要因素[31]。
研究表明,胶南近海饵料生物丰富、环境适宜,有利于幼乌贼的栖息生长。因此,根据海况条件可以将放流时间适当提前,使幼乌贼尽早适应自然环境,实现快速生长。胶南近海金乌贼的开捕时间为9月1日,此时金乌贼的个体尚小,且幼乌贼处于快速生长期,其资源不能被合理利用。如延迟开捕时间,充分延伸金乌贼的生长潜力,则可获得更高的预期产量。
4 结语
增殖放流是养护海洋生物资源和修复渔业环境的一项重要手段[32]。本文研究了胶南近海幼乌贼的生长特性、资源分布以及移动规律等,旨在为金乌贼增殖放流提供基础数据,并为制定科学的增殖放流管理策略提供参考。研究结果表明,金乌贼放流群体能够在胶南近海快速生长,形成一定数量的补充群体,当年即可使渔民受益;剩余群体经过越冬洄游,翌年可形成一定数量的繁殖群体,对自然资源进行补充。研究证实,放流初期金乌贼增殖效果显著,但放流群体对补充群体和繁殖群体的贡献率仍有待进一步调查分析。
[1] 郑元甲, 陈雪忠, 程家骅, 等. 东海大陆架生物资源与环境[M]. 上海: 上海科学技术出版社, 2003: 722-727. Zheng Y J, Chen X Z, Cheng J H, et al. Biological resources and environment in the East China Sea continental shelf [M]. Shanghai: Shanghai Scientific& Technical Press, 2003: 722-727.
[2] 齐钟彦. 中国经济软体动物[M]. 北京: 中国农业出版社, 1998: 293-294. Qi Z Y. Economic Mollusca of China [M]. Beijing: China Agriculture Press, 1998: 293-294.
[3] 董正之. 世界大洋经济头足类生物学[M]. 济南: 山东科学技术出版社, 1991: 197-207. DONG Z Z. The Biology of Oceanic Economic Cephalopod in the World [M]. Jinan: Shangdong Science Press, 1991: 197-207.
[4] 郝振林, 张秀梅, 张沛东. 金乌贼的生物学特性及增殖技术[J]. 生态学杂志, 2007 (4): 601-606. Hao Z L, Zhang X M, Zhang P D. Biological characteristics and propagation ofSepiaesculenta[J]. Chinese Journal of Ecology, 2007(4): 601-606.
[5] 房元勇, 唐衍力. 人工鱼礁增殖金乌贼资源研究进展[J]. 海洋科学, 2008(8): 87-90. Fang Y Y, Tang Y L. Research advances onSepiaesculentaresource enhancement of artificial reefs [J]. Marine Sciences, 2008 (8): 87-90.
[6] 赵厚钧, 魏邦福, 胡明, 等. 金乌贼受精卵孵化及不同材料附着基附卵效果的初步研究[J]. 海洋湖沼通报, 2004(3): 64-68. Zhao H J, Wei B F, Hu M, et al. Preliminary study onSepiaesculentaoosperm hatching and effects of different adhesion substrates [J]. Transactions of Oceanology and Limnology, 2004(3): 64-68.
[7] 韦柳枝, 高天翔, 韩志强, 等. 日照近海金乌贼生物学的初步研究[J]. 中国海洋大学学报(自然科学版), 2005(6): 45-50. Wei L Z, Gao T X, Han Z Q, et al. Biology ofSepiaesculentafrom the Coastal Waters of Rizhao [J]. Periodical of Ocean University of China, 2005(6): 45-50.
[8] Choe S. Rearing of cuttlefishes and squids [J]. Nature, 1963, 197: 307-327.
[9] 八木貞二. 東京湾産コウイカSepiaesculentaの甲の成長について[J]. 日本水産学会誌, 1960, 26(7): 646-652.
[10] 魏臻邦. 金乌贼生活习性的初步观察[J]. 动物学杂志, 1964(3): 132-134. Wei Z B. Preliminary observation ofSepiaesculentahabits [J]. Chinese Journal of Zoology, 1964(3): 132-134.
[11] Watanuki N, Kaneuchi S, Fujita T, et al. Entry of immature cuttlefishSepiaesculentainto basket traps [J]. Fisheries Science, 1998, 64(5): 707-710.
[12] Wada T, Takegaki T, Mori T, et al. Sperm displacement behavior of the cuttlefishSepiaesculenta(Cephalopoda: Sepiidae) [J]. Journal of Ethology, 2005, 23(2): 85-92.
[13] 藤田孝康, 平山泉, 松岡達郎, 等. 雌コウイカの産卵行動と産卵基質の選択[J]. 日本水産学会誌, 1997, 63(2): 145-151.
[14] 李嘉泳. 金乌贼Sepiaesculenta在黄渤海的结群生殖和洄游[J]. 山东海洋学院学报, 1963 (2): 69-108. Li J Y. On the breeding and migration of the golden Cuttlefish,Sepiaesculenta, living in Yellow Sea [J]. Journal of Shandong College of Oceanology, 1963(2): 69-108.
[15] 山田梅芳, 田川勝, 岸田周三, 等. 東シナ海·黄海のさかな[M]. 長崎: 水産庁西海区水産研究所, 1986: 208-461.
[16] 刘长琳, 庄志猛, 陈四清, 等. 金乌贼亲体驯养与繁殖特性研究[J]. 渔业现代化, 2009(2): 34-37. Liu C L, Zhuang Z M, Chen S Q, et al. Study on the broodstock domestication and propagation characteristics ofSepiaesculentaHoyle [J]. Fishery Modernization, 2009(2): 34-37.
[17] 国家海洋局. 海洋调查规范[M]. 北京: 海洋出版社, 2007. Ministry of Oceanography. Specifications of oceanographic survey [M]. Beijing: Maritime Press, 2007.
[18] 孙峰德. 胶州湾金乌贼生物学特性及渔场建设前景[J]. 河北渔业, 2008(6): 26-27. Sun D F. The biological characteristics and the prospect of fishery construction ofSepiaesculentain Jiaozhou Bay [J]. Hebei Fisheries, 2008(6): 26-27.
[19] 唐启升,叶懋中.山东近海渔业资源开发与保护[M]. 北京:农业出版社, 1990: 180-193. Tang Q S, Ye M Z. Development and Protection of Fishery Resources in Shandong Coastal Waters [M]. Beijing: Agriculture Press, 1990, 180-193.
[20] Natsukari Y, Tashiro M. Neritic squid resources and cuttlefish resources in Japan [J]. Marine and Freshwater Behaviour and Physiology, 1991, 18(3): 149-226.
[21] 李忠炉, 金显仕, 单秀娟, 等. 小黄鱼体长-体质量关系和肥满度的年际变化[J]. 中国水产科学, 2011(3): 602-610. Li Z L, Jin X S, Shan X J, et al. Inter-annual changes on body weight-length relationship and relative fatness of small yellow croaker (Larimichthyspolyactis)[J]. Journal of Fishery Sciences of China, 2011(3): 602-610.
[22] Nabhitabhata J, Nilaphat P. Life cycle of cultured pharaoh cuttlefish,SepiapharaonisEnrenberg, 1831 [J]. Phuket Marine Biological Center Special Publication, 1999, 19(1): 25-40.
[23] 程济生. 黄海针乌贼的渔业生物学及其资源状况的初步研究[J]. 中国水产科学, 1997(4): 22-28. Cheng J S. Studies on fishery biology of squid and its resources in the Yellow Sea [J]. Journal of Fishery Sciences of China, 1997(4): 22-28.
[24] 倪正雅, 徐汉祥. 东海曼氏无针乌贼种群的研究[J]. 海洋科学, 1985(4): 41-45. Ni Z Y, Xu H X. The preliminary study of the population of the cuttlefishSepiellamaindronide rochebrune along the East China Sea [J]. Marine Sciences, 1985(4): 41-45.
[25] Moguel C, Mascaró M, Avila-Poveda O H, et al. Morphological, physiological and behavioural changes during post-hatching development ofOctopusmaya(Mollusca: Cephalopoda) with special focus on the digestive system [J]. Aquat Biol, 2010, 9: 35-48.
[26] 雷舒涵, 张秀梅, 张沛东, 等. 金乌贼的早期生长发育特征[J]. 中国水产科学, 2014(1): 37-43. Lei S H, Zhang X M, Zhang P D, et al. Early development of golden cuttlefishSepiaesculenta[J]. Journal of Fishery Sciences of China, 2014(1): 37-43.
[27] 徐海洪, 蔡文飞, 周淑进, 等. 拟目乌贼幼体日摄食量及其对体重影响[J]. 氨基酸和生物资源, 2012(4): 67-70. Xu H H, Cai W F, Zhou S J, et al. Daily food consumption and its effect on the larvae body weight ofsepialycidas[J]. Amino Acids and Biotic Resources, 2012(4): 67-70.
[28] 唐锋. 拟目乌贼繁殖生物学特性及人工育苗技术初步研究[D]. 宁波:宁波大学, 2014. Tang F. Preliminary study on reproductive biology and artificial breeding technology ofSepialycidas[D]. Ningbo:Ningbo University, 2014.
[29] 张建设. 曼氏无针乌贼养殖生物学特性和血细胞免疫功能研究[D]. 厦门:厦门大学, 2007. Zhang J S. Culture biological characteristics and haemocytes immune function ofSepiellamaindroni[D]. Xiamen: Xiamen University, 2007.
[30] Dall W, Hill B J, Rothlisberg P C. 对虾生物学[M]. 青岛: 青岛海洋大学出版社, 1992: 384-395. Dall W, Hill B J, Rothlisberg P C. The Biology of the Penaeidae [M]. Qingdao: Qingdao Ocean University Press, 1992: 384-395.
[31] 周维武, 郑小东. 金乌贼产卵规律及室内人工孵化培育方法探索与研究[J]. 渔业现代化, 2006(3): 36-37. Zhou W W, Zheng X D. The inquiry and investigation of the Spawning law and the indoor artificial incubation cultivating method of theSepiaesculenta[J]. Fishery Modernization, 2006(3): 36-37.
[32] 姜亚洲, 凌建忠, 林楠, 等. 象山港日本对虾增殖放流的效果评价[J]. 生态学报, 2012(9): 2651-2658. Jiang Y Z, Ling J Z, Lin N, et al. Stocking effectiveness of hatchery-released kuruma prawnPenaeusjaponicusin the Xiangshan Bay, China [J]. Acta Ecologica Sinica, 2012(9): 2651-2658.
责任编辑 朱宝象
Preliminary Assessments on Growth Characteristics, Resource DistributionandSepiaesculentaReleasing Effect in Jiaonan Coastal Water
NIU Chao, ZHANG Xiu-Mei, DING Peng-Wei, SHAN Bin-Bin
(The Key Laboratory of Mariculture(Ocean University of China), Ministry of Education, Qingdao 266003, China)
Four monitoring and recapture surveys of the releasedSepiaesculentain coastal waters of Jiaonan and Lingshan Bays (Qingdao, China) were conducted from August to October, 2015. An investigation of growth, distribution, relative stock density and an effect evaluation ofS.esculentastock enhancement were carried out. The results showed that the mean biomass density and the mean numerical density were the lowest on August 28th in the four surveys, the highest mean biomass density and the highest mean numerical density were on October 26th and October 4th, respectively. Moreover, the resource density was significant higher in the southwest waters of Lingshan Island than in the Lingshan Bay. The occurrence frequency ofS.esculentawas 100% in the four surveys. The area of high resource density moved out from Lingshan Bay to the deep waters southwest Lingshan Island with the growing ofS.esculenta. The juvenile cuttlefishS.esculentagrew quickly. The average mantle length growth rate was about 0.46 mm /d and the average body weight increase rate was about 0.46 g/d. The relationship of mantle-length (ML) and body-weight (W) could be expressed asTW=8.0×10-4ML2.6642. Both the mantle length growth and the body weight increase showed an S pattern. The genetic marker results showed that 14 recapturedS.esculentawere consistent with the bloodstock by using the six microsatellite loci, proving that they were released juvenile, accounting for about 4.86% of the 288 recapturedS.esculentaby random sampling in the four surveys. The enhancement effect was remarkable at the preliminary stage of the release. Our study provided a scientific basis for the stock maintenance and rational exploitation ofS.esculentaand helped to develop strategies for the corresponding enhancement and release management.
Sepiaesculenta; releasing and enhancement; spatial-temporal distribution; growth; genetic markers; Jiaonan; resource density
国家自然科学基金项目(41676153);国家海洋公益性行业科研专项(201405010;201305043)资助 Supported by National Natural Science Foundation (41676153); Public Science and Technology Research Funds Projects of Ocean (201405010; 201305043)
2016-05-20;
2016-09-06
牛超(1991-), 男,硕士生, 主要从事渔业资源修复研究。
❋❋ 通讯作者:E-mail: gaozhang@ouc.edu.cn
S931.5
A
1672-5174(2017)07-036-10
10.16441/j.cnki.hdxb.20160190
牛超,张秀梅,丁鹏伟,等. 胶南近海金乌贼生长特性、资源分布及增殖放流效果初步评价[J].中国海洋大学学报(自然科学版),2017,47(7):36-45.
NIU Chao, ZHANG Xiu-mei, DING Peng-wei, et al. Preliminary assessments on growth characteristics, resource distribution andSepiaesculentareleasing effect in Jiaonan coastal water [J].Periodical of Ocean University of China, 2017,47(7):36-45.
