毒死蜱降解菌CD7的筛选与植物根际促生菌JD37的联合应用
2017-05-15苏翠珠蒋秋悦杨文武孙舒荣
苏翠珠, 蒋秋悦, 章 丽, 罗 斯, 杨文武, 孙舒荣, 肖 明*
(1.上海师范大学 生命与环境科学学院 植物种质资源开发协同创新中心,上海 200234; 2.复旦大学 生命科学学院,上海 200438)
毒死蜱降解菌CD7的筛选与植物根际促生菌JD37的联合应用
苏翠珠1†, 蒋秋悦1,2†, 章 丽1, 罗 斯1, 杨文武1, 孙舒荣1, 肖 明1*
(1.上海师范大学 生命与环境科学学院 植物种质资源开发协同创新中心,上海 200234; 2.复旦大学 生命科学学院,上海 200438)
筛得一株毒死蜱降解菌CD7,联合植物根际促生菌JD37,研制了一种能修复土壤的农药污染,同时促进植物生长的复合型土壤改良剂.实验结果显示:将CD7和JD37发酵液按体积比1∶1使用,可以促进植物生长,并在25 d内降解土壤中约66.43%的毒死蜱.在载体量相同情况下,蚯蚓粪比滑石粉吸附更多混合菌株.在室温贮藏一个月,活菌数为4.81×107CFU/g;制备的复合改良剂与土壤按质量比1∶1使用时,能促进植物生长、提升土壤酶活性、增加土壤中微生物的数量.
植物根际促生菌; 毒死蜱降解菌 CD7; 土壤改良; 筛选
0 引 言
随着人口的不断增长,中国耕地资源日趋缺乏,施用化肥和农药是目前维持人口与粮食间平衡的主要手段之一[1].然而,大量使用化肥和农药会导致土壤板结、土壤酸化、地下水污染和农产品农药残留超标等问题[2].其中,较普遍使用的有机磷农药“毒死蜱”在土壤中残留时间长,使生态环境恶化[3-4].
植物根际微生物种类繁多且活跃,构成了植物根际特有的微生物区系.植物根际促生菌(PGPR)是一类可以自由生活在土壤或定殖于植物根际的有益菌类[5].它能影响植物对矿质营养的吸收与利用,保护植物免受不同土壤病原体的危害,从而促进植物生长.同时它还能够快速、高效地分解农药残留物,改善土壤品质[6].
本文作者在土壤中进行毒死蜱降解菌的筛选与培育,并与植物根际促生菌复配,制备了微土壤改良剂.从毒死蜱降解与促进植物生长能力方面,研究了两株菌的最佳复配比例;研究不同载体对复配菌株的吸附能力和菌株贮藏时间的影响;通过盆栽实验研究所制备的微生物土壤改良剂的施用量,为微生物土壤改良的实际应用提供参考.
1 材料与方法
1.1 材 料
1.1.1 土壤样品
筛选毒死蜱降解菌的土样采自上海市金山区廊下果蔬园艺有限公司植物根际土壤和园艺土壤.
栽培土取自上海师范大学徐汇校区植物园地表下10 cm处土壤,使用筛孔边长为1.43 mm的标准筛过筛,121 ℃下灭菌20 min,重复3次,烘干备用.
1.1.2 供试菌株
桔黄假单胞菌JD37(PseudomonasaurantiacaJD37)由上海师范大学微生物分子生物学实验室分离、纯化、保藏.菌种保藏号:CGMCC No.1.10967.
1.1.3 供试植物
小青菜种子选用上海青(BrassicachinensisL.),购自上海白玉兰蔬菜种子有限公司.
1.1.4 培养基和材料
无机盐培养基和富集培养基,灭菌后加入经氯仿抽滤灭菌的毒死蜱,质量浓度为50 mg/L,用于毒死蜱降解菌的筛选与分离.
培养基包括:King′s B(KB)液体培养基、牛肉膏蛋白胨液体培养基、高氏(Gause)1号培养基、马丁氏(Martin)培养基.
所有培养基使用前在121 ℃下高压灭菌20 min.
载体材料:蚯蚓粪购于南京华墨现代农业发展有限公司;滑石粉购于上海前进化学试剂厂.载体在121 ℃下灭菌30 min,重复3次,烘干备用.
1.2 实验方法
1.2.1 供试菌株的活化与毒死蜱降解菌的筛选
将-80 ℃下贮藏的JD37菌株接种于KB液体培养基,置于28 ℃下摇床振荡培养,转速为200 r/min,活化3次,接种,接种量为1%.培养20 h后,取出处于对数生长期的种子液(生物量浓度约为109CFU/mL)接入装有50 mL KB液体培养基的容量为250 mL的三角瓶中,置于摇床,28 ℃,转速为200 r/min,震荡培养20 h制备成JD37菌悬液.
将筛得并贮藏的CD7菌株接种于牛肉膏蛋白胨液体培养基,置于摇床,30 ℃,转速为200 r/min,震荡培养,按上述相同方法进行菌株活化,制备CD7菌悬液.
采用土壤细菌筛选、分离的常规方法[7],利用含毒死蜱(质量浓度为50 mg/L)的无机盐培养基和富集培养基进行毒死蜱降解菌的筛选.
1.2.2 菌株在培养基中降解能力测定
1.2.2.1 标准曲线绘制[7]
将毒死蜱标准品用石油醚溶解后确配制成质量浓度为84 mg/L的25 mL毒死蜱母液,然后将母液稀释成质量浓度分别为0,8.4,16.8,25.2,33.6,42.0,50.4 mg/L的毒死蜱标准液,并测定它们对293 nm波长光的吸光度.
1.2.2.2 菌株降解能力测定[8]
用富集培养基富集待测菌株,当菌悬液的OD600为0.8时,以5 000 r/min转速离心5 min后收集菌株,再用质量分数为0.9%的NaCl冲洗2遍后重悬于无机盐培养基中,按1%的接种量转接到毒死蜱质量浓度为100 mg/L的无机盐培养基中,培养72h后,取4 mL培养液加入等体积石油醚萃取2次,测定两次得到的萃取液混合对293 nm波长光的吸光度,依据标准曲线计算毒死蜱质量浓度.
菌株在培养基中的降解率为
(1)
式中C2为培养72h后对照组毒死蜱的质量浓度,C1为培养72h后实验组毒死蜱的质量浓度,C0为毒死蜱初始质量浓度.
1.2.3 菌株在土壤中降解能力测定
1.2.3.1 标准曲线绘制
用乙酸乙酯溶解毒死蜱标准品,并精确配制出25 mL质量浓度为100 mg/L的毒死蜱母液.再用乙酸乙酯将已配制的母液稀释成质量浓度分别为0,1,5,10,50,80 mg/L的毒死蜱标准液,并测定它们对293 nm波长光的吸光度.
1.2.3.2 菌株降解能力测定
取1g实验土样置于容量为50 mL的离心管中,加入25 mL乙酸乙酯浸泡.浸泡液经装有无水Na2SO4的漏斗至圆底烧瓶中,再依次用20,20,10 mL乙酸乙酯冲洗剩余土壤,合并冲洗液,置于45 ℃的真空旋转蒸发仪中浓缩至干,加入5 mL乙酸乙酯定容后于293 nm波长光下测定吸光度[10-11],依据标准曲线计算毒死蜱的质量浓度.实验3次重复.
1.2.4 复配菌株对植物生长的影响
将毒死蜱加至灭菌土壤,搅拌混匀,使土壤中毒死蜱的质量浓度达到500 mg/L.
挑选健康饱满、大小均一的小青菜种子,用质量分数为0.1%的高锰酸钾溶液浸泡20 min进行表面消毒,用无菌水冲洗4~5遍,置于铺有无菌滤纸的平皿中,注入15 mL无菌水,在28 ℃的光照培养箱内暗培养3d后,挑选已发芽的健康小青菜种子,播种在含毒死蜱的土壤中,2粒/穴,6穴为1组,实验3次重复.在播种后第1天,及之后每隔4d浇灌不同配比(体积比)的菌液,CD7和JD37菌液中菌体数量约为107CFU/mL.对照组浇灌无菌水.盆栽实验放置于光照培养箱中进行,设定参数为30 ℃光照培养14 h,20 ℃暗培养10 h,实验期间浇灌无菌水保持土壤湿润.于出苗后第25天取样,统计小青菜幼苗的生长指标.
1.2.5 复配菌株对毒死蜱降解能力的测定
上述实验取样结束后,收集种植过小青菜的土壤,采用1.2.3的方法分别测定播种第1天与第25天土壤中毒死蜱的残留量.实验3次重复.
1.2.6 不同载体材料吸水能力的测定
向不同载体材料中加无菌水,每次加入1 mL,充分搅拌混匀,使载体保持湿润不结块.实验3次重复.
载体吸水率为
(2)
式中m1为添加无菌去离子水的质量,m2=100 g为载体质量.
1.2.7 不同载体材料对复配菌株吸附能力的测定
分别取培养至对数生长期的CD7和JD37菌液5,15,25,35,50 mL,4 ℃下,以10 000r/min的转速离心10 min,弃上清液,用无菌水冲洗1遍后将等体积的CD7和JD37菌液混合,用无菌水冲洗2~3遍,收集复配菌株并称重,加入10 mL无菌水重悬.
分别将1g滑石粉和1 g蚯蚓粪加入到装有40 mL无菌水的容量为250 mL的三角瓶中,再加入已制备的10 mL复配菌株悬液,置于磁力搅拌器上进行复配菌株吸附能力实验,吸附时间为30 min,然后过滤,将滤液离心后收集菌株并称重.实验3次重复.
复配菌株吸附率为
(3)
式中N为吸附前溶液中复配菌株的质量浓度,N′为吸附后溶液中复配菌株的质量浓度.
1.2.8 不同载体材料对复配菌株贮藏时间的影响
分别向滑石粉和蚯蚓粪中加入等体积的复配菌株悬液,搅拌混匀,于室温密封贮藏.分别于实验后1,5,11,25,30 d取样,采用稀释涂布法测定样品中的有效活菌数.对照组为不添加载体的复配菌株发酵液,实验3次重复.
1.2.9 复合土壤改良剂的施用配比研究
将制备好的复合土壤改良剂与土壤按不同质量比混合:(1)土壤对照组(CK组即不添加复合改良剂组);(2)m(复合土壤改良剂)∶m(土壤)=1∶2;(3)m(复合土壤改良剂)∶m(土壤)=1∶1;(4)m(复合土壤改良剂)∶m(土壤)=2∶1;(5)复合土壤改良剂载体.
在上述土壤中分别播种小青菜后置于光照培养箱培养,期间浇灌无菌水保持土壤湿润,实验3次重复.于出苗后25 d取样,测定土壤酶活性[12]、土壤微生物数量[7]和小青菜幼苗生长指标.
2 结果与分析
2.1 毒死蜱降解菌的筛选及降解能力的测定

表1 毒死蜱降解菌在培养基、土壤中的降解能力
从金山大田植物根际土壤和园艺土壤中,经过筛选排重后,共得到11株毒死蜱降解菌.分别命名为:CD1~3,CD5~12.经分离纯化后测定11株菌对培养基和土壤中毒死蜱的降解效率如表1所示.从表1可知,与培养基中的菌株相比,在营养较差的土壤环境的多数菌株降解能力减弱,而CD5~7和CD10降解能力反而增强,说明这4株菌适应外界环境能力较强.另外,可明显看出CD7降解毒死蜱能力最强,分别为29.35%和71.54%,故选用CD7菌株进行后续实验.
提取CD7菌株的基因组DNA进行16S rDNA扩增,将扩增得到的产物纯化后测序,结果上传至NCBI(National Center for Biotechnology Information)的Genbank中进行BLAST比对,鉴定其属于伯克氏菌属(Burkholderiasp.).
2.2 复配菌株对植物生长的影响
桔黄假单胞菌JD37从上海市郊农作物根际土壤中筛选得到[13],相关实验证实该菌株对玉米、小麦、小白菜和蕹菜等作物生长有促进效果,还能高效抑制多种植物病原菌,例如小麦赤霉病(Fusariumgraminearum)、水稻纹枯病(Rhizoctoniasolani)、番茄灰霉病(Botrytiscinerea)及油菜菌核病(Sclerotiniasclerotiorum)等[14].
苗穴实验观察CD7与JD37联合接种对小青菜的促生效果,播种后25 d采样,分别测定小青菜的根长、苗高、鲜重及干重(表2).单因素方差分析结果表明,CD7与JD37联合接种对小青菜的苗高、鲜重和干重的促进作用显著大于单独接种CD7或JD37(P<0.05).此外,CD7与JD37按1∶1体积比配比联合接种小青菜的生长情况最好(图1).
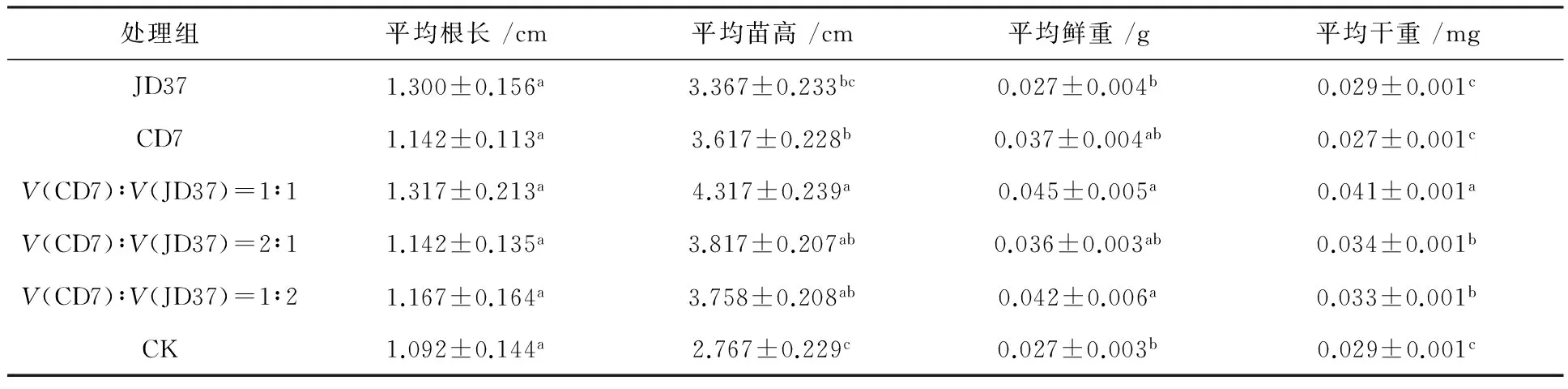
表2 不同配比复配菌株对小青菜幼苗生长的影响

图1 不同配比复配菌株对小青菜幼苗生长的影响
2.3 复配菌株对毒死蜱降解能力的测定
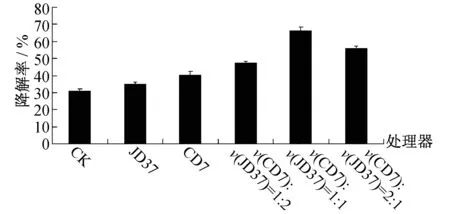
图2 不同配比复配菌株对毒死蜱的降解率
不同配比复配菌株对毒死蜱的降解率如图2所示,从图2可看出,在种植小青菜的土壤中单独接种CD7或JD37可降解土壤中的毒死蜱,与对照组相比,降解率差异显著.当CD7与JD37按体积比1∶1配比联合接种时,对种植小青菜的土壤中的毒死蜱降解效果最好,降解率约66.43%,分别是单独接种CD7或JD37的1.65倍和1.89倍.
综合2.2节和2.3节的实验结果,CD7与JD37最适复配比(体积比)为1∶1,该复配比可以降低土壤中毒死蜱含量,同时促进含毒死蜱土壤中小青菜的生长.
2.4 不同载体材料吸水能力的测定
分别选用滑石粉和蚯蚓粪作为复配菌株的载体材料,实验发现,滑石粉的吸水率为54.1%,蚯蚓粪的吸水率为23.4%.滑石粉的吸水能力高于蚯蚓粪.
2.5 不同载体材料对复配菌株吸附能力的测定
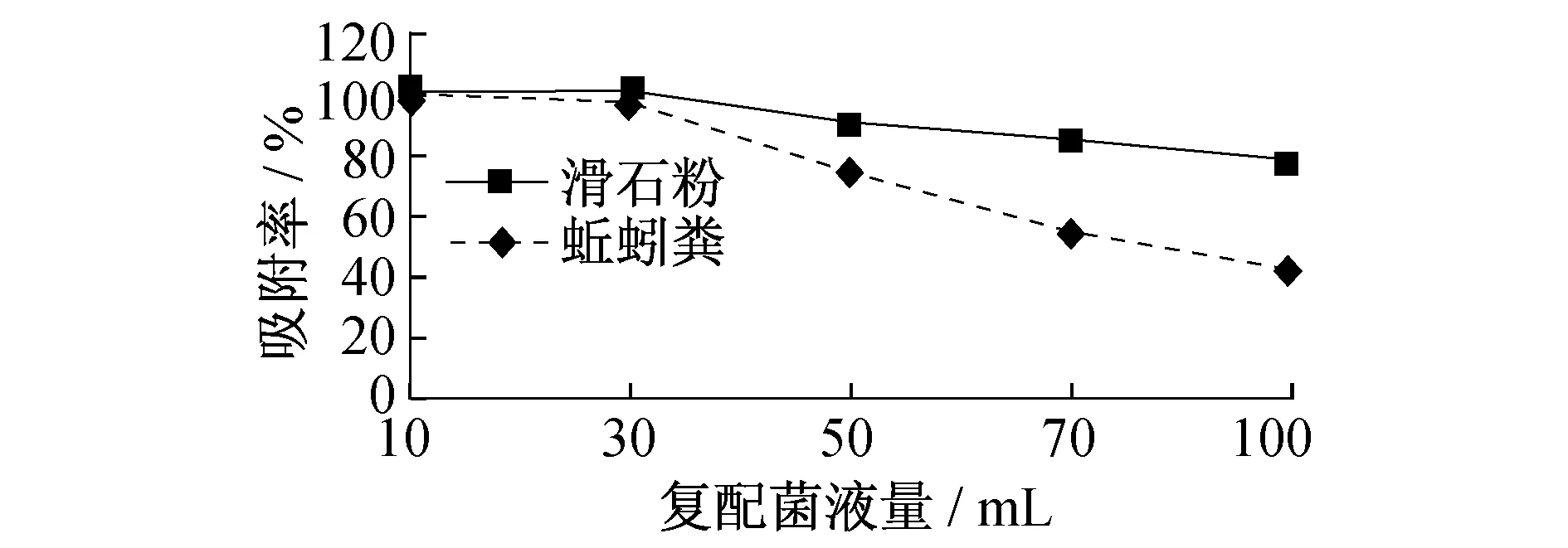
图3 不同载体对复配菌株的吸附能力
不同载体对复配菌株的吸附能力如图3所示.从图3可以看出,当载体用量相同时,不同载体对复配菌株的吸附能力都随复配菌株菌液量的增加而减少,2种载体的吸附率As都呈下降趋势.当复配菌液量为10 mL时,复配菌株能完全被2种载体吸附,As=100%.当菌液量为30 mL时,蚯蚓粪仍然能完全吸附复配菌株,而滑石粉对菌株的吸附率下降为96.33%;当菌液量为50 mL时,滑石粉对菌株的吸附率下降至73.77%,变化较大,蚯蚓粪的吸附率也略有下降,约为89.70%;当菌液量为100 mL时,滑石粉的吸附率仅为42.31%.相比而言,蚯蚓粪的吸附率下降较缓慢,其吸附能力好于滑石粉,能吸附更多的混合菌株,这可能与蚯蚓粪的结构性质相关.
2.6 不同载体材料对复配菌株贮藏时间的影响
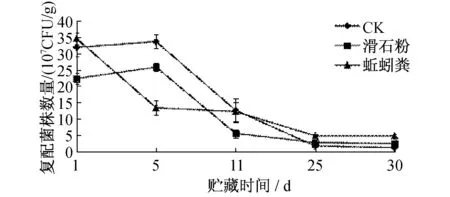
图4 不同载体对复配菌株贮藏时间的影响
在长期贮藏过程中,合适的载体是保障微生物活性的关键,它不仅会影响微生物的数量,还会影响成品的质量.不同载体对复配菌株贮藏时间的影响如图4所示.从图4可知,不添加载体或以滑石粉为载体的复配菌株数量变化相似,室温贮藏5 d后,复配菌株数量略有上升,第5~11 d,复配菌株数量呈明显下降趋势;以蚯蚓粪为载体的复配菌株数量在室温贮藏5 d后急剧下降,从3.45×108CFU/g降至1.34×108CFU/g.室温贮藏30 d后,添加滑石粉和蚯蚓粪作为载体更利于复配菌株的贮藏,菌株数量为2.47×107CFU/g和4.81×107CFU/g.
综合2.5节和2.6节实验结果,蚯蚓粪更适合作为复配菌株的载体,既有利于复配菌株的吸附,又为复配菌株的长期贮藏提供保障.
2.7 复合土壤改良剂的制备方法
蚯蚓粪经121 ℃灭菌30 min,重复3次,烘干备用.无菌条件下,分别取培养20 h,处于对数生长期的CD7菌悬液和JD37菌悬液500 mL,4 ℃下,以转速1×104r/min离心10 min,弃上清液,用无菌水冲洗2~3遍后收集复配菌株,加入23.4 mL无菌水(吸水率为23.4%)和100 g蚯蚓粪,将载体与菌株充分混匀,装入塑封袋中,室温贮藏.
2.8 复合土壤改良剂与土壤不同配比施用对土壤酶活性的影响
探究复合土壤改良剂的不同施用配比是后续实际施用实验的参考依据.表3结果显示,与对照组相比,按不同配比施用复合土壤改良剂能提高各种土壤酶的活性.复合土壤改良剂与土壤按1∶1(质量比)配比施用对土壤蔗糖酶活性的增加效果最为明显(P<0.05),且高于含丰富有机质的蚯蚓粪处理组;同时也可以提高土壤脲酶和纤维素酶活性,并与其他处理组差异显著.蚯蚓粪处理组的土壤过氧化氢酶活性最高,其次是复合土壤改良剂与土壤2∶1施用配比处理组.
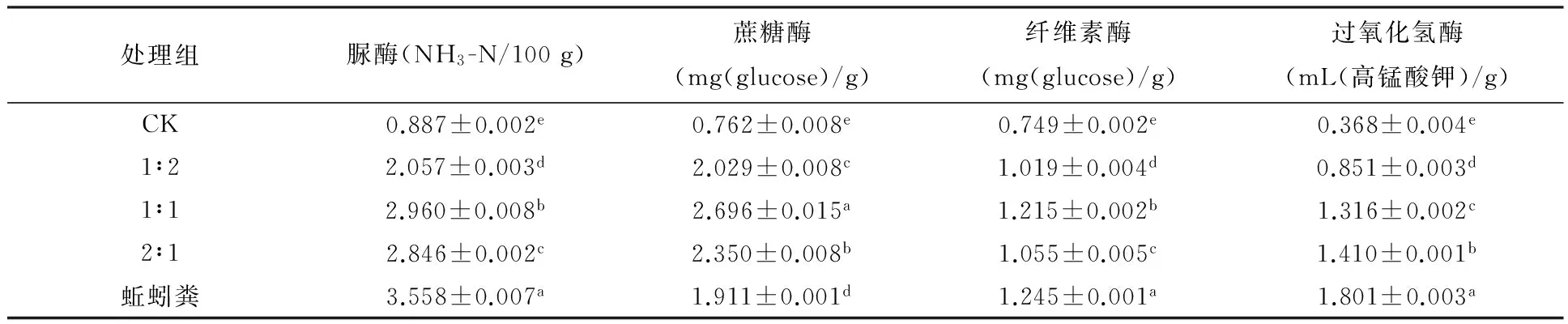
表3 不同配比土壤改良剂对土壤酶活性的影响
2.9 复合土壤改良剂与土壤不同配比施用对土壤微生物数量的影响

图5 不同配比土壤改良剂对土壤微生物数量的影响
从图5结果可知,与对照组相比,不同配比复合土壤改良剂的施用能增加土壤中真菌数量,有机质含量较高的蚯蚓粪反而会对真菌数量产生抑制作用.土壤中细菌数量变化不明显,除复合土壤改良剂与土壤配比为2∶1(质量比)的处理组会减少细菌数量,其他各处理组土壤细菌数量无显著差异.土壤中放线菌数量变化较明显,复合土壤改良剂与土壤配比为2∶1(质量比)的处理组和蚯蚓粪处理组含放线菌数量最高,分别为6.6×106CFU/g和6.3×106/g,与其他各处理组均存在显著差异.
2.10 复合土壤改良剂与土壤不同配比施用对植物生长的影响
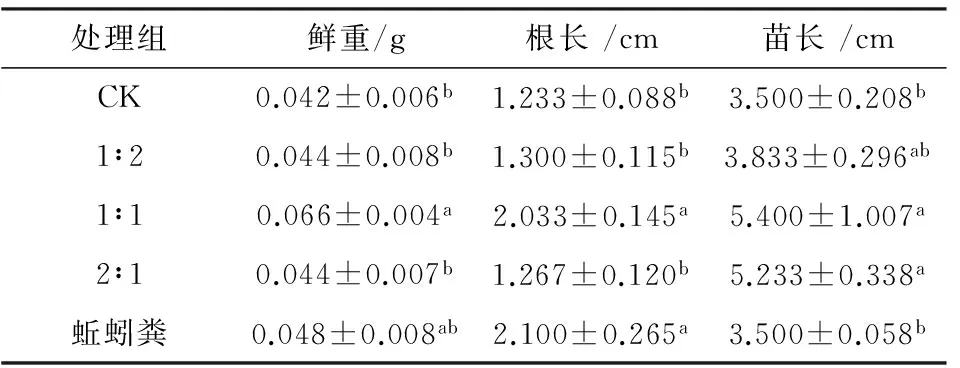
表4 不同配比土壤改良剂对植物生长的影响
播种25 d后采样,分别测定小青菜的鲜重、根长和苗长(表4).结果表明,复合土壤改良剂对小青菜的鲜重、根长和苗长有促进作用,复合土壤改良剂与土壤1∶1(质量比)配比施用对小青菜生长的作用效果显著优于对照组(P<0.05),鲜重、根长和苗长分别增加57.14%、64.88%和54.19%.
综合2.8、2.9和2.10节实验结果,复合土壤改良剂与土壤按1∶1(质量比)配比混合施用效果最佳,对土壤酶活性、土壤微生物数量和小青菜的生长都具有积极作用.
3 结 论
筛选得到的毒死蜱降解菌菌株CD7,其降解土壤中毒死蜱的效率为66.43%,虽单独降解毒死蜱能力相较其他菌株略有不足[3],但与其他生物联合作用较好.将其与植物根际促生菌JD37联合后,不仅能够降解土壤中残留的毒死蜱,促进作物的生长,还能增加部分土壤酶活性、维持土壤中微生物数量,从而改善土壤品质;而与小青菜联合作用后也能降解毒死蜱,但降解能力有所下降,这很可能是因为受到小青菜根际分泌物的影响.
在制备土壤改良剂的过程中,采用不同载体材料研究了载体对复配菌株贮藏时间的影响.发现复配菌株在蚯蚓粪中贮藏5 d后活菌数量急剧下降,这是因为蚯蚓粪颗粒大且多孔导致细菌吸附在其中,不易洗出.
通过探究CD7和JD37的最佳配比、不同载体对联合菌株的吸附能力和菌株贮藏时间的影响,选择将CD7和JD37按1∶1的体积比吸附于蚯蚓粪中制备出复合菌种改良剂;通过盆栽实验得出将土壤与改良剂按质量比1∶1使用时改善土壤品质效果最佳,且小青菜的生长情况最好,这为复合微生物土壤改良剂的实际应用奠定基础.但是,有关CD7菌株的对毒死蜱的降解机制、如何提高其降解效率有待深入研究,有关保护剂的选择、制备条件的优化也需要进一步的探讨.
[1] 郑伟.中国化肥施用区域差异及对粮食生产影响的研究 [D].北京:中国农业大学,2005.
Zheng W.Regional differences of chemical fertilizer application in China and its influence on food production [D].Beijing:China Agricultural University,2005.
[2] 李竹林.农药化肥施用存在的问题及对策 [J].现代农业科技,2014(16):217,226.
LI Z L.Problems and countermeasures of using pesticide and fertilizer [J].Modern Agricultural Sciences and Technology,2014(16):217,226.
[3] 杨丽,赵宇华,张炳欣,等.一株毒死蜱降解细菌的分离鉴定及其在土壤修复中的应用 [J].微生物学报,2005,45(6):89-93.
Yang L,Zhao Y H,Zhang B X,et al.Isolation and characterization of a chlorpyrifos degrading bacteria and its biorediation application in the soil [J].Acta Microbiologica Sinica,2005,45(6):89-93.
[4] Rani M S,Lakshmi K V,Devi P S,et al.Isolation and characterization of a chlorpyrifos-degrading bacterium from agricultural soil and its growth response [J].African Journal of Microbiology Research,2008,2(2):26-31.
[5] De-bashanL E,Hernandez J,Bashan Y.The potential contribution of plant growth-promoting bacteria to reduce environmental degradation-A comprehensive evaluation [J].Applied Soil Ecology,2012,61:171-189.
[6] 王静岩,傅营,王斌.微生物降解农药研究 [J].北京农业,2015(8).
Wang J Y,Fu Y,Wang B.Study on microbial degradation of pesticides [J].Beijing Agriculture,2015(8).
[7] 肖明,王雨净.微生物学实验 [M].北京:科学出版社,2008.
Xiao M,Wang Y J.Microbiology experiments [M].Beijing:Science Press,2008.
[8] 金鑫,冉雪琴,王嘉福.农田土壤中毒死蜱降解菌的分离与鉴定 [J].贵州农业科学,2010,38(4):103-106.
Jin X,Ran X,Wang J.Isolation and identification of chlorpyrifos degradation bacteria in soil [J].Guizhou Agricultural Sciences,2010,38(4):103-106.
[9] 王金花,朱鲁生,王军,等.3株真菌对毒死蜱的降解特性 [J].应用与环境生物学报,2005,11(2):211-214.
Wang J,Zhu L,Wang J,et al.Degradation characteristics of three fungi to chlorpyrifos [J].Chinese Journal of Applied & Environmental Biology,2005,11(2):211-214.
[10] 赵萍,亓文静,王雅,等.两株有机磷农药降解菌的分离鉴定及降解特性 [J].兰州理工大学学报,2010,36(3):86-90.
Zhao P,Qi W J,Wang Y,et al.Isolation and identification of two strains capable of degrading of organophosphorus pesticides and their biodegradation abilities [J].Journal of Lanzhou University of Technology,2010,36(3):86-90.
[11] 谢慧,朱鲁生,王军,等.真菌WZ-1对有机磷杀虫剂毒死蜱的酶促降解 [J].环境科学,2005,26(6):164-168.
Xie H,Zhu L S,Wang J,et al.Enzymatic degradation of organophosphorus insecticide chlorpyrifos by fungus WZ-I [J].Environmental Science,2005,26(6):164-168.
[12] 关松荫.土壤酶及其研究法 [M].北京:农业出版社,1986.
Guan S Y.Method of soil enzyme study [M].Beijing:Agriculture Press,1986.
[13] 王慧捷,宋璟,朱玉兵,等.1株拮抗植物病原真菌的细菌筛选及其抑菌机理的初步研究 [J].微生物学杂志,2010,30(2):7-13.
Wang H J,Song J,Zhu Y B,et al.Screening of an antagonistic bacterial strain against plant pathogenic fungi and its antimicrobial mechanism [J].Journal of Microbiology,2010,30(2):7-13.
[14] Fang R,Lin J,Yao S,et al.Promotion of plant growth,biological control and induced systemic resistance in maize byPseudomonasaurantiacaJD37 [J].Annals of Microbiology,2013,63(3):1177-1185
(责任编辑:顾浩然)
Screening of chlorpyrifos degrading bacteria CD7 andits combined application with PGPR JD37
Su Cuizhu1, Jiang Qiuyue1,2†, Zhang Li1, Luo Si1, Yang Wenwu1, Sun Shurong1, Xiao Ming1*
(1.Development Center of Plant Germplasm Resources,College of Life and Environmental Sciences, Shanghai Normal University,Shanghai 200234,China; 2.School of Life Sciences,Fudan University,Shanghai 200438,China)
We screened a chlorpyrifos degrading bacteria,Burkholderiasp.CD7.Joint with plant growth-promoting rhizobacteria(PGPR) JD37 to produce a compositesoil amendment,which could restorethe pesticides polluted soil and promote plant growth.Results showed that CD7 and JD37 (at the volume ratio of 1∶1) can promote the growth of plants,and within 25 days degrade about 66.43% chlorpyrifos in the soil.Further research found that under the same conditions of carrier dosage,vermicompost can adsorbed more bacteria than talcum powder;after a month preservation at room temperature,the number of living bacterium still maintained about 4.81×107CFU/g.Carrier and soil,at the mass ratio of 1∶1,could optimally promote plant growth,improve soil enzyme activities and increase the number of microorganisms in soil.
plant growth-promoting rhizobacteria; chlorpyrifos degrading bacteria CD7; soil amendment;screening
2016-10-31
上海市科委重点项目(16391902100)
苏翠珠(1991-),女,硕士研究生,主要从事土壤有益微生物方面的研究.E-mail:czsu2012@126.com
导师简介: 肖 明(1961-),男,博士后,教授,博士生导师,主要从事环境微生物、分子生物学以及微生物与植物相互关系方面的研究.E-mail:xiaom88@shnu.edu.cn
Q 939.96
A
1000-5137(2017)02-0311-08
*通信作者
†并列第一作者: 蒋秋悦设计了本研究的主要研究技术路线及初稿的撰写;苏翠珠进行了本研究的相关实验内容并统计分析了相关数据,完成了论文的终稿及相关修改工作.
