复合溶剂预处理对葵花秆木质素去除率和结构的影响
2017-05-02侯彬彬宋江涛马骁陈福欣周安宁
侯彬彬++宋江涛+马骁+陈福欣+周安宁
摘要:采用NaOH、乙醇复合溶剂对葵花秆进行预处理,通过单因素试验研究了反应时间、温度、固液比、溶剂质量分数及复合溶剂比例对葵花秆木质素去除率的影响,然后利用正交试验法对预处理条件进行优化,得到最佳预处理条件为温度170 ℃,2% NaOH和70%乙醇的复合溶剂体积比为2 ∶[KG-*3]1,固液比1 ∶[KG-*3]25(g ∶[KG-*3]mL),反应时间1 h,該条件下木质素去除率为53.75%。酶解试验表明,木质素去除率越高,葡萄糖产率越高。最后通过红外光谱、扫描电镜对预处理前后的葵花秆进行结构分析,发现预处理后的葵花秆结构遭到破坏,出现不规则的裂痕,木质素与半纤维素之间的结构被破坏,暴露出更多的纤维素和半纤维素。
关键词:葵花秆;预处理;复合溶剂;酶解;木质素
中图分类号:TS721+.1;TQ914.1文献标志码:A
文章编号:1002-1302(2017)03-0136-05
收稿日期:2016-04-28
基金项目:国家自然科学基金(编号:51174279);教育部博士学科专项基金(编号:20116121110005)。
作者简介:侯彬彬(1991—),男,陕西榆林人,硕士研究生,主要从事煤炭基精细化学品合成及有机合成研究。E-mail:774716071@qq.com。
通信作者:周安宁,博士,教授,博士生导师,主要从事煤及生物质多联产转化与功能材料制备研究。E-mail:psu564@139.com。
中国作为传统的农业大国,每年葵花秆产量约7亿多t[1]。葵花秆作为一种重要的生物综合利用资源,在农村多数被就地焚烧或弃置腐烂,不仅浪费资源,也污染环境。葵花秆的主要成分为木质素、纤维素等,可作为生产生物质能源的重要原料[2]。在制备生物乙醇方面,关键步骤是将纤维素、半纤维素水解为单糖,而在自然状态下,木质素像保护层一样包围在纤维素和半纤维素之间,且有很高的结晶度[3],导致纤维素酶对其水解能力变弱,所以有必要对葵花杆进行木质素脱除。对秸秆木质素进行预处理的方法较多,较早的方法是机械处理法[4],但成本高;蒸汽爆破处理法[5-6]木质素转化及半纤维素溶解效果好,但易产生有毒物质;微波加热法速率快,所需能量少[7],可以破坏纤维素的结晶区,降低表皮木质素含量[8],但对酶水解促进作用小;生物法主要利用白腐菌、褐腐菌、软腐菌、木腐菌对秸秆木质素进行预处理[9-12],其优点是条件温和,环境友好,但缺点是受菌种及其分泌酶状况的影响,且处理周期长,水解得率较低;碱法可以发生溶剂化、皂化作用,导致生物质膨胀,可有效脱除木质素,与酸法比较,对纤维素、半纤维素的破坏程度较轻,而且会导致纤维素变得比天然纤维素更致密、稳定[13-14]。Mathew等开展了NaOH预处理油菜秸秆用于评价葡萄糖产率的研究,发现碱预处理比酸预处理效果好,碱预处理下产率为44%左右[15]。有机溶剂能断裂秸秆内部木质素与纤维素之间的酯键,增大葡萄糖产率[16],还可通过减压蒸馏进行回收,降低成本,且提取的木质素纯度高,可避免阻碍微生物生长、酶法水解和发酵的化合物生成[17]。Neilson等使用乙醇预处理来脱除木质素,可以提高木材的酶解率[18]。虽然各种预处理方法各有优势,但单一的预处理方式有局限性,文献中也多次报道组合试剂法,Dai等采用NaOH、尿素对水稻秸秆预处理,发现其有协同效应,明显提高了糖产率[19]。He等用离子液体 1-丁基-3-甲基咪唑氯盐与NaOH处理玉米秸秆,酶促水解 2 d,生物质转化成还原糖的产率为95.1%[20]。基于溶剂法和碱法的各自优势,尝试选用复合溶剂法进行葵花秆的预处理。本研究选用NaOH、乙醇复合溶剂对葵花秆进行预处理,研究预处理时间、温度、固液比、碱醇比以及碱和乙醇浓度对木质素去除率的影响,并通过正交试验确定最佳条件,比较复合溶剂与单溶剂预处理对葵花秆酶解制糖的影响,以期提高木质素的去除率,进一步提高酶解制糖产率。
1材料与方法
1.1材料及仪器
材料:葵花秆取自陕西省神木县,用粉碎机粉碎后过 40~80目筛,主要成分如下:水分12.51%、综纤维素4884%、木质素13.26%、灰分4.24%;纤维素酶来源于黑曲霉(载体为淀粉),粉末,购自于阿拉丁公司;氢氧化钠、无水乙醇、葡萄糖、3,5-二硝基水杨酸、柠檬酸钠、柠檬酸、盐酸、丙酮、硫酸均为分析纯。
仪器:恒温油浴锅(DF-101S型),离心机(SK-1型),恒温水浴振荡器(DKZ系列),鼓风干燥箱(101-3型),旋转蒸发器(RE-2000B型),电子天平(FA-2004型),双光束紫外可见分光光度计(TU-1901型),马弗炉(XSI-25-1200型),傅里叶红外光谱仪(EQUINOX55型),扫描电镜(JSM 6460 LV型)。
1.2葵花秆预处理
取一定量葵花秆,在鼓风干燥箱中烘干至恒质量。取2 g葵花秆置于三口烧瓶中,加入预处理液,在一定温度下反应一段时间。反应结束冷却至室温后抽滤,用超纯水将滤饼洗涤至中性,收集滤液、滤饼。滤饼在105 ℃下烘干至恒质量。滤液用旋转蒸发仪减压蒸馏,回收乙醇,然后在滤液中加入浓硫酸使木质素析出沉淀,最后回收木质素,木质素去除率计算方法如下:
[JZ(]木质素去除率=[JB((]1-[SX(]溶剂法处理后木质素质量葵花秆中木质素质量[SX)][JB))]×100%。[JZ)][JY](1)
1.3滤纸酶活力的测定
参照QB 2583—2003《纤维素酶制剂》的方法配制DNS试剂、柠檬酸缓冲液、葡萄糖标准贮备溶液(10 mg/mL)及葡萄糖标准使用溶液,绘制葡萄糖标准曲线。参照QB 2583—2003《纤维素酶制剂》的方法,制备待测酶样和滤纸条,利用下式计算滤纸酶活力:
[JZ(]X1=A×1/0.5×n。[JZ)][JY](2)
式中:X1为滤纸酶活力(FPA);A为由测得吸光度计算的还原糖量;1/0.5为酶液的稀释倍数。
1.4酶解试验
分别取50 mg未经处理的葵花秆、经2% NaOH溶液处理、经70%乙醇溶液处理、经2% NaOH溶液和70%乙醇溶液协同处理的葵花秆各4组,共16组于试管内,对其进行编号。在每只试管中加入一定量柠檬酸缓冲液和90 U/g的纤维素酶,混匀,盖塞,置于50 ℃的恒温水浴振荡器中酶解,每隔 12 h 各取4种原料中的1支试管,加入DNS试剂,在沸水浴中加热10 min使酶失活。然后在冷水浴中使其降到室温,加水至25 mL混匀,使用双光束紫外可见分光光度计测定溶液在波长540 nm下的吸光度,将该吸光度代入标准葡萄糖曲线的线性回归方程,计算出葡萄糖产量。
2结果与分析
2.1各因素对葵花秆木质素去除率的影响
2.1.1水解温度、水解时间对木质素去除率的影响
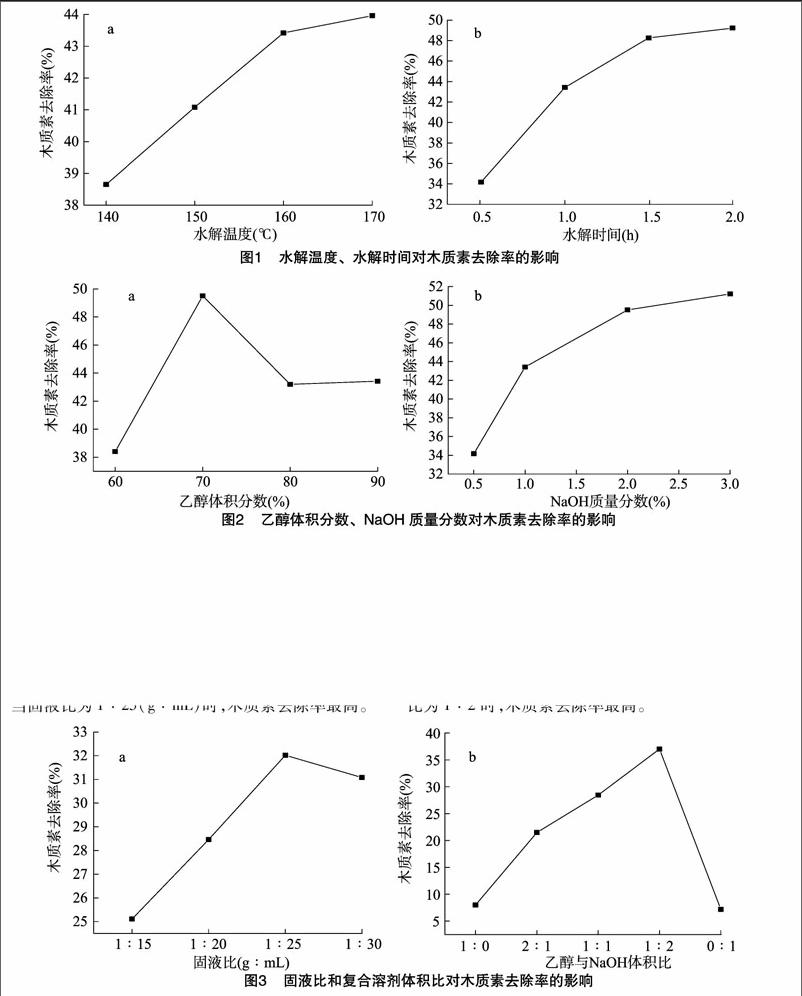
水解温度选择:称取2 g葵花秆,加入90%乙醇、2% NaOH复合溶剂(V ∶[KG-*3]V=1 ∶[KG-*3]1)40 mL,分别在140、150、160、170 ℃下水解 1 h,测其木质素去除率。如图1-a所示,随着温度升高,木质素去除率不断提高,但是当温度进一步提高时,木质素去除率上升缓慢。说明随着温度升高,预处理反应越来越剧烈,温度到160 ℃时反应剧烈程度趋于饱和,所以木质素去除率的上升速率变慢。
水解时间选择:称取2 g葵花秆,加入90%乙醇、2% NaOH复合溶剂(V ∶[KG-*3]V=1 ∶[KG-*3]1)40 mL,在160 ℃下,分别水解0.5、1.0、1.5、2.0 h,测其木质素去除率。如图1-b所示,随着处理时间延长,木质素去除率呈现迅速增大而后趋于平缓增长的趋势。处理时间越长,木质素去除率越高。当处理时间超过1.5 h后,反应液中的木质素含量趋于饱和,时间过长可能会阻止木质素的继续溶出。
2.1.2溶剂质量分数、体积分数对木质素去除率的影响
乙醇体积分数选择:称取2 g葵花秆,分别加入60%、70%、80%、90%乙醇和2% NaOH的复合溶剂(V ∶[KG-*3]V=1 ∶[KG-*3]1)40 mL,在160 ℃下水解1 h,测其木质素去除率。如图2-a所示,随着乙醇浓度增大,木质素去除率先升高后降低,当乙醇体积分数为70%时,木质素去除率最高。这与有机溶剂乙醇破坏了木质素之间的连接键、半纤维素之间的糖苷键以及木质素和半纤维素之间的醚键、4-O-甲基葡萄糖醛酸酯键,加速木质素的溶出有关,所以乙醇体积分数不宜过高或过低,结合实际生产成本,选择乙醇体积分数为70%。
[JP+1]NaOH质量分数选择:称取2 g葵花秆,分别加入70%乙醇和0.5%、1.0%、2.0%、3.0% NaOH的复合溶剂(V ∶[KG-*3]V=1 ∶[KG-*3]1) 40 mL,在160 ℃下水解1 h,测其木质素去除率。如图2-b所示,随着NaOH浓度增大,木质素去除率不断上升,但是上升趋势不断减缓。氢氧化钠导致木质素膨胀、纤维素内表面积增加以及聚合度和结晶度降低,从而引发木质素结构的断裂,考虑到实际成本,选择NaOH溶液浓度为2.0%。
2.1.3固液比和复合溶剂体积比对木质素去除率的影响
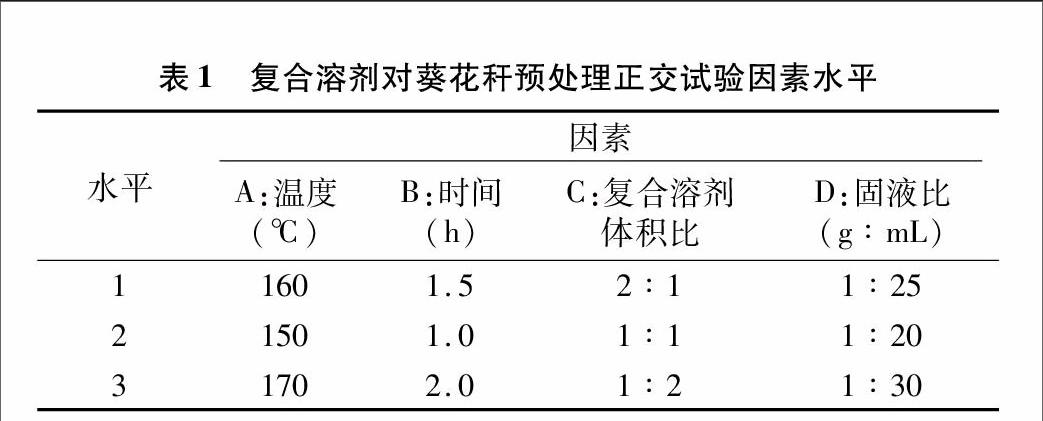
固液比选择:称取2 g葵花秆,分别加入70%乙醇、2% NaOH复合溶剂(V ∶[KG-*3]V=1 ∶[KG-*3]1)30、40、50、60 mL,在160 ℃下水解 1 h,测其木质素去除率。如图3-a所示,随着固液比的增加,木质素去除率先升高后缓缓下降。由于乙醇可以溶解木质素,因此增大固液比有利于木质素的溶出,但到一定程度就会饱和。当固液比为1 ∶[KG-*3]25(g ∶[KG-*3]mL)时,木质素去除率最高。
乙醇与NaOH体积比的选择:称取2 g葵花秆,分别加入70%乙醇、2% NaOH复合溶剂(V ∶[KG-*3]V=1 ∶[KG-*3]0、2 ∶[KG-*3]1、1 ∶[KG-*3]1、1 ∶[KG-*3]2、0 ∶[KG-*3]1)40 mL,在160 ℃下水解1 h,测其木质素去除率。如图3-b所示,单独用2种溶液进行预处理时,木质素去除率很低;当2种溶液进行复合处理时,木质素去除率有较大提升,说明复合溶剂有协同作用,当乙醇溶液与NaOH溶液体积比为1 ∶[KG-*3]2时,木质素去除率最高。
2.1.4正交试验
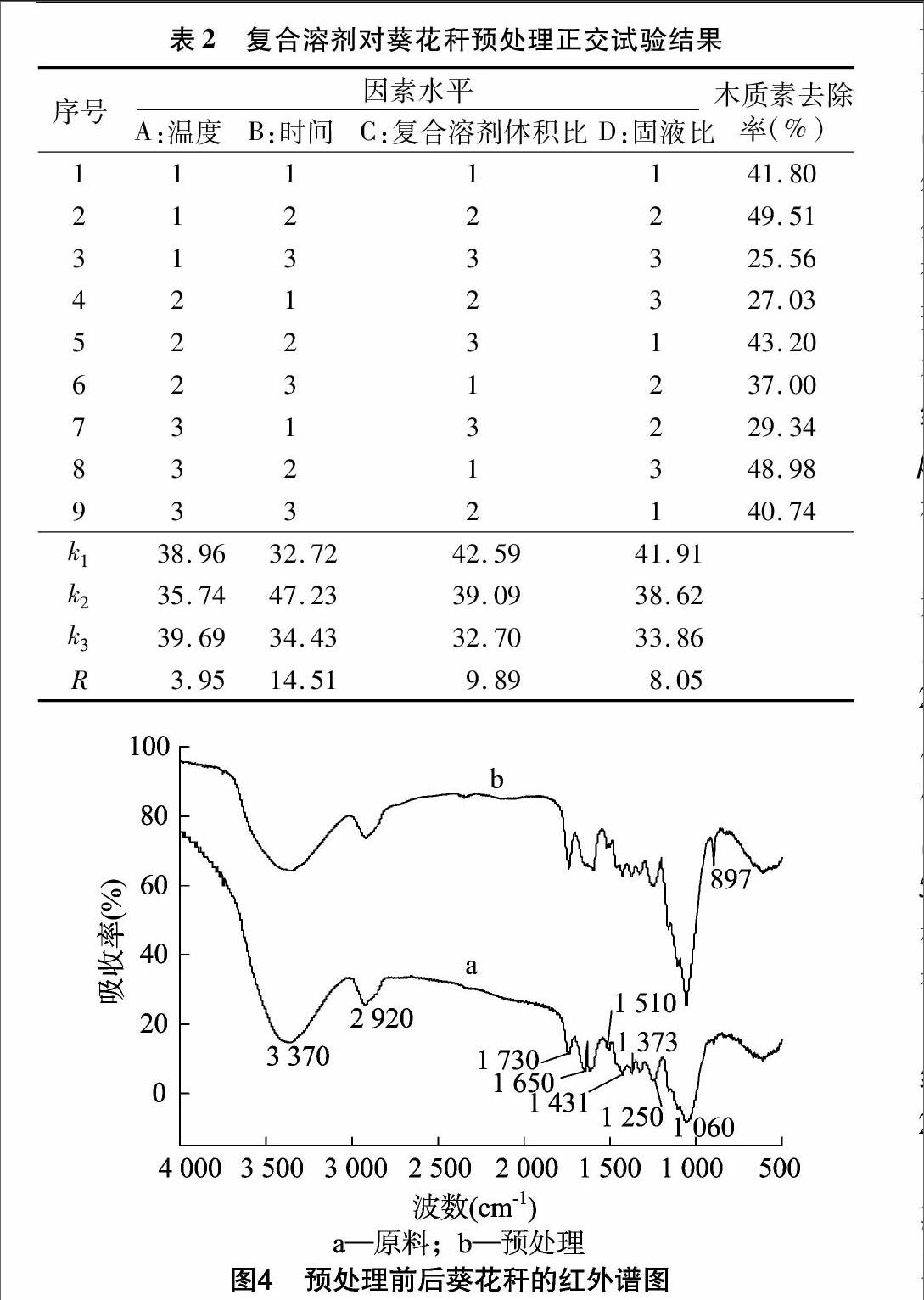
根据单因素试验结果,分别将NaOH浓度、乙醇浓度确定为2%、70%,将考察因素定为温度、时间、复合溶剂(2% NaOH、70%乙醇)比例、固液比,采用L9(34)正交表进行试验,因素水平见表1,正交试验结果见表2。
由表2可知,4个因素对葵花秆木质素去除率影响大小次序为时间>复合溶剂体积比>固液比>温度。优化得到的最佳条件为A3B2C1D1,即加热温度170 ℃,时间1 h,2% NaOH、[JP2]70%乙醇体积比2 ∶[KG-*3]1,固液比为1 ∶[KG-*3]25(g ∶[KG-*3]mL)。使用该最优条件进行试验验证,得到的木质素去除率为 53.75%,高于表2中所有结果,验证了正交试验结果的正确性。
2.2葵花秆预处理前后的结构变化
2.2.1红外光谱分析
从图4可以看出,水解前后的葵花秆红外谱图基本相似,3 370 cm-1为分子内羟基O—H伸缩振动谱带,2 920 cm-1为—CH、—CH2伸缩振动的吸收峰,波数 1 720~1 733 cm-1处的吸收峰表征与木质素或半纤维素有关的非共轭酮基、羰基及酯键的C[FY=,1]O伸缩振动[21],1 650 cm-1处的吸收峰由木质素中共轭羰基伸缩振动所导致[22]。经预处理后,发现其特征吸收峰基本消失不见,说明木质素的结构被破坏,1 510 cm-1為木质素苯环骨架振动的特征吸收峰,经预处理后也基本消失,说明脱出了木质素。1 250 cm-1愈创木基的苯环伸缩振动引起,1 060~1 062 cm-1为葵花秆的中纤维素与半纤维素的特征光谱带,897 cm-1为纤维素中 β-D-葡萄糖苷的特征峰[23-24],预处理的特征峰与原样品相比有了更明显的变化,这可能是因为经过碱和有机溶剂协同预处理,断裂了木质素与半纤维素间的连接键,使部分木质素得以去除。消除了木质素的包裹,纤维素和半纤维素暴露出来的部分越来越多,所以其特征峰更加明显。
2.2.2掃描电镜分析
在植物细胞壁中,纤维素被木质素伸展蛋白、半纤维素、果胶质组成的基质所包埋,这样可以增强植物细胞壁的抗拉强度和机械性能,所以在图5-a中所看到的葵花秆结构致密,纤维素紧密排列在一起,高度有序。如图5-b所示,经过氢氧化钠、乙醇复合溶剂预处理后,葵花秆结构被破坏,表面出现不规则的裂痕和孔洞、褶皱,大量木质素被降解,木质素与半纤维素之间的空间立体交联结构被破坏,内部纤维素骨架显现,暴露出更多纤维素[25],比表面积增大,纤维素酶与纤维素的接触面增加,增大了酶解制糖的产率。
2.3不同预处理方法对葵花秆酶解制糖的影响
以吸光度为纵坐标,葡萄糖含量为横坐标,绘制葡萄糖标准曲线(图6),回归方程为y=0.229 2x+0.009 6,线性回归系[CM(25]数为r2=0.999[KG*3]01。通过测定分析得出,本试验所用的纤维素滤纸酶活力为546 U/g。
以未处理的葵花秆、经过2% NaOH预处理的葵花秆、70%乙醇预处理的葵花秆、2% NaOH和70%乙醇协同预处理的的葵花秆为原料进行酶解试验。由图7可知,所有曲线都呈上升趋势,并且上升速率越来越小。未经过预处理的葵花秆相关曲线上升幅度和速率都最小,可能是由于木质素的阻挡,酶与纤维素接触受阻,酶解率也低。对于单溶剂来说,利用2% NaOH处理的葵花秆,其葡萄糖产率比70%乙醇处理的葵花秆稍高一些,这是由于2% NaOH预处理葵花秆时,其木质素脱除率略高于70%乙醇溶剂。用2% NaOH、70%乙醇共同预处理葵花秆,其葡萄糖产率明显比单一溶剂预处理的效果好,这是由于用混合溶剂预处理葵花秆时,木质素的脱除率最高。
[FK(W13][TPHBB7.tif][FK)]
3结论
本研究表明,2% NaOH、70%乙醇复合溶剂预处理葵花秆时,木质素去除率显著高于2%氢氧化钠或70%乙醇溶剂单独处理;通过正交试验优化后的最佳预处理条件是:加热温度170 ℃,时间1 h,2% NaOH溶液、70%乙醇体积比为2 ∶[KG-*3]1,固液比为1 ∶[KG-*3]25(g ∶[KG-*3]mL),该条件下木质素去除率为 53.75%;葵花秆预处理后,其木质素去除率越高,酶解后葡萄糖的产率越高。
[HS2]参考文献:
[1]刘海燕,刘鹏,王秀飞,等. 利用农作物秸秆生产原料糖的研究进展[J]. 材料导报,2015,29(9):97-101.
[2]王风芹,仝银杏,李传斌,等. 蒸汽爆破玉米芯水解液脱毒及其发酵生产燃料丁醇[J]. 农业工程学报,2016,32(5):257-262.
[3]李梓木,于艳玲,孙嘉星,等. 水热预处理工艺参数对玉米秸秆组分与酶解效率的影响[J]. 化工学报,2015,66(4):1529-1536.
[4]Ibrahim A H. Pretreatment of straw for bioethanol production[J]. Energy Procedia,2012,14(14):542-551.
[5]Agudelo R,García-Aparicio M,Gírgens J. Steam explosion pretreatment of triticale (× Triticosecale Wittmack) straw for sugar production[J]. New Biotechnology,2016,33(1):153-163.
[6]López-Linares J,Ballesteros I,Tourán J,et al. Optimization of uncatalyzed steam explosion pretreatment of rapeseed straw for biofuel production[J]. Bioresource Technology,2015,190:97-105.
[7]Huang Y F,Chiueh P T,Kuan W H,et al. Microwave pyrolysis of lignocellulosic biomass:heating performance and reaction kinetics[J]. Energy,2016,100(92):137-144.
[8]高杨,郝一男,王虎军,等. 不同处理方法对玉米秸秆表面性能的影响[J]. 包装工程,2016,37(3):13-17.
[9]Rouches E,Herpoel-Gimbert I,Steyer J P,et al. Improvement of anaerobic degradation by white-rot fungi pretreatment of lignocellulosic biomass:a review[J]. Renewable and Sustainable Energy Reviews,2016,59:179-198.
[10]Schilling J,Ai J,Blanchette R,et al. Lignocellulose modifications by brown rot fungi and their effects,as pretreatments,on cellulolysis[J]. Bioresource Technology,2012,116(7):147-154.
[11]Hamed S A. In-vitro studies on wood degradation in soil by soft-rot fungi:Aspergillus niger and Penicillium chrysogenum[J]. International Biodeterioration & Biodegradation,2013,78(2):98-102.
[12]Singh A P,Singh T. Biotechnological applications of wood-rotting fungi:a review[J]. Biomass and Bioenergy,2014,62(352):198-206.
[13]Hendriks A M,Zeeman G. Pretreatments to enhance the digestibility of lignocellulosic biomass[J]. Bioresource Technology,2009,100(1):10-18.
[14]Mosier N,Wyman C,Dale B,et al. Features of promising technologies for pretreatment of lignocellulosic biomass[J]. Bioresource Technology,2005,96(6):673-686.
[15]Mathew A,Chaney K,Crook M,et al. Alkaline pre-treatment of oilseed rape straw for bioethanol production:evaluation of glucose yield and pre-treatment energy consumption[J]. Bioresource Technology,2011,102(11):6547-6553.
[16]Imman S,Arnthong J,Burapatana V,et al. Fractionation of rice straw by a single-step solvothermal process:effects of solvents,acid promoters,and microwave treatment[J]. Renewable Energy,2015,83:663-673.
[17]于雪. 綠色溶剂中木质纤维素原料预处理及其酶解研究[D]. 大连:大连工业大学,2013.
[18]Neilson M,Shafizadeh F,Aziz S,et al. Evaluation of organosolv pulp as a suitable substrate for rapid enzymatic hydrolysis[J]. Biotechnology and Bioengineering,1983,25(2):609-612.
[19]Dai Y,Si M,Chen Y,et al. Combination of biological pretreatment with NaOH/Urea pretreatment at cold temperature to enhance enzymatic hydrolysis of rice straw[J]. Bioresource Technology,2015,198:725-731.
[20]He Y,Liu F,Gong L,et al. Significantly improving enzymatic saccharification of high crystallinity indexs corn stover by combining ionic liquid [Bmim]Cl-HCl-water media with dilute NaOH pretreatment[J]. Bioresource Technology,2015,189:421-425.
[21]Gastaldi G,Capretti G,Focher B,et al. Characterization and proprieties of cellulose isolated from the Crambe abyssinica hull[J]. Industrial Crops and Products,1998,8(3):205-218.
[22]池玉杰. 6种白腐菌腐朽后的山杨木材和木质素官能团变化的红外光谱分析[J]. 林业科学,2005,41(2):136-140.
[23]Karlsson C,Mrgelin M,Collin M,et al. SufA—a bacterial enzyme that cleaves fibrinogen and blocks fibrin network formation[J]. Microbiology,2009,155(1):238-248.
[24]Wada M A,Okano T A,Sugiyama J U. Synchrotron-radiated X-ray and neutron diffraction study of native cellulose[J]. Cellulose,1997,4(3):221-232.
[25]马海元,林燕,张伟,等. NaOH预处理小麦秸秆对纤维素酶水解的影响[J]. 湖北农业科学,2013,52(18):4355-4358.
