MG患者外周血Th17细胞与AChR抗体产生的关系研究
2017-04-25张晓燕常婷杨林刘沙沙李柱一
张晓燕 常婷 杨林 刘沙沙 李柱一
MG患者外周血Th17细胞与AChR抗体产生的关系研究
张晓燕 常婷 杨林 刘沙沙 李柱一
目的 探讨重症肌无力(MG)患者外周血中Th17细胞及相关细胞因子白细胞介素17(IL-17)在MG发病中的作用。方法 收集40例MG患者和10名健康人(对照组)外周血标本,采用流式细胞术检测外周血单个核细胞(PBMCs)中Th17细胞比例,反转录酶-聚合酶链锁反应(RT-PCR)检测PBMCs中维甲酸受体相关孤儿受体γt(RORγt) mRNA水平,ELISA检测血清中IL-17水平,放射免疫沉淀法检测血清中抗乙酰胆碱受体抗体(AChR-Ab)滴度;分离PBMCs中CD4+T细胞和CD19+B细胞与金黄色葡萄球菌肠毒素B(SEB)进行共培养,培养系统中加入人IL-17和(或)IL-21中和抗体,放射免疫测定法检测培养液中AChR-Ab滴度。采用MG评分(quantitative MG scoring system, QMGs)对MG的严重程度进行评估,并对MG患者的Th17细胞比例、RORγt mRNA和 IL-17水平与病情QMGs的相关性,以及MG患者抗AChR-Ab滴度与PBMCs中Th17细胞比例的相关性进行分析。结果 MG患者PBMCs中Th17细胞比例〔1.11%(0.90%,1.34%)〕高于健康对照组Th17细胞比例〔0.26%(0.08%,0.36%)〕(z=5.494,P<0.001),且与疾病严重程度呈正相关(r=0.4394,P=0.0046);血清中IL-17水平和PBMCs中RORγt mRNA相对表达〔分别71.46(53.91,104.76)pg/mL、2.63(1.94,3.12)〕均较健康对照组〔分别18.82(12.73,29.80)pg/mL、1.13(0.98,1.28)〕显著增高(均P<0.001);MG患者血清中抗AChR-Ab滴度〔2.34(1.19,3.60)nmol/L〕较健康对照组〔-0.08(-0.24,-0.03)nmol/L〕显著增高(z=4.662,P<0.001),且与Th17细胞比例呈正相关(r=0.7066,P=0.0001)。MG患者外周血T、B细胞与SEB共培养后抗AChR-Ab水平高于未加入SEB时及健康对照(均P<0.01);加入抗人IL-21或IL-17中和抗体后,两者AChR-Ab滴度与未加入抗体时AChR-Ab滴度比较均降低(均P<0.05),且均仍高于MG患者未加入SEB时及健康对照(P<0.01);在培养上清中同时加入抗人IL-21和IL-17中和抗体时AChR-Ab滴度明显低于加入单种抗体时,而与未加入SEB时及健康对照差异无统计学意义(均P>0.05)。结论 MG患者外周血中Th17细胞可能通过IL-17促进AChR-Ab产生,参与疾病的病理过程。
重症肌无力;Th17淋巴细胞;IL-17;胆碱能;抗体
重症肌无力(myasthenia gravis,MG)是主要累及神经-肌肉接头突触后膜上烟碱型乙酰胆碱受体(AChR)的神经系统自身免疫性疾病,MG中约80% 是由乙酰胆碱受体抗体(acetylcholine receptor antibody,AChR-Ab)介导[1]。目前触发抗AChR-Ab产生的机制尚不明确。
辅助性Th17(T help,Th17)细胞是2005年发现的T辅助细胞(T help,Th)亚群,该群细胞可分泌细胞因子IL-17,表达转录因子维甲酸受体相关孤儿受体γt(retinoid-related orphan nuclear receptor γt,RORγt)[2]。以往认为Th17细胞主要参与细胞的炎性反应[3],近期发现Th17细胞还参与了多种自身免疫性疾病的病理过程[4-5]。既往研究发现MG患者外周血中Th17细胞及细胞因子IL-17水平均增高[6],但Th17细胞在MG发病中的作用机制尚不明确。本研究通过分析Th17细胞及其细胞因子IL-17在MG患者和健康对照外周血中表达的差异,研究Th17细胞及IL-17在MG患者致病性自身抗体产生中的可能作用及其机制。
1 对象和方法
1.1 观察对象 收集2012-05—2013-11在第四军医大学唐都医院神经内科首诊确诊MG患者40例。其中男17例、女23例,年龄3~78岁,平均年龄(38.60±16.04)岁,病程0.5~156个月,病程中位数(上、下四分位数)为26.00(8.25,76.50)个月。患者临床症状符合MG诊断[7],即有波动性的肌无力,呈晨轻暮重,持续活动时加重,休息后减轻;胆碱酯酶抑制剂新斯的明试验阳性;电生理检查重复频率电刺激(repetitive nerve stimulation,RNS)检测低频(3~5 Hz)衰减大于10%。患者均无家族性遗传病及其他自身免疫疾病病史。所有患者均进行Ossermann分型,其中Ⅰ型12例,Ⅱ型15例,Ⅲ型7例,Ⅳ型6例。同期收集与MG患者年龄、性别相匹配的健康人10名作为对照组,其中男4名,女6名,龄年龄6~72岁,平均年龄(32.20±20.16)岁。所有受试者均签署知情同意书,并经第四军医大学伦理委员会审批同意。
1.2 主要试剂和仪器 人淋巴细胞分离液购于MP Biomedicals公司;反转录试剂盒购于Takara公司;抗人IL-17、β-actin单克隆抗体购于Millipore公司;免疫磁珠购于美天尼公司;抗人IL-17、IL-21中和抗体购于sigma公司。流式细胞仪购于BD公司;荧光定量PCR仪购于Bio-Rad公司;高速低温离心机购于Eppendorf公司。PCR引物由上海生工公司合成,包括RORγt上游引物5’-CTTGGTGTGGACTGAGATTGC-3’,下游引物5’-ACTGGAAGGATAGGGGGACA-3’;GAPDH上游引物5’-GACCTGACCTGCCGTCTA-3’,下游引物5’-AGGAGTGGGTGTCGCTGT-3’。
1.3 方法
1.3.1 流式细胞术检测外周血单个核细胞(Peripheral blood mononuclear cells ,PBMCs)中Th17细胞比例:清晨空腹采集MG患者及健康对照每人静脉血10 mL,提取血清冻存备用。采用Ficoll-Hypaque密度梯度离心法分离PBMCs。取2×106个PBMCs加入无菌48孔培养板中,分别加入PMA和离子霉素,37 ℃孵育30 min,加入莫能霉素培养5 h,洗涤后加入抗人CD3-APC 单克隆抗体和抗人CD8-PerCP-Cy5.5单克隆抗体,4 ℃避光孵育30 min,洗涤后Cytofix/Cytoperm试剂盒破膜 ,加入抗人IL-17-PE单克隆抗体,4 ℃避光孵育30 min,洗涤后使用 FACS Calibur流式细胞仪进行检测。
1.3.2 Th17细胞特异性转录因子和细胞因子检测:采用RT-PCR检测MG患者及对照组PBMCs中RORγt mRNA水平(以GAPDH为内参,计算目的基因与GAPDH比值);采用ELISA检测血清中IL-17水平(pg/mL)。
1.3.3 采用放射免疫沉淀法检测血清中抗AChR-Ab滴度:取外伤截肢患者的肌肉组织,使用低温高速离心机离心提取AChR,加入MG患者及对照组血清,再加入125I标记的α-BuTx充分混匀后4 ℃过夜;加入兔抗人γ-球蛋白IgG,混匀后4 ℃静置2 h,4 ℃离心、洗涤后γ计数仪中计数,抗体滴度以nmol/L表示。比较两组抗体滴度,并分析MG患者的抗AChR-Ab滴度与PBMCs中Th17细胞比例的相关性。
1.3.4 放射免疫测定法检测体外培养T、B细胞抗AChR-Ab滴度:随机选取MG患者和对照组各6例,使用细胞免疫磁珠分离PBMCs中CD4+T细胞和CD19+B细胞共孵育7 d,共分为6组,分别为健康对照T细胞+B细胞,MG患者T细胞+B细胞,MG患者T细胞+B细胞+金黄色葡萄球菌肠毒素B(staphylococcal enterotoxin B,SEB),MG患者T细胞+B细胞+ SEB+抗人IL-17中和抗体,MG患者T细胞+B细胞+ SEB+抗人IL-21中和抗体,MG患者T细胞+B细胞+ SEB+抗人IL-17及IL-21中和抗体。通过放射免疫沉淀检测培养上清中抗AChR-Ab滴度。
1.3.5 MG病情评估及相关性分析:根据MG评分(quantitative MG scoring system, QMGs)对疾病的严重程度进行评估[8]。对MG患者的Th17细胞比例、RORγt mRNA和 IL-17水平与病情QMGs进行相关性分析。
1.4 统计学处理 应用SPSS 17.0统计软件进行分析。患者年龄及对照组年龄符合正态分布,用均数±标准差表示;其他数据均不符合正态性分布,
以中位数(上、下四分位数)表示。两组间比较采用Wilcoxon秩和检验;相关性检验采用Spearman法分析。以双侧P<0.05为差异具有统计学意义。
2 结果
2.1 两组Th17细胞比例、RORγtmRNA和 IL-17表达 结果见图1、表1。MG患者PBMCs中Th17细胞比例、RORγt mRNA表达水平及血清中IL-17水平均高于对照组(均P<0.001)。
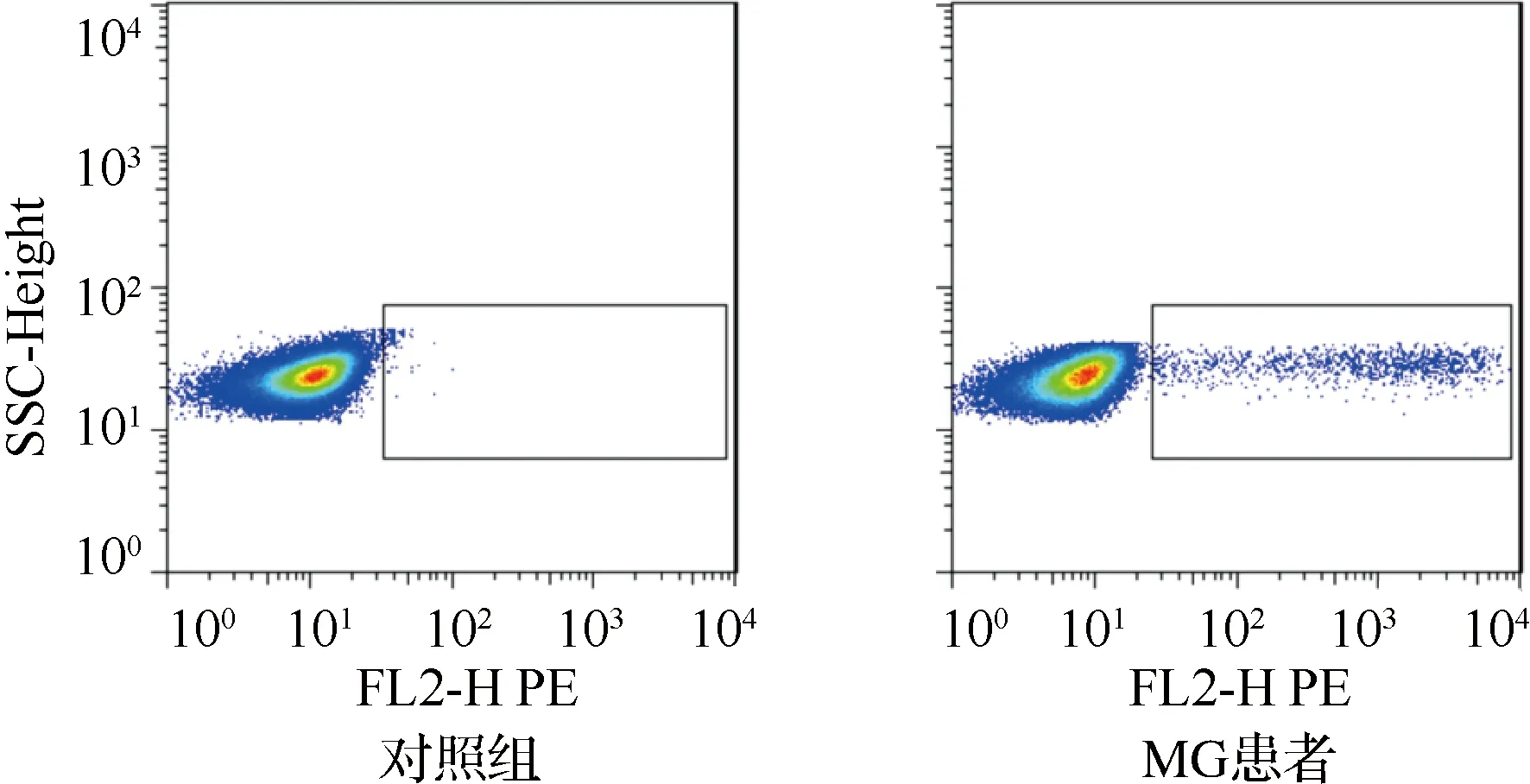
SSC-Height:侧散射 图1 MG患者和对照组PBMCs中Th17细胞比例比较(流式细胞术)
2.2 两组血清抗AChR-Ab滴度比较 MG患者血清中抗AChR-Ab滴度均高于对照组(P<0.001;表1),且与PBMCs中Th17细胞比例呈正相关(r=0,7066,P=0.0001)。
2.3 不同抗体干预情况下MG患者外周血T、B细胞体外培养上清抗AChR-Ab水平变化 MG患者外周血T、B细胞加入SEB后共培养抗AChR-Ab水平高于未加入SEB时及对照组比较(P<0.01);加入抗人IL-21或IL-17中和抗体后,两者AChR-Ab滴度比较差异无统计学意义(P>0.05),但与未加入抗体时AChR-Ab滴度比较均降低(P<0.05),且均仍高于MG患者未加入SEB时及对照组(P<0.01);在培养上清中同时加入抗人IL-21和IL-17中和抗体,AChR-Ab滴度明显低于加入单种抗体时,而与未加入SEB时及对照组差异无统计学意义(图2)。
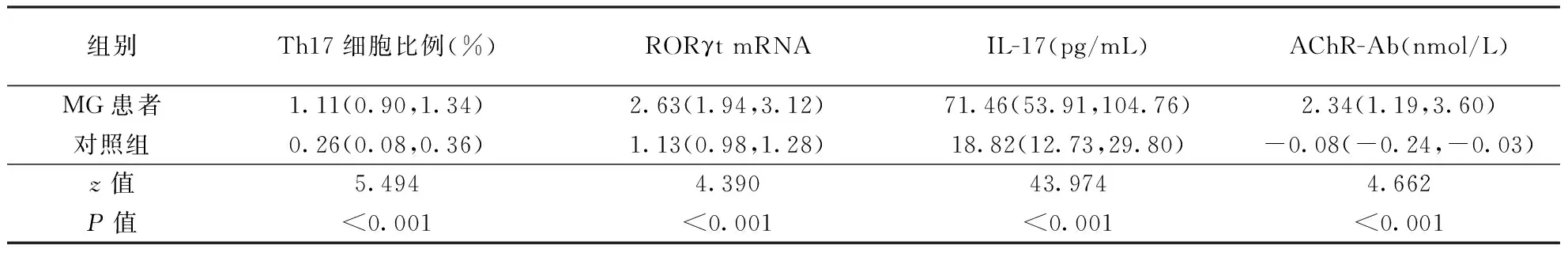
表1 MG患者与对照组PBMCs中Th17细胞比例以及外周血中RORγt mRNA、 IL-17和AChR-Ab水平比较 〔M(QL、QU)〕
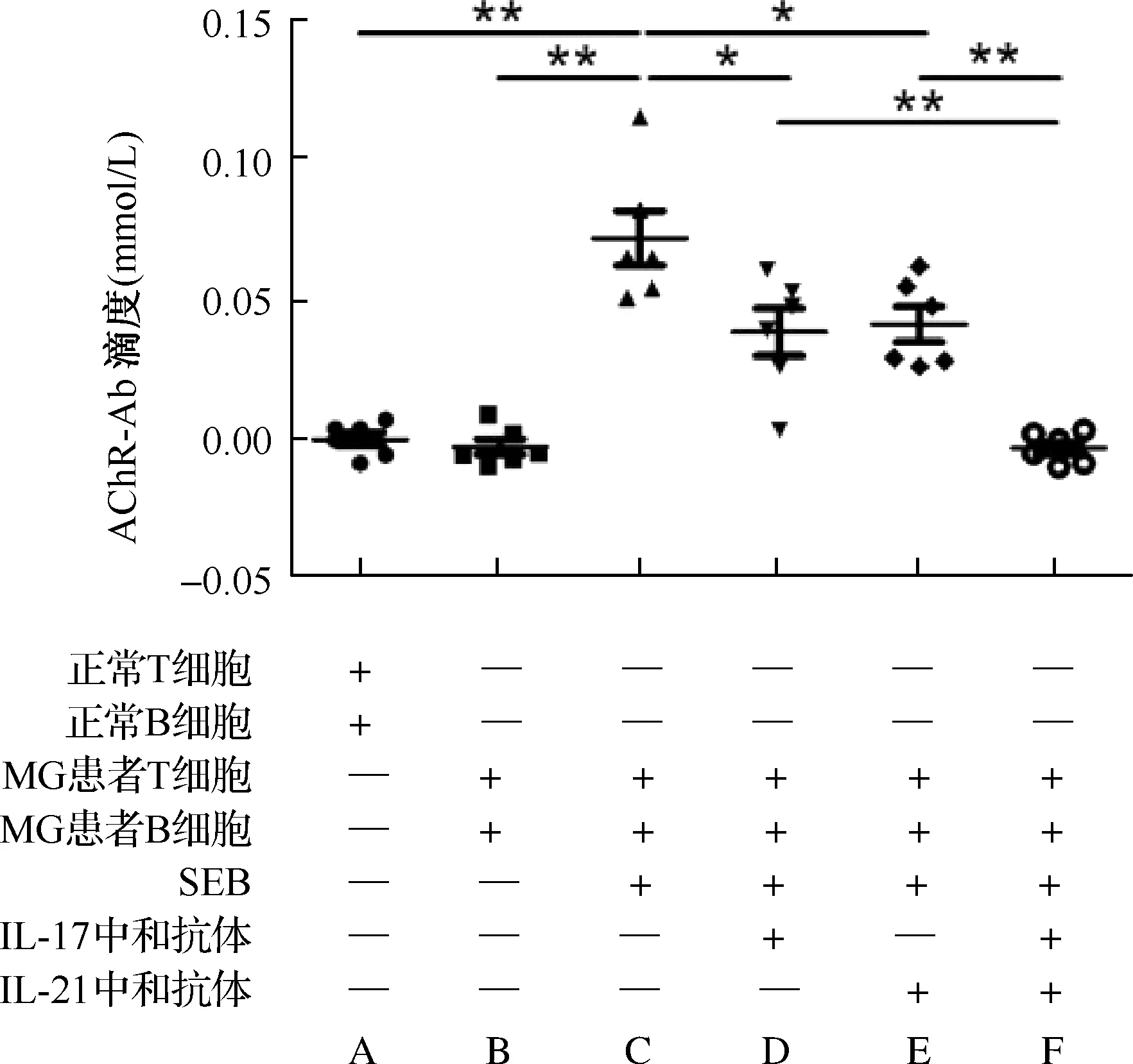
A:对照组;B:MG患者;C:MG患者+金黄色葡萄球菌肠毒素B (SEB);D:MG患者+SEB+IL-17中和抗体;E:MG患者+SEB+IL-21中和抗体;F:MG患者+SEB+IL-17中和抗体+IL-21中和抗体 图2 不同干预下外周血CD4+T细胞和CD19+B细胞共培养上清中AChR-Ab滴度变化(两组间比较,*P<0.05,**P<0.01)
2.3 病情严重程度与MG患者Th17细胞比例、RORγt mRNA和 IL-17水平的相关性 MG患者Th17细胞比例与QMGs呈正相关(r=0.4394,P=0.0046)。血清中IL-17水平与QMGs呈正相关(r=0.4350,P=0.0050)。RORγt mRNA表达水平与QMGs呈正相关(r=0.4047,P=0.0096)。
3 讨论
MG是AChR-Ab介导的,细胞免疫依赖的,补体参与的神经系统自身免疫性疾病。B细胞产生抗体需要T细胞的辅助作用,而在MG患者中Th细胞辅助B细胞产生AChR-Ab的作用机制尚不明确。
以往认为Th2细胞可以辅助B细胞产生抗体[9],但IL-4缺陷的小鼠仍然能够产生T细胞依赖的抗体。2008年发现了滤泡辅助性T细胞(T follicular helper cells ,Tfh)细胞,所分泌细胞因子主要是IL-21,认为IL-21在辅助B细胞产生抗体中发挥核心作用,但研究显示在MG患者中使用IL-21中和抗体阻断Tfh细胞的作用后仍有部分AChR-Ab产生[6],因此本文作者推测在MG患者AChR-Ab产生的过程中存在其他Th细胞参与。Th17细胞是2005年发现的CD4+T细胞亚群,主要表达转录因子RORγt,所分泌细胞因子主要为IL-17,并通过IL-17来实现其生理及病理作用。最初研究认为Th17细胞主要作用于细胞外病原菌及真菌,或参与慢性炎性反应,之后发现Th17细胞同时也参与了多种自身免疫性疾病的病理过程[10]。另有研究显示在EAMG大鼠中Th17细胞增多,且大鼠肌无力严重程度与Th17细胞和IL-17水平呈正相关[11];MG患者PBMCs中Th17细胞及其分泌的细胞因子均增高[6]。本研究显示MG患者外周血Th17细胞比例、RORγt mRNA表达及血清中IL-17水平均较健康对照显著增高,并且Th17细胞比例、IL-17 浓度和RORγt mRNA水平均与MG的严重程度(QMGs评分)呈正相关,与以往研究结果相符[12],表明Th17细胞及IL-17参与了MG的病理过程,但其在MG发病中的作用机制尚不明确。
研究发现Th17细胞中表面表达人趋化因子受体6((human chemokine receptor 6,CCR6)的细胞同时表达趋化因子受体5(chemokine receptor 5,CXCR5),而CXCR5是Tfh细胞表面的标志物,它可以受趋化因子配体 13(Cxc Chemokine Ligand,CXCL13)趋化迁移到B细胞滤泡或生发中心(germinal center ,GC),活化B细胞成为分泌抗体的长寿浆细胞或记忆B细胞,因此推测Th17细胞也有辅助B细胞的功能。在BXD2小鼠的脾脏中Th17细胞通过IL-17促进自发的GCs形成。在实验性变态反应性脑脊髓炎(experimental lyallergic encephalomyelitis,EAE)模型中Th17细胞可以诱导小鼠CNS内形成异位的GC[13]。本研究中通过放射免疫沉淀方法检测血清中抗AChR-Ab滴度,结果显示MG患者血清中抗体滴度明显高于健康对照组,并且与Th17细胞比例呈正相关,表明MG患者外周血中Th17细胞与AChR-Ab的产生具有密切关系。为进一步证实,本研究通过免疫磁珠分离出PBMCs中CD4+T细胞和CD19+B细胞与SEB进行共培养,并在培养体系中分别加入IL-21和(或)IL-17中和抗体,结果显示MG患者T、B细胞与SEB共培养可以产生大量抗AChR-Ab,阻断IL-21或IL-17作用后,AChR-Ab滴度虽显著下降,但仍有部分抗体产生;但同时阻断IL-17和IL-21的作用,培养系统中AChR-Ab滴度与健康对照比较差异无统计学意义。上述结果表明, Th17细胞可能在MG患者外周血中通过分泌IL-17辅助B细胞促进AChR-Ab产生,从而参与疾病的病理过程,这可能也是MG患者致病性AChR-Ab产生的机制。
综上所述,本研究结果表明Th17可能参与了MG患者的病理过程,其主要作用是辅助B细胞产生致病性自身抗体AChR-Ab,提示通过研究Th17细胞和B细胞之间的相互作用可能为治疗MG提供新的作用靶点。
[1]Berrih-Aknin S, Le Panse R. Myasthenia gravis: a comprehensive review of immune dysregulation and etiological mechanisms[J]. J Autoimmun,2014,52(8): 90-100.
[2]Park H, Li Z, Yang XO, et al. A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17[J]. Nat Immunol, 2005,6(11): 1133-1141.
[3]Pathak M, Sharma P, Sharma A, et al. Regulatory T cells neutralization in mice during filariasis helps in parasite clearance by enhancing Th17 mediated pro-inflammatory response[J]. Immunology,2016,147(2):190-203.
[4]Kleinewietfeld M, Hafler DA.The plasticity of human Treg and Th17 cells and its role in autoimmunity[J]. Semin Immunol,2013,25(4): 305-312.
[5]Bishu S, Su EW, Wilkerson ER, et al. Rheumatoid arthritis patients exhibit impaired Candida albicans-specific Th17 responses[J]. Arthritis Res Ther,2014,16(1): R50.
[6]Zhang X, Liu S, Chang T, et al. Intrathymic Tfh/B cells interaction leads to ectopic GCs formation and anti-AChR antibody production: Central role in triggering MG occurrence[J]. Mol Neurobiol,2016,53(1):120-131.
[7]中国免疫学会神经免疫学分会,中华医学会神经病学分会神经免疫学组.重症肌无力诊断和治疗中国专家共识[J].中国神经免疫学和神经病学杂志,2012,19(6):401-408.
[8]Jaretzki A 3rd, Barohn RJ, Emstoff RM, et al. Myasthenia gravis: recommendations for clinical research standards. Task Force of the Medical Scientific Advisory Board of the Myasthenia Gravis Foundation of America[J]. Ann Thorac Surg,2000,70(1): 327-334.
[9]Link J, Navikas V, Yu M, et al. Augmented interferon-gamma, interleukin-4 and transforming growth factor-beta mRNA expression in blood mononuclear cells in myasthenia gravis[J]. J Neuroimmunol,1994,51(2): 185-192.
[10]Rother N, van der Vlag J.Disturbed T Cell Signaling and Altered Th17 and Regulatory T Cell Subsets in the Pathogenesis of Systemic Lupus Erythematosus[J]. Front Immunol, 2015,30(6): 610.
[11]Mu L, Sun B, Kong Q, et al. Disequilibrium of T helper type 1, 2 and 17 cells and regulatory T cells during the development of experimental autoimmune myasthenia gravis[J]. Immunology,2009,128 (1 Suppl): e826-836.
[12]Wang ZK, Wang W, Chen YP,et al. Thymoma T helper type 17 cells and related cytokines in myasthenia gravis[J]. Zhonghua nei ke za zhi,2012,51:540-542.
[13]Peters A, Pitcher LA, Sullivan JM, et al. Th17 cells induce ectopic lymphoid follicles in central nervous system tissue inflammation[J].Immunity,2011,35(6): 986-996.
(本文编辑:邹晨双)
The circulating Th17 cells enhance AChR antibody production in myasthenia gravis patients
ZHANGXiaoyan,CHANGTing,YANGLin,LIUShasha,YANGKun,LIZhuyi*.
*DepartmentofNeurology,TangduHospital,theFourthMilitaryMedicalUniversity,Xi’anShaanxiProvince710038,China
Li Zhuyi,Email: lizhuyi@fmmu.edu.cn
Objective To investigate the role of circulating Th17 cells and IL-17 in myasthenia gravis(MG). Methods Forty MG patients and 10 healthy controls(HC) were recruited. The proportion of Th17 cells in peripheral blood mononuclear cells(PBMCs) was detected via flow cytometry. The transcription factor RORγt mRNA expression in PBMCs was detected with Reverse Transcription-Polymerase Chain Reaction (RT-PCR). The concentration of cytokine IL-17 in sera was measured by ELISA. The anti-human AChR antibody in the serum was assayed using the radioimmunoprecipitation method. CD19+B cells and CD4+T cells were isolated from PBMCs of MG patients and healthy controls at the presence of SEB. The anti-AChR antibody secretion in T/B cells co-culture supernatant was detected by radioimmunoprecipitation. The effects of inhibiting IL-17 or IL-21 were examined by adding anti-IL-17 or IL-21 neutralizing antibody in the co-culture system. A quantitative MG scoring system (QMG score) was used to objectively evaluate the disease severity. Then, we analyzed the correlation between Th17 cells proportion, serum IL-17 level, RORγt mRNA and QMG scores. Results The percentage of Th17 cells increased significantly in PBMCs of MG patients compared with HC(P<0.0001), and Th17 cells counts was positively correlated with disease severity(r=0.4394,P=0.0046). Th17 cell-associated transcription factors RORγt mRNA and cytokines IL-17 expression elevated in MG patients(P<0.001). The titers of anti-AChR antibody(AChR-Ab)increased significantly in MG patients compared with HC(P<0.001), and the titer of AChR-Ab was positively correlated with disease severity. High level of anti-AChR antibody was detected in the co-culture of patients T and B cells . Blocking IL-17 or IL-21 alone by neutralizing antibodies led to a moderate decrease of anti-AChR antibody titer, while simultaneous blockage of IL-17 and IL-21 resulted in dramatically decrease of anti-AChR antibody titer.Conclusions In creased Th17 cell was involved in the pathological process of MG, and exacerbated its severity probably via enhanced AChR-Ab production.
myasthenia gravis; Th17 cell;IL-17; cholinergic; antibodies
10.3969/j.issn.1006-2963.2017.02.008
国家自然科学基金资助项目(31270952);甘肃省自然科学基金 资助项目(1506RJZA302)
730050中国人民解放军兰州总医院神经内科(张晓燕);710038第四军医大学唐都医院神经内科(常婷、刘沙沙、李柱一);730000 中国人民解放军兰州军区善后办机关门诊部(杨林)
李柱一,Email: lizhuyi@fmmu.edu.cn
R746.1
A
1006-2963(2017)02-0105-05
2015-12-16)
