瑞戈非尼与索拉非尼治疗晚期肝癌的间接meta分析
2017-04-24石伟峰陈永法
石伟峰+陈永法

摘要:[目的]系统评价瑞戈非尼与索拉非尼治疗晚期肝癌的疗效。[方法]以间接Meta分析的方法对已有研究进行合并,系统评价两种药物治疗晚期肝癌的疾病控制率、生存期、和疾病进展时间。[结果]瑞戈非尼和索拉非尼可以延长患者的生存期、疾病进展时间和疾病控制率,且改善疾病控制率,但间接meta分析结果无统计学意义(P>0.05)。[结论]瑞戈非尼相对于索拉非尼不能够延长晚期肝癌患者的生存时间和疾病进展时间。
关键词:瑞戈非尼;索拉非尼;晚期肝癌;间接Meta分析
中图分类号:F24文献标识码:Adoi:10.19311/j.cnki.16723198.2017.04.041
肝癌指在肝及肝内胆管细胞发生的恶性肿瘤,是世界较为常见且恶性程度极高。我国是肝癌的高发地区,癌症患者数量超过全球的50%。由于肝癌隐蔽性强,疾病进展迅速,被发现时多为晚期,通常无法进行手术或局部治疗,只能通过采取化疗以及靶向药物等方案进行治疗。
索拉非尼(Sorafenib)是一种口服的多靶点、多激酶抑制剂,是第一个被批准应用于治疗肝癌的分子靶向药物。索拉非尼具有双重抑制、多靶点阻断的抗肿瘤效果,它通过抑制包括血管内皮生长因子受体(VEGFR)和血小板源性生长因子受体(PDGFR)的多种作用于肿瘤血管生成的受体阻断肿瘤血管生成,同时也可通过阻断Raf/MEK/ERK等信号传导通路抑制肿瘤细胞增殖。国内外多项系统评价显示索拉非尼能够延缓肝癌的进展时间,使患者生存期得到明显提升,且具有较好的安全性;此外,基线水平和预后因素不同的患者在使用索拉非尼治疗后都获得了良好的临床收益。瑞戈非尼(Regorafenib)是由拜耳和美国生技制药公司联合开发的一种新型的多激酶抑制剂,它与索拉非尼具有相似的结构,但瑞戈非尼靶向的激酶范围更广,在药理学上具有更强的作用。它除了抑制血管内皮生长因子受体(VEGFR)外,还靶向作用于酪氨酸蛋白激酶受体-2(Tie-2)以及多种与肿瘤细胞增殖相关的原癌基因,抑制肿瘤生成。临床研究RESOURCE显示,瑞戈非尼联合最佳支持治疗可显著改善患有无法切除的晚期肝癌患者的生存期。
尽管临床研究显示,瑞戈非尼和索拉非尼均可延长晚期肝癌患者的生存期并延缓肿瘤进展时间,但尚未有研究对两者在晚期肝癌方面的效果进行直接比较。因此本研究采用间接比较的方法对两者治疗晚期肝癌的临床疗效进行了比较。本研究对在2007年1月至2016年12月期间国外公开发表的瑞戈非尼和索拉非尼治疗晚期肝癌的随机对照临床研究进行了间接Meta分析,以对比两种药物治疗晚期肝癌的有效性。
1材料和方法
1.1文献检索策略
在Pubmed、Cochrane Library、Embase等数据库中根据事先设定好的检索词进行检索。瑞戈非尼文献的检索词为:“regorafenib”、“advanced hepatocellular carcinoma”、“ahcc”、“RCT”,将“regorafenib”的检索词替换为“sorafenib”,即为索拉非尼的检索词,语言限制为英语,时间限制为2007年1月至今。
1.2间接meta分析研究方法
间接比较是指为得到干预措施B和干预措施C的相对效果,通过比较干预措施A与B和A与C的效果间接得到B与C的效果的一种方法。进行间接比较的原因有两种:一是不存在直接比较的原始研究;二是尽管存在直接比较的原始研究,但是研究数量较少或质量较低。本研究选择间接meta的原因是无两种药物的直接比较研究,故选择间接比较方法。计数资料采用相对比值(OR,HR,RR)作为效应指标,通过A方案计算B和C各自的有效率等指标,以OR为例,即ORbc=ORba/ORca。
1.3文献入选及排除标准
1.3.1文献入选标准
(1)研究类型:瑞戈非尼、索拉非尼治疗晚期肝癌的Ⅱ或Ⅲ期RCT试验。(2)研究对象:病理学检查确诊的晚期肝癌患者,美国东部肿瘤协作组(ECOG)体力状态评分为0~2分,肝功能为Child A或B级,肾功能及造血功能良好。(3)干预措施:实验组和对照组分别为瑞戈非尼(或索拉非尼)治疗及安慰剂治疗。(4)评价指标:根据提取的数据,结局指标包括关键结局指标和重要结局指标。关键结局指标包括生存期(OS)和疾病进展时间(TTP);重要结局指标则为疾病控制率(DCR)。
1.3.2文献排除标准
(1)非随机双盲临床对照试验如回顾性研究、Ⅰ期临床试验、综述等文献。(2)无法提供研究数据或者完整研究方案的文献。(3)其他不符合本研究纳入标准者。
1.4数据提取及质量评价
由两位研究者设计资料提取表并且分开独立进行数据提取。内容为各研究的基本特征,包括样本数量、各组患者平均年龄、男女比例、患者入组标准、干预措施、研究结局指标等。纳入研究的质量评价,如遇争议之处则向第三位研究者商议解决。
1.5统计学方法
本研究使用Review Manager5.3软件进行数据合并分析,间接Meta分析采用加拿大药物与卫生技术局CADTH发布的间接治疗比较软件ITC,采用HR(Hazard Ratio,風险比率)及OR(Odd Ratio,相对危险性比)作为效应尺度,并用95%置信区间(confidence interval,CI)表达。生存资料(例如TTP和OS)采用风险比(HR)作为效应量进行合并,二分类资料(如DCR、ORR)则采用优势比(OR)作为效应量进行合并进行分析,各效应量均以95%置信区间(95%CI)表示。合并各项指标前先各项研究的异质性,不存在异质性(I2<50%,P>0.1)的采用固定效应模型分析,如研究结果存在异质性(I2>50%,P<0.1),先讨论异质性产生的原因,再采用随机效应模型合并。
2結果
2.1文献纳入情况
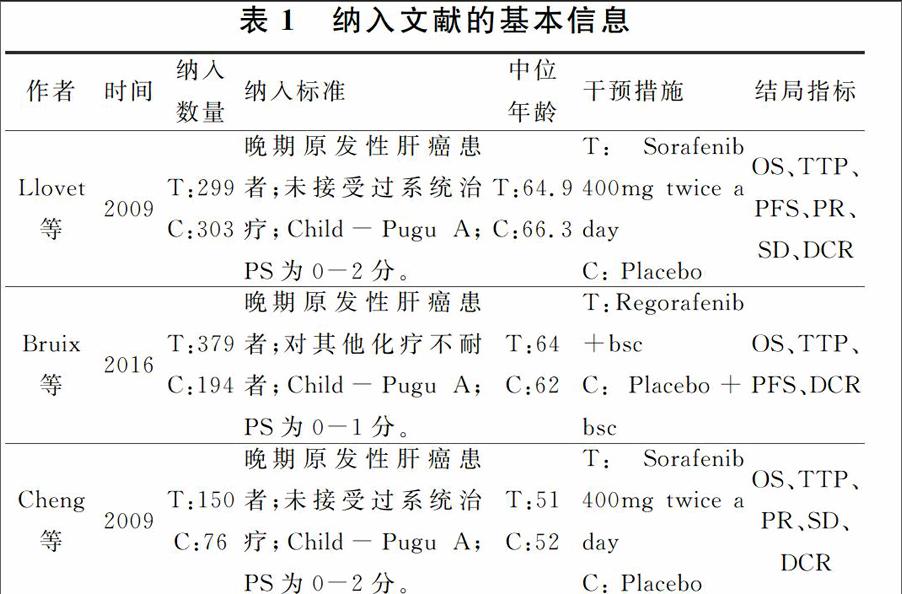
在Pubmed,Embase,Cochrane Library数据库中共检索到索拉非尼治疗文献458篇,瑞戈非尼文献33篇。按照文献纳入和排除标准,排除不符合纳入标准的文献488篇(索拉非尼456篇,瑞戈非尼32篇),共纳入索拉非尼文献2篇,瑞戈非尼文献1篇。纳入文献的基本信息见表1。
2.2效果meta分析
2.2.1瑞戈非尼治疗晚期肝癌的分析结果
符合纳入标准的瑞戈非尼的研究共1篇,纳入573名患者,其中治疗组379例,对照组为194例。结果显示瑞戈非尼可以有效提高晚期肝癌患者的疾病进展时间(HR=0.44,95%CI为0.36-0.55,P<0.0001)和中位生存期(瑞戈非尼组为10.6月,对照组为7.8月,HR=0.63,95%CI为0.50-0.79,P<0.0001),同时改善疾病控制率(OR=3.31,95%CI为2.31-4.76,P<00001)。
2.2.2索拉非尼治疗晚期肝癌的分析结果
符合纳入标准的索拉非尼的研究共2篇,纳入828名患者,其中治疗组449例,对照组为379例。中位生存期(OS)结果合并后显示索拉非尼可提高患者的OS(HR=0.66,95%CI为0.57-0.77,P<0.0001),且研究间无明显异质性(I2=0)。疾病进展时间(TTP)结果合并后显示索拉非尼可延长患者的TTP(HR=058,95%CI为0.47-0.70,P<0.0001)。DCR合并后具有较大异质性(I2=55%),采用随机效用模型合并后显示索拉非尼可提升患者的疾病控制率(OR=199,95CI=1.14-3.48,P<0.05),见表1。
2.3间接meta分析结果
根据上述合并分析得出的OS、TTP及DCR再合并进行间接meta分析,共纳入瑞戈非尼组患者379例,索拉非尼组449例。结果显示,以瑞戈非尼作实验组,索拉非尼作对照组治疗晚期肝癌的疾病控制率的OR为1.66,(95%CI为0.856-3.224,P>0.05),中位生存时间的HR为0.913(95%CI为0.64-4.65,P>005),疾病进展时间的HR为0.759(95%CI为0.57-102,P>0.05),均不具有统计学意义。
3讨论
间接性meta分析中,研究结果的可靠性受相似性影响,分别为临床相似性及方法学相似性。临床相似性指纳入试验的研究对象、干预措施和结局测量的相似性,方法学相似性指纳入试验质量的相似性。该研究中,每组实验集所采取的实验方案均相同,且收纳病人的病情也较为相似,因此避免了基线不同造成的误差,保证了研究结果的可靠性。
本研究纳入的文献均对干预时年龄、性别、PS得分、肝功能评级等因素进行了一致性分析,以降低中间药物可能产生的偏倚。研究纳入的文献均为随机双盲临床试验,且都说明了具体的随机化方法,具有较高的可信度。但由于纳入的研究较少,可能会产生选择偏倚,这可能是部分研究存在异质性的主要原因。此外,由于直接比较和间接比较的结果可能不完全一致,因此研究结果有待高质量的大样本随机对照试验予以证实。
4结论
瑞戈非尼与索拉非尼均能够延长晚期肝癌患者的生存时间和疾病进展时间和提高疾病控制率。但间接Meta分析结果并无统计学意义,表明瑞戈非尼相对于索拉非尼不能延长患者的生存时间和疾病进展时间(P>0.05)。本研究结论可能受到某些偏倚的影响,如纳入研究较少以及直接比较和间接比较的差异性等。因此,本评价结果尚有待于高质量的大样本随机对照试验予以证实。
参考文献
[1]原发性肝癌诊疗规范(2011年版)[J].临床肝胆病杂志,2011,(11):11411159.
[2]Tanaka S,Arii S.Molecular targeted therapies in hepatocellular carcinoma[C].Seminars in oncology.WB Saunders,2012,39(4):486492.
[3]Dhillon A S,Hagan S,Rath O,et al.MAP kinase signalling pathways in cancer[J].Oncogene, 2007,26(22):32793290.
[4]Connock M,Round J,Bayliss S,et al.Sorafenib for the treatment of advanced hepatocellular carcinoma[J].Health Technol Assess,2010,14(Suppl 1):1721.
[5]Shen A,Tang C,Wang Y,et al.A systematic review of sorafenib in Child-Pugh A patients with unresectable hepatocellular carcinoma[J].Journal of clinical gastroenterology,2013,47(10):871880.
[6]Rimassa L,Santoro A.Sorafenib therapy in advanced hepatocellular carcinoma:the SHARP trial[J].Expert review of anticancer therapy,2009,9(6):739745.
[7]Wilhelm S M,Dumas J,Adnane L,et al.A new oral multikinase inhibitor of angiogenic,stromal and oncogenic receptor tyrosine kinases with potent preclinical antitumor activity[J].Int. J. Cancer,2011,(129):245255.
[8]Wilhelm S M,Carter C,Tang L Y,et al.BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J].Cancer research,2004,64(19):70997109.
[9]Trojan J,Waidmann O.Role of regorafenib as second-line therapy and landscape of investigational treatment options in advanced hepatocellular carcinoma[J].Journal of Hepatocellular Carcinoma,2016,(3):31.
[10]曾憲涛,曹世义,孙凤.Meta分析系列之六:间接比较及网状Meta分析[J].中国循证心血管医学杂志,2012,4(5):399402.
[11]Llovet J M,Ricci S,Mazzaferro V,et al.Sorafenib in advanced hepatocellular carcinoma[J].New England journal of medicine,2008,359(4):378390.
[12]Bruix J,Qin S,Merle P,et al.Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE):a randomised,double-blind,placebo-controlled,phase 3 trial[J].The Lancet,2017,389(10064):5666.
[13]Cheng A L,Kang Y K,Chen Z,et al.Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma:a phase III randomised,double-blind,placebo-controlled trial[J].The lancet oncology,2009,10(1):2534.
[14]Jansen J P,Fleurence R,Devine B,et al.Interpreting indirect treatment comparisons and network meta-analysis for health-care decision making:report of the ISPOR Task Force on Indirect Treatment Comparisons Good Research Practices:part 1[J].Value in Health,2011,14(4):417428.
[15]Hoaglin D C,Hawkins N,Jansen J P,et al.Conducting indirect-treatment-comparison and network-meta-analysis studies: report of the ISPOR Task Force on Indirect Treatment Comparisons Good Research Practices:part 2[J].Value in health,2011, 14(4):429437.1
