太子参的组织培养与快速繁殖研究
2017-04-12颜培玲王振华靳志飞高云邱奉同
颜培玲+王振华+靳志飞+高云+邱奉同
摘 要:该研究以太子参冬芽茎尖为外植体,采用茎尖脱毒的方法,以MS为基本培养基,通过组织培养筛选出了适宜太子参芽增殖诱导、丛生芽的快速繁殖、生根壮苗,炼苗移栽的最适条件,为太子参规模化育苗生产提供理论支持。结果表明:太子参茎尖脱毒后,其最适芽诱导培养基为:MS + 2.5mg/L 6-BA+0.2mg/L IAA;最适继代增殖培养基为:MS + 1.2mg/L KT + 0.4mg/L NAA;最适生根培养基为MS+0.2mg·L-1 KT+0.5mg·L-1dA-6。
關键词:太子参;茎尖脱毒;组织培养;快速繁殖
中图分类号 S567.53 文献标识码 A 文章编号 1007-7731(2016)23-0050-03
太子参又名孩儿参、童参[1-2],为石竹科孩儿参属多年生草本植物,喜生长在温暖湿润的环境,怕高温,分布于华东、华中、华北、东北和西北等地,主产于山东、贵州、福建等地[3]。太子参是一种药食两用的补益中药材,营养丰富,含有16种氨基酸,其中8种氯基酸是人体必需的,药用具有益气健脾、生津润肺等多种作用,特别对于小孩盗汗、食欲不振、改善贫血、老人体虚失眠具有显著功效,是男女老少四季皆宜的清补珍品[4,5],此外,近年来太子参也被用作园林观赏植物[6]。
太子参以种根进行无性繁殖为主,由于长期的无性繁殖使太子参病毒病的发生日趋严重,造成种性退化,严重影响太子参的品质[7-9];且常规无性繁殖不仅繁殖系数低、用种量大,难以满足规模化生产对种源的需求。因此,进行高效的太子参组织培养脱毒体系是进行规模化育苗、防治太子参病毒病最有效的途径[10]。本试验选择在当地表现良好的太子参品种作为试验材料,采用茎尖脱毒、芽的诱导、芽的增殖、丛生芽诱导、生根获得大量优质、无病毒的太子参种苗,以满足规模化生产的需求,同时为建立太子参优质种苗快繁的工厂化生产提供技术参考和依据。
1 材料与方法
1.1 试验材料 供试材料来源于山东省临沭县药材基地二月份太子参冬芽,按常规方法种植于临沂大学遗传学实验室苗圃中。以太子参幼芽为外植体。
1.2 试验方法
1.2.1 培养基和培养条件 培养基:以MS为基础培养基,附加白糖3.0%、琼脂粉0.4%,pH调至5.6~5.8,按不同目的添加激素种类和设置不同浓度,配成诱导分化、继代增殖、生根培养基,以筛选出最优培养基。培养条件:温度为(25±2)℃,光照为12h/d,光照强度为2 800lx。
1.2.2 外植体脱毒方法 根据课题组前期研究,选取生长健壮的太子参顶芽2~3cm于烧杯中,加入表面活性剂清洗15min,流水冲洗1~2h,先置于75%酒精中浸泡约10~15s,用无菌水清洗3~5次,加升汞至淹没外植体(加3~5滴吐温-80)灭菌8~10min,无菌水冲洗5~6次。在超净工作台上,将经消毒过的茎段放在低倍双筒解剖镜下逐层剥去茎尖外面的幼叶,将切下0.5mm的茎尖,接种于芽增殖诱导培养基上。
1.2.3 芽的增殖诱导 将经过脱毒处理的茎尖,转移到增殖诱导培养基上,暗培养7d后转移到2 800lx的光照强度下继续培养。30d后将成活的茎尖转移到不同激素配比的培养基上进行培养。每个处理30个茎尖,每个处理重复3次。
1.2.4 丛生芽的诱导 将经过诱导培养基诱导出的芽,转接到增殖培养基上诱导丛生芽,培养30d左右。每个处理20个外植体,每个处理重复3次。
1.2.5 生根壮苗培养 丛生芽长至3~4cm的太子参无菌苗,转接至生根培养基上进行生根壮苗诱导。每个处理30个外植体,每个处理重复3次。
1.2.6 炼苗移栽 将长势一致的生根试管苗移栽至装满珍珠岩的塑料杯中进行锻炼。每隔7d浇灌一次营养液和0.1%的多菌灵,20d左右,炼苗过程结束,移栽至大田。
2 结果与分析
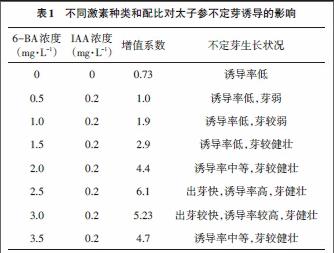
2.1 茎尖增殖诱导 将脱毒太子参茎尖经过暗培养7d后的外植体转移到2 800lx光照强度下培养30d后,观察接种在不同激素配比的诱导培养基上的不定芽诱导率和生长状况。由表1可知,6-BA、IAA的培养基对不定芽的诱导具有促进作用。IAA浓度为0.2mg/L时,随着6-BA浓度的升高,对太子参不定芽的诱导作用也逐渐增强;当6-BA的浓度升高到2.5mg/L时,不定芽的诱导率最高,出芽快,芽健壮,增值系数为6.1;随着6-BA的浓度的继续升高,则表现出对不定芽的抑制作用。综上,激素配比为2.5mg/L 6-BA +0.2mg/L IAA的培养基最适宜太子参茎尖不定芽的诱导。
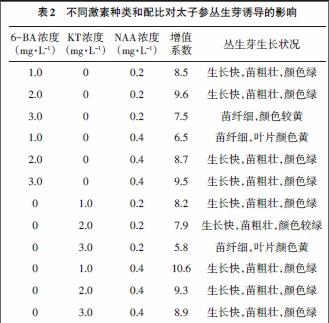
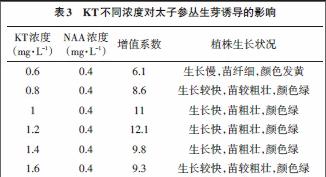
本试验在筛选出最适激素种类的基础上,进一步探索了激素KT与NAA的配比对丛生芽诱导的影响。结果如表3所示,当KT浓度为0.6~1.2mg·L-1时,随着KT浓度的升高,对诱导丛生芽的的促进作用越来越强,太子参丛生芽的增殖系数也不断增加,幼苗生长的速度越来越快,苗粗壮,叶片颜色深绿,植株健壮,整体长势越来越好;当KT浓度为1.2mg/L时,丛生芽增殖倍数最高,出芽最快,苗颜色绿而且粗壮,长势最好,增值系数达到12.1。而后随着KT浓度的增加,增殖倍数又不断的下降,太子参丛生芽的生长收到抑制。由此可知,激素配比分别为1.2mg/L KT + 0.4mg/L NAA的培养基对太子参丛生芽的诱导效果最佳。
2.3 不同激素处理对太子参生根壮苗培养 选择在增殖培养基上长至3~4cm,且长势一致的试管苗转接到生根培养基中进行培养,使其生根并茁壮生长,为炼苗做好准备。由表4结果可以看出:生长激素NAA和DA-6均能诱导根的产生,太子参的生根率均达到100%,并且DA-6更适宜太子参生根壮苗的培养,激素配比为0.2mg·L-1 KT+0.5mg·L-1dA-6。DA-6培养出来的苗粗壮,颜色绿,产生的根系也多并且粗壮,有大量块根产生。
2.4 炼苗移栽 将长势一致的生根试管苗移栽至装满珍珠岩的塑料杯中进行锻炼。每隔7d浇灌一次营养液和0.1%的多菌灵,20d左右,炼苗过程结束,移栽至大田,移栽成活率达到100%。
3 讨论与结论
植物茎尖分生组织中,维管系统尚未发育完善,病毒传播速度很慢,因此,组培后获得无毒苗的几率也较大。本试验中,通过对太子参茎尖脱毒处理,在合适的培养条件下,选择适宜的MS培养基,诱导丛生芽的产生,并进行扩繁,经过生根和炼苗等过程,得到了大量的太子参块根。
通过太子参茎尖脱毒、扩繁技术研究可得,适宜太子参组织培养的基本培养基为MS培养基;最适宜太子参茎尖不定芽的诱导的培养基激素配比为MS + 2.5mg/L 6-BA +0.2mg/L IAA;对太子参丛生芽的诱导效果最佳细胞分裂素为KT,且培养基激素种类和配比分别为MS + 1.2mg/L KT + 0.4mg/L NAA时诱导效果最佳,增值系数为12.1。在适激素配比为MS + 0.2mg·L-1 KT+0.5mg·L-1dA-6的培养基上进行生根壮苗的培养效果最佳。下一步的研究是通过指示植物法检测太子参茎尖脱毒效果[11],以期为建立太子参优质种苗快繁的工厂化生产提供技术参考和依据。
参考文献
[1]熊厚溪,周涛,江维克,等.基于表型性状和药材品质的8个贵州太子参品系的筛选与评价[J].中国中药杂志,2014,39(21):4197-4203.
[2]任永權,杨芩,徐元江,等.太子参水浸液对其种子萌发和幼苗生长的影响[J].北方园艺,2012(06):172-174.
[3]林秀渠,李早永,隋春青.太子参高产栽培技术[J].山东农业科学,2011⑴:111-113.
[4]晏春耕,曹瑞芳,太子参药材性状与多糖含量的研究[J].安徽农学通报,2009,15(11):81.
[5]温学森,霍德兰,赵华英.太子参常见病害及防治[J].中药材,2003,26(4):243-245.
[6]李修清.药用观赏植物在园林中的应用研究[J].现代农业科技,2011(3):215-216.
[7]张国辉,张西平,贺定翔.贵州省黔东南州太子参斑点病的调查及防治[J].安徽农业科学,2011,39(7):3993-3994.
[8]高玮,张敬水,张建红.太子参花叶病毒的检测与防治[J].中国病毒学,1993,8(4):390-393.
[9]陈建祥,王飞,左群.贵州省施秉县太子参生产存在问题与高产栽培关键技术[J].农技服务,2011,28(2):231-232.
[10]戴军,姚厚军,张九玲,等.太子参超低温脱毒及规模化组培苗技术[J],生物学杂志,2014(3):84-86。
[11]Wang Q C,Liu Y,Xie Yh,et al.Cryotherapy of potato shoot tips for efficient elimination of potato leafroll virus(PL R V)and potato virus Y(PVY) [J].Potato Research,2006,49:119-129.
(责编:张宏民)
