响应面法对苦槠果实中黄酮提取工艺的优化
2017-04-12周鲜娇陈秋愉陈蓉潘进权
周鲜娇++陈秋愉++陈蓉++潘进权

摘要:为研究苦槠(Castanopcis sclerophylla)果实中黄酮的提取工艺,利用单因素试验及响应面分析法,探讨了乙醇体积分数、料液比、提取温度和提取时间对苦槠果实黄酮提取量的影响。结合响应面交互作用,分析优化得出苦槠果实中黄酮的最佳提取条件为:乙醇体积分数50%,料液比1∶36(g∶mL),提取时间2.5 h,提取温度83 ℃。在此条件下黄酮提取量实测值可达2.107 mg/g,与预测值(2.091 mg/g)相吻合。
关键词:苦槠(Castanopcis sclerophylla);黄酮;响应面法;提取工艺
中图分类号:S792.17;R284.2 文献标识码:A 文章编号:0439-8114(2016)22-5911-07
DOI:10.14088/j.cnki.issn0439-8114.2016.22.046
Study on the Extraction Technology of Flavonoids from Sclerophylla
Fruit by Response Surface Methodology
ZHOU Xian-jiaoa,b,CHEN Qiu-yua,b,CHEN Ronga,b,PAN Jin-quana,b,RAO Ying-zhua,b
(a.Life Science and Technology School;b.Institute of Applied Biotenology,Lingnan Normal University,Zhanjiang 524048,Guangdong,China)
Abstract: In order to study the extraction technology of flavonoids from Sclerophylla fruit,using THE single factor experiment and response surface methodology to investigate the impacts of ethanol volume fraction,solid-to-liquid ratio,extraction temperature and extraction time on the extraction rate of flavonoids from Sclerophylla fruit. Combined with the response surface interaction,the optimum extraction conditions of flavonoids from Sclerophylla fruit were an ethanol volume fraction of 50%,the solid-to-liquid of 1∶36 g/mL, extraction time of 2.5 h and extraction temperature of 83 ℃. Under these conditions the measured extraction rate of flavonoids was 2.107 mg/g,which was identical with predicted value(2.091 mg/g).
Key words: Castanopcis sclerophylla; flovonoids; response surface methodology; extraction technology
苦櫧(Castanopcis Sclerophylla)别名苦槠拷、槠树、槠栗,属壳斗科,是亚热带常绿阔叶林的主要群种之一[1]。它主要分布于江西、广东、福建、四川、云南、湖南、湖北、浙江、安徽、江苏等地,各地产量较大。苦槠果实的药用价值很高,据李时珍《本草纲目》介绍,槠果实主治阳痿、水肿,有益气、充饥、明目、壮筋骨、助阳气、补虚劳、健腰膝、盖颜色等效用[2]。研究显示,苦槠果实中主要含有淀粉、还原糖、果胶、维生素C和黄酮等成分[3]。
黄酮是一类广泛存在于植物内的多酚类物质,在植物的花、叶、果等组织中,一般以黄酮苷的形式存在[4]。黄酮苷一般易溶于水、甲醇、乙醇等极性溶剂[5]。黄酮类化合物对治疗冠心病、心绞病、高血压、支气管哮喘等有显著效果,具有抗肿瘤、抗氧化、抗过敏、降血压、抗炎抗菌、保护心血管等多种作用[6-9]。
响应面分析法(Response Surface Methodology,RSM)是在合理的试验设计条件下,通过利用多元二次回归方程拟合多因素与响应值之间的函数关系及分析回归方程来求得最佳工艺参数,以解决含有多个变量问题的一种数学统计方法。它与被广泛使用的正交试验设计法不同,具有试验周期短,回归方程精确度高,能研究多因素间交互作用等优点[10]。
目前,对于苦槠果实的加工利用仅集中于用苦槠淀粉生产附加值较低的产品,如苦槠豆腐、粉条、凉皮、苦槠干粉等产品,而苦槠果实中黄酮的提取及其提取条件优化工艺少有文献报道[2,3]。本研究以乙醇作为溶剂,采用回流法通过单因素试验和Box-Behnken的中心组合试验,并利用Design-Expert软件进行响应面优化分析,确定苦槠果实黄酮的最佳提取工艺参数,为苦槠果实黄酮的进一步开发利用提供技术支持,期待能为苦槠果实开发成功能食品提供科学依据。
1 材料与方法
1.1 材料与试剂
苦槠果实,购自江西抚州东乡马圩周家,烘干研磨,过100目筛,置阴凉干燥处备用;芦丁标准溶液,光谱纯,国药集团化学试剂公司;无水乙醇、亚硝酸钠、氢氧化钠、硝酸铝均为分析纯级,均购于湛江康佰生物试剂公司。
1.2 仪器与设备
BS124S型电子天平,赛多利斯科学仪器(北京)有限公司;HH-601型超级恒温水浴锅,江苏金坛市亿通电子有限公司;UV-7504型单光束紫外-可见分光光度计,上海欣茂仪器有限公司;DG30/14-IIA HG202-IA型电热干燥箱,南京实验仪器厂。
1.3 方法
1.3.1 苦槠果实黄酮提取工艺 称量苦槠果实粉末→倒入浸提回流装置→加入乙醇溶液浸泡→提取→抽滤→吸取苦槠黄酮提取液→NaNO2—Al(NO3)3比色法[11]测定黄酮含量。
1.3.2 标准曲线的绘制 精密称取充分干燥后的芦丁标准样品0.055 1 g,置于100 mL容量瓶中,用30%乙醇溶解并定容,摇匀得浓度为0.551 g/L标准溶液[12]。准确吸取芦丁标準溶液0、1、2、3、4、5 mL于6只25 mL比色管中,0 mL的比色管作为空白对照组,按上述加入试剂的步骤进行,于最大吸收波长λmax处比色测定。以芦丁质量浓度为纵坐标,吸光度为横坐标,绘制标准曲线。
1.3.3 最大吸收波长的确定 准确吸取芦丁标准溶液10 mL于25 mL比色管中,加入5% NaNO2溶液0.3 mL,摇匀,放置5 min;加入10% Al(NO3)3溶液0.3 mL,摇匀,放置5 min;加入4% NaOH溶液2.0 mL,再加入30%乙醇溶液至刻度线,摇匀,放置15 min;同时以蒸馏水替代标准溶液做空白对照。以空白试剂为参比,在495~515 nm范围内测定芦丁标准显色液的吸光度[13],绘制波长—吸光度曲线以确定芦丁标准显色液的最大吸收波长λmax。
1.3.4 总黄酮浓度的测定 取10 mL苦槠黄酮提取液于25 mL比色管中,同样按上述步骤加入试剂;同时以提取液[不加入NaNO2、Al(NO3)3和NaOH溶液,只加入30%乙醇溶液至刻度线]作为空白试剂[14]。将做好的显色试剂摇匀装入比色皿内(本试验所用的两个比色皿吸光度分别为0.041与0.044,以空气作为空白测得),于最大吸收波长λmax处比色测定,最后根据标准曲线计算黄酮浓度C(μg/mL)。
黄酮提取量=■
式中,V1为每次加入乙醇溶液的体积;V2为第二次定容时比色管的体积,此处为25 mL;V3为抽取滤液的体积,此处为10 mL;m为称量的苦槠粉的质量,此处为2.000 g。
1.3.5 单因素试验设计 以乙醇体积分数、料液比、提取温度和提取时间4个因素进行单因素试验,重复3次,确定影响苦槠果实黄酮提取量的适宜单因素条件。
1)乙醇体积分数的确定。精确称取苦槠果实粉末2.000 g 7份,按料液比1∶30(g∶mL,下同),在70 ℃提取温度下分别用30%、40%、50%、60%、70%、80%、90%的乙醇溶液回流提取2 h,抽滤,取滤液测定苦槠果实中黄酮浓度,比较不同乙醇体积分数对苦槠果实黄酮提取量的影响,由此确定较为优化的乙醇体积分数。
2)料液比的确定。精确称取苦槠果实粉末2.000 g 7份,在70 ℃提取温度下,分别按料液比1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40,用50%的乙醇溶液回流提取2 h,抽滤,取滤液测定苦槠果实中黄酮浓度,比较不同料液比对苦槠果实黄酮提取量的影响,由此确定较为优化的料液比。
3)提取温度的确定。精确称取苦槠果实粉末2.000 g 7份,用50%的乙醇溶液按料液比1∶30分别在30、40、50、60、70、80、90 ℃提取温度下回流提取2 h,抽滤,取滤液测定苦槠果实中黄酮浓度,比较不同提取温度对苦槠果实黄酮提取量的影响,由此确定较为优化的提取温度。
4)提取时间的确定。精确称取苦槠果实粉末2.000 g 6份,在提取温度70 ℃条件下,用50%乙醇溶液按料液比1∶30分别提取1.0、1.5、2.0、2.5、3.0、3.5 h,抽滤,取滤液测定苦槠果实中黄酮浓度,比较不同提取时间对苦槠果实黄酮提取量的影响,由此确定较为优化的提取时间。
1.3.6 响应面优化试验 采用Design-Expert 8.0.5.0软件处理数据。根据单因素试验结果,利用Box-Behnken设计法,选取乙醇体积分数、料液比、提取温度、提取时间4个因素作试验因素,以黄酮提取量为响应值,设计4因素3水平试验。试验因素与水平见表1。
2 结果与分析
2.1 标准曲线的绘制
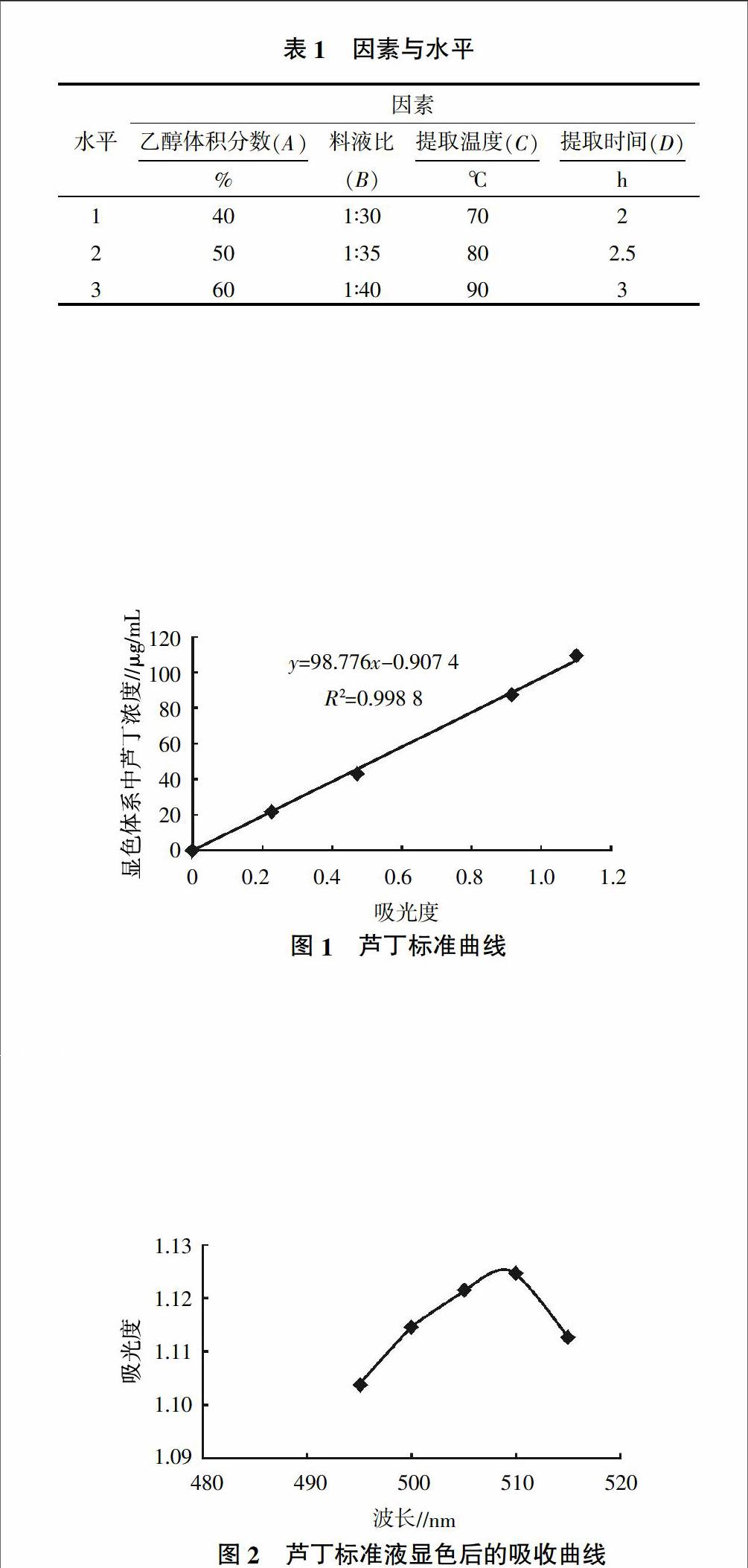
如图1所示,在一定范围内,芦丁标准溶液的浓度与显色液的吸光度之间呈良好的线性关系,满足方程y=98.776x-0.907 4,R2=0.998 8。
2.2 芦丁标准显色溶液最大吸收波长的测定
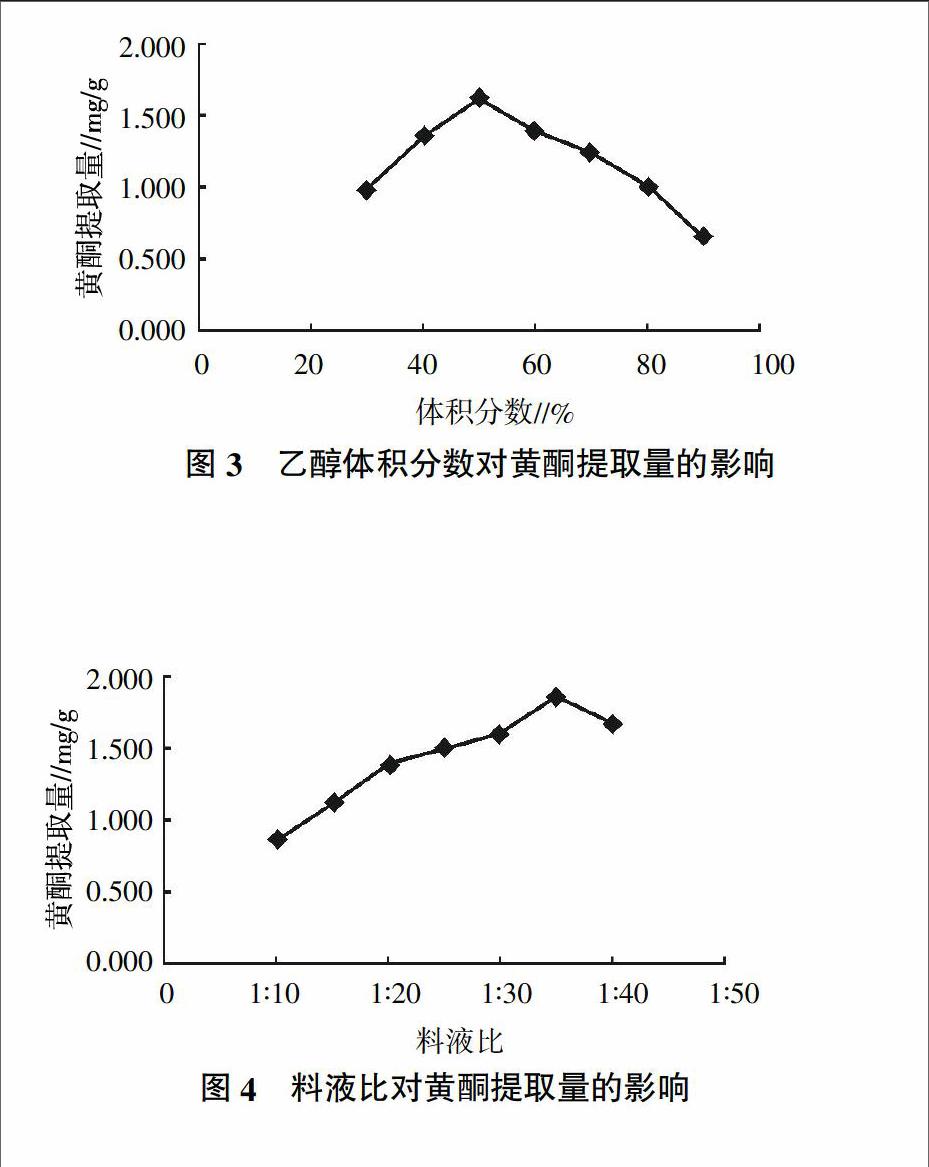
如图2所示,芦丁标准溶液经显色后,在波长495~515 nm区间内,最大吸收波长为510 nm。因此,通过比色法测定苦槠果实黄酮的含量时,其波长也选定为510 nm。
2.3 单因素试验结果
2.3.1 乙醇体积分数 如图3所示,不同体积分数的乙醇对苦槠黄酮提取量有明显影响。在30%~50%的范围内,随着乙醇体积分数的增加,苦槠果实黄酮提取量增加;当乙醇体积分数为50%时,黄酮提取量最大;在50%~90%的范围内,黄酮提取量随着体积分数的升高而下降。因此,乙醇为50%时提取效果最佳。不同的有效成分在不同的溶剂内溶解性有很大的区别,使用不同的溶剂提取相同的材料,可得到不同的提取液[15]。溶剂浓度不同,产生的渗透压大小也不同,进而影响提取量[16]。本研究的结果表明,随着乙醇体积分数的增加,苦槠果实黄酮提取量先增后减,且变化幅度很大。这主要是由于乙醇体积分数较低时,黄酮溶解度较差,水的含量相对较高,以水作为提取剂,把蛋白质、糖类等易溶于水的物质提取出来,因而当乙醇体积分数较低时,黄酮提取量较低;而乙醇体积分数过高时会产生较大的渗透压,一些脂溶性物质的溶出量增大,使黄酮类物质的溶解度降低,从而导致黄酮提取量降低。
2.3.2 料液比 如图4所示,1∶10~1∶35的料液比范围内,黄酮提取量随着溶剂的增大而增大;当料液比为1∶35时,黄酮提取量最大;当料液比小于1∶35时,苦槠果实的黄酮提取量降低。所以,提取效果最佳的料液比为1∶35。
料液比能影响固液两相中有效成分的浓度梯度,进而影响提取速率[15]。固液两相中,提取液有效成分扩散是否达到平衡对提取量存在影响[16,17]。由本研究结果可以看出,随着料液比的增加,苦槠果实黄酮提取量先增后减,变化幅度较大。这可能是因为料液比的增加降低了提取溶液中黄酮的浓度,从而增加固液两相中黄酮的浓度梯度,进而提高黄酮溶出的速度,最终提高提取量。当扩散达到平衡时,增加提取剂的比值并不会促进黄酮的提取,溶剂用量的增加反而会导致其他杂质过多溶出,从而降低黄酮的提取量。
2.3.3 提取温度 如图5所示,在30~80 ℃的溫度范围内,苦槠果实黄酮提取量随着温度的升高而增加;当提取温度为80 ℃时,黄酮提取量最大;超过80 ℃后,随温度的升高,提取量降低。因此,提取温度为80 ℃时提取效果最佳。
在提取过程中,温度升高可促进分子运动,软化组织,增加溶解性、渗透性,降低溶液黏度,从而提高提取效率[18]。温度过高会破坏易热解物质的结构[19]。本研究结果表明,随着提取温度的增加,苦槠果实黄酮提取量先增后减,变化幅度较大。这主要是由于温度的升高能增加黄酮的运动程度,也可使苦槠果实组织的细胞壁容易破裂,从而加速黄酮的渗透、扩散、溶解速度等,使之更容易被提取出来;但过高的温度容易引起黄酮被氧化破坏,从而导致黄酮提取量降低。
2.3.4 提取时间 如图6所示,苦槠果实黄酮的提取量在2.5 h之前随着提取时间的延长而增加,2.5 h时,黄酮提取量最大;2.5 h后随着时间的增长提取量反而降低。所以,最佳的提取时间为2.5 h。
提取时间越长,所能提取出的有效成分就越多,但过长的提取时间也常常会提取出一些无效成分,影响提取效果[18]。由本研究结果可以看出,随着时间的延长,黄酮提取量也是先增后减,但变化幅度较小。这主要是因为提取时间过短时,黄酮不能充分溶出,适当的延长提取时间则有利于黄酮充分的扩散浸出;而提取时间过长,大量的水溶性物质溶出,提取液变黏稠而对黄酮产生吸附作用,导致黄酮不能快速扩散析出,亦可能使黄酮结构被破坏,从而降低黄酮的提取量。
2.4 响应面分析与优化
2.4.1 回归模型的建立 对响应面试验共设计29个试验点,设计及结果见表2。采用响应面分析法分析试验结果,得到以黄酮提取量为响应值的回归方程:黄酮提取量=-24.790 85+0.410 89A+0.334 68B+0.185 11C+2.168 83D+0.001 375AB-0.000 187 5AC-0.003 7AD + 0.000 28BC + 0.0027BD + 0.00005CD -0.004 292 67A2 - 0.006 040 67B2 - 0.001 115 17C2 -0.413 07D2各因素的方差分析见表3。由表3可知,模型P<0.000 1,表明该二次方程模型极显著,失拟项P=0.533 5,不显著,表明该方程对试验结果拟合情况好、误差小,因此可用该回归方程对试验结果进行分析和预测。
2.4.2 响应面交互作用分析与优化 用Design-Expert软件对表2数据进行四元二次回归拟合,所得回归方程的响应面等高线曲面图(图7~图12)。由图7(a)可知,乙醇体积分数的曲面较陡,料液比的平面比较平缓,说明乙醇体积分数对苦槠果实黄酮提取量的影响较显著,而料液比的影响不显著;图7(b)中等高线沿乙醇体积分数轴向较料液比轴向密集,说明乙醇体积分数对苦槠果实黄酮提取量的影响比料液比大;等高线为椭圆形,说明乙醇体积分数与料液比的交互作用较强,对苦槠果实黄酮提取量的影响显著。
由图8(a)可知,乙醇体积分数的曲面较陡,提取温度的平面比较平缓,说明乙醇体积分数对苦槠果实黄酮提取量的影响较显著,而提取温度的影响不显著;图8(b)中等高线沿乙醇体积分数轴向较提取温度轴向密集,说明乙醇体积分数对苦槠果实黄酮提取量的影响比提取温度大;等高线为椭圆形,说明乙醇体积分数与提取温度的交互作用较强,对苦槠果实黄酮提取量的影响显著。
由图9(a)可知,乙醇体积分数的曲面较陡,提取时间的平面比较平缓,说明乙醇体积分数对苦槠果实黄酮提取量的影响较显著,而提取时间的影响不显著;图9(b)中等高线沿乙醇体积分数轴向较提取时间轴向密集,说明乙醇体积分数对苦槠果实黄酮提取量的影响比提取时间大;等高线为椭圆形,说明乙醇体积分数与提取时间的交互作用较强,对苦槠果实黄酮提取量的影响显著。
由图10(a)可知,提取温度的曲面较陡,料液比的平面比较平缓,说明提取温度对苦槠果实黄酮提取量的影响较显著,而提取温度的影响不显著;图10(b)中等高线为椭圆形,说明料液比与提取温度的交互作用较强,对苦槠果实黄酮提取量的影响显著。
由图11(a)所示,料液比的曲面较陡,提取时间的平面比较平缓,说明料液比对苦槠果实黄酮提取量的影响较显著,而提取时间的影响不显著;图11(b)中等高线沿料液比轴向较提取时间轴向密集,说明料液比对苦槠果实黄酮提取量的影响比提取时间大;等高线比较接近圆形,说明料液比与提取时间的交互作用较弱,对苦槠果实黄酮提取量的影响不显著。
由图12(a)可知,提取温度的曲面较陡,提取时间的平面比较平缓,说明提取温度对苦槠果实黄酮提取量的影响较显著,而提取时间的影响不显著;图12(b)中等高线为椭圆形,说明料液比与提取时间的交互作用较强,对苦槠果实黄酮提取量的影响显著。
由各响应面立体图可看出,响应值存在最大值。通过软件分析计算得出,苦槠果实黄酮的最佳提取工艺为乙醇体积分数50.72%,料液比1∶35.97,提取时间2.52 h,提取温度83.30 ℃。考虑到实际操作的便利,调整其最佳提取工艺条件为乙醇体积分数50%,料液比1∶36,提取时间2.5 h,提取温度83 ℃。在此条件下,重复试验3次,苦槠果实黄酮提取量平均实测值为2.107 mg/g,与预测值(2.091 mg/g)相差0.016 mg/g,说明该方程与实际情况的拟合性良好,充分证明了该回归方程的可靠性。
3 结论
以乙醇溶液作为溶剂,采用回流法提取苦槠果实黄酮,在单因素试验结果的基础上,采用Design-Expert软件的Box-Behnken设计法设计响应面试验,建立了苦槠果实黄酮的四元二次回归方程,经检验该回归方程是合理可靠的,能较好地预测苦槠果实黄酮的提取量,优化了苦槠果实黄酮的最佳提取工艺条件。结果表明,乙醇体积分数、料液比和提取温度对苦槠果实黄酮的提取效果影响较大,而提取时间影响较小。结合响应面交互作用分析结果和实际情况预测最佳条件,并验证后得出苦槠果实黄酮的最佳提取条件为乙醇体积分数50%,料液比1∶36,提取时间2.5 h,提取温度83 ℃。此条件下黄酮的提取量为2.107 mg/g,与预测值(2.091 mg/g)基本相符,充分证明了该模型的可靠性。
參考文献:
[1] 岳华锋,井振华,邵文豪,等.浙江天目山苦槠种群结构与动态研究[J].植物研究,2012,32(4):473.
[2] 涂宗财,刘光宪,豆玉新,等.苦槠果实总黄酮的提取与纯化[J].食品研究与开发,2008,29(1):33-36.
[3] 刘光宪.苦储黄酮、淀粉、果胶的提取及理化性质研究[D].南昌:南昌大学,2008.
[4] 吴立军.天然药物化学[M].第6版.北京:人民卫生出版社,2011.
[5] 董建武.天然药物化学[M].杭州:浙江大学出版社,2010.
[6] 延 玺,刘会青,邹永青,等.黄酮类化合物生理活性及合成研究进展[J].有机化学,2008,28(9):1535-1539.
[7] MARCIA V,WESTON P,DAVID B,et al. Polyphenols of selected peach and plum genotypes reduce cell viability and inhibit proliferation of breast cancer cells while not affecting normal cells[J].Food Chemistry,2014,164:363-370.
[8] KRISTIEN J A L,BREGJE VAN DE W,NATHALIE V,et al. The flavonoid 7-mono-O-(b-hydrox-yethyl)-rutoside is able to protect endothelial cells by a direct antioxidant effect[J]. Toxicology in Vitro,2014,28:538-543.
[9] LIU Y J,ZHAN J,LIU X L,et al. Dietary flavonoids intake and risk of type 2 diabetes:A meta-analysis of prospective cohort studies[J].Clinical Nutrition,2014,33:59-63.
[10] 肖卫华,韩鲁佳,杨增玲,等.响应面法优化黄芪黄酮提取工艺的研究[J].中国农业大学学报,2007,12(5):52-56.
[11] 魏永生,王永宁,石玉平,等.分光光度法测定总黄酮含量的实验条件研究[J].青海大学学报,2003,21(3):61-63.
[12] 冯 涛.竹叶总黄酮提取及纯化工艺的研究[D].天津:天津科技大学,2003.
[13] 叶思平.荷叶黄酮提取纯化及其特性研究[D].广州:仲恺农业工程学院,2013.
[14] 郑杭生,李计萍,韩 炜,等.紫外-可见分光光度法测定总黄酮含量的方法学考察要点[J].中成药,2008,30(9):1364-1365.
[15] 许 晖.响应面优化花生壳黄酮提取工艺的研究[J].中国粮油学报,2009,24(1):107-111.
[16] 林建原,季丽红.响应面优化银杏叶中黄酮的提取工艺[J].中国食品学报,2013(2):83-90.
[17] 常丽新,贾长虹,郁春乐.响应面优化玉米芯黄酮的提取工艺研究[J].食品工业科技,2014,35(2):259-263.
[18] 曹光明.中药浸提物生产工艺学[M].北京:化学工业出版社,2009.
[19] 张玉香,屈慧鸽,杨润亚,等.响应面法优化蓝莓叶黄酮的微波提取工艺[J].食品科学,2012,31(16):33-37.
