盐藻蛋白酶体亚基PSMD7在鞭毛解聚后的表达分析
2017-04-06石科梁瑞峰杨亮
石科 梁瑞峰 杨亮
(1. 河南医学高等专科学校,郑州 451191;2. 郑州大学细胞生物研究室,郑州450008;3. 河南省中医药研究院,郑州 450004)
盐藻蛋白酶体亚基PSMD7在鞭毛解聚后的表达分析
石科1,2梁瑞峰3杨亮1
(1. 河南医学高等专科学校,郑州 451191;2. 郑州大学细胞生物研究室,郑州450008;3. 河南省中医药研究院,郑州 450004)
为了研究盐藻19S蛋白酶体亚基PSMD7和鞭毛解聚的关系,用3-异丁基-1-甲基黄嘌呤(IBMX)诱导盐藻鞭毛解聚,实时荧光定量PCR检测PSMD7在鞭毛解聚后的mRNA表达变化。同时通过原核表达和蛋白纯化得到高纯度的盐藻PSMD7蛋白,制备盐藻PSMD7的山羊多克隆抗体,Western blot检测PSMD7蛋白在鞭毛解聚后的表达情况。结果显示IBMX诱导鞭毛解聚后PSMD7的mRNA表达水平增高,其中在鞭毛解聚后30 min达到最大值。成功制备了盐藻PSMD7的山羊多克隆抗体,Western blot结果显示PSMD7蛋白在鞭毛解聚后表达增加,说明蛋白酶体亚基PSMD7参与盐藻鞭毛的解聚。
PSMD7;蛋白酶体;鞭毛解聚
泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)通过选择性降解目标底物来调节细胞内许多蛋白的稳定,在细胞内参与维持蛋白平衡和细胞活性,参与细胞周期的调控、凋亡、信号传导及病毒感染等[1,2]。UPS是一个由多个亚基组成的降解复合体,由泛素结合体系和26S蛋白酶体两部分组成,底物蛋白的泛素化是被蛋白酶体降解的一个标志[3]。26S蛋白酶体由一个20S核心颗粒(core particle,CP)和两个19S调节颗粒(regulatory particle,RP)构成,可将泛素标记的蛋白水解成小的肽段。20S CP中含有蛋白水解活性位点,是蛋白酶体的降解部位,19S RP作为多泛素化蛋白的受体位于20S CP的两端,具有筛选泛素化底物并使其进入20S CP的作用[4]。
19S RP中有4个去泛素化酶亚基来调控泛素标记底物的降解,分别为USP14、UCHL5/Uch37、PSMD14/RPN11和PSMD7/RPN8[5],其中PSMD14和PSMD7属于JAMM家族的去泛素化酶位于19S RP的lid中[6]。组织结构学研究表明,19S RP的lid亚复合体由9个亚基组成,PSMD7位于中央核心位置[7],说明PSMD7在形成19S蛋白酶体lid亚复合体中起重要的作用,然而它在细胞内的具体功能尚不完全清楚。
纤毛/鞭毛是进化上保守的具有特殊功能的细胞器,来源于细胞质膜下的基体向上突出于细胞表面。实质上纤毛和鞭毛的结构基本相同:均由微管蛋白的轴丝及其外部包裹的与细胞膜相连的纤毛膜组成[8]。在鞭毛的解聚过程中,远端的鞭毛蛋白被泛素化标记,通过IFT机制运输至基体而被蛋白酶体降解[9]。前期实验中本课题组已用shotgun strategy对盐藻鞭毛蛋白组学进行了分析,发现了大量参与泛素结合过程的蛋白质[10],并且通过酵母双杂交实验证实了盐藻鞭毛相关蛋白KCBP和蛋白酶体亚基PSMD7相互作用,并且蛋白酶体参与KCBP蛋白的降解[11,12]。作为蛋白酶体19S RP的lid中的核心蛋白,PSMD7在纤毛/鞭毛解聚后的表达情况还不清楚,因此本文通过3-异丁基-1-甲基黄嘌呤(IBMX)诱导盐藻鞭毛的解聚,用实时荧光定量PCR检测PSMD7在鞭毛解聚后mRNA的表达变化,同时构建原核表达载体pET28a(+)-PSMD7,利用大肠杆菌BL21(DE3)进行His-PSMD7融合蛋白的表达并进行了蛋白纯化,制备盐藻PSMD7的多克隆抗体,研究PSMD7蛋白在鞭毛解聚后的表达情况,旨在为研究PSMD7生物学功能及其应用奠定基础。
1 材料与方法
1.1 方法
1.1.1 材料与试剂 质粒pET28a(+)由本实验室保存;感受态大肠杆菌BL21(DE3)、感受态大肠杆菌DH5α、胶回收试剂盒、蛋白提取试剂盒和Bradford蛋白定量试剂盒购自生工生物工程(上海)股份有限公司;限制性内切酶Nde I和Hind Ⅲ、T4 DNA连接酶、蛋白Marker等购自TaKaRa;异丙基β-D-硫代半乳糖苷(IPTG)、3-异丁基-1-甲基黄嘌呤(IBMX)、弗氏完全佐剂(CFA)和弗氏不完全佐剂(IFA)购自Sigma;HisTrap column购自Amersham;AKTA Purifier购自GE;Quant SYBR Green PCR试剂盒购自Qigen。
亲和层析Buffer A:Tris 50 mmol/L(pH 8.0)、NaCl 500 mmol/L、咪唑20 mmol/L;亲和层析Buffer B:Tris 50 mmol/L(pH 8.0)、NaCl 500 mmol/L、 咪唑1 mol/L;Hepes缓冲液:Hepes 0.04 mol/L、KCl 0.01 mol/L、CaCl20.01 mol/L、NaCl 1 mol/L、山梨醇0.04 mol/L、甘露醇0.04 mol/L,用NaOH调节pH为7.2;鞭毛银染液:将50 mL 5% AgNO3溶液置三角瓶内,缓慢加入5%氨水,直至溶液变为透明即可。
1.1.2 实验动物 波尔山羊一只,雄性,体重35 kg,购自河南省郑州大学医学动物实验中心。
1.2 方法
1.2.1 实时荧光定量PCR 参照Hirono等[13]的方法用IBMX诱导盐藻鞭毛解聚,操作如下:收集500 mL对数生长期杜氏盐藻细胞,1 200 r/min离心4 min,用无菌培养基清洗3次,将细胞用500 mL含0.1 mol/L IBMX的培养基光照培养诱导鞭毛解聚。分别在诱导后30、60和90 min收集藻体,并用改进的银染法[10]观察盐藻鞭毛解聚后的形态变化。用Trizol法提取盐藻细胞总RNA,琼脂糖凝胶电泳和紫外分光光度计法A260/A280检测所提取RNA的质量和浓度。根据反转录试剂盒说明书合成cDNA,保存于-20℃备用。用Primer Premier 6.0设计一对PSMD7特异性引物(上游引物:ATGGCACCGGCTCCGGACAG,下游引物:ATGACCAGCACTGGAGACAC),同时设计GAPDH引物作为内参(上游引物:CAAGTTCTCCGCCGATGTGA, 下 游 引 物:GAACACGCCTGTGCCCTCAA)。先用普通PCR对退火温度、引物浓度和模板浓度等实验条件进行优化,确保PCR产物中没有非特异产物扩增及引物二聚体。然后用Quant SYBR Green PCR试剂盒进行实时荧光定量PCR,反应体系:cDNA模板0.3 μL,上下游引物(10 μmol/L)各0.3 μL,2.5×Real Master Mix 35.7 μL,20×SYBR solution 29.25 μL,H2O 35.15 μL,反应程序为:95℃预变性5 min;95℃ 30 s,58℃ 30 s,72℃ 5 min,共30个循环;72℃ 10 min;4℃终止反应。反应结束后观察扩增曲线和熔解曲线,进行1%琼脂糖凝胶电泳鉴定PCR产物的特异性。所有反应重复3次,采用2-ΔΔCT计算法分析数据[14]。
1.2.2 融合载体pET28a(+)- PSMD7的构建 以杜氏盐藻cDNA为模板,设计引物序列,上游引物:5'-AGCCATATGATGGCACCGGCTCCG-3';下游引物:5'- CCCAAGCTTTTACTTCTTGCTCTC-3'(下划线分别为Nde I和Hind Ⅲ限制性内切酶序列),PCR扩增获得PSMD7基因片段,将PCR产物进行1%琼脂糖凝胶电泳并回收目的片段,目的片段和pMD19-T载体相连转化大肠杆菌DH5α化学感受态细胞,挑取阳性克隆并提取质粒,用Nde I和Hind Ⅲ双酶切后进行琼脂糖凝胶电泳,回收PSMD7目的片段与双酶切(Nde I和Hind Ⅲ)后的pET28a(+)连接,转化DH5α化学感受态细胞,提取阳性克隆的质粒双酶切鉴定并进行测序。
1.2.3 融合载体的表达 将构建成功的融合载体转化大肠杆菌BL21(DE3)细胞,挑取阳性菌落至试管,37℃,220 r/min振荡培养至菌液OD值约0.6。从试管中取200 μL菌液至1.5 mL离心管进行离心(12 000 r/min,1 min),弃上清后菌体冻存于-20℃作为诱导前样品。将菌液分为两管,加入终浓度为0.2 mmol/L的IPTG,分别在37℃下诱导4 h和16℃下诱导8 h,取诱导后上清与沉淀进行SDS-PAGE电泳检测。
1.2.4 融合蛋白的纯化 PSMD7原核表达的融合蛋白上带有His标签可用HisTrap column进行纯化。每升菌体加入40 mL Buffer A充分悬浮菌体,超声破碎菌体,振幅为40%,工作6 s间歇6 s,共20 min,然后12 000 r/min离心20 min,上清用0.45 μm滤膜过滤备用。用AKTA Purifier蛋白纯化系统进行融合蛋白的纯化,具体操作如下:将HisTrap column接入系统,设定系统流速为5 mL/min,压限0.25 MPa,先用去离子水清洗柱中的乙醇,接着用Buffer A平衡柱子,然后将样品接入super loop中,每次约50 mL,紫外检测系统显示有吸收峰时便开始收集穿透液,上样结束后用8% Buffer B平衡柱子洗去与HisTrap column结合力较弱的杂蛋白,再用30% Buffer B洗脱目的蛋白并收集洗脱峰,结束后取20 μL洗脱峰蛋白进行SDS-PAGE检测融合蛋白纯度。
1.2.5 山羊抗盐藻PSMD7多克隆抗体的制备 为研究盐藻鞭毛解聚后PSMD7蛋白的表达情况,本实验制备了山羊抗盐藻PSMD7多克隆抗体。首先测定纯化后PSMD7的蛋白浓度,与CFA等体积混合,在震荡混合器上剧烈振荡混匀,用超声法短时间充分乳化抗原,功率为200 W,脉冲2 s,间歇59 s,工作5次。首次免疫时用CFA乳化抗原,加强免疫时均采用IFA乳化抗原。免疫程序如下:
波尔山羊免疫方案(图1):首次免疫:400 μg/0.5 mL+0.5 mL CFA/只;第2次免疫:200 μg/0.5 mL+0.5 mL IFA/只;第3次免疫:200 μg/0.5 mL+0.5 mL IFA /只;第4次免疫:200 μg/0.5 mL+0.5 mL IFA /只;第5次免疫:200 μg/0.5 mL+0.5 mL IFA /只。抗原经颈部皮下注射免疫,其中首次和第2次免疫间隔14 d,其余每次免疫间隔时间均为7 d。第5次免疫7 d后静脉采血检测抗血清滴度。检测前先确定最佳抗原包被浓度,方法为在第3次免疫后耳静脉采血,用间接ELISA法检测抗体滴度,正常山羊血清作为阴性对照。

图1 波尔山羊免疫方案
1.2.6 Western blot分别在IBMX诱导盐藻鞭毛解聚后30、60和90 min收集藻体,用蛋白提取试剂盒提取盐藻蛋白,根据Bradford蛋白质定量试剂盒的说明书测定蛋白浓度。将各组蛋白与5×SDS上样缓冲液按5∶1的比例混合,沸水浴10 min使蛋白完全变性,进行SDS-PAGE电泳,电压调至80 V,待溴酚蓝通过浓缩胶后,改用120 V电压继续电泳2-3 h,直至溴酚蓝刚跑出即终止电泳。用Bio-Rad半干式电转仪进行转膜,ECL发光液进行显影,将X胶片放在PVDF膜上曝光,然后进行定影,胶片用扫描仪扫描,目标条带和内参条带的净光密度值用Image J软件进行分析。
2 结果
2.1 融合载体pET28a(+)- PSMD7的构建
PCR扩增杜氏盐藻PSMD7基因片段为993 bp,与pMD19-T载体相连转化DH5α化学感受态细胞后,提取阳性克隆质粒,Nde I和Hind III双酶切后得到2 700 bp和993 bp的两个片段(图2-A),回收PSMD7目的片段与Nde I和Hind III双酶切后的pET28a(+)相连构建融合载体,转化大肠杆菌DH5α化学感受态细胞后,质粒的双酶切后结果如图2-B所示,含有预期大小的片段,测序结果显示为杜氏盐藻PSMD7序列,表明PSMD7融合载体构建成功。

图2 pET28a(+)-PSMD7融合载体的构建
2.2 融合蛋白的表达与纯化
将构建成功的融合载体转化大肠杆菌BL21(DE3),加入终浓度为0.2 mmol/L的IPTG进行融合蛋白的诱导表达,分别在37℃下诱导4 h和16℃下诱导8 h。诱导前和诱导后的上清与沉淀进行SDSPAGE电泳检测。结果如图3所示,0.2 mmol/L的IPTG在37℃和16℃都能成功诱导融合蛋白His-PSMD7的表达,分子量为36 kD,但表达量存在差异。37℃诱导4 h的His-PSMD7多以包涵体形式存在于沉淀中,而16℃诱导8 h的则多以可溶性蛋白存在于上清中,故选取16℃诱导8 h进行大量表达,为后期抗体的制备提供足够的蛋白。

图3 SDS-PAGE检测融合蛋白的表达
大量诱导融合蛋白的表达后,超声裂解细菌并离心得到大量上清蛋白,用HisTrap column对融合蛋白进行亲和纯化。首先用含20 mmol/L咪唑的Buffer A将收集的上清液打入上样环,分别用6.5%和8% Buffer B洗脱杂蛋白,最后用30% Buffer B从镍柱上洗脱目的蛋白(图4-A)。SDS-PAGE检测纯化后融合蛋白的纯度,结果显示融合蛋白His-PSMD7纯度较好(图4-B),经Image J软件灰度分析显示,纯化后融合蛋白的纯度高达为96%,满足了后期抗体制备的要求。

图4 融合蛋白His-DsPSMD7的亲和纯化
2.3 蛋白酶体亚基PSMD7在盐藻鞭毛解聚后的表达
作为19S蛋白酶体中的一个去泛素化酶亚基,PSMD7和鞭毛解聚的关系仍不清楚。本实验用IBMX诱导盐藻鞭毛的解聚,如图5所示,在IBMX处理后30,60和90 min盐藻鞭毛发生明显缩短。从鞭毛长度变化曲线(图6)中可以看出,IBMX处理盐藻30 min后,鞭毛长度由~11.0 μm缩短到~7.5 μm,缩短约30%。本研究通过IBMX诱导盐藻鞭毛的解聚来观察PSMD7表达水平的变化,结果显示PSMD7在鞭毛解聚后的mRNA表达量增高,与对照组相比差异显著(P<0.05),其中在鞭毛解聚后30 min的表达量最高(图7-A)。本实验用纯化的PSMD7蛋白制备了山羊多克隆抗体,ELISA法检测所制备抗体的滴度高达1∶256K-1∶512K,Western blots结果显示该抗体可以特异识别PSMD7,说明该抗体效价高、特异性强。从图7-B和7-C可以看出鞭毛解聚后PSMD7蛋白的表达量增加,其中鞭毛解聚后60 min表达量最高。
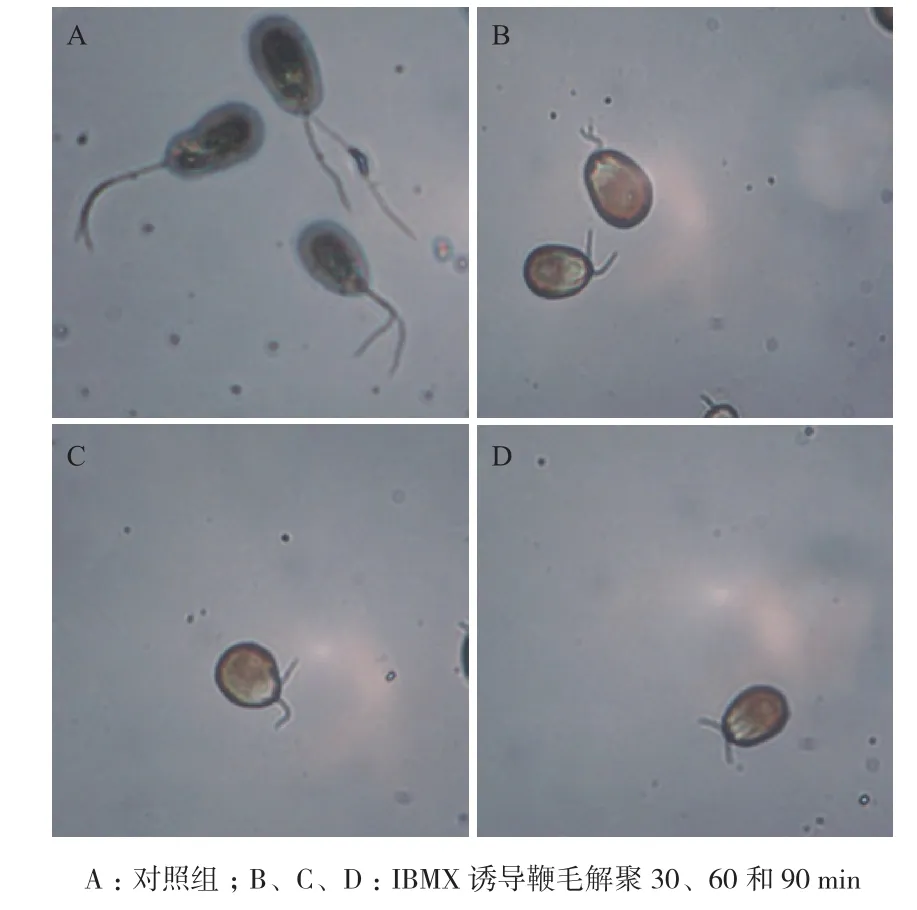
图5 IBMX诱导盐藻鞭毛的解聚

图6 盐藻鞭毛解聚曲线(n=50)
3 讨论
泛素结合体系不仅参与植物的免疫应答和非生物胁迫(干旱、低温、盐胁迫)[15-17],而且参与纤毛/鞭毛的解聚[19]。不论是衣藻和盐藻细胞上的鞭毛,还是哺乳动物细胞上的纤毛,都是通过轴丝微管的组装来进行延长,通过轴丝微管的解聚来缩短,纤毛/鞭毛的组装和解聚受细胞周期和外界信号的调节[19]。有研究表明,衣藻的鞭毛中存在着完整的泛素结合系统,包括E1、E2和E3[16]。这些系统在其他可动纤毛和初级纤毛中也都存在,如泛素、E1和E2在线虫、果蝇、小鼠和人类的纤毛蛋白质组都已被鉴定出来[5,20,21]。游离的泛素蛋白和泛素结合酶CrUbc13已在衣藻鞭毛中鉴定出来,并且当加入外源泛素和腺苷三磷酸酶的时候,在分离的鞭毛中多个蛋白被泛素化,说明鞭毛中泛素结合体系在发挥作用。此外,在交配的早期泛素结合体系的底物(α-tubulin、dynein亚基IC2、两个参与衣藻交配过程的信号蛋白、依赖环鸟苷酸的激酶和多囊肾离子通道2)泛素化增强,说明泛素化在调节鞭毛信号通路中非常活跃[18],然而有关蛋白酶体是否参与鞭毛的解聚未见报道。

图7 PSMD7在鞭毛解聚过程中的表达
鞭毛的解聚伴随着鞭毛蛋白的降解,鉴于PSMD7在19S蛋白酶体lid结构中的重要位置,我们推测PSMD7表达与鞭毛的解聚有关。杜氏盐藻PSMD7含有331个氨基酸(42-1 034 bp),与莱茵衣藻、拟南芥等其他物种的同源度较高,约为60%,说明PSMD7与26S蛋白酶体的其他亚基一样在进化上高度保守。此外,PSMD7的C末端含有大量带正电的(如赖氨酸)和带负电的(如谷氨酸)氨基酸构成的KEKE基序,这个基序在20S和19S亚基中的多个蛋白中都存在[7]。为了深入研究PSMD7的功能,本文构建了融合表达载体pET28a(+)- PSMD7,在大肠杆菌BL21(DE3)中诱导了PSMD7-His融合蛋白的表达,并用HisTrap column对融合蛋白进行了纯化并制备了多克隆抗体,为后期深入研究PSMD7蛋白的功能奠定了基础。
本实验用0.2 mmol/L IPTG成功诱导了His-PSMD7在BL21(DE3)中的表达。当在37℃下诱导时融合蛋白多为包涵体,而在16℃诱导时则表达的大部分是可溶性蛋白。载体pET28a(+)上含有6×His标签,可以用HisTrap column进行目的蛋白的亲和纯化。亲和层析柱中的填料螯合Ni2+金属离子,带His标签的融合蛋白与Ni2+相互作用被吸附在层析柱上,而杂蛋白可以被洗脱下来。高浓度的咪唑溶液可竞争性与Ni2+结合,使目的蛋白被洗脱下来,从而达到纯化的目的。本实验结果显示His-PSMD7与镍柱的结合非常强,在洗脱过程中当咪唑浓度达到80 mmol/L时,杂蛋白几乎完全被洗脱,再用300 mmol/L咪唑洗脱目的蛋白。经SDS-PAGE检测纯化后的His-PSMD7纯度较高为96%,满足后续制备多克隆抗体的实验要求。本实验利用纯化的PSMD7蛋白和免疫佐剂混合后作为抗原免疫波尔山羊,经过多次免疫后获得了高效价的山羊抗PSMD7蛋白的多克隆抗体,其滴度为1∶256K-1∶512K,同时Western blot也证实该抗体识别抗原时具有特异性,为后续检测PSMD7蛋白的表达奠定了基础。本实验结果发现鞭毛解聚后PSMD7的表达量增高,其mRNA水平在鞭毛解聚后30 min达到最大值。同时用Western blot检测了鞭毛解聚后PSMD7蛋白的表达情况,结果表明鞭毛解聚后PSMD7蛋白的表达量增高,说明PSMD7参与盐藻鞭毛的解聚。
4 结论
成功构建融合表达载体pET28a(+)-PSMD7,用0.2 mmol/L IPTG在16℃诱导8 h可使融合蛋白以可溶形式表达,用HisTrap column亲和纯化得到高纯度的目的蛋白,SDS-PAGE检测结果显示目的蛋白纯度较高,制备的抗体效价高特异性强。鞭毛解聚后PSMD7的mRNA和蛋白的表达水平增高,说明蛋白酶体亚基PSMD7参与鞭毛的解聚。
[1]Gate D, Danielpour M, Bannykh S, et al. Characterization of cancer stem cells and primary cilia in medulloblastoma[J].CNS Neurol Disord Drug Targets, 2015, 14:600-611.
[2] 赵朴, 郑玉姝, 刘兴友. 泛素-蛋白酶体在病毒感染中的作用[J]. 生物技术通报, 2007(6):48-50.
[3]Walsh CK, Sadanandom A. Ubiquitin chain topology in plant cell signaling:a new facet to an evergreen story[J]. Front Plant Sci, 2014, 5:122.
[4]D’Arcy P, Linder S. Proteasome deubiquitinases as novel targets for cancer therapy[J]. Int J Biochem Cell Biol, 2012, 44(11):1729-1738.
[5]Obin M, Lee BY, Meinke G, et al. Ubiquitylation of the transducin betagamma subunit complex. Regulation by phosducin[J]. J Biol Chem, 2002, 277(46):44566-44575.
[6]Sowa ME, Bennett EJ, Gygi SP, et al. Defining the human deubiquitinating enzyme interaction landscape[J]. Cell, 2009, 138(2):389-403.
[7]Sharon M, Taverner T, Ambroggio XI, et al. Structural organization of the 19S proteasome lid:insights from MS of intact complexes[J]. PLoS Biol, 2006, 4(8):e267.
[8]Fisch C, Dupuis-Williams P. The rebirth of the ultrastructure of cilia and flagella[J]. Biol Aujourdhui, 2011, 205(4):245-267.
[9]Marshall WF, Rosenbaum JL. Intraflagellar transport balances continuous turnover of outer doublet microtubules:implications for flagellar length control[J]. J Cell Biol, 2001, 155:405-414.
[10]Jia Y, Xue L, Li J, et al. Isolation and proteomic analysis of the halotolerant alga Dunaliella salina flagella using shotgun strategy. Mol Biol Rep, 2010, 37(2):711-716.
[11]Shi K, Li J, Han K, Jiang H, et al. The degradation of kinesin-like calmodulin binding protein of D. salina(DsKCBP)is mediated by the ubiquitin-proteasome system[J]. Mol Biol Rep, 2013, 40(4):3113-3121.
[12]石科. 蛋白酶体亚基PSMD7在纤毛/鞭毛解聚及食管癌发生发展中的作用[D]. 郑州:郑州大学, 2013.
[13]Hirono M, Uryu S, Ohara A, et al. Expression of conventional and unconventional actins in Chlamydomonas reinhardtii upon deflagellation and sexual adhesion[J]. Eukaryot Cell, 2003, 2(3):486-493.
[14]Livak K, Schmittgen T. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25:402-408.
[15]王安邦, 金志强, 刘菊华, 等. 香蕉泛素结合酶基因MaUCE2在非生物胁迫下的表达分析[J]. 生物技术通报, 2013(5):77-80.
[16]严金平, 杨华. 泛素化修饰与植物免疫应答[J]. 生物技术通报, 2011(2):18-22.
[17]王金利, 史胜青, 贾利强, 等. 植物泛素结合酶E2功能研究进展[J]. 生物技术通报, 2010(4):7-10.
[18]Huang K, Diener DR, Rosenbaum JL. The ubiquitin conjugation system is involved in the disassembly of cilia and flagella[J]. J Cell Biol, 2009, 186:601-613.
[19]Hu Z, Liang Y, Meng D, et al. Microtubule-depolymerizing kinesins in the regulation of assembly, disassembly, and length of cilia and flagella[J]. Int Rev Cell Mol Biol, 2015, 317:241-265.
[20]Inglis PN, Boroevich KA, Leroux MR. Piecing together a ciliome[J]. Trends Genet, 2006, 22(9):491-500.
[21]Lutz MS, Burk RD. Primary cilium formation requires von hippellindau gene function in renal-derived cells[J]. Cancer Res, 2006, 66(14):6903-6907.
(责任编辑 狄艳红)
Expression Analysis of Proteasome Subunit PSMD7 After Flagellar Disassembly of Dunaliella salina
SHI Ke1,2LIANG Rui-feng3YANG Liang1
(1. Henan Medical College,Zhengzhou 451191;2. Laboratory for Cell Biology of Zhengzhou University,Zhengzhou 450008;3. Henan Province Chinese Medicine Research Institute,Zhengzhou 450004)
To study the relationship between the 19S proteasome subunit PSMD7 and flagellar disassembly in Dunaliella salina,the flagellar disassembly was induced by 3-isobutyl-1-methylxanthine(IBMX)and the mRNA expression of PSMD7 was detected by real-time PCR. The high-purity PSMD7 protein of D. salina was obtained by prokaryotic expression and protein purification,followed by the preparation of goat anti-PSMD7 polyclonal antibody. The expression of PSMD7 protein after flagellar disassembly was investigated by Western blot. Results showed that the mRNA expression of PSMD7 increased after flagellar disassembly induced by IBMX and reached the highest at 30 min after disassembly. The goat anti-PSMD7 polyclonal antibody was successfully prepared. Results of Western blot showed that the protein level of PSMD7 rose after flagellar disassembly,indicating that the proteasome subunit PSMD7 was involved in flagellar disassembly of D. salina,thus this provides the basis for further study of the molecular mechanism of ubiquitin-proteasome system in flagellar disassembly.
PSMD7;proteasome;flagellar disassembly
10.13560/j.cnki.biotech.bull.1985.2017.03.014
2016-08-25
河南省高等学校重点科研项目(16A310008),河南省科技攻关计划项目(152102310161,162102310047)
石科,女,博士,研究方向:生物工程;E-mail:shikesay@163.com,梁瑞峰为共同第一作者
梁瑞峰,男,硕士,助理研究员,研究方向:中药药理;E-mail:1654917295@qq.com
