基于Ir/MnO2标记型前列腺特异性抗原免疫传感器的研制
2017-03-21白茹燕马玉洪陈志莉胡慧英毕满玲杨云慧
白茹燕,马玉洪,陈志莉,胡慧英,余 佩,毕满玲,胡 蓉,杨云慧
(云南师范大学化学化工学院,云南昆明650500)
0 引言
前列腺癌是最常见的男性恶性肿瘤之一。近年来,前列腺癌在我国的发病率呈逐年上升趋势。前列腺癌的早期诊断对指导前列腺癌穿刺、治疗方式以及疾病预后具有直接的影响。前列腺癌的早期诊断主要通过前列腺特异抗原(Prostate specific antigen,PSA)筛查。PSA是目前唯一公认的诊断前列腺癌的指标,其诊断前列腺癌的曲线下面积为0.821[1]。PSA属于类激肽释放酶,是前列腺腺泡和导管上皮细胞分泌的具有244个氨基酸残基的、相对分子质量为33000~34000的一种丝氨酸蛋白酶[2]。在正常生理条件下,它存在于前列腺组织、前列腺液、精液、血清和尿液中[3]。PSA显示出一种类糜蛋白酶的降解底物的特异催化活性,主要作用于新鲜精浆中较大分子的胶蛋白,使它们分解成几个低分子量的、可溶性的蛋白片断,这导致了精液液化,以及随之而来的活动精子的释放。大多数PSA与蛋白酶抑制剂抗糜蛋白酶结合,只有少量以游离形式存在于血清中[4],因此PSA得检测受到了广大学者的关注。
癌症生物标志物的常规免疫检测方法主要是酶联免疫吸附测定(ELISA)法[5],目前PSA的检测方法除了酶联免疫测定之外,常用的还有荧光定量检测法[6]、放射免疫测定(RIA)[7]、化学发光法[8]、电泳法[9]、质谱免疫测定[10]等。然而这些常规免疫测定法较复杂,并且耗费时间,操作繁琐,费用昂贵,不适宜病床前的检测[11]。因此,急需发展适用于现场检测的简单、快速、灵敏方法来检测PSA。电化学免疫传感器不但结合了电化学传感器和免疫传感器的双重优点,还具有能与抗原-抗体反应的特异性结合力,具有低成本、高灵敏、检测快速、操作简便等优点而被广泛应用[12]。
MnO2是一种重要的功能氧化物,具有来源丰富、价格低廉、合成容易和相对无毒等特点,在电池材料、磁性材料、催化剂和离子交换剂等方面有广泛的应用[13-14]。MnO2具有多种晶体结构和形貌特征,而纳米材料的晶型、尺寸、形貌和维数对其性能有重要的影响,因而不同晶型和形貌氧化锰纳米材料的可控合成一直是研究者关注的重点问题之一[15]。近年来,已报道的制备纳米氧化锰的方法有氧化还原沉淀法[16]、溶胶-凝胶法[17]、液相沉淀法[18]、模板法[19]、电化学沉积法[20]和低温水热法[21]等。其中水热合成法由于其独特的优点,已成为制备一维纳米材料的重要途径,成功地合成了许多具有独特形貌和优良物理、化学性质的纳米材料。
该文以KMnO4与MnCl2·4H2O为反应原料,采用水热合成法,制备了蚕茧状纳米MnO2。通过控制反应温度从而达到调控MnO2形貌的目的,未使用任何表面活性剂,避免了繁琐的后期处理过程和对环境的污染。并在所制备MnO2纳米材料上负载了贵金属Ir。采用Ir/MnO2标记PSA抗体(Ab2),并在电极上修饰Ag/COF-LZU1固定了PSA抗体(Ab1),制备了Ir/MnO2夹心型PSA免疫传感器。由于本文所合成的MnO2是具有较大的比表面积的疏松多孔物质,对抗体具有较好的吸附性能,可增强电化学信号,提高检测PSA的灵敏度。该传感器可用于真实样品的检测。
1 实验部分
1.1 试剂和仪器
IrCl3、AgNO3购于昆明铂锐金属材料有限公司;高锰酸钾购于沈阳市化学试剂厂;硫酸锰购于麦克林公司,浓硫酸购于四川西陇化工股份有限公司;硼氢化钠购于天津市科密欧化学试剂有限公司;无水乙醇购于天津市风船化学试剂科技有限公司;前列腺特异性抗原的抗体(anti-PAS)、前列腺特异性抗原(PSA)购于上海领潮生物科技有限公司;30%过氧化氢 (30%H2O2)、四氢呋喃(THF)、N,N-二甲基甲酰胺(DMF)均购于西陇化工股份有限公司;牛血清蛋白 (BSA)、壳聚糖(CHIT)和磷酸缓冲溶液(PBS,pH7.40)均购于美国Sigma公司;冰醋酸购于成都化学试剂厂;1,4-对苯二胺 (1,4-diaminobenzene)、1,4-二氧六环(1,4-dioxane)购于阿拉丁试剂;1,3,5-均三苯甲醛(1,3,5-triformylbenzene)购于百灵威科技有限公司。实验中所用试剂均为分析纯(A.R.),所用水为二次蒸馏水。
计时电流(i-t)、电化学交流阻抗(ELS)是在CHI 660D电化学工作站 (中国上海辰华仪器公司)测量;实验中使用三电极体系,饱和甘汞电极(SCE)为参比电极,修饰的玻碳电极(GCE)为工作电极,铂电极为辅助电极;JEM2100透射电镜(日本电子株式会社);TGL16离心机 (长沙湘智离心机仪器有限公司);CS501超级恒温器(重庆实验设备厂);液氮罐(成都金凤液氮容器有限公司);ST2200HP超声波清洗器 (上海科导超声仪器有限公司);DZF-6020型真空干燥箱(上海博迅实业有限公司)。
1.2 材料的制备
1.2.1 MnO2纳米材料的制备
参照文献[22]合成MnO2纳米颗粒。将0.2535 g的一水合硫酸锰(MnSO4·H2O)充分溶解于300 mL水中。在搅拌的条件下,加入25 μL浓硫酸。接着用分液漏斗加入含有0.1580 g高锰酸钾(KMnO4)的200 mL水溶液,滴加速度约为1~2滴/s,然后在室温下搅拌反应一段时间。将得到的产品离心分离,用水和乙醇洗涤3次,最后将洗涤后得到的产品在60℃的烘箱中干燥12 h,即制得实验所用MnO2纳米颗粒。
1.2.2 Ir/MnO2纳米颗粒的制备
参照文献[23]还原Ir的方法合成Ir/MnO2,将10 mg MnO2分散到装有20 mL 1∶1乙醇-水溶液的圆底烧瓶中,超声处理半小时后,加入4 mL 1%H2IrCl4溶液,再逐滴加入3 mL 0.1 mol/L NaBH4溶液,均匀搅拌过夜,将所得产物离心分离,并用无水乙醇和去离子水反复洗涤三到五次。60℃干燥4 h,即可制得Ir/MnO2纳米材料。
1.2.3 Ir/MnO2标记的PSA抗体的制备
取上面所制得的Ir/MnO2纳米材料5 mg,超声溶解在4 mL灭菌水中,取所得溶液1mL用200 mmol/L Na2CO3溶液调节pH至9后,加入10.0 μL 1 mg/mL的 PSA 抗体,每次加入 2.0 μL,分五次加完,每次间隔3 min。然后将上述溶液在室温下振摇反应2 h后,加入10%的BSA溶液25 μL,继续振摇反应30 min以封闭剩余的非特异性活性位点。将所得溶液以5000 r/min的转速低温离心5 min,用PBS溶液洗涤2次,分散在1 mL eluent buffer溶液中于4℃保存备用。
1.2.4 COF-LZU1材料的制备
参照文献[24]合成共价有机框架材料COFLZUl。 准确称取 1,4-苯二胺 (0.16 g,15 mmol),1,3,5-均三苯甲醛(0.16 g,10 mmol)于反应试管中,加入1.5 mL 1,4-二氧六环将其溶解混匀,然后缓慢滴加3 mol/L的醋酸0.5 mL,随即有黄色固体产生。将真空线接到反应试管上抽真空,赶尽气泡,封管。用液氮冷冻反应管,然后使其自然回升至室温,连续三次冻融,然后将反应管转移到120℃的油浴中反应3 d,停止加热。将系统冷却至室温,打开反应管,加入THF溶解,离心,依次用DMF、THF分别洗涤所得物质三次,然后在60℃下真空干燥12h,得淡黄色固体,即为COF-LZU1。
1.2.5 Ag/COF-LZU1材料修饰的玻碳电极的制备
用金相砂纸将玻碳电极(Φ=3mm)打磨干净,将电极表面在麂皮上用不同粒径大小的Al2O3粉末抛光,再分别用硝酸水溶液(1∶1)、无水乙醇、蒸馏水各超声洗涤电极5 min。将5 mg COF-LZU1溶解在4 mL DMF溶剂中,超声使其充分溶解,取10 μL溶解的COF-LZU1溶液与10 μL壳聚糖溶液1∶1混合均匀,然后取10 μL混合液滴加到经处理过的电极表面,自然晾干。接着通过循环伏安法将硝酸银溶液(0.1 mol/L)中的银离子电还原到修饰了COF材料的电极表面 (扫描电压为-2到1.8,扫描速度为50 mV/s),用PBS溶液冲洗三次,自然晾干,即可以制得Ag/COF-LZU1材料修饰的玻碳电极。
1.2.6 免疫传感器的制备
在Ag/COF-LZU1材料修饰的玻碳电极表面滴加30 μg/mL PSA抗体10.0 μL, 之后于4℃过夜,第二天,将已修饰好的电极用PBS溶液冲洗三次,自然晾干,滴加10.0 μL的1%BSA溶液,在温度为37℃
恒温箱中封闭1 h。用PBS溶液冲洗封闭完成后的电极三次,自然晾干后便可用于实验中PSA的测定。PSA免疫传感器的制备流程图如图1所示。

图1 免疫传感器制备流程Fig.1 Stepwise procedure of the immunosensor
1.2.7 检测方法
将不同浓度的PSA抗原滴加在上述修饰好的免疫传感器上,在37℃恒温箱中培育,之后用PBS冲洗并自然晾干。然后滴加10.0 μL Ir/MnO2纳米材料标记的PSA抗体,置于恒温箱中培育后用PBS冲洗,自然晾干,用该传感器做工作电极,连接好电化学工作站。在支持电解质(PBS)中加入100 μL 3%的H2O2在-0.2 V下进行计时电流的测定,根据该传感器计时响应达到稳定时的电流值与PSA浓度成正比的关系,实现对PSA的定量测定。每次测定完后用4 mol/L的尿素洗脱30 min,洗脱之后用PBS溶液冲洗干净,使电极能够再次利用。
2 结果与讨论
2.1 材料的表征
2.1.1COF-LZU1材料的XRD表征
为了考察所合成的材料是否与文献报道一致[24],对合成的COF-LZU1材料进行了X射线粉末衍射表征。如图2所示,通过PXRD表征,可以知道该文所合成的COFs材料与文献报道一致,在2θ 4.7°处出现了明显的特征峰,说明COFLZU1形成了有序的多孔结构。

图2 COF材料的XRD图.(a):标准[24];(b):该文合成Fig.2 XRD patterns of COF(a):standard;(b):synthesis
2.1.2 COFs材料的微观形貌表征
为了确定COF材料的微观形貌,取少量COF-LZUl声分散在无水乙醇中,用高倍透射电镜观察了其微观形貌特征,如图3所示。图3为COF-LZUl的透射电镜图,从图中可以看出COFLZU1为层层堆叠的多孔材料。

图3 COF-LZUl的TEM图Fig.3 TEM images of COF-LZU1
2.1.3 Ag/COFs材料的微观形貌
为了验证是否将Ag成功地还原到COFs材料的表面,采用高倍扫描电镜观察通过电还原的方法还原了Ag的COFs材料修饰的电极表面。为了进一步确定Ag是否被还原在COFs上,还对其进行了能谱表征。结果如图4所示。图4a、为放大20000倍的Ag/COFs材料的扫描电镜图,b为Ag/COF材料的能谱图。从图4a中可以看到Ag被均匀的还原到COFs材料的表面,图4b进一步确定了Ag被成功的修饰到了COFs材料的表面。
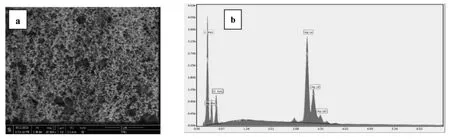
图4 Ag/COF-LZUl的 SEM 图(a)和能谱图(b)Fig.4 SEM images(a)and EDS(b)of Ag/COF-LZUl
2.1.4 MnO2纳米材料的微观形貌
采用高倍扫描电镜和透射电镜观察所合成的MnO2材料的微观形貌,结果如图5所示。图5中a为放大120000倍的MnO2的扫描电镜图,图5c为120000倍下的MnO2的透射电镜图,从图中可以看出MnO2纳米材料的形貌为均匀的蚕茧状,尺寸大约在100 nm~500 nm之间,而且呈现出巨大的比表面积,有利于抗体的固定,所以用它在作为标记材料能增强电化学信号。

图5 MnO2纳米材料的扫描电镜图(a)和透射电镜图(b)Fig.5 The SEM illustration(a)and TEM illustration(b)of MnO2
2.1.5 Ir/MnO2纳米材料的透射电镜图
为了验证是否成功的将金属Ir还原到MnO2材料上,将Ir/MnO2材料通过超声溶解在乙醇溶液中,并通过高倍透射电镜观察了Ir/MnO2的形貌。其结果如图6所示,从图中可以看出Ir被均匀的还原到了MnO2纳米材料中。

图6 Ir/MnO2纳米材料的透射电镜图Fig.6 The TEM illustration of Ir/MnO2
2.2 氧化还原峰电流与扫描速度的关系
为了进一步了解PSA/Ir/MnO2labeled anti-PSA/Ag/COF-LZU1/CHIT/GCE免疫传感器的电化学行为,实验还考察了扫描速度对PSA/Ir/MnO2labeled anti-PSA/Ag/COF-LZU1/CHIT/GCE免疫传感器的峰电流的影响,当扫描速度在10~100 mV/s范围内变化时,传感器在含有0.01 mol/L H2O2的 PBS(0.01 mol/L,pH7.4)底液中的循环伏安行为,如图7所示。由内置图可看出,阴极峰电流和阳极极峰与扫描速度的平方根成正比。说明此电流受扩散控制。
2.3 MnO2和Ir/MnO2的催化性能比较
为了研究MnO2和Ir/MnO2对H2O2的催化性能,将MnO2和Ir/MnO2用壳聚糖修饰在电极上,采用计时电流法测定其对H2O2还原电流的催化作用,结果如图8所示,其中a为修饰了MnO2的电极对H2O2的催化电流;b是修饰了 Ir/MnO2电极对H2O2的催化电流;由图可看出Ir/MnO2材料比MnO2材料对H2O2的催化电流更大,说明Ir与MnO2对H2O2的还原具有协同催化作用。
2.4 不同修饰电极界面的交流阻抗行为
交流阻抗常用于考察传感器在制备过程中各界面在5 mmol/L K3Fe(CN)6/K4Fe(CN)6溶液中的变化。图9为不同修饰电极在5 mmol/L K3Fe(CN)6/K4Fe(CN)6溶液中的交流阻抗图。曲线a为裸玻碳电极的阻抗图,近似一条直线,说明电子传递几乎没有阻碍;曲线b为COFs/CHIT/GCE的交流阻抗图,因覆盖了COFs和壳聚糖阻碍电子传递,阻抗增加(Ret=680 Ω)。 c 为 Ag-COFs/CHIT/GCE交流阻抗曲线,因负载了金属Ag后导电能力增强,阻抗值小于曲线b(Ret=500 Ω)。d为anti-PSA/Ag-COFs/CHIT/GCE交流阻抗曲线,其阻抗值比曲线c大(Ret=800 Ω),这是由于不导电的抗体阻碍了电子在电极表面的传递,说明抗体已固定在电极表面上。曲线e为PSA/anti-PSA/Ag-COFs/CHIT/GCE交流阻抗曲线,与d曲线相比,半圆直径显著增大(Ret=1350 Ω),这是由于抗体和抗原的特异性结合阻碍了电子的传递;曲线f为Ir/MnO2labeled-anti-PSA/PSA/anti-PSA/Ag-COFs/CHIT/GCE交流阻抗曲线,阻抗值进一步增大(Ret=1700 Ω),这是因为免疫复合物对电子的阻碍作用增强。

图7 扫描速度对电极响应电流的影响(内置图为峰电流对扫描速率平方根的线性图)Fig.7 Cyclic voltammograms of the immunosensor at various scan ratesFrom inner to outer curve(a:20 mV/s;b:40 mV/s;c:60 mV/s;d:80 mV/s;e:100 mV/s;)(Inset shows the plot of current vs v1/2)

图8 不同修饰电极对H2O2还原电流的催化效应(a:Ir/MnO2/GCE;b:MnO2/GCE;c:GCE)Fig.8 The catalytic effect of different modified electrode to the reduction current of H2O2(a.Ir/MnO2/GCE;b.MnO2/GCE;c.GCE)

图9 不同修饰电极界面的交流阻抗行为Fig.9 Electrochemical impedance spectroscopy(EIS)by using different modified electrodes(a:bare GCE;b:COFs/CHIT/GCE;c:Ag/COFs/CHIT/GCE;d:anti-PSA/Ag/COFs/CHIT/GCE;e:PSA/anti-PSA/Ag/COFs/CHIT/GCEf:Ir/MnO2 labeled-anti-PSA/PSA/anti-PSA/Ag/COFs/CHIT/GCE)
2.5 实验条件的优化
2.5.1 固定抗体浓度对传感器峰电流的影响
固定抗体浓度是影响免疫传感器灵敏度和检测范围的重要因素。实验对固定抗体浓度进行了优化,同一条件下,固定PSA抗原的浓度为20 ng/mL,通过改变电极上固定抗体浓度(10 μg/mL、20 μg/mL、30 μg/mL、40 μg/mL、50 μg/mL), 考察了不同固定抗体浓度对传感器响应电流的影响,结果如图10所示,随着固定抗体浓度的增大,传感器的响应电流逐渐增大,当抗体浓度达到30 μg/mL时响应电流最大,继续增大浓度时响应电流有所减小。因此选择30 μg/mL作为最佳固定抗体浓度。

图10 固定抗体浓度对免疫传感器响应电流的影响Fig.10 Effects of the concentration of anti-PSA on the response current of PSA immunosensor
2.5.2 抗原培育时间对免疫传感器响应电流的影响
抗原培育时间对免疫传感器响应电流也有一定的影响,在最佳固定抗体浓度下,采用不同时间(10 min、20 min、30 min、40 min、50 min)培育20 ng/mL的PSA抗原测定传感器的响应电流值。结果如图11所示。从图中可以看出响应电流随培育时间增大,30 min时达到最大。30 min以后响应电流下降。因此选择30 min作为最佳抗原培育时间。

图11 抗原培育时间对免疫传感器响应电流的影响Fig.11 Effects of incubation time of PSA on the response current of PSA immunosensor
2.5.3 标记抗体培育时间对免疫传感器响应电流的影响
标记抗体培育时间也是影响免疫传感器的重要因素之一,在以上所选的最佳条件下,将修饰有20 ng/mL的免疫传感器在37℃的条件下采用不同时间 (15 min、30 min、45 min、60 min、75 min)培育标记抗体。结果如图12所示。由图可看出,从15 min到40 min,传感器响应电流的值随着培育时间的增加逐渐增大,随后电流值趋于平稳。说明此时PSA抗原和Ir/MnO2NPs标记的PSA抗体结合形成了稳定的复合物。因此,该实验中选择最佳标记抗体的培育时间为40 min。

图12 标记抗体培育时间对免疫传感器响应电流的影响Fig.12 Effects of incubation time of labeled anti-PSA on the response current of PSA immunosensor
2.6 免疫传感器的校正曲线
在最佳实验条件下,获得了传感器对不同浓度的PSA响应曲线,从图13可以看出,Ir/MnO2labeled-anti-PSA/PSA/anti-PSA/Ag/COFs/CHIT/GCE免疫传感器的响应电流随PSA浓度的增加而增加,电流在0.01 ng/mL~150 ng/mL范围内具有良好的线性关系,其线性方程为I(μA)=0.06029 c(ng/mL)+0.23217,线性相关系数为0.9980,检测下限为3 pg/mL。所以该文研制的PSA免疫传感器线性范围宽,相关系数良好,灵敏度较高。
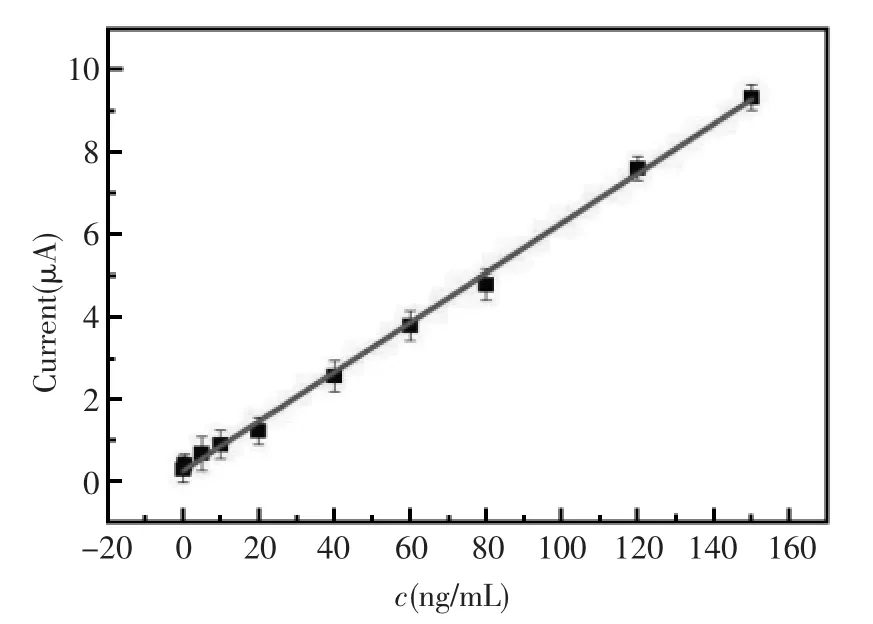
图13 免疫传感器的校正曲线Fig.13 Calibration curve for the PSA immunosensor
2.7 免疫传感器的选择性
为了考察所制备的免疫传感器对PSA的选择性,选择了4种干扰物:1%牛血清蛋白(BSA)、200 ng/mL谷氨酸 (Glu)、200 ng/mL人绒毛促性腺激素(HCG)、200 ng/mL 癌胚抗原(CEA)与 40 ng/mL的PSA抗原按体积比1∶1混合在相同条件下测定。结果见表1,结果显示当BSA、谷氨酸、人绒毛促性腺激素(HCG)和癌胚抗原(CEA)的浓度远大于PSA的浓度时,对PSA响应电流的影响较小。说明BSA(1%)、谷氨酸、人绒毛促性腺激素(HCG)和癌胚抗原(CEA)对PSA的检测基本不造成干扰,传感器对PSA具有较高的选择性。

表1 电化学免疫传感器的选择性Tab.1 Selective of the CRP electrochemical immunosensors
2.8 回收率的测定
在生物样品的实际测定中总会存在许多的干扰物质,因此在最佳实验条件下,研究了干扰物质的存在对PSA测定的影响,该实验采用标准加入法,在稀释的血清中加入3种不同浓度的PSA抗原,在最佳实验条件下,进行PSA回收率的测定,三次检测平均回收率为97.41%(如表2所示),结果令人满意,说明该传感器对检测PSA有一定的可行性。

表2 PSA回收率的测定Tab.2 Recovery of the immunosensor
2.9 传感器的稳定性
为了考察免疫传感器的稳定性,将所研制的免疫传感器检测一次后置于冰箱中4℃保存,分别过7 d、14 d、28 d后再次培育相同浓度的PSA抗原进行检测,结果如图14所示。图中I/I0为放置一定天数后测得的电流I与初始电流I0的比值。由图可见,该传感器的稳定性良好。

图14 PSA电化学免疫传感器的稳定性Fig.14 The stability of PSA electrochemical immunosensors(a:0day;b:7days;c:14days;d:28days)
3 结论
该实验研制了一种新型的以Ag/COF-LZU1复合材料为固定基质,Ir/MnO2为标记材料的夹心型PSA免疫传感器,并用于测定血清样品中的PSA。基于Ag/COF-LZU1材料良好的导电性和Ir/MnO2纳米材料的多孔尺寸效应、表面效应、小尺寸效应等特点对PSA抗体有较好的生物相容性,从而增强了响应信号,提高了免疫传感器的灵敏度,与传统的PSA抗原检测方法相比较,其灵敏度提高了许多,检测下限也可达到3 pg/mL,扩宽了线性范围,提高了选择性。
[1]Lojanapiwat B,Anutrakulchai W,Chongruksut W,et al.Correlation and diagnostic performance of the prostatespecific antigen level with the diagnosis,aggressiveness,and bone metastasis of prostate cancer in clinical practice[J].Prostate international,2014,2(3):133-139.
[2]年新文,任善成,许传亮,等.前列腺癌早期诊断标志物的研究进展[J].临床泌尿外科杂志,2016,9:852-856.
[3]石玮,董莉,包军胜.前列腺癌相关分子研究进展[J].中华男科学杂志,2015,21(4):357-362.
[4]Tasian G E,Cooperberg M R,Cowan J E,et al.Prostate specific antigen screening for prostate cancer:Knowledge of,attitudes towards,and utilization among primary care physicians[C].Urologic Oncology:Seminars and Original Investigations.Elsevier,2012,30(2):155-160.
[5]Link A J,Eng J,Schieltz D M,et al.Direct analysis of protein complexes using mass spectrometry[J].Nature biotechnology,1999,17(7):676-682.
[6]李娅,苏明权,岳乔红,等.前列腺癌特异DD3基因实时荧光定量PCR检测方法建立及初步应用[J].第四军医大学学报,2009,30(17):1623-1626.
[7]Maury C P,Teppo A M.Raised serum levels of cachectin/tumor necrosis factor alpha in renal allograft rejection[J].The Journal of experimental medicine,1987,166(4):1132-1137.
[8]Jones S,Zhang X,Parsons D W,et al.Core signaling pathways in human pancreatic cancers revealed by global genomic analyses[J].science,2008,321(5897):1801-1806.
[9]Schmalzing D,Koutny L B,Taylor T A,et al.Immunoassay for thyroxine (T4)in serum using capillary electrophoresis and micromachined devices[J].Journal of Chromatography B:Biomedical Sciences and Applications,1997,697(1):175-180.
[10]Schwartz B S,Hu H.Adult lead exposure:time for change[J].Environmental health perspectives,2007,115(3):451-454.
[11]Akter T,Kim W S.Reversibly stretchable transparent conductive coatings of spray-deposited silver nanowires[J].ACS applied materials&interfaces,2012,4(4):1855-1859.
[12]Kavosi B,Salimi A,Hallaj R,et al.Ultrasensitive electrochemical immunosensor for PSA biomarker detection in prostate cancer cells using gold nanoparticles/PAMAM dendrimer loaded with enzyme linked aptamer as integrated triple signal amplification strategy[J].Biosensors and Bioelectronics,2015,74:915-923.
[13]Xia Y,Yang P,Sun Y,et al.One-dimensional nanostructures:synthesis,characterization,and applications[J].Advanced materials,2003,15(5):353-389.
[14]Liu Z,Ooi K.Preparation and alkali-metal ion extraction/insertion reactions with nanofibrous manganese oxide having 2×4 tunnel structure[J].Chemistry of materials,2003,15(19):3696-3703.
[15]雷晓玲,代海,冯开忠,等.MnO2纳米材料的可控制备和催化性能研究[J].功能材料,2013,44(13):1940-1942.
[16]Chen L,Song Z,Liu G,et al.Synthesis and electrochemical performance of polyaniline-MnO2nanowire composites for supercapacitors[J].Journal of Physics and Chemistry of Solids,2013,74(2):360-365.
[17]Reddy R N,Reddy R G.Sol-gel MnO2as an electrode material for electrochemical capacitors[J].Journal of Power Sources,2003,124(1):330-337.
[18]Subramanian V,Zhu H,Wei B.Alcohol-assisted room temperature synthesis of different nanostructured manganese oxides and their pseudocapacitance properties in neutral electrolyte[J].Chemical Physics Letters,2008,453(4):242-249.
[19]Sugantha M,Ramakrishnan P A,Hermann A M,et al.Nanostructured MnO2for li batteries[J].International Journal of Hydrogen Energy,2003,28(6):597-600.
[20]Hu C C,Tsou T W.Capacitive and textural characteristics of hydrous manganese oxide prepared by anodic deposition[J].Electrochimica Acta,2002,47(21):3523-3532.
[21]Hu C C,Wu Y T,Chang K H.Low-temperature hydrothermal synthesis of Mn3O4and MnOOH single crystals:determinant influence of oxidants[J].Chemistry of Materials,2008,20(9):2890-2894.
[22]Liu R,Zhou H,Liu J,et al.Preparation of Pd/MnO2-reduced graphene oxide nanocomposite for methanol electro-oxidation in alkaline media[J].Electrochemistry Communications,2013,26(1):63-66.
[23]Chang S H,Yeh M,Rick J,et al.Bimetallic catalyst of PtIr nanoparticles with high electrocatalytic ability for hydrogen peroxide oxidation[J].Sensor and Actuators B:Chemical,2014,190(1):55-60.
[24]Ding S Y,Gao J,Wang Q,et al.Construction of covalent organic framework for catalysis:Pd/COF-LZU1 in Suzuki-Miyaura coupling reaction[J].Journal of American Chemical Society,2011,133(49):19816-19822.
