深圳近海表层浮游细菌分布特征及其环境影响因素
2017-03-09李建洋谢宁栋王雅琼冷科明陈子熙汪光义
李建洋,赵 月,谢宁栋,王雅琼,冷科明,陈子熙,汪光义,*
1 天津大学环境学院, 天津 300072 2 国家海洋局第三海洋研究所, 厦门 361005 3 深圳市海洋与渔业环境监测站, 深圳 518067 4 天津大学化工学院, 天津 300072
近岸海域连接着陆地水域(包括河流、河口等)和大洋,是全球碳循环和存储的重要场所[1]。相比于大洋水体,近岸海水接受了大量的陆源营养输入,并且更易受到人类活动的干扰,往往具有更高的初级和次级生产[2]。而浮游细菌作为近海生态系统中主要的分解者和生产者,在海洋营养循环过程中扮演着重要的角色,对于海域生态环境具有显著的调节作用,其丰度的高低直接影响着生态系统的物质转化和能量流动[3]。同时,浮游细菌的丰度也受到诸多环境因素的影响。作为反映水体质量的一项重要指标,浮游细菌的丰度在研究水体污染、富营养化等方面起到重要作用[4]。因此,浮游细菌的丰度是近海生态系统的一项关键参数,研究其时空分布特征以及与环境因子的关系,有助于了解海域生态环境状况,同时促进人们对浮游细菌生态功能的理解。
流式细胞检测技术(flow cytometry, FCM)以效率高、稳定性好等优点,已被广泛应用于海洋微生物的研究,包括浮游细菌丰度的测定[5- 8]。根据核酸含量不同,流式细胞仪还可以将经核酸染料染色后的浮游细菌分为两个亚群,即高核酸含量(HNA)亚群和低核酸含量(LNA)亚群[9- 12]。研究表明,HNA亚群和LNA亚群在生长速率和细胞活性方面可能存在一定差异[12]。一些研究表明HNA亚群的生长速率高于LNA亚群[13],但LNA亚群因其特殊的膜结构和蛋白代谢抗性机制而对某些胁迫环境有着更强的适应力[14- 15]。迄今对于这两个亚群在天然水生环境中分布规律和生态功能的研究不多。Li等[13]比较了HNA亚群与LNA亚群在北大西洋和地中海东部海域的分布特点,并分析了它们与环境的关系,发现HNA亚群细菌丰度与环境中叶绿素的含量相关性显著,而LNA亚群并没有类似的现象,表明两者对海洋营养循环的贡献是有差异的。Liu等[16]在海河的研究结果则支持HNA亚群与LNA亚群在淡水生态系统中也扮演着不同的生态角色。也许这两类细菌在不同的水域和环境条件下会表现出不同的分布特征和生态功能。目前,还没有见到在中国近岸海域开展类似调查研究的报道。
深圳市濒临南海,海岸线长229.96 km,其近岸海域被九龙半岛分隔为东西两部分,其中西部海域包括珠江口和深圳湾,东部海域包括大鹏湾和大亚湾,为研究浮游细菌(包括HNA亚群和LNA亚群)在近海生态系统中的分布和功能提供了良好的环境。近年来,深圳市近岸海域尤其是深圳湾和珠江口海域的水体污染问题一直没能得到控制和解决[17]。先后有学者对深圳湾和大鹏湾的浮游细菌丰度进行过研究,结果表明两个海域水体质量差,富营养化严重[17- 18]。然而,深圳市近岸各海域污染程度不同,环境因子空间差异显著[19],目前对深圳市近岸海域浮游细菌的整体时空分布格局以及主要环境影响因素尚不清楚。特别是HNA亚群和LNA亚群在深圳近海的分布特点和生态功能差异,更是从未被人研究。
本研究使用流式细胞计数方法测定了深圳近海总浮游细菌及HNA、LNA两个亚群的丰度,并通过方差分析方法探讨其时空分布特点,再结合皮尔森相关性分析阐释浮游细菌丰度与各环境因子之间的关系,进而了解浮游细菌在近海生态系统营养循环过程中的作用机理和功能特点,为合理开发、利用以及保护海洋资源提供科学依据。
1 材料与方法
1.1 采样
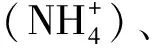
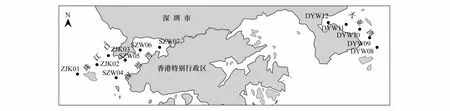
图1 深圳市近岸海域采样点分布图Fig.1 The distribution of sample sites in Shenzhen coastal waters
1.2 环境参数的测定
盐度、酸碱度、溶解氧和温度用多参数水质测定仪在采样现场测定;铵盐、硝酸盐、亚硝酸盐、磷酸盐、总氮、总磷和化学需氧量的测定参照《海洋调查规范·第4部分:海水化学要素调查(GB/T 12763.4—2007)》进行;Chl-a含量的测定参照《海洋监测规范·第7部分:近海污染生态调查和生物监测(GB 17378.7—2007)》进行。
1.3 浮游细菌丰度的测定
使用流式细胞计数方法测定水样中的总浮游细菌丰度和HNA、LNA亚群丰度[11]。将购买的SYBR Green I(InvitrogenTM) 荧光染料用无颗粒的TE缓冲液(经0.22 μm微孔滤膜过滤除菌)稀释500倍,作为浮游细菌染色的工作液。配制适宜浓度的约1 μm粒径的荧光微球悬液(InvitrogenTM),作为流式细胞检测和计数的内参。将冻存的水样融化,涡旋混匀后取50 μL至流式进样管中,加入450 μL无颗粒的TE缓冲液将水样稀释10倍,再加12.5 μL SYBR Green I 工作液,涡旋混匀后在室温下避光染色10 min。然后加入10 μL涡旋混匀的荧光微球悬液,短暂涡旋后在流式细胞仪中进样分析。本实验所使用流式细胞仪为FACS CaliburTMflow cytometer(BD-Biosciences)。该仪器配有氩离子激光器,激发光波长为488 nm,功率为15 mW。
1.4 数据分析
使用Canoco 5.0软件对不同时空条件下的环境参数进行主成分分析,阐明海域环境特征;使用R软件对浮游细菌丰度(包括总浮游细菌丰度、HNA亚群丰度、LNA亚群丰度)进行双因素方差分析,比较浮游细菌丰度时空分布差异的显著性;使用IBM SPSS Statistics 19.0软件计算浮游细菌丰度(包括总浮游细菌丰度、HNA亚群丰度、LNA亚群丰度)与各项环境参数之间的皮尔森相关性,揭示环境对浮游细菌分布的影响,进而推测HNA亚群和LNA亚群在近岸海域营养循环过程中的功能特点。
2 结果与分析
2.1 深圳近岸表层海域环境参数特征
在本次调查中,海域水温变化范围为19.92—31.74℃,平均水温为25.80℃,3月平均水温最低(21.85℃),8月最高(28.50℃)。珠江口、深圳湾和大亚湾海域的平均盐度分别为13.36‰、18.99‰和32.90‰。Chl-a含量在8月和10月明显高于3月和5月。除了温度、溶解氧和Chl-a含量外,其他环境参数在三个海域之间的差异显著(表1)。珠江口和深圳湾海域的COD、磷酸盐、亚硝酸盐、硝酸盐和铵盐含量显著高于大亚湾海域(P< 0.01)(表1)。红树林地区(SZW07)的COD、磷酸盐、氨氮以及Chl-a含量均明显高于其他站位。
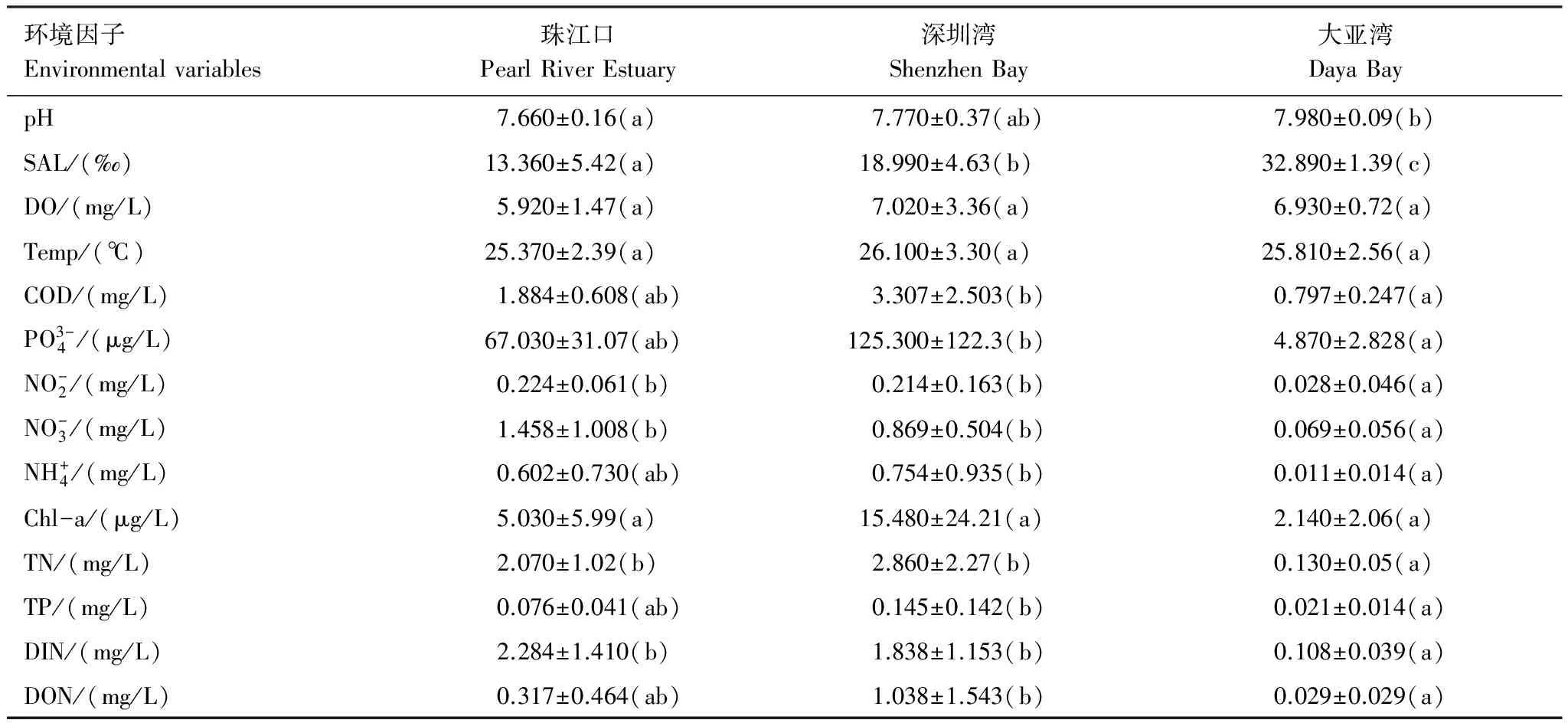
表1 深圳市近岸海域(珠江口、深圳湾和大亚湾)各环境参数平均值
Sal:盐度,Salt;DO:溶解氧,Dissolved Oxygen;Temp:水温,Temperature;Chl-a:叶绿素a ,Chlorophyll a;TN:总氮,Total Nitrogen;TP:总磷,Total Phosphorus;DIN:溶解性无机氮,Dissolved Inorganic Nitrogen;DON:溶解性有机氮,Dissolved Organic Nitrogen;括号内标注同一字母或有相同字母(例如ab和a或者ab和b)的两组平均值差异不显著(P> 0.05),标注相邻字母(例如a和b或者b和c)表示两组平均值差异显著(P< 0.05),标注相隔字母(例如a和c)表示两组平均值差异极显著(P< 0.01)
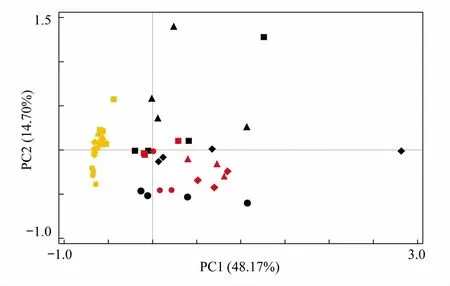
图2 深圳市近岸海域(珠江口、深圳湾和大亚湾)环境参数主成分分析(PCA)Fig.2 Principal Component analysis of environmental parameters in the Shenzhen coastal waters (Pearl River Estuary, Shenzhen Bay and Daya Bay)红色代表珠江口海域站位;黑色代表深圳湾海域站位;黄色代表大亚湾海域站位;“●”代表3月;“◆”代表5月;“▲”代表8月;“■”代表10月
对4个月份所有站位的环境参数(盐度、酸碱度、溶解氧、温度、铵盐、硝酸盐、亚硝酸盐、磷酸盐、总氮、总磷、化学需氧量和叶绿素a)进行主成分分析(Principal Component Analysis,PCA),发现珠江口、深圳湾和大亚湾各自表现出独特而鲜明的环境变化特点(图2)。如图2,深圳湾海域不同月份和站位的样品点分布最为分散,其次是珠江口海域,大亚湾海域样品点分布最集中。由此可见,深圳湾海域环境参数的时空变化差异最大,环境梯度特别明显;其次是珠江口海域;而大亚湾海域环境参数的时空变化差异最小,尤其是在5月和8月几乎没有空间差异。
2.2 深圳近岸海域总浮游细菌丰度的时空分布
深圳市近岸海域表层水体浮游细菌丰度的变化范围为1.41 × 106—1.75 × 107个/mL,最高值出现在深圳湾海域,最低值出现在大亚湾海域。深圳湾、珠江口和大亚湾海域浮游细菌平均丰度依次降低,分别为7.67 × 106个/mL、3.82 × 106个/mL和3.38 × 106个/mL。8月浮游细菌平均丰度最高(5.80 × 106个/mL),3月最低(2.98 × 106个/mL)。
深圳市近岸海域浮游细菌时空分布如图3所示。在珠江口海域,ZJK01站位4个月份浮游细菌丰度差异小,然而ZJK03站位4个月份之间浮游细菌丰度差异大,其中8月浮游细菌丰度是3月的2倍。在深圳湾海域,10月浮游细菌丰度从湾外到湾内递增,而其他月份各站位浮游细菌丰度均在SZW04最低在湾内差异不大,8月和10月浮游细菌丰度显著高于3月和5月(P< 0.05)。在大亚湾海域,浮游细菌丰度随时间和空间变化幅度较小。
对比3个海域,同一采样时间内深圳湾海域浮游细菌丰度均高于珠江口和大亚湾海域,珠江口海域除了5月外其他月份均高于大亚湾海域(图4)。
2.3 深圳近岸海域HNA和LNA亚群丰度的时空分布
依据SSC侧向散射角信号和FL1荧光信号观察浮游细菌聚类情况。各海域样品中浮游细菌均被发现有类似分类现象即HNA和LNA细菌亚群明显分开(图5)。
HNA亚群时空分布如图6所示。HNA亚群丰度变化范围为5.20 × 105—8.31 × 106个/mL,平均值为2.89 × 106个/mL。最高值出现在10月SZW06站位,最低值出现在3月DYW11站位。深圳湾海域HNA丰度显著高于珠江口和大亚湾海域(P< 0.01),在珠江口和深圳湾海域8月和10月的HNA丰度均高于3月和5月,而在大亚湾海域5月和8月的HNA丰度高于3月和10月。
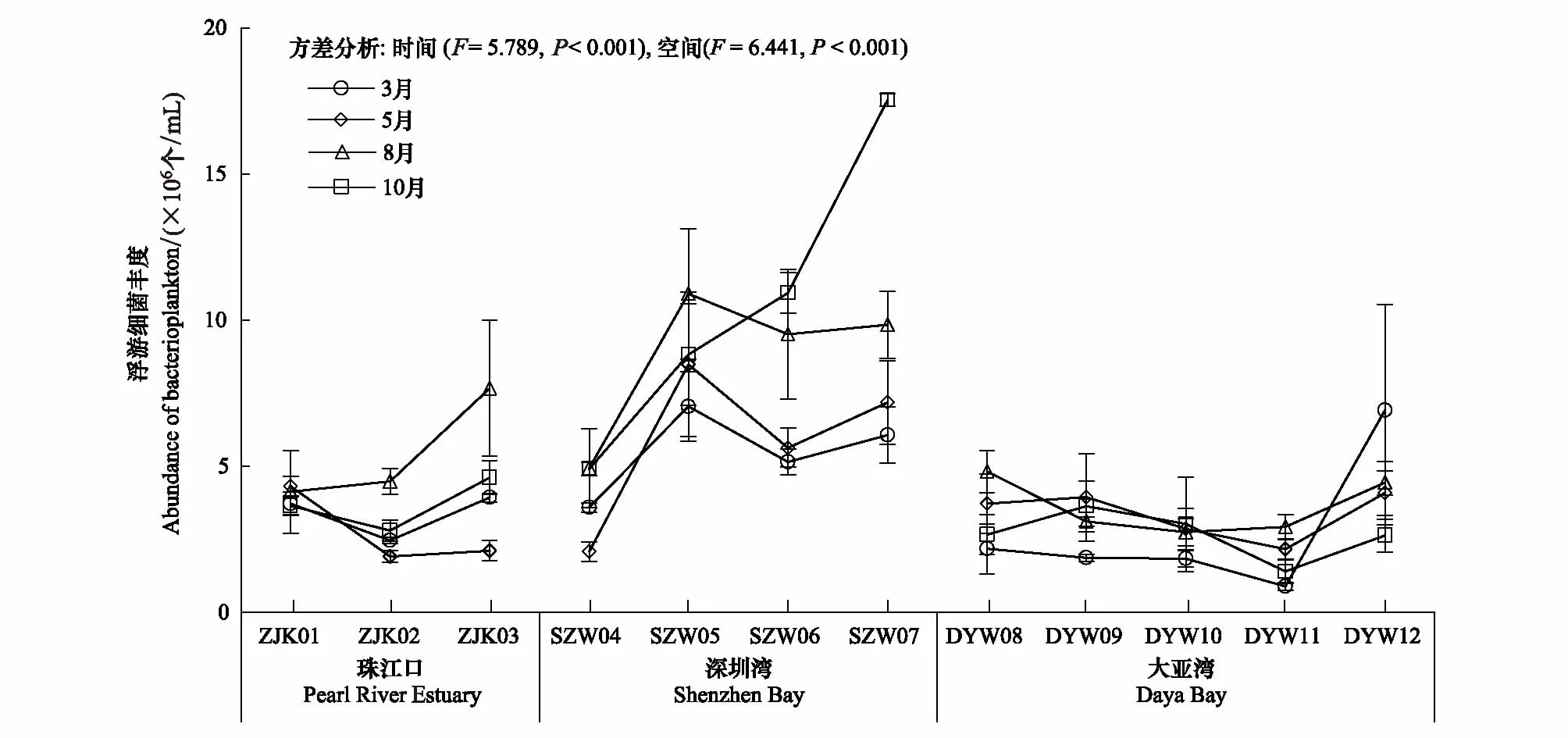
图3 深圳市近岸海域(珠江口、深圳湾和大亚湾)浮游细菌丰度时间和空间分布情况Fig.3 Spatio-Temporal Variations of the abundance of bacterioplankton in Shenzhen coastal waters (Pearl River Estuary, Shenzhen Bay and Daya Bay)

图4 深圳市3个海域(珠江口、深圳湾和大亚湾)浮游细菌平均丰度比较Fig.4 Comparison of the average abundance of bacterioplankton in the three coastal waters(Pearl River Estuary, Shenzhen Bay and Daya Bay)
LNA亚群时空分布如图7所示。LNA亚群丰度范围为3.74 × 105—1.13 × 107个/mL,平均值为1.91 × 106个/mL。最高值出现在10月SZW07站位,最低值出现在3月DYW12站位。
HNA亚群占总浮游细菌的比例为25.97%—82.93%,最小比例和最大比例均出现在10月份,3月份、5月份和8月份的HNA亚群占比在60%左右波动,空间变化较小。3月份、5月份、8月份和10份月的HNA亚群占总浮游细菌比例分别为56.58%、58.71%、62.38%和63.69%(图8)。
2.4 深圳近岸海域浮游细菌丰度与环境参数的相关性
3 讨论
3.1 环境对浮游细菌丰度的影响
温度是影响浮游细菌生长的重要因素,也是导致浮游细菌丰度时空差异的主要原因。温度通过控制细胞内酶的活性间接影响细菌新陈代谢,在一定温度范围内细菌生长速率与温度呈正相关[18]。同时温度通过影响初级生产者丝状绿藻的生长及其对水体中氮磷元素的去除间接影响浮游细菌的丰度和群落组成[20]。本研究结果表明总浮游细菌丰度与温度呈显著正相关(r=0.352,P=0.021),与TN呈显著正相关(r=0.379,P=0.012),与TP呈极显著正相关性(r=0.511,P=0),在营养丰富的地区更益于浮游细菌的生长。
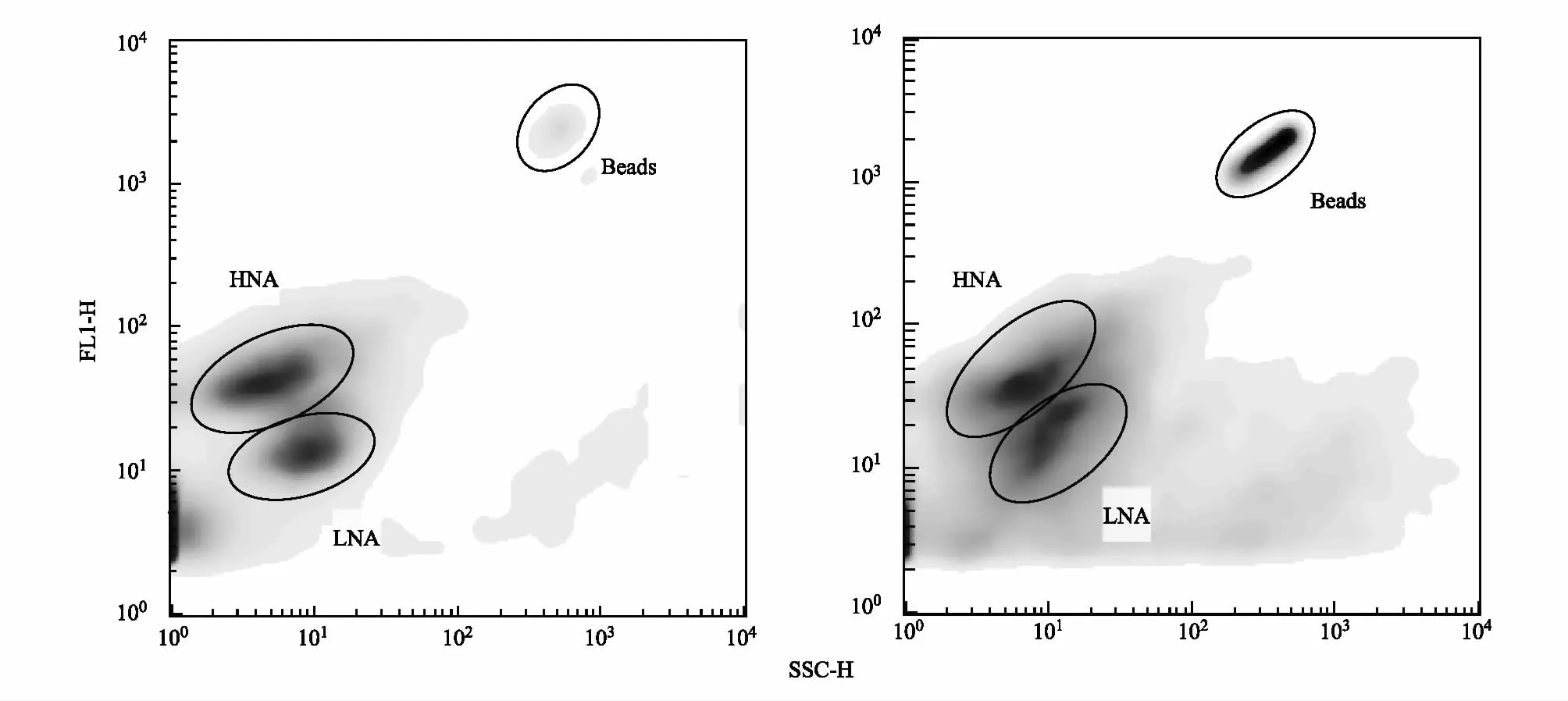
图5 HNA亚群和LNA亚群的流式细胞仪(FCM)分类Fig.5 Flow cytometry plot of LNA and HNA bacteriaBeads为荧光微球,作为流式细胞检测和计算的内参;FL1-H(Fluorescence 1- Height)为第1荧光通道的信号曲线高度,反映FL1荧光信号强度;SSC-H(Side Scatter-Height)为侧向散射角的信号曲线高度,反映细胞形态特征,代表细胞的颗粒度

图6 深圳市近岸海域(珠江口、深圳湾和大亚湾)HNA亚群细菌丰度时间和空间分布情况Fig.6 Spatio-Temporal Variations of the abundance of HAN bacteria in Shenzhen coastal waters (Pearl River Estuary, Shenzhen Bay and Daya Bay)

图7 深圳市近岸海域(珠江口、深圳湾和大亚湾)LNA亚群细菌丰度时间和空间分布情况Fig.7 Spatio-Temporal Variations of the abundance of LAN bacteria in Shenzhen coastal waters (Pearl River Estuary, Shenzhen Bay and Daya Bay)SZW07站位在十月份LNA亚群丰度为1.13 × 107个/mL,图中未显示
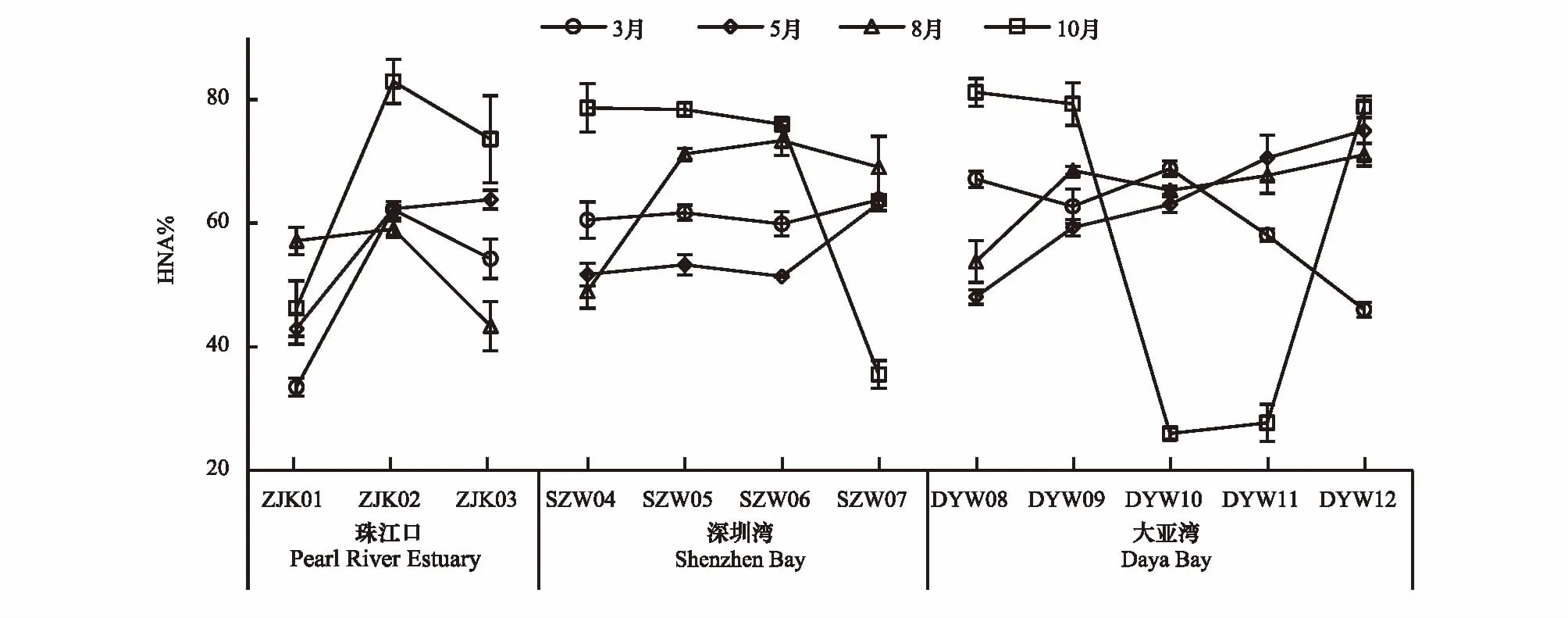
图8 深圳市近岸海域(珠江口、深圳湾和大亚湾)HNA亚群占浮游细菌的百分比Fig.8 The percentage of HNA subgroup bacteria in bacterioplankton in Shenzhen coastal waters (Pearl River Estuary, Shenzhen Bay and Daya Bay)
盐度作为表征生态位的指标,其通过改变水体中营养盐水平间接影响生态系统中浮游细菌丰度和组成[21],本研究结果显示盐度与浮游细菌丰度存在显著负相关性(r=-0.369,P=0.015),与营养盐浓度呈极显著负相关性。在深圳湾、珠江口、大亚湾海域盐度浓度依次升高,营养盐浓度则依次显著降低,浮游细菌丰度也依次降低。
Chl-a对深圳近岸海域浮游细菌丰度起到重要作用。Chl-a作为浮游植物现存量的良好指标,可作为研究浮游细菌生长繁殖与浮游植物之间关系的桥梁[22- 25]。水体中部分溶解性有机物由浮游植物光合作用产出,为浮游细菌二次生长提供充足的碳源,同时浮游细菌在生长过程中的代谢产物为浮游植物提供一定的营养[26]。在深圳近岸海域浮游细菌与Chl-a的含量呈极显著正相关,且相关系数较高(r=0.721)(表2),印证了浮游植物与细菌之间的密切关系。Chl-a含量在深圳湾和珠江口海域比在大亚湾海域明显高,具有较大梯度,结果显示深圳湾和珠江口海域浮游细菌丰度显著高于大亚湾海域(图4)。同时,深圳湾海域LNA亚群丰度在3个海域中最高,珠江口海域和大亚湾海域无明显高低差异(图7)。
表2深圳市近岸海域(珠江口、深圳湾和大亚湾)浮游细菌、HNA亚群和LNA亚群丰度与主要环境因子的Pearson相关系数
Table2Pearsoncorrelationcoefficientofbacterioplankton,HNAsubgroupbacteriaandLNAsubgroupbacteriainabundanceandkeyenvironmentalparametersinShenzhencoastalwaters(Pearl River Estuary, Shenzhen Bay and Daya Bay)
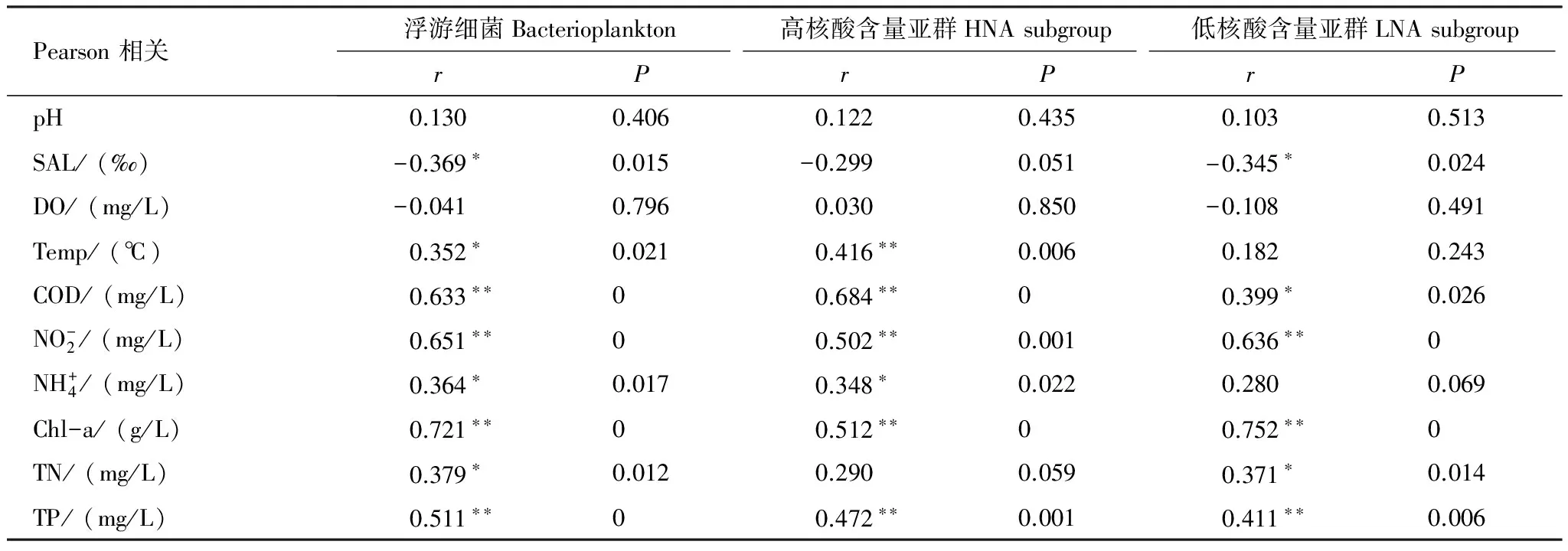
Pearson相关浮游细菌Bacterioplankton高核酸含量亚群HNAsubgroup低核酸含量亚群LNAsubgrouprPrPrPpH0.1300.4060.1220.4350.1030.513SAL/(‰)-0.369∗0.015-0.2990.051-0.345∗0.024DO/(mg/L)-0.0410.7960.0300.850-0.1080.491Temp/(℃)0.352∗0.0210.416∗∗0.0060.1820.243COD/(mg/L)0.633∗∗00.684∗∗00.399∗0.026NO-2/(mg/L)0.651∗∗00.502∗∗0.0010.636∗∗0NH+4/(mg/L)0.364∗0.0170.348∗0.0220.2800.069Chl-a/(g/L)0.721∗∗00.512∗∗00.752∗∗0TN/(mg/L)0.379∗0.0120.2900.0590.371∗0.014TP/(mg/L)0.511∗∗00.472∗∗0.0010.411∗∗0.006
*表示显著相关(P< 0.05双尾检验);**表示极显著相关(P< 0.01,双尾检验)

3.2 环境对HNA和LNA亚群丰度的影响
时间、空间双因素方差分析结果表明,HNA亚群丰度随时间和空间变化的差异极显著,且二者对HNA亚群丰度时空分布格局的贡献相当。LNA亚群丰度时空分布与HNA不同,LNA随时间变化差异不显著(F=1.504,P=0.219),而空间变化差异极显著(F=3.249,P< 0.0001)。无论是时间差异还是空间差异HNA亚群均大于LNA亚群,在其他海域的研究中也有同样的结论[16]。
本研究表明在深圳市近岸海域,温度是造成HNA亚群时间差异的主要因素,营养盐和Chl-a是影响HNA亚群空间差异的主要因素;LNA亚群随时间变化差异不显著(F=1.504,P=0.219),而空间差异显著,主要由营养盐和叶Chl-a控制[16,31- 33]。
对比HNA亚群和LNA亚群与环境因子的相关性,最大的区别是HNA亚群丰度与温度存在极显著正相关(r=0.416,P< 0.01),而LNA亚群丰度与温度相关性不显著(r=0.182,P=0.243),表明HNA和LNA两个亚群细菌繁殖和生长受温度的影响不同。温度通过控制细胞内酶的活性间接影响细菌生长和繁殖,因此两个细菌亚群内与细胞新陈代谢相关的酶对温度的敏感程度不一样。Shiah等研究Chesapeake湾时表明温度高于20℃时浮游细菌受温度的影响变小[34]。本研究中水体温度范围为19.92—31.74℃,在该温度范围内LNA亚群细胞酶活性接近最高值,新陈代谢受温度的影响不再显著;而对于HNA亚群,20℃时酶活性没有接近最高值,随着温度的升高酶活性继续提高。皮尔森相关性分析发现总浮游细菌丰度与温度的相关系数(r=0.352,P< 0.05)比HNA亚群与温度相关系数(r=0.416,P< 0.01)低,也间接表明LNA亚群受温度因素的影响小。Liu等关于海河中HNA和LNA亚群时空分布的研究[16]表明HNA和LNA两个亚群丰度时间差异主要都由温度的控制,与本文结果不同。Liu所研究的地点处于38°N附近,最低温度低于10℃,最高温度高于30℃,温度变化范围大,因此LNA亚群与温度的相关性可以彰显出来。
已有研究表明HNA比LNA亚群更趋向于在营养丰富的环境中生长[35- 36]。本实验结果显示,除个别站位LNA亚群丰度高于HNA亚群外,大部分营养丰富地区HNA亚群丰度均高于LNA亚群,占总浮游细菌的平均比例为60.34%,表明HNA亚群是总浮游细菌中的优势群。
4 结论
综上所述,深圳市近岸海域浮游细菌丰度时间和空间差异均显著,且时间差异主要受温度影响,空间差异主要受营养盐和Chl-a影响。HNA亚群时间分布格局由温度控制,空间分布格局由营养盐和Chl-a控制;而对于LNA亚群,时间差异不显著,但空间差异显著且主要由营养盐和Chl-a控制。环境对HNA和LNA亚群丰度的影响有相似之处,但两者对某些环境因子有着不同的响应,这暗示了它们在近海生态系统中扮演着部分重叠但略有不同的生态角色。
致谢:深圳市海洋与渔业环境监测站提供实验室和实验试剂,特此致谢。
[1] Mallin M A, Williams K E, Esham E C, Lowe R P. Effect of human development on bacteriological water quality in coastal watersheds. Ecological Applications, 2000, 10(4): 1047- 1056.
[2] Fuhrman J A, Azam F. Bacterioplankton secondary production estimates for coastal waters of British Columbia, Antarctica, and California. Applied and Environmental Microbiology, 1980, 39(6): 1085- 1095.
[3] Taylor J D, Cottingham S D, Billinge J, Cunliffe M. Seasonal microbial community dynamics correlate with phytoplankton-derived polysaccharides in surface coastal waters. The ISME Journal, 2014, 8(1): 245- 248.
[4] 王博雯, 汤祥明, 高光, 余多慰, 李琳琳, 赛·巴雅尔图. 博斯腾湖细菌丰度时空分布及其与环境因子的关系. 生态学报, 2014, 34(7): 1812- 1821.
[5] Sosik H M, Olson R J, Armbrust E V. Flow cytometry in phytoplankton research//Suggett D J, Prášil O, Borowitzka M A, eds. Chlorophyll A Fluorescence in Aquatic Sciences——Methods and Applications. Netherlands: Springer, 2010: 171- 185.
[6] Winder M. Photosynthetic picoplankton dynamics in Lake Tahoe: temporal and spatial niche partitioning among prokaryotic and eukaryotic cells. Journal of Plankton Research, 2009, 31(11): 1307- 1320.
[7] Marie D, Shi X L, Rigaut-Jalabert F, Vaulot D. Use of flow cytometric sorting to better assess the diversity of small photosynthetic eukaryotes in the English Channel. FEMS Microbiology Ecology, 2010, 72(2): 165- 178.
[8] Marie D, Rigaut-Jalabert F, Vaulot D. An improved protocol for flow cytometry analysis of phytoplankton cultures and natural samples. Cytometry Part A, 2014, 85(11): 962- 968.
[9] Lebaron P, Servais P, Agogué H, Courties C, Joux F. Does the high nucleic acid content of individual bacterial cells allow us to discriminate between active cells and inactive cells in aquatic systems? Applied and Environmental Microbiology, 2001, 67(4): 1775- 1782.
[10] Prest E I, Hammes F, Kötzsch S, van Loosdrecht M C M, Vrouwenvelder J S. Monitoring microbiological changes in drinking water systems using a fast and reproducible flow cytometric method. Water Research, 2013, 47(19): 7131- 7142.
[11] Gasol J M, Del Giorgio P A. Using flow cytometry for counting natural planktonic bacteria and understanding the structure of planktonic bacterial communities. Scientia Marina, 2000, 64(2): 197- 224.
[12] Corzo A, Rodríguez-Gálvez S, Lubian L, Sobrino C, Sangrá P, Martínez A. Antarctic marine bacterioplankton subpopulations discriminated by their apparent content of nucleic acids differ in their response to ecological factors. Polar Biology, 2005, 29(1): 27- 39.
[13] Li W K W, Jellett J F, Dickie P M. DNA distributions in planktonic bacteria stained with TOTO or TO-PRO. Limnology and Oceanography, 1995, 40(8): 1485- 1495.
[14] Salcher M M, Pernthaler J, Posch T. Seasonal bloom dynamics and ecophysiology of the freshwater sister clade of SAR11 bacteria ‘that rule the waves’ (LD12). The ISME Journal, 2011, 5(8): 1242- 1252.
[15] Fierer N, Schimel J P. Effects of drying-rewetting frequency on soil carbon and nitrogen transformations. Soil Biology and Biochemistry, 2002, 34(6): 777- 787.
[16] Liu J, Hao Z Y, Ma L L, Ji Y R, Bartlam M, Wang Y Y. Spatio-temporal variations of high and low nucleic acid content bacteria in an exorheic river. PLoS One, 2016, 11(4): e0153678.
[17] 周凯, 章洁香, 张瑜斌, 卢东伟, 丁玉静, 孙省利. 深圳湾浮游细菌生物量的时空分布及其影响因素. 热带海洋学报, 2013, 32(3): 65- 71.
[18] 姜发军, 胡章立, 胡超群. 大鹏湾浮游细菌时空分布与环境因子的关系. 热带海洋学报, 2011, 30(1): 96- 100.
[19] 谭上进, 朱小山, 周进, 蔡中华. 深圳近岸海域环境状况近10a变化趋势. 海洋环境科学, 2014, 33(1): 154- 160.
[20] 陈祯, 何聃, 任丽娟. 温度和营养盐水平对淡水浮游细菌群落结构的潜在影响. 南京大学学报: 自然科学版, 2016, 52(4): 590- 600.
[21] 张军晓, 李绪录, 周毅频, 梁佩喜. 2000—2010年深圳湾及其邻近海域溶解无机氮的时空分布. 生态环境学报, 2013, 22(3): 475- 480.
[22] 白洁, 时瑶, 宋亮, 李正炎. 黄海西北部浮游细菌生物量分布特征及其与环境因子的关系. 中国海洋大学学报: 自然科学版, 2009, 39(4): 592- 596.
[23] Yuan X C, He L, Yin K D, Pan G, Harrison P J. Bacterial distribution and nutrient limitation in relation to different water masses in the coastal and northwestern South China Sea in late summer. Continental Shelf Research, 2011, 31(11): 1214- 1223.
[24] Zhou W H, Long A M, Jiang T, Chen S Y, Huang L M, Huang H, Cai C H, Yan Y. Bacterioplankton dynamics along the gradient from highly eutrophic Pearl River Estuary to oligotrophic northern South China Sea in wet season: implication for anthropogenic inputs. Marine Pollution Bulletin, 2011, 62(4): 726- 733.
[25] Liu H B, Dagg M, Campbell L, Urban-Rich J. Picophytoplankton and bacterioplankton in the Mississippi River plume and its adjacent waters. Estuaries, 2004, 27(1): 147- 156.
[26] 倪健斌, 张朝霞, 柯才焕, 等. 北部湾夏, 冬两季异养细菌的水平分布特征及其影响因子. 厦门大学学报: 自然科学版, 2012, 51(3): 144- 150.
[27] 史华明, 李绪录, 石晓勇, 张军晓, 肖志建. 2000—2012年深圳湾及邻近沿岸水域溶解无机磷的来源和时空分布. 环境科学学报, 2015, 35(11): 3579- 3586.
[28] Farjalla V F, de Faria B M, de Assis Esteves F, Bozelli R L. Bacterial density and biomass, and relations with abiotic factors, in 14 coastal lagoons of Rio de Janeiro State. Oecologia Brasiliensis, 2001, 9(1): 65- 76.
[29] Karl D M, Björkman K M, Dore J E, Fujieki L, Hebel D V, Houlihan T, Letelier R M, Tupas L M. Ecological nitrogen-to-phosphorus stoichiometry at station ALOHA. Deep Sea Research Part II: Topical Studies in Oceanography, 2001, 48(8/9): 1529- 1566.
[30] Benitez-Nelson C R. The biogeochemical cycling of phosphorus in marine systems. Earth-Science Reviews, 2000, 51(1/4): 109- 135.
[31] Jochem F J, Lavrentyev P J, First M R. Growth and grazing rates of bacteria groups with different apparent DNA content in the Gulf of Mexico. Marine Biology, 2004, 145(6): 1213- 1225.
[32] Schattenhofer M, Wulf J, Kostadinov I, Glöckner F O, Zubkov M V, Fuchs B M. Phylogenetic characterisation of picoplanktonic populations with high and low nucleic acid content in the North Atlantic Ocean. Systematic and Applied Microbiology, 2011, 34(6): 470- 475.
[33] Bouvier T, Del Giorgio P A, Gasol J M. A comparative study of the cytometric characteristics of high and low nucleic-acid bacterioplankton cells from different aquatic ecosystems. Environmental Microbiology, 2007, 9(8): 2050- 2066.
[34] Shiah F K, Ducklow H W. Temperature and substrate regulation of bacterial abundance, production and specific growth rate in Chesapeake Bay, USA. Marine Ecology Progress Series, 1994, 103(3): 297- 308.
[36] Andrade L, Gonzalez A M, Rezende C E, Suzuki M, Valentin J L, Paranhos R. Distribution of HNA and LNA bacterial groups in the southwest Atlantic ocean. Brazilian Journal of Microbiology, 2007, 38(2): 330- 336.
