丛枝菌根网络对不同喀斯特适生植物生长及氮摄取的影响
2017-03-09何跃军王鹏鹏司建朋谢佩耘
杨 应,何跃军,3,* ,董 鸣,王鹏鹏,司建朋,谢佩耘
1 贵州大学林学院/贵州大学贵州省森林资源与环境研究中心,贵阳 550025 2 杭州师范大学,生态系统保护与恢复杭州市重点实验室,杭州 310036 3 中国科学院植物研究所,植被与环境变化国家重点实验室,北京 100093
丛枝菌根真菌(Arbuscular Mycorrhizal Fungi, AMF)是一种能与世界上80%的维管束植物形成互利共生关系的微生物[1],AMF通过菌丝侵入到植物根系与宿主植物根系形成菌根,根系外延菌丝通过利用植物碳水化合物维持生长并吸收土壤养分供给宿主植物实现互利共生[2],外延菌丝还可以通过侵入点再度侵染其他植物根系后在不同植物间形成庞大的地下公共菌根网络(Common Mycorrhizal Networks,CMN)[3- 4]。CMN能够在不同植物个体之间传递营养元素[5],对植物个体间营养平衡[6- 7]和物种多样性维持[8]等方面具有重要的生态功能,并对宿主植物的氮、磷等养分的转移分配产生影响[9- 10],因此改变植物个体功能性状如营养性状和表型性状等。
中国是世界上喀斯特分布面积最大的国家,分布的喀斯特面积达130万km2,西南地区分布着最为典型的碳酸岩发育的喀斯特地理景观[11],喀斯特生态系统包含一系列不同的微生境如石面、石沟、石缝、露头等[12],因此喀斯特生态系统具有较高的生境异质性,生境异质性影响了喀斯特土壤微生物和地上植物群落的空间分布。Hutchinson[13]提出了一个重要的生态学问题:大量物种是如何持续共存于同一生境的?Tilman 和Pacala[14]认为植物个体的竞争是促进异质生境资源再分配实现多物种共存的重要原因。CMN影响植物功能性状促进异质生境资源营养分配而对生态系统的稳定性产生影响,因此对高度异质的喀斯特生境而言CMN可能在调控生境资源方面也扮演着重要的角色。当前喀斯特地区菌根生态学的研究主要集中在菌根植物光合生理[15]、AMF与宿主植物的抗旱性[16]、AM植物的氮磷营养利用[17]等方面,高度异质的喀斯特生境中CMN对植物个体的影响还缺乏研究,该地区维持了较高的植物物种多样性,这些物种的分布是与喀斯特异质生境高度适应的。在喀斯特生境中,不同物种形成的植物群落个体之间是如何实现养分资源分配是很多学者关注的问题,CMN在不同物种间如何调节分配养分资源的研究尚属空白。虽然He等[6]、Fellbaum等[9]曾采用同位素示踪研究发现灰松(Gray pine)和豆科苜蓿(Medicagotruncatula)植物氮转移,但这两类植物主要是外生菌根型植物和固氮型植物,并且他们的研究并没有考虑同一生境条件下不同生长型植物间养分转移。喀斯特植物群落由许多不同生长型物种构成,如乔木型香樟(Cinnamomumcamphora)、灌木型构树(Broussonetiapapyrifera)和草本型鬼针草(Bidenspilosa)等植物常共存于同一喀斯特小生境,这些物种在喀斯特群落演替过程中,因生境资源异质性分布,个体之间可能存在养分浓度差异,不同的物种间是否通过CMN调节分配养分资源促进植物个体的营养平衡我们并不清楚,这一问题的明确对深入阐明喀斯特植被稳定性维持机制具有重要意义。此外,植物个体间养分资源在CMN作用下的再分配必然引起植物功能更性状如营养性状、表型性状的改变,因此有必要通过同位素示踪技术研究CMN介导的喀斯特不同植物个体间养分转移分配与植物功能性状调控适应对策。为此,提出如下假说:(1)CMN转移了植物个体的养分;(2)CMN对同种生物个体和异种生物个体养分的转移分配存在差异;(3)CMN对不同物种个体生长性状和根系表型特征产生影响。为此,本研究采用同位素示踪技术模拟自然环境构建微生态系(microcosms),探索CMN在喀斯特土壤中对不同物种个体养分转移分配和植物生长性状的影响。
1 材料及方法
1.1 试验装置
本研究模拟自然采用如图1设置的试验装置构建微生态系,微生态系由1个聚丙烯材料制成的圆形大盆和7个11.8 cm× 14.0 cm(直径×高度)的柱形隔室(厚度2 mm)构成。圆形大盆作为一个单元,每个单元内包含7个柱形隔室,其中1个隔室作为供体室放置在中间,另外6个隔室作为受体室放置在周围,整个试验共包含了6个微生态系单元作为实验重复。供体室底部开4 cm直径的圆孔连接大盆底部外侧,并与6 cm直径的外部同位素标记培养皿联通,培养皿与供体室间用2 mm的尼龙网隔离以保证供体植物根系能够穿透尼龙网进行同位素标记又阻隔土壤下渗。从每个隔室底部向上3—10 cm的柱壁上钻1 cm的圆孔带,孔间间隔2 cm,用20 μm或者0.45 μm的尼龙网(Amersham Hybond, USA)粘附在隔室柱壁两侧,其中20 μm尼龙网允许菌丝通过,却阻止植物根系通过,0.45 μm网只允许土壤中的离子通过,却阻止菌丝和植物根系通过[18]。供体室植物接种AMF,并采用20 μm尼龙网处理,这样供体室内的AMF菌丝体能够进入20 μm尼龙网处理的受体室,并侵染受体室植物根系,在微生态系装置内不同植物个体间形成公用菌丝网CMN。
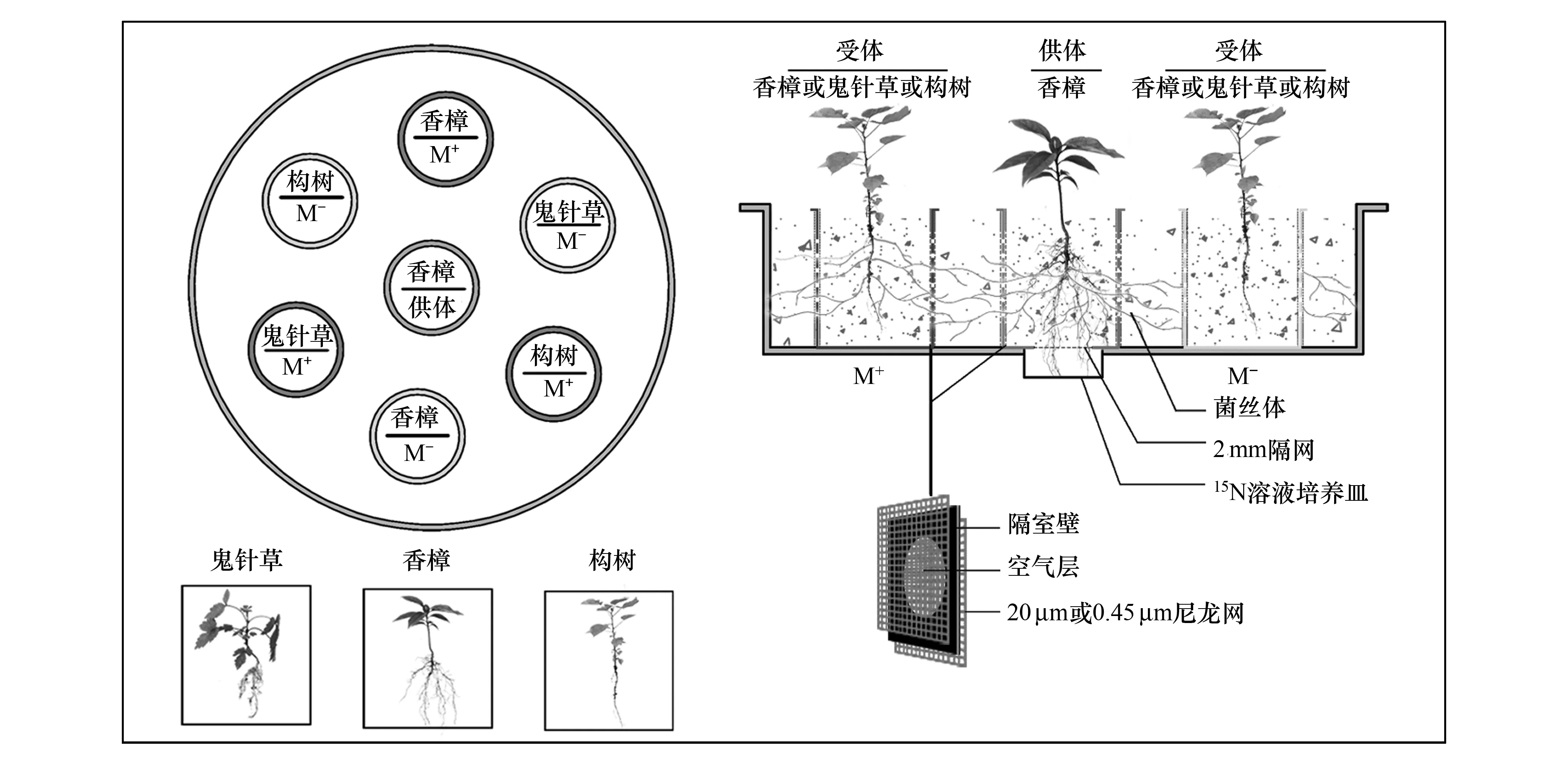
图1 试验生态系装置示意图Fig.1 The microcosm device design
1.2 试验材料与处理
试验材料:本试验场所位于贵州大学林学院温室大棚内进行,地理位置: 106°22′E,29°49′N, 海拔1120 m。试验土壤采集于贵阳市花溪区典型喀斯特地段的石灰土,按石灰土∶河沙=3∶1的体积比充分混合作为植物培养基质。试验基质在126℃,0.14 Mpa下连续湿热灭菌1 h备用。基质理化性质为:pH6.92,全氮2160 mg/kg、碱解氮137.43 mg/kg、全磷170 mg/kg和速效磷19.58 mg/kg。土壤采样地段分布有香樟(Cinnamomumcamphora)、构树(Broussonetiapapyrifera)和鬼针草(Bidenspilosa)3种不同生长型的喀斯特适生植物,其中香樟是乔木树种,构树是灌木树种,鬼针草是草本植物。本试验3种植物种子分别采集于同一成年植株,试验采用幼套球囊霉(Glomusetunicatum)作为供试菌种,购于北京农林科学院营养资源研究所(BGCAM 0046),试验前将该菌种通过白三叶草(Trifoliumrepens)扩繁4个月获得试验菌剂,菌剂孢子密度≥10个/g,包含菌丝片段及侵染根段等。
试验处理:所有隔室中放置2.5 kg的灭菌基质,隔室之间的空隙用灭菌基质填充,填充高度与隔室中土壤高度持平。先将种子在10%的H2O2溶液中消毒10 min,并在无菌水中清洗3次后播入隔室中。供体室播入5粒香樟种子并接种100 g的幼套球囊霉培养菌剂;6个受体隔室均不接种,其中3个隔室采用20 μm的尼龙网处理(M+处理),另外3个隔室采用0.45 μm的尼龙网处理(M-处理),每个M+和M-受体隔室分别播入5粒香樟、构树和鬼针草种子,所有隔室在种子播入后浇足水分,放置在塑料大棚中常规培养。当幼苗出土2周后,在供体室中留置1株幼苗,受体室中各留置2株幼苗,当幼苗生长3个月后在培养皿中注入8 mL浓度为0.5%的(15NH4)2SO4(δ15N=99.14%,购于上海同位素工程研究中心)溶液标记供体植株根系,同位素标记2周后收获所有的试验土壤和植物材料进行指标分析。
1.3 指标测定及方法
菌根侵染率按照Kormanik等[19]和Brundrett等[20]所描述的染色观察方法测定。生物量采用烘干法,将植株根、茎、叶放置在105℃下恒温48 h至恒重后称量。植氮含量采用凯氏定氮法(Büchi Distillation Unit B- 324全自动凯氏定氮仪)进行测定。同位素δ15N值的测定是将植株叶片在105℃烘干后采用球磨机粉碎,过筛100目后装入锡箔纸作为待测样品,送至国家海洋局第三海洋研究所进行测定,所用仪器为Thermal Finnigan TC/EA-IRMS 测试仪,型号DELTAV Advantage。根直径、根总长、根表面积和根体积的测定是采用加拿大WinRHIZO_Pro LA2400根系分析系统测定,叶面积采用叶面积仪测定。
1.4 数据处理及分析
数据采用SPSS 13.0版本软件分析,采用ANOVA最小极差法(LSD)分析δ15N值、氮摄取量、株高、地径、叶面积、根直径、根总长、根表面积和根体积等性状指标值之间的差异,t检验比较分析M+与M-处理之间的性状指标值差异,显著性检验水平为5%,采用Origin 8.0作图。
2 结果与分析
2.1 不同处理条件下受体植物菌根侵染率
试验中3种不同的受体植物在M-处理下均未发现菌根真菌侵染,也未发现菌丝体片段或者AM孢子的存在。3种不同的受体植物在M+处理下侵染率表现为构树>香樟>鬼针草,香樟、构树和鬼针草菌根侵染率分别为55.50%、61.75%和43.50%,香樟与构树菌根侵染率差异不显著(P>0.05),但二者分别与鬼针草差异显著,该结果表明0.45 μm的尼龙网有效阻隔了AM菌丝体向M-隔室生长。
2.2 CMN对植株个体叶片δ15N值的影响
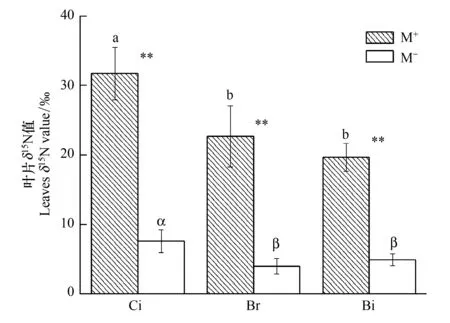
图2 受体植物在M+与M-处理下的叶片δ15N值 Fig.2 The leaves δ15N value of receiver plants in the M+and M- treatmentsCi:香樟, Cinnamomum camphora; Br:构树, Broussonetia papyrifera; Bi:鬼针草, Broussonetia papyrifera;英文字母(a,b,c)不同表示M+处理下不同植株幼苗叶片δ15N值之间差异显著(P<0.05);希腊字母(α,β,γ)不同表示M-处理下不同植株幼苗叶片δ15N值之间差异显著(P<0.05);**表示差异极显著P<0.01
如图2在M+处理下受体植物香樟、构树和鬼针草叶片δ15N值分别显著高于M-处理,3种受体植物分别提高了317.79%、394.96%和300.20%。在M+处理下,香樟幼苗叶片δ15N值显著高于构树和鬼针草,而构树与鬼针草间叶片δ15N值没有显著差异,同样地,M-处理的结果与M+处理相似,仍表现为香樟分别与构树、鬼针草间存在显著差异,但构树与鬼针草间差异未达到显著水平。该试验结果表明,CMN显著提高了香樟、构树和鬼针草对供体香樟15N的转移和利用,受体植物不同,对供体植物15N的转移分配效应存在差异。
2.3 CMN对不同受体植物个体氮摄取量及其分配的影响
3种受体植株个体总氮摄取量如图3所示,M+处理的香樟幼苗总氮摄取量显著高于M-处理,但构树和鬼针草幼苗各自的总氮摄取量在M+与M-处理间差异不显著;在M+处理下,香樟总氮摄取量分别显著低于构树和鬼针草,但构树与鬼针草间差异不显著,在M-处理下也表现类似的结果。3种植物氮摄取量分配如图3b所示,M+处理下香樟幼苗地上部分和地下部分氮摄取量分别显著高于M-,但构树和鬼针草各自的地上部分和地下部分氮摄取量在不同处理间差异均不显著;就地上部分氮摄取量而言,M+处理下,构树和鬼针草间氮摄取量没有显著差异,但均显著高于香樟,M-处理也表现同样结果;就地下部分氮摄取量而言,M+处理的构树与鬼针草间氮摄取量没有显著差异,但均显著高于香樟,而M-处理下,3个物种间彼此差异显著。该结果表明,M+处理下CMN显著提高了香樟幼苗地上部分、地下部分和植株总氮摄取量,对供体香樟相对的异种植物构树和鬼针草没有显著效应,但构树和鬼针草氮摄取量均显著高于同种个体的香樟。
2.4 CMN对不同种受体植物个体生物量的影响
如图4,M+处理的香樟总生物量显著高于M-处理,但构树和鬼针草各自的总生物量在M+与M-处理间差异未达到显著水平;在M+处理下,构树与鬼针草间总生物量差异不显著,但二者显著高于香樟,M-处理下,3个物种间彼此差异显著。图4为植株幼苗地上和地下生物量的分配。就地上生物量而言,M+处理下香樟和鬼针草分别显著高于M-,其中香樟表现为极显著差异,但构树在不同处理间差异未达到显著水平;M+处理下,构树与鬼针草地上生物量差异不显著,但二者显著高于香樟,而M-处理下,3个物种间彼此差异显著。就地下生物量而言,M+处理的香樟显著高于M-,构树和鬼针草的不同处理间差异不显著;M+和M-处理的地下生物量均表现为3个物种间彼此差异显著。由此可知,只有香樟幼苗在M+处理下其地上、地下和总生物量均显著高于M-,与供体植物为同一物种的香樟生物量显著低于异种个体的构树和鬼针草。
2.5 CMN对不同种受体植物生长性状的影响
如表1所示,比较分析香樟、构树和鬼针草幼苗M+与M-处理下植株表型性状特征,M+处理的香樟株高、地径和叶面积均分别显著高于M-,构树株高、地径和叶面积在不同处理间差异均未达到显著水平,M+处理的鬼针草株高和地径显著高于M-,但叶面积差异不显著。比较3种植物在相同处理下性状差异,就株高而言,M+和M-处理的3个物种间彼此差异显著,均表现为鬼针草>构树>香樟;就地径而言,M-处理下,香樟与构树间差异显著,二者分别与鬼针草无显著差异;就叶面积而言,相同处理下香樟分别显著低于构树和鬼针草,但构树与鬼针草间差异不显著。该结果表明,CMN显著提高了香樟幼苗株高、地径和叶面积,显著促进了鬼针草幼苗的高生长和茎生长,但对构树没有显著影响。
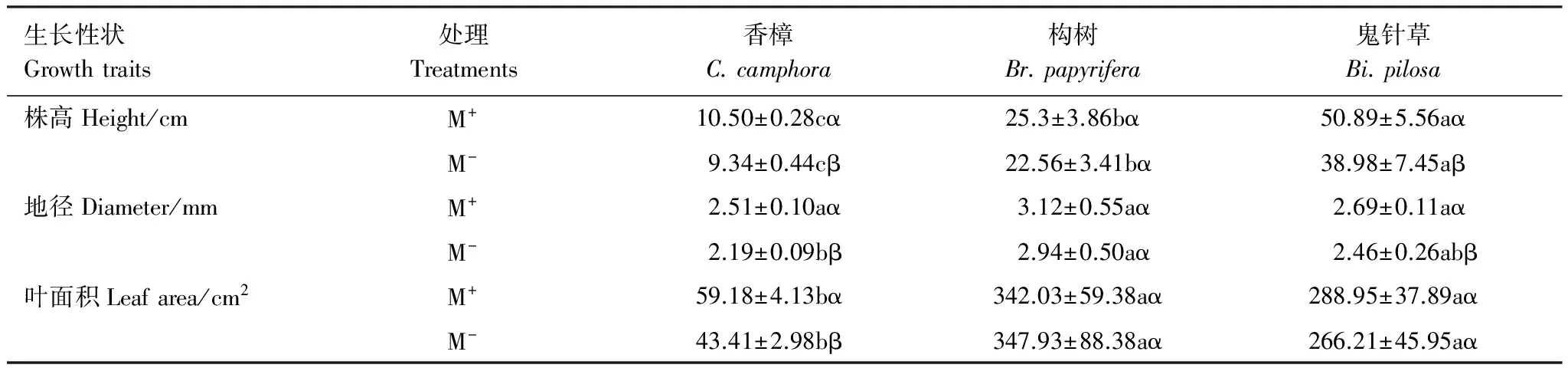
表1 不同受体植物株高、地径和叶面积
同列中不同希腊字母(α、β)表示同一物种不同处理下差异显著(P<0.05),同行中不同小写字母(a、b、c)表示同一处理下不同物种相同器官间差异显著
2.6 CMN对不同种受体植物根系性状的影响
3种受体植物根系性状特征如图5所示,M+处理的香樟幼苗根平均直径、根总长、根表面积、根体积分别显著高于M-,构树幼苗的根平均直径、根总长、根表面积、根体积在M+处理下显著低于M-,而鬼针草在不同处理间各根系性状特征无显著差异。M+处理下,香樟与构树间根平均直径差异显著,但二者分别与鬼针草无显著差异,M-处理下,三个树种间彼此差异不显著;M+和M-处理的三个物种间彼此差异显著,根总长表现为鬼针草>构树>香樟;植物根表面积和根体积的变化规律与根总长相似。该结果表明,CMN显著提高了香樟幼苗根系平均直径、根总长,根表面积和根体积,显著降低构树幼苗的,而对鬼针草的影响并不显著。
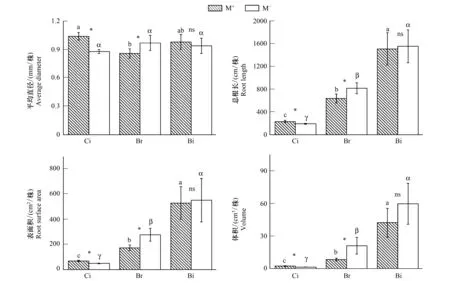
图5 在M+与M-处理下的受体植物根系平均直径、根总长、根表面积和根体积Fig.5 The root traits on average diameter, root length, root surface area and root volume of receiver plants in the M+ and M- treatments
3 讨论与结论
本试验结果表明,微生态系中AM菌丝体形成的菌根菌丝网CMN提高了受体室植株的氮含量,CMN转移供体香樟15N分配给受体香樟、构树和鬼针草幼苗,这一结果与He等[6]在加利佛利亚橡树林内用同位素标记技术研究外生菌根植物和丛枝菌根植物之间通过CMN移动15N的结果相一致,Cheng等[21]的研究结果也表明,通过AMF菌丝网作用在雀麦等作物相邻葡萄树中发现15N的存在。然而,CMN对15N的转移可能是供体植物和受体植物根系联结的菌丝桥直接转移,也可能通过植物根系细胞剥离溶解或者根系分泌物将氮释放在土壤中被菌丝体间接吸收转移[22- 23],亦或菌丝体从供体植物根系将氮转移到土壤,再从土壤转移到受体植物根系[24]。He等[25]认为AM真菌和植物个体间可能存在氮的双向转移,这种双向转移正如Lu等[26]报道7个月大的黄檀Dalbergiaodorifera在接种固氮细菌Bradyrhizobiumelkanii后,通过同位素示踪技术标记15N发现半寄生植物白檀Santalumalbum与黄檀幼苗之间存在双向15N转移的结果一样,这种转移是通过根系分泌物释放转移的。这就使得CMN促进邻体植物之间氮的转移和利用过程变得十分复杂,而我们的试验仅是对供体香樟幼苗根系单向标记了15N同位素,个体之间的氮转移也可能从受体的香樟、构树和鬼针草向供体香樟发生,甚至通过微生态系隔室之间的土壤间接吸收转移,或者通过CMN在受体植物如香樟、构树和鬼针草之间相互转移,因此更为深入的研究是十分必要的。
本试验中CMN对3种受体植物各部分氮摄取量的影响存在差异性,CMN对同种植物的香樟具有显著正效应,而对异种植物的构树和鬼针草的影响不显著,引起不同物种个体氮摄取量差异的原因可能是宿主植物生活型不同引起AMF对不同植物的功能选择差异[27- 28],导致CMN对氮的分配存在差异性。Weremijewicz等[29]认为CMN具有增大植物物种个体对资源分配的非平衡性,Burke[30]发现Maianthemumracemosum幼苗在生长和养分摄取上通过CMN受益于邻近的同种个体,但异种的个体则对之是负效应,本试验中氮摄取量在3个物种上的差异支持了他们观点,从AMF对物种的生活型功能选择支持了Yang等[28]的研究。植物可通过生物和非生物过程竞争土壤中的矿质营养,并改变各部分的生物量积累及分配格局以适应土壤养分变化,从而最大限度获取土壤中的养分资源[31],在植株个体养分资源分配上,3种植物地上部分的氮摄取量高于地下部分的氮摄取量,因而可能促进地上部分生物量高于地下部分生物量。
根长,根表面积,根平均直径以及根体积是度量根系表型性状的常规指标[32],而AMF对宿主植物根系的空间结构和形态特征具有重要影响,并直接影响了植物对土壤水分和矿质养分的吸收[33]。如宋会兴等[34]的研究表明接种摩西球囊霉Glomusmosseae后提高了构树的根总长、根平均直径、根表面积和根体积;邹英宁等[35]对枳苗Poncirustrifoliate接种AMF后发现其根表面积、体积和根长增加,但平均直径降低。CMN可能对资源进行非平衡再分配而改变不同植物个体原有性状表现,而CMN对不同植物而言可能是正效应,也可能是负效应,甚至对一些物种没有影响,本实验中菌丝网络显著促进了香樟幼苗根系的生长,显著抑制了构树幼苗根系的生长,而对鬼针草没有显著影响,各根系性状特征在3个物种上的差异正好支持Burke[30]的异种个体菌根功能贡献观点。研究表明CMN通过菌丝体转移养分并改变植物个体养分的摄取,从而影响植物生长性状和表型性状,如Fellbaum等[9]认为CMN对宿主植物个体间氮、磷等养分的转移分配具有重要生态功能;Merrild等[36]则认为CMN增加了物种间对养分竞争从而影响了植物个体性状,如营养性状和表型性状等的改变,这种竞争是实现异质生境中资源再分配和多物种共存的重要原因[13],这与本试验中CMN促进了香樟和鬼针草幼苗的地上部分高和茎生长,提高香樟叶面积的研究结果相符合。本试验中不同物种的氮摄取和分配、表型性状等存在差异性,其原因可能是3种不同生长型的植物生物性和生长特征差异较大,同时进行4个月的试验,香樟还处在幼苗期、而构树和鬼针草可能已经进入生长旺盛期,各自对于养分资源的吸收利用速率和生物量积累速率不一致,当然更为深入的研究是必要的。CMN往往会对不同大小个体的植株非平衡性资源分配,从而实现同种个体或异种个体因菌丝网络的调节共存于同一生境[37- 38]。生境异质性影响了喀斯特土壤微生物和地上植物群落的空间分布[39], 喀斯特地区不连续的土被和特殊的地表形态决定了生境异质性高,这种异质生境中的养分资源呈现不均匀分布,因此由CMN介导的植物个体间资源再分配可能是促进喀斯特异质生境物种共存的重要因素之一。在本试验的模拟微生态系中,结果表明CMN影响了植物个体间氮转移, 植株氮的摄取量依赖于植物个体生物量强度;CMN对植物个体的养分吸收和表型性状影响具有非平衡性,同种和异种植物个体养分转移和分配对CMN具有不同的响应,同种个体的香樟对CMN具有生长和氮摄取方面显著正效应;CMN改变了植物个体生长和生理性状,导致植物生长性状和根系表型性状的差异。
[1] 李晓林, 冯固. 丛枝菌根生理生态. 北京: 华文出版社, 2001: 345- 358.
[2] Smith S E, Read D J. Mycorrhizal Symbiosis. 3rd. New York: Academic Press, 2008.
[3] Newman E I. Mycorrhizal links between plants: their functioning and ecological significance. Advances in Ecological Research, 1988, 18: 243- 270.
[4] He X H, Critchley C, Bledsoe C. Nitrogen transfer within and between plants through common mycorrhizal networks (CMNs). Critical Reviews in Plant Sciences, 2003, 22(6): 531- 567.
[5] Booth M G. Mycorrhizal networks mediate overstorey-understorey competition in a temperate forest. Ecology Letters, 2004, 7(7): 538- 546.
[6] He X H, Bledsoe C S, Zasoski R J, Southworth D, Horwath W R. Rapid nitrogen transfer from ectomycorrhizal pines to adjacent ectomycorrhizal and arbuscular mycorrhizal plants in a California oak woodland. New Phytologist, 2006, 170(1): 143- 151.
[7] 陈永亮, 陈保冬, 刘蕾, 胡亚军, 徐天乐, 张莘. 丛枝菌根真菌在土壤氮素循环中的作用. 生态学报, 2014, 34(17): 4807- 4815.
[8] Selosse M A, Richard F, He X H, Simard S W. Mycorrhizal networks:desliaisonsdangereuses. Trends in Ecology & Evolution, 2006, 21(11): 621- 628.
[9] Fellbaum C R, Mensah J A, Cloos A J, Strahan G E, Pfeffer P E, Kiers E T, Bücking H. Fungal nutrient allocation in common mycorrhizal networks is regulated by the carbon source strength of individual host plants. New Phytologist, 2014, 203(2): 646- 656.
[10] Weremijewicz J, Sternberg L D S L O, Janos D P. Common mycorrhizal networks amplify competition by preferential mineral nutrient allocation to large host plants. New Phytologist, 2016, 212(2): 461- 471.
[11] Wang S J, Liu Q M, Zhang D F. Karst rocky desertification in southwestern China: geomorphology, landuse, impact and rehabilitation. Land Degradation & Development, 2004, 15(2): 115- 121.
[12] Zhang X Y, Sui Y Y, Zhang X D, Meng K, Herbert S J. Spatial variability of nutrient properties in black soil of northeast China. Pedosphere, 2007, 17(1): 19- 29.
[13] Hutchinson G E. Homage to Santa Rosalia or why are there so many kinds of animals. The American Naturalist, 1959, 93(870): 145- 159.
[14] Tilman D, Pacala S. The Maintenance of Species Richness in Plant Communities//Ricklefs R E, Schluter D, eds. Species Diversity in Ecological Communities. Chicago: University of Chicago Press, 1993.
[15] Chen K, Shi S M, Yang X H, Huang X Z. Contribution of arbuscular mycorrhizal inoculation to the growth and photosynthesis of mulberry in karst rocky desertification area. Applied Mechanics and Materials, 2014, 488- 489: 769- 773.
[16] 何跃军, 钟章成. 喀斯特土壤上香樟幼苗接种不同AM真菌后的耐旱性效应. 植物研究, 2011, 31(5): 597- 602, 622- 622.
[17] 何跃军, 钟章成, 刘济明, 刘锦春, 金静, 宋会兴. 构树(Broussonetiapapyrifera)幼苗氮、磷吸收对接种AM真菌的响应. 生态学报, 2007, 27(11): 4840- 4847.
[18] 吴强盛, 夏仁学. 水分胁迫下丛枝菌根真菌对枳实生苗生长和渗透调节物质含量的影响. 植物生理与分子生物学学报, 2004, 30(5): 583- 588.
[19] Kormanik P P, Bryan W C, Schultz R C. Procedures and equipment for staining large numbers of plant root samples for endomycorrhizal assay. Canadian Journal of Microbiology, 1980, 26(4): 536- 538.
[20] Brundrett M C, Piché Y, Peterson R L. A new method for observing the morphology of vesicular-arbuscular mycorrhizae. Canadian Journal of Botany, 1984, 62(10): 2128- 2134.
[21] Cheng X M, Baumgartner K. Arbuscular mycorrhizal fungi-mediated nitrogen transfer from vineyard cover crops to grapevines. Biology and Fertility of Soils, 2004, 40(6): 406- 412.
[22] Staddon P L, Ramsey C B, Ostle N, Ineson P, Fitter A H. Rapid turnover of hyphae of mycorrhizal fungi determined by AMS microanalysis of14C. Science, 2003, 300(5622): 1138- 1140.
[23] Jones D L, Hodge A, Kuzyakov Y. Plant and mycorrhizal regulation of rhizodeposition. New Phytologist, 2004, 163(3): 459- 480.
[24] Johnson D, Leake J R, Ostle N, Ineson P, Read D J.Insitu13CO2pulse-labelling of upland grassland demonstrates a rapid pathway of carbon flux from arbuscular mycorrhizal mycelia to the soil. New Phytologist, 2002, 153(2): 327- 334.
[25] He X H, Xu M G, Qiu G Y, Zhou J B. Use of15N stable isotope to quantify nitrogen transfer between mycorrhizal plants. Journal of Plant Ecology, 2009, 2(3): 107- 118.
[26] Lu J K, Kang L H, Sprent J I, Xu D P, He X H. Two-way transfer of nitrogen betweenDalbergiaodoriferaand its hemiparasiteSantalumalbumis enhanced when the host is effectively nodulated and fixing nitrogen. Tree Physiology, 2013, 33(5): 464- 474.
[27] Van Der Heijden M G A, Bardgett R D, Van Straalen N M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecology Letters, 2008, 11(3): 296- 310.
[28] Yang H S, Zang Y Y, Yuan Y G, Tang J J, Chen X. Selectivity by host plants affects the distribution of arbuscular mycorrhizal fungi: evidence from ITS rDNA sequence metadata. BMC Evolutionary Biology, 2012, 12: 50.
[29] Weremijewicz J, Janos D P. Common mycorrhizal networks amplify size inequality inAndropogongerardiimonocultures. New Phytologist, 2013, 198(1): 203- 213.
[30] Burke D J. Shared mycorrhizal networks of forest herbs: does the presence of conspecific and heterospecific adult plants affect seedling growth and nutrient acquisition. Botany, 2012, 90(10): 1048- 1057.
[31] 王庆成, 程云环. 土壤养分空间异质性与植物根系的觅食反应. 应用生态学报, 2004, 15(6): 1063- 1068.
[32] Murphy S L, Smucker A J M. Evaluation of video image analysis and line-intercept methods for measuring root systems of alfalfa and ryegrass. Agronomy Journal, 1995, 87(5): 865- 868.
[33] Atkinson D, Black K E, Forbes P J, Hooker J E, Baddeley J A, Watson C A. The influence of arbuscular mycorrhizal colonization and environment on root development in soil. European Journal of Soil Science, 2003, 54(4): 751- 757.
[34] 宋会兴, 钟章成, 王开发. 土壤水分和接种VA菌根对构树根系形态和分形特征的影响. 林业科学, 2007, 43(7): 142- 147.
[35] 邹英宁, 吴强盛, 李艳, 黄咏明. 丛枝菌根真菌对枳根系形态和蔗糖、葡萄糖含量的影响. 应用生态学报, 2014, 25(4): 1125- 1129.
[36] Merrild M P, Ambus P, Rosendahl S, Jakobsen I. Common arbuscular mycorrhizal networks amplify competition for phosphorus between seedlings and established plants. New Phytologist, 2013, 200(1): 229- 240.
[37] Shumway D L, Koide R T. Size and reproductive inequality in mycorrhizal and nonmycorrhizal populations ofAbutilontheophrasti. Journal of Ecology, 1995, 83(4): 613- 620.
[38] Facelli E, Facelli J M. Soil phosphorus heterogeneity and mycorrhizal symbiosis regulate plant intra-specific competition and size distribution. Oecologia, 2002, 133(1): 54- 61.
[39] Zhang Z H, Hu B Q, Hu G. Spatial heterogeneity of soil chemical properties in a subtropical karst forest, southwest China. The Scientific World Journal, 2014, 2014: 473651.
