茶叶多酚氧化酶同工酶热稳定性分析
2017-03-09陈盛虎徐小云伍梦瑶黄莹捷
陈盛虎++徐小云++伍梦瑶++黄莹捷++姚燕妮++黄友谊

摘要:对分离纯化得到的龙井43多酚氧化酶同工酶在30~50 ℃下的热稳定性进行了分析,发现多酚氧化酶同工酶PPOⅡ、PPOⅢ在30 ℃时的热稳定性最高,随温度的升高其热稳定性下降;多酚氧化酶粗酶的热稳定在40 ℃时最高,并整体高于多酚氧化酶同工酶的热稳定性。试验结果给茶叶生产中维持适当的温度来控制多酚氧化酶的活性提供了依据。
关键词:茶叶;多酚氧化酶;同工酶;酶活力;热稳定性
中图分类号:S571.1 文献标识码:A 文章编号:0439-8114(2017)01-0095-04
DOI:10.14088/j.cnki.issn0439-8114.2017.01.024
Thermal Stability Analysis on Polyphenol Oxidase Isozymes from Camellia sinensis
CHEN Sheng-hu, XU Xiao-yun, WU Meng-yao, HUANG Ying-jie, YAO Yan-ni, HUANG You-yi
(Ministry of Education Key Laboratory of Horticultural Plant Biology/Horticulture and Forestry Science College, Huazhong Agricultural University, Wuhan 430070, China)
Abstract:The thermal stabilities of the polyphenol oxidase isozymes purified from Camellia sinensis cv. Longjing No. 43 were analyzed at 30~50 ℃,the results showed that the activities of two polyphenol oxidase isozymes PPOII and PPOIII were the highest under 30 ℃,and decreased with the increasing of temperature. The thermal stability of crude polyphenol oxidase was the highest under 40 ℃, and the overall thermal stability was higher than those of polyphenol oxidase isozymes. The experiment results provide a basis for maintaining appropriate temperature to control the activity of polyphenol oxidase in tea production.
Key words:Camellia sinensis; polyphenol oxidase; isozyme; enzyme activity; thermal stability
多酚氧化酶(Polyphenol oxidase, PPO, EC 1.10.3.1)在茶叶生理代谢及产品加工中具有重要作用。目前对茶叶PPO粗酶[1-3]研究较多,对其同工酶[4-6]也有一些报道,但整体而言对茶叶PPO同工酶的研究相对匮乏[7,8]。除在绿茶[9]中需要快速钝化PPO外,红茶加工[10,11]以及固定化酶体外制备茶黄素[12-14]等过程中都需要PPO具有很好的催化活性和热稳定性。已证实茶叶PPO单一同工酶较粗酶有更高的催化效率[5,7],并且茶叶PPO基因克隆和外源表达等方面的研究进展[15,16]也使得催化活性高、热稳定性佳的单一同工酶的工业化利用成为可能。本研究在成功分离纯化得到PPO同工酶的基础上,分析了PPO同工酶的热稳定性,丰富了对茶叶PPO同工酶的研究,可为生产中控制茶叶PPO的活性提供参考。
1 材料与方法
1.1 材料
龙井43号(Camellia sinensis var. Longjing 43)一芽二叶鲜叶于2015年春采自华中农业大学茶学专业教学基地。
试验仪器:DEAE Sepharose CL-6B(GE Health Bio-Sciences AB公司); Sephadex G-150(美国PHARMACIA公司);HH-2型恒温水浴锅(江苏金坛中大仪器厂);Synergy HT酶标仪(基因有限公司)。所用试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 PPO同工酶分离纯化 按许雷等[7,17,18]PPO同工酶分离纯化方法进行分离纯化。取适量茶鲜叶,加入PVP(聚乙烯吡咯烷酮,5%,W/V)和0.05 mol/L、pH 7.2的磷酸盐缓冲液(料液比1∶2),冰浴研磨,4 ℃下浸提12 h,离心、过滤制得粗酶液。对粗酶液进行30%~80%的硫酸铵沉淀,将所得沉淀用适量0.02 mol/L、pH 7.2磷酸盐缓冲液溶解后,再用4倍体积同样的缓冲液脱盐,制得上样液。将上样液用DEAE-Sepharose CL-6B材料进行阴离子交换层析,选用含0、0.05、0.10、0.20、0.30、0.40、0.50、0.60 mol/L NaCl的0.02 mol/L、pH 7.2的磷酸盐缓冲液各2倍柱体积进行梯度洗脱,280 nm下检测吸收峰并收集、脱盐、浓缩。再将收集峰用Sephadex G-150材料進行凝胶过滤层析,选用含有0.10 mol/L NaCl的0.02 mol/L、pH 7.2的磷酸盐缓冲液等梯度洗脱,280 nm下检测吸收峰并收集、脱盐、浓缩。重复上述过程,收集足量样品,4 ℃保存备用。
1.2.2 PPO同工酶的电泳检测 PPO同工酶条带数量采用非变性凝胶不连续垂直板电泳法进行检测。制备7.5%的分离胶和4%的浓缩胶。分别取PPOⅡ、PPOⅢ、粗酶液40 μL,加10 μL电泳上样缓冲液混合后于12 000 r/min离心10 min,取20 μL上样。冰浴条件下电泳,在样品中溴酚蓝迁移至靠近分离胶底部时停止。进行酶特异性反应染色30 min后,脱色至条带清晰。
1.2.3 PPO同工酶热稳定性分析 将PPOⅡ、PPOⅢ、粗酶液分别置于恒温水浴锅中于30、40、50 ℃下温浴60 min,每10 min取样1次,快速冰浴降温,测定酶活性。以未经过热处理的酶样品单位酶活力值记为100%,计算相对酶活力。
1.3 PPO酶活力测定
取酶液10 μL于96孔板中,加入0.1 mol/L、pH 5.6的柠檬酸磷酸盐缓冲液50 μL和75 μL反应混合液(0.1 mol/L柠檬酸磷酸盐缓冲液∶0.1%脯氨酸∶1%邻苯二酚=10∶2∶3,现配现用),置于酶标仪中37 ℃控温反应30 min,410 nm下每间隔1 min测定1次吸光值,根据30 min连续测定得来的吸光值曲线计算酶活力。将活性测定反应液的吸光值每分钟增加0.001定义为1个酶活力单位(U)。
1.4 PPO半衰期计算
按袁新跃[19]的方法计算茶叶PPO的半衰期,计算公式:T1/2=0.693/kd,kd=2.303log(E0/E1)/t,其中E0为初始酶活力,E1为保存一段时间后的酶活力,t为PPO在不同温度下的温浴时间,本试验中t=1 h。
1.5 PPO蛋白含量测定
依据Bradford法,使用蛋白质定量试剂盒测定蛋白质含量。
1.6 数据处理
采用Excel 2010和SPSS软件进行数据统计分析。所有数据均为3次重复试验的平均值。
2 结果与分析
2.1 茶树PPO同工酶分离纯度鉴定
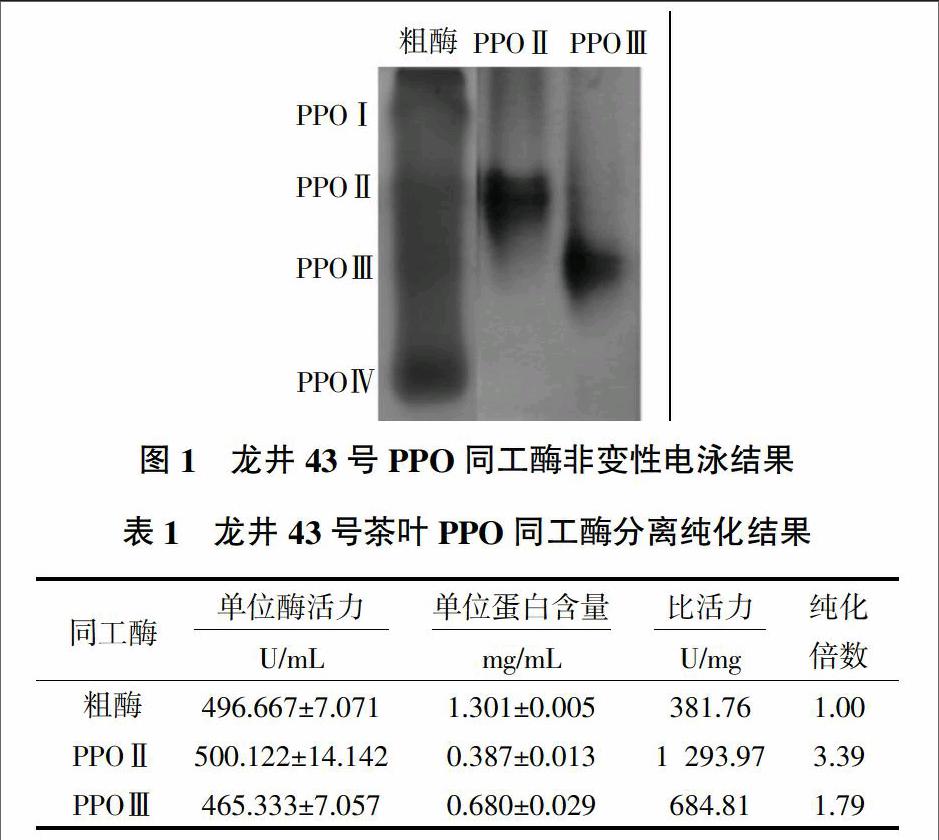
龙井43号茶树鲜叶经过匀浆浸提、硫酸铵沉淀、阴离子交换层析和凝胶过滤层析之后,非变性凝胶电泳检测结果(图1)表明,从主要含有4条明显PPO同工酶的粗酶中成功分离得到了第2、3条同工酶,分别记为PPOⅡ、PPOⅢ。从表1可知,PPOⅡ的比活力为1 293.97 U/mg,纯化倍数为3.39;PPOⅢ的比活力为684.81 U/mg,纯化倍数为1.79。在单位酶活力相近的情况下,粗酶蛋白质含量为1.301 mg/mL,含杂蛋白最多,PPOⅡ蛋白质含量为0.387 mg/mL,纯度更高。许雷等[7]同样利用龙井43号茶树鲜叶分离得到变性电泳纯的PPO同工酶,比活力为648.22 U/mg,纯化倍数为1.30,同工酶纯度较高,但酶活力下降,且得率很低,不便于后续试验分析。
2.2 不同温度热处理时PPO粗酶相对酶活性的变化
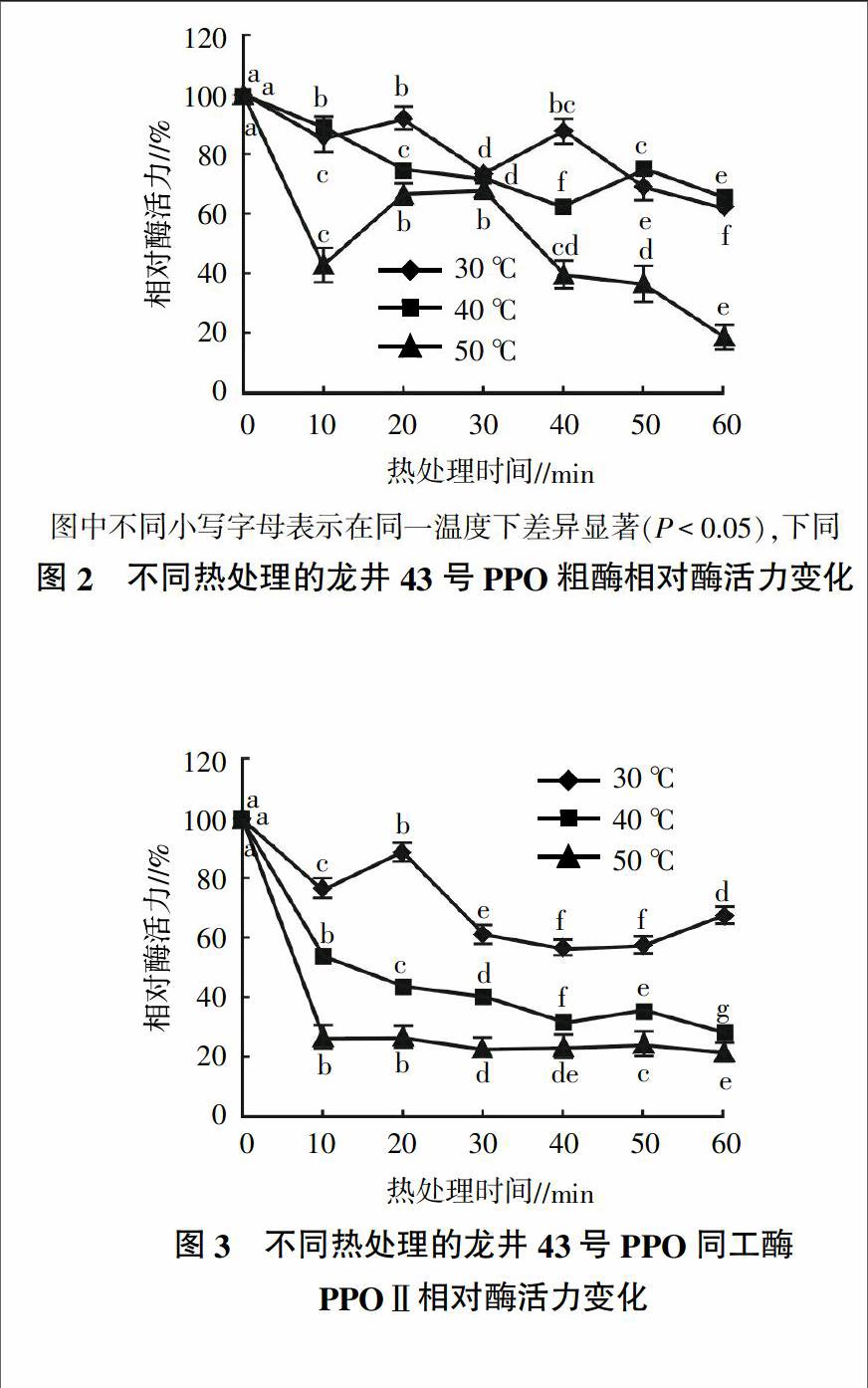
从图2可以看出,龙井43号PPO粗酶活力在30 ℃热处理时丧失最少,在第20分钟时酶活力有明显回升,此后酶活力持续下降,在第40分钟时酶活力又有所回升,到60 min时相对酶活仍保留有62.41%,表明PPO粗酶在30 ℃时热稳定性好。40 ℃处理60 min后,PPO粗酶相对酶活保留有65.71%,在第50分钟时相对酶活也有明显回升,表明PPO粗酶在30~40 ℃下较为稳定。在50 ℃下时,PPO粗酶相对酶活快速丧失,10 min后相对酶活仅剩余43.22%,但在第30分钟时又回升至68.64%,之后又快速下降,至60 min时仅剩19.03%。
2.3 不同温度热处理时PPO同工酶PPOⅡ相对酶活性的变化
如图3所示,龙井43号PPO同工酶PPOⅡ在30 ℃热处理10 min后,相对酶活为76.05%,在第20分钟时有明显回升,此后酶活力持续下降,在第60分钟时又有少量回升,相对酶活剩余67.64%。在40 ℃和50 ℃处理时,PPOⅡ相对酶活随热处理时间延长明显下降,但40 ℃第50分钟时相对酶活有少量回升,至60 min时仅剩余28.29%;在50 ℃下处理时相对酶活丧失最为快速,10 min后仅剩余26.49%,此后下降速度变缓,第50分钟时有极少量回升,在60 min后仍剩余21.57%,表明PPOⅡ在50 ℃熱处理10~60 min之间剩余的酶活保持稳定。
2.4 不同温度热处理时同工酶PPOⅢ相对酶活性的变化
如图4所示,龙井43号PPO同工酶PPOⅢ在30 ℃热处理时相对酶活丧失最少。在40 ℃和50 ℃处理时,PPOⅢ相对酶活随热处理时间延长明显下降,在40 ℃热处理60 min后相对酶活为46.94%;50 ℃处理时相对酶活快速丧失,10 min后仅剩余44.46%,此后下降速度变缓,至60 min时保留有33.34%。
2.5 不同温度热处理对龙井43号PPO酶活力的影响
如图2、图3、图4所示,龙井43号PPO粗酶、PPOⅡ、PPOⅢ等3个酶分别在30~50 ℃温度下温浴60 min后,酶活力相比初始酶活力均明显下降。根据不同温度下温浴60 min后酶活力的变化值,计算出龙井43号PPO粗酶、PPOⅡ、PPOⅢ等3个酶分别在30~50 ℃温度下的半衰期,结果见表2。从表2可以看出,30 ℃下PPO粗酶、PPOⅡ、PPOⅢ的半衰期分别为1.48、1.78、1.38 h,PPOⅡ的热稳定性显著高于PPO粗酶和PPOⅢ(P<0.05),PPO粗酶和PPOⅢ之间无显著差异。40 ℃下PPO粗酶、PPOⅡ、PPOⅢ的半衰期分别为1.65、0.55、0.92 h,PPO粗酶的半衰期最长,PPOⅡ的半衰期最短,三者间表现出极显著差异(P<0.01)。50 ℃下PPO粗酶、PPOⅡ、PPOⅢ的半衰期分别为0.42、0.45、0.63 h,PPO粗酶和PPOⅡ的酶活力保持时间相近,PPOⅢ酶活力保留时间较长,与前两者间有极显著差异(P<0.01),但PPO粗酶与PPOⅡ之间无显著差异。由以上可知,PPO粗酶在40 ℃时的热稳定性高于其他温度;而PPOⅡ和PPOⅢ在30 ℃时的热稳定性最好。
3 小结与讨论
3.1 茶叶PPO酶活力的热稳定性
整体可见,茶叶PPO酶活力随热处理温度升高和时间延长依次下降,30 ℃下PPO酶活力保留量较多,50 ℃时PPO酶活力即快速丧失。刘琨[20]发现碧螺春鲜叶PPO在30 ℃热处理时酶活力随时间延长先升后降,40 ℃时酶活力随时间延长持续下降,在50 ℃热处理时酶活力下降趋势明显强烈,与本研究结果一致。酶活力的丧失与酶蛋白空间构型的改变有直接关系,热处理是改变酶蛋白活性中心结构的常见方法[9]。高温能破坏H键或疏水键,从而使酶空间构型变化,活力丧失,温度越高破坏作用越强,酶活力丧失越快。茶叶PPO在30~50 ℃范围内仍保留酶活力,说明在此温度范围内,只有部分PPO构型发生改变。在30 ℃下茶叶PPO酶活力较50 ℃时高,且半衰期较50 ℃时长,说明处理温度越低,PPO活性中心的构型越稳定。另外茶叶PPO在30~50 ℃范围内出现多次酶活力回升的现象,可能是PPO酶蛋白空间构型的改变是可逆的,或是形成活性更高的PPO蛋白質构型。
3.2 茶叶PPO同工酶与粗酶的热稳定性差异
对PPO粗酶、PPOⅡ、PPOⅢ等3个酶样进行热稳定性分析后可知,单一条带的PPOⅡ、PPOⅢ在30~50 ℃热处理过程中,酶活力值回升次数明显少于粗酶,且在相同温度下酶活力的保留量也低于粗酶液,说明单一条带的PPOⅡ、PPOⅢ热稳定性较PPO粗酶差,可能是因为未经纯化的PPO粗酶中含有较多的杂蛋白或多肽,能对PPO蛋白起保护作用,增强其热稳定性;而同工酶蛋白较粗酶纯,受温度作用更为直接,活性丧失快。荣绍丰等[21]也发现一些蛋白质和多肽对谷氨酰胺转胺酶有保护作用,能增强其热稳定性,该发现支持了这一推论。但在30 ℃时PPOⅡ、PPOⅢ的活性增幅较粗酶明显,且PPOⅢ在60 min内平均酶活力值较粗酶高,说明在30 ℃时PPO蛋白结构受热破坏作用不明显,此温度下单一条带同工酶较粗酶催化效率更高。
3.3 茶叶PPO同工酶的热稳定性在生产上的应用
酶蛋白在反应温度条件下分子结构的稳定性是其发挥催化作用的关键,探明茶叶PPO及其同工酶在不同温度条件下的热稳定性,可为其实际应用提供理论依据。内源PPO在植物生理代谢及茶叶加工中的重要作用已无需赘言,外源PPO在红茶发酵及茶黄素制备等方面应用前景亦十分广阔[10,19]。在实际生产中,红茶发酵和体外酶促制备茶黄素等过程反应温度均在30 ℃左右,这与PPO粗酶、PPOⅡ和PPOⅢ在30 ℃时热稳定性高是相一致的。由此可见,在红茶生产中进行鲜叶萎凋和渥红发酵以及体外样化制备茶黄素等,均需注意控制温度,维持PPO酶活性,促进氧化过程的进行。
参考文献:
[1] ?譈MIT ?譈 M,SELIN N Y,■ENER A. Exraction, partial purification and characterisation of polyphenol oxidase from tea leaf(Camellia sinensis)[J]. GIDA,2011,36(3):137-144.
[2] RAJANNA L, RAMAKRISHNAN M. Isozyme studies on some selected Camellia clones[J].International Journal of Engineering Science and Technology,2010,2(12):6918-6921.
[3] 李荣林,方辉遂.一个世纪以来茶多酚氧化酶研究的进展[J].福建茶叶,1997(4):10-14.
[4] JYOTSNABARAN H, PRODIP T,BHADURI A N.Isolation and characterization of polyphenol oxidase from Indian tea leaf(Camellia sinensis)[J].The Journal of Nutritional Biochemistry,1998,9(2):75-80.
[5] TAKEO T,URITANI I.Tea leaf polyphenol oxidase part II. Purification and properties of the solubilized polyphenol oxidase in tea leaves[J].Agricultural and Biological Chemistry,1966, 30(2):155-163.
[6] TAKEO T,BAKER J E. Changes in multiple forms of polyphenol oxidase during maturation of tea leaves[J].Phytochemistry,1973,12(1):21-24.
[7] 许 雷,张书芹,陈盛虎,等.茶树多酚氧化酶同工酶的分离纯化[J].华中农业大学学报,2015,34(6):114-118.
[8] 张书芹.龙井43号多酚氧化酶同工酶质谱鉴定与酶性质研究[D].武汉:华中农业大学,2014.
[9] 胡振长.绿茶杀青中多酚氧化酶活性变化的研究[J].食品科学,1988(2):6-10.
[10] 谭振初,毛清黎,贾海云,等.利用外源天然酶提高红碎茶品质研究初报[J].福建茶叶,1990(2):18-21.
[11] 屠幼英.红茶萎凋过程中多酚氧化酶生化特性的变化[J].茶叶科学简报,1990(4):16-19.
[12] 屠幼英,方 青,梁惠玲,等.固定化酶膜催化茶多酚形成茶黄素反应条件优选[J].茶叶科学,2004(2):129-134.
[13] 吴红梅.多酚氧化酶酶源筛选及酶法制取茶色素研究[D].合肥:安徽农业大学,2004.
[14] 谷记平.茶黄素酶促氧化制备技术的研究[D].长沙:湖南农业大学,2004.
[15] 刘敬卫.茶树多酚氧化酶的基因克隆与原核表达[D].武汉:华中农业大学,2009.
[16] 王乃栋.茶多酚氧化酶基因的克隆及其工程菌的构建[D].山东泰安:山东农业大学,2012.
[17] 许 雷.茶树多酚氧化酶的提取、分离纯化及其部分酶性质研究[D].武汉:华中农业大学,2014.
[18] 许 雷,张书芹,徐小云,等.龙井茶树多酚氧化酶蛋白提取方法的优化[J].食品安全质量检测学报,2015(4):1237-1242.
[19] 袁新跃.树脂固定化多酚氧化酶及其催化茶多酚形成茶黄素的研究[D].北京:中国农业科学院,2009.
[20] 刘 琨.茶叶多酚氧化酶酶学特性及红外对其活力与构象的影响[D].江苏无锡:江南大学,2013.
[21] 荣绍丰,高红亮,常忠义,等.一些蛋白质和多肽对谷氨酰胺转胺酶热稳定性的影响[J].食品工业科技,2006(12):95-97.
