酒石酸美托洛尔片溶出曲线的测定和评价
2017-03-01孙蓉李丁康巍梅锦平
孙蓉+李丁+康巍+梅锦平

摘 要 目的:比较受试片剂和不同厂家市售片剂的溶出行为。方法:依据中国药典2015版第四部通则0931第二法,结合高效液相色谱法测定受试片剂和市售片溶出度,采用f2相似因子评价不同制剂溶出曲线的相似度。结果:三种介质中,受试制剂溶出曲线f2因子均大于50,市售片A的溶出曲线f2因子均小于50,市售片B在pH 4.0介质中的溶出曲线f2因子大于50,但在pH 1.2和pH 6.8介质中小于50。结论:受试片在三种介质中的f2因子均符合一致性评价要求,两种市售片剂则不完全符合,相对而言,pH6.8介质中测定、计算获得的f2因子可以在一定程度上区分不同来源酒石酸美托洛尔片的溶出行为。
关键词 酒石酸美托洛尔片 溶出曲线 一致性评价 相似因子
中图分类号:R927.11; R972 文献标识码:A 文章编号:1006-1533(2017)01-0072-04
Comparative studies on dissolution profiles of metoprolol tartrate tablets from different companies
SUN Rong*, LI Ding**, KANG Wei, MEI Jinping
(Shanghai Sine Promod Pharmaceutical Co. Ltd., Shanghai 202174, China)
ABSTRACT Objective: To compare the dissolution behaviors among home-made metoprolol tartrate tablets and two other commercially available ones. Methods: Dissolution was determined based on Chinese Pharmacopoeia and the similarity of dissolution among those tablets was evaluated by the f2 similarity factor. Results: As compared with the dissolution profiles of reference substance, the f2 similarity factors of the home-made metoprolol tartrate tablets were greater than 50, while those of the commercially available tablet A were less than 50 in pH 1.2, pH 4.0 and pH 6.8 media and those of the commercially available tablet B were greater than 50 in pH 4.0 medium, but less than 50 in pH 1.2 and pH 6.8 medium. Conclusion: The f2 similarity factors of home-made metoprolol tartrate tablets in three different media are consistent with those of reference substance, but two commercially available tablets are not or only partially, indicating that the dissolution behaviors of metoprolol tartrate tablets from different companies can be distinguished to some extent by f2 similarity factors calculated based on the dissolution profiles determined in pH 6.8 medium.
KEY WORDS metoprolol tartrate tablets; dissolution profiles; consistency; f2 similarity factor
美托洛尔系高选择性β1受体阻滞剂,可以减低心肌自律性,延长房室结有效不应期,减慢传导速度,提高室颤阈值,防止室速、室颤的发生。酒石酸美托洛尔片能有效治疗高血压、心绞痛、心肌梗塞、肥厚型心肌病、主动脉夹层、慢性心力衰竭、心律失常和心脏神经官能症等疾病[1-4]。在我国,酒石酸美托洛尔片是常用的高血压、心力衰竭、心绞痛疾病等治疗药物,相对进口制剂,国产药品在用药成本上更有优势[5-8]。
国内有十几家企业生产酒石酸美托洛尔片,市售产品质量良莠不齐,按照2015版中国药典方法,仅对制剂进行溶出度检测无法反映产品质量的真正差异,只有通过全面、深入地进行溶出度试验以及溶出曲线的精确、客观绘制,才可揭示各制剂的差别和内在品质的优劣[9]。国家药监局高度重视仿制药的质量,下发了一系列文件要求并指导企业做好仿制药一致性评价工作,并且提供了酒石酸美托洛尔片对照品的标准溶出曲线供企业参考[10]。
本研究通过受试片剂和不同来源市售酒石酸美托洛尔片的溶出曲线与对照品标准曲线进行比较,探索与药典方法相比,可以在体外能更好地区分不同来源酒石酸美托洛尔片的品质的方法。
1 材料与方法
1.1 仪器与试药
ZRS-8G智能溶出试验仪( 天津天大天发科技有限公司),高效液相色谱仪(Agilent 1260,美國Agilent公司),AL204型电子分析天平(瑞士梅特勒托利多公司)。酒石酸美托洛尔对照品(中国药品生物制品检定所,批号:100084-200101);酒石酸美托洛尔受试片(上海信谊百路达药业有限公司,批号1459026,规格25 mg);市售片A和B(分别为厂家A和B产品,批号14032301和20140724,规格均为25 mg);乙腈(色谱纯,百灵威科技有限公司);其它试剂均为分析纯,全部购自上海国药试剂有限公司;蒸馏水(自制)。
1.2 方法
1.2.1 色谱条件
采用Agilent C18柱( 4.6×150 mm,5 μm),以0.1 mol/L高氯酸钠溶液(用0.85%高氯酸调节pH 至3.2)-乙腈(3∶1)为流动相,检测波长274 nm,柱温30 ℃,流速1 ml/min,进样量50 μl。理论板数按美托洛尔峰计算不低于2 000,拖尾因子不大于1.5[ 1 0 ]。
1.2.2 标准曲线
精密称取酒石酸美托洛尔对照品11.2 mg,用水溶解并稀释至200 ml,配制成浓度为56.0 μg/ml的酒石酸美托洛尔储备液;然后系列稀释成2.8、5.6、11.2、22.4、28 μg/ml的溶液,分别取样进行液相色谱测定并计算回归方程。
1.2.3 稳定性考察
精密称量酒石酸美托洛尔对照品5.6 mg,置于200 ml量瓶中,分别用pH 1.2、pH 4.0、pH 6.8的缓冲液溶解,定容。于配制后0、2、4、6、8、24 h各取样测定峰面积。
1.2.4 仪器精密度
以28.0 μg/ml的酒石酸美托洛尔对照品溶液为试样,连续6次进行HPLC测定,考察仪器精密度。
1.2.5 加样回收率
由于溶出介质是pH 1.2,pH 4.0,pH 4.8的水溶性缓冲液,酒石酸美托洛尔在这三种介质中稳定性良好,缓冲液对检测专属性无影响,因此仅用水作回收率试验。
精密称定酒石酸美托洛尔原料药14、22和28 mg,分别置于100 ml量瓶中,加水超声溶解并定容,共处理3个平行,再分别吸取10 ml于100 ml容量瓶中,按处方比例加入空白辅料,加水稀释至刻度,摇匀,滤过,取续滤液,作为回收率50%、80% 和100%供试品溶液,并以28.0 μg/ml酒石酸美托洛尔为对照品溶液。对照品和供试品溶液分别进行液相色谱测定,记录峰面积,并按外标法计算即得。
1.2.6 溶出曲线测定和比较
按照(中国药典2015版第四部通则0931第二法)及《酒石酸美托洛尔片一致性评价参比制剂/溶出曲线测定(草案)》操作和测定溶出度,绘制溶出曲线[10]。
溶出曲线相似性评价方法有多种[11-12],本研究采用相似因子(f2)法比较溶出曲线相似性,评价受试制剂与参比制剂的溶出行为异同。f2因子计算公式如下:
其中n为取样时间点个数,Rt为参比样品在t时刻的溶出度值,Tt为受试样品在t时刻的溶出度值。每种溶出介质中,每个样品平均溶出量是12片的均值,从5 min开始,分别于5、10、15、30、45、60 min共6个时间点取样。通常情况下,前3个时间点累积释放度较快,30 min后达到溶出平台。以上述6个点的取样时间为横坐标,累积释放度为纵坐标,绘制溶出曲线,并以5~45 min的 5个取样时间点的累积释放度计算f2因子,若50≤f2≤100,则表示受试制剂与参比制剂溶出行为相似。
2 结果
2.1 方法学验证
1)稳定性 酒石酸美托洛尔在三种介质中峰面积的RSD值分别為0.15%,0.23%,0.29%,表明,酒石酸美托洛尔在这三种介质中24 h内均稳定。
2)仪器精密度 6次测定的RSD值为0.34%,说明仪器精密度良好。
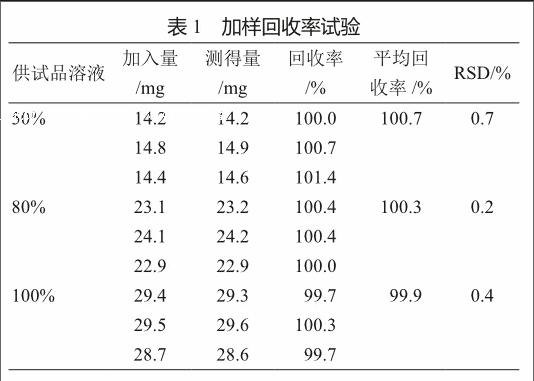
3)加样回收率 50%、80%和100%供试品溶液的平均回收率分别为100.7%、100.3%、99.9%、RSD<2%,表明本方法加样回收率良好(表1)。
2.2 标准曲线
以浓度为横坐标、峰面积为纵坐标,进行线性回归测,溶出度大于75%即合格。但采用单点溶出度控制药物学溶出行为,对很多产品而言并不能全面准确地反映产品的溶出行为,也不能反映固体制剂之间的质量差异。科学的选用溶出条件,比较药物制剂在不同溶出介质中的溶出行为已成为对口服固体制剂质量一致性和体内生物等效性评估的重要手段[14-15]。
本研究考察的受试片、市售片A和B的累积溶出曲线,虽然都符合药典收载标准的要求,但溶出行为存在处理,计算得回归方程Y=11.245X+0.5636,相关系数R2=0.999 95,说明在2.8~56 μg/ml浓度范围内线性关系良好,检测限为5 ng。
2.3 累积溶出度曲线比较
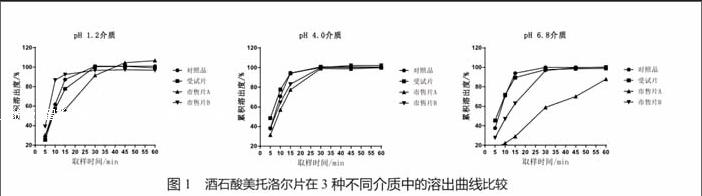
每种试样(12片)在3种pH介质中的累积溶出曲线见图1。由试验结果可知,3种制剂于pH 1.2介质中在30 min内的累积溶出度都可达75%以上,但溶出行为却有较大差别(表2),与对照品的溶出曲线相比,受试片、市售片A和B的f2因子分别为65、41和45;在其他两种介质中,受试片的f2因子均大于50,市售片A均小于50,而市售片B在pH 4.0介质中大于50,但在pH 6.8介质中小于50,表明两市售片的质量均不符合一致性评价的相关要求。
3 讨论
中国药典2015版(二部)规定了酒石酸美托洛尔片溶出度检测方法[13],30 min取样,紫外分光光度法检明显差别,由此可见,不同处方配比和生产工艺条件下生产出的酒石酸美托洛尔片,有效成分的释放不尽相同,药典方法并不能完全区分不同厂家制剂溶出行为的差异。人体消化道的pH和蠕动速度存在个体差异,而一个品质优良的药物,应在各种pH的消化液中及在较低的蠕动速度下,均能较为稳定和高效地释放。含量合格的药物,如不能在体内较好地释放,仍不能达到预期的治疗效果。溶出曲线能间接反映出生物利用度,可作为临床选择药物的参考。
与对照品在3种介质中的溶出曲线相比,受试片溶出行为均与其一致,市售片A均不一致、市售片B在pH 6.8和pH 1.2两种介质中不一致,相对pH 1.2介质而言,在pH 6.8介质中的研究结果更具有区分力。
综上所述,采用pH 6.8溶出介质测定溶出曲线较现行中国药典单点溶出度测定方法能进一步区分不同厂商来源的酒石酸美托洛尔片剂的质量,可为酒石酸美托洛尔片的质量控制提供参考和依据。
参考文献
[1] Hialmarson A. Effects of beta blockade on sudden cardiac death during acute myocardial infarction and post-infarction period[J]. Am J Cardiol, 1997, 80(9B): 35J-39J.
[2] MIAMI Trial Research Group. Metoprolol in acute myocardial infarction(MIAMI): a randomized placebocontrolled international trial[J]. Eur Heart J, 1985, 6(3): 199-226.
[3] Fox K, Borer JS, Camm AJ, et al. Resting heart rate in cardiovascular disease [J]. Am J Cardiol, 2007, 50(9): 823-830.
[4] 张陶莉, 沈荣岩. 酒石酸美托洛尔治疗老年慢性心力衰竭疗效观察[J]. 中国病案, 2010, 11(11): 23-24.
[5] 王平绪, 顾琴. 酒石酸美托洛尔片治疗老年人高血压病118例分析[J]. 中国医药导报, 2011, 8(21): 134, 137.
[6] 陈中奎, 程青丽, 付晶晶. 酒石酸美托洛尔片治疗慢性心力衰竭80例临床观察[J]. 中国社区医师, 2014, 30(15): 24-25.
[7] 吴勤英, 罗玉寅. 國产与进口酒石酸美托洛尔治疗原发性高血压的疗效与经济比较[J]. 中国现代医生, 2012, 50(22): 56-57.
[8] 陈胜海, 寿华达, 钟琴娟. 酒石酸美托洛尔片用于慢性阻塞性肺疾病合并心力衰竭患者的临床观察[J]. 中国临床药理学杂志, 2013, 29(2): 91-93.
[9] 谢沐风. 溶出曲线相似性的评价方法[J]. 中国医药工业杂志, 2009, 40(4): 308-311.
[10] 中国食品药品检定研究院化学药品检定所. 《酒石酸美托洛尔片一致性评价参比制剂/溶出曲线测定(草案)》[EB/ OL]. (2013-12-31)[2016-06-13]. http://www.nifdc.org.cn/fzy/ CL0628/5203.html.
[11] 夏锦辉, 刘昌孝. 固体药物制剂的体外溶出度的统计学评价分析[J]. 中国药学杂志, 2000, 35(2): 130-131.
[12] 陈贤春, 吴清, 王玉蓉, 等. 关于溶出曲线比较和评价方法[J]. 中国医院药学杂志, 2007, 27(5): 662-664.
[13] 国家药典委员会. 中华人民共和国药典2015版二部[M].北京: 中国医药科技出版社, 2015: 1189.
[14] 张启明, 谢沐风, 宁保明, 等. 采用多条溶出曲线评价口服固体制剂的内在质量[J]. 中国医药工业杂志, 2009, 40(12): 946-950, 955.
[15] 国家食品药品监督管理总局.《普通口服固体制剂溶出度试验技术指导原则》[EB/OL]. (2015-02-05)[2016-06-13]. http://www.sda.gov.cn/WS01/CL1616/114288.html.
