金霉素生物合成基因ctcK的研究
2017-02-28林龙镇万云凤洪文荣
林龙镇,万云凤,洪文荣
(福州大学生物科学与工程学院,中国 福州 350108)
金霉素生物合成基因ctcK的研究
林龙镇,万云凤,洪文荣
(福州大学生物科学与工程学院,中国 福州 350108)
为检测ctcK基因的功能,利用基因工程技术在金色链霉菌J13(StreptomycesaureofaciensJ13)上构建ctcK基因缺失工程菌SK12(ΔctcK),并分析了其次级代谢产物的变化.经质谱分析显示,工程菌SK12代谢物中检测到去甲基金霉素m/z=465.10 [M+H]+的分子离子峰,但未检测到金霉素m/z=479.12 [M+H]+的分子离子峰,这与出发菌J13代谢物的检测结果相反.结果表明,ctcK基因的失活阻断了金霉素的生物合成代谢流,使工程菌SK12主要积累去甲基金霉素,显示ctcK基因参与金霉素C-6位甲基化.本研究初步阐明了ctcK基因的功能,同时获得了一株主产去甲基金霉素的工程菌.
ctcK基因;去甲基金霉素;甲基化;生物合成;金色链霉菌
金霉素(CTC)是一类临床上主要用于治疗革兰氏阳性球菌,特别是葡萄球菌(Staphylococcus)、肺炎球菌(Streptococuspneumoniae)的四环类广谱抗生素.除了抗生和抗炎功效之外[1-3],自20世纪80年代以来,科学家还陆续发现金霉素具有抗肿瘤活性[4]、非抗菌作用[5]及非抗感染用途[6].去甲基金霉素(DMCTC),亦属于四环类抗生素,与金霉素相比在C-6位少了一个甲基.去甲基金霉素不仅对革兰氏阳性和阴性菌有抑菌活性,对衣原体(Chlamydia)、立克次体(Rickettsia)、肺炎支原体(Mycoplasmapneumonia)等致病性病毒亦有很好的抑制效果.与金霉素相比,去甲基金霉素不仅抗菌活力更强、结构更稳定、还因具有易被人体吸收、排泄快、长效性和高效性等优点而被广泛应用.此外,它还是合成米诺环素和替加环素的重要母体[7].
金霉素生物合成途径和生物合成基因的相关研究不多[8-10].2013年,邓子新团队报道了金霉素生物合成基因簇并确定了卤化酶基因,同时还推测ctcK基因可能是金霉素C-6位甲基化酶基因,但至今仍未经生物学实验证明(GenBank:HM627755)[11].基于本实验室已建立的大肠杆菌(Escherichiacoli)与金色链霉菌接合转移体系[12-13],本研究采用基因框内敲除方法,特异性灭活ctcK基因,分析ctcK基因失活突变株代谢产物的变化,旨在阐明ctcK基因在金霉素pretetramid到6-methylpretetramid生物转化中的作用,进而验证ctcK基因是否为金霉素C-6位甲基化酶基因.研究结果可间接获得主产去甲基金霉素的工程菌,为开发去甲基金霉素等系列药物奠定基础.
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 金色链霉菌J13,大肠杆菌top10,大肠杆菌ET12567(pUZ8002),大肠杆菌-链霉菌穿梭质粒pKC1139及pJTU412均为本实验室保藏;克隆载体pMD19-T购自TaKaRa公司.
1.1.2 培养基与抗生素 金色链霉菌斜面培养基及预萌发培养基见文献[13],种子培养基及发酵培养基见文献[14];大肠杆菌生长培养基为LB培养基[15].本研究中使用的抗生素及其终浓度分别为:氨苄青霉素 100 mg/L,安普霉素 50 mg/L,氯霉素 25 mg/L,卡那霉素 50 mg/L,萘啶酮酸 25 mg/L.
1.1.3 主要试剂 限制性内切酶、TaqDNA聚合酶和T4 DNA连接酶均购自TaKaRa公司;溶菌酶,RNase A酶,Proteinase K和DNA凝胶回收试剂盒均购自上海生工公司;其他常规试剂见文献[16].
1.2 方法
1.2.1 引物设计 以金霉素生物合成基因簇(GenBank:HM627755)为模板,设计两对引物K1/K2和K3/K4,分别用于扩增ctcK基因上游交换臂KB1和下游交换臂KB2;再根据同源重组原理,设计两对筛选单交换和双交换的鉴定引物K5/K6和K7/K8;引物序列及其限制酶见表1.

表1 本研究所用引物
1.2.2 分子克隆 PCR、酶切、酶连、大肠杆菌感受态细胞制备及其转化、小量质粒DNA提取,方法参见实验手册[17];金色链霉菌染色体DNA提取参见链霉菌遗传操作手册[16];DNA测序委托上海生工公司.
1.2.3 单交换突变株筛选 将重组质粒转化大肠杆菌ET12567(pUZ8002),再通过接合转移方法将其导入金色链霉菌J13.35 ℃培养16~20 h后,覆盖30 mg/L安普霉素和25 mg/L萘啶酮酸,继续在35 ℃培养,4 d后长出接合子.挑取其中一株命名为金色链霉菌SK11,简称SK11,提取其基因组DNA作为模板,进行PCR验证.接合转移具体方法见文献[14].
1.2.4 双交换突变株筛选 将单交换工程菌在斜面培养基上松弛培养5代,然后分离单菌落,将单菌落影印至含安普霉素的抗性平板和不含抗生素的普通平板上.培养5 d后,从887株菌中筛选得到1株安普霉素敏感菌株,命名为金色链霉菌SK12,简称SK12,提取其基因组DNA,进行PCR验证.
1.2.5 发酵及代谢产物组分检测 对菌株进行分离纯化,获得长势较好的单菌落,转接斜面35 ℃培养5~7 d,待斜面孢子丰满.刮取适量的孢子接种于种子培养基中,32 ℃,280 r/min振荡培养18~22 h,使菌体处于对数生长期.再按照10%的接种量接种于发酵培养基中,29 ℃,265 r/min,发酵72 h.放瓶后,将发酵液用草酸酸化至pH 1.2~1.5,并于4 ℃静置30 min,以释放效价.再依次加入0.1%~0.2%的黄血盐及0.1%~0.2%的硫酸锌,不断搅拌10 min,以除去蛋白.然后4 ℃,12 000 r/min,离心5 min,取上清,经甲醇稀释5倍,过0.22 μm滤膜,所得样品直接用于高效液相色谱分析.样品经甲醇稀释至适当浓度,再过0.22 μm滤膜,用于质谱分析.
1.2.6 高效液相色谱条件及质谱方法 液相色谱条件:采用岛津液相色谱仪LC-20A和SinoChrom ODS-BP色谱柱 (4.6 mm×250 mm,5 μm)进行分析;流动相中V(甲醇)∶V(10 mol/L甲酸)=20∶80;流速:1 mL/min;柱温40 ℃;检测波长360 nm;进样量:10 μL.
质谱扫描条件:采用Exactive Plus高分辨质谱仪和电喷雾离子化源(ESI源)进行测定;极性检出模式:正模式(MS+);毛细管电压:3 800 V;干燥气:N2;流速:6 L/min;干燥气温度:320 ℃;检测方式:一级全扫描.
2 结果与分析
2.1 CtcK蛋白序列基本性质分析
通过生物信息学软件Vector.NTI 11.5查找已公布的金霉素生物合成基因簇(GenBank:HM627755)并将ctcK基因序列翻译成CtcK蛋白氨基酸序列.使用瑞士生物信息中心引擎(http://web.expasy.org/cgi-bin/protscale/protscale.pl)及蛋白质二级结构在线分析软件TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)分析此蛋白氨基酸的亲疏水性和跨膜区,可知CtcK蛋白以疏水性氨基酸为主,且CtcK蛋白不具有跨膜区,蛋白全部在膜外.
2.2 CtcK蛋白三维结构及功能分析

图1 CtcK蛋白三维结构示意图Fig.1 Tertiary structure of CtcK
将CtcK蛋白氨基酸序列通过SWISS-MODEL(http://swissmodel.expasy.org/)进行同源建模,经Rasmol软件进行显示和分析,结果如图1(彩图见封三).该蛋白含有两条肽链,二级结构以α-螺旋为主.再经蛋白保守结构域在线分析(http://www.ncbi.nlm.nih.gov/structure/cdd/wrpsb.cgi)表明CtcK中76 aa~317 aa组成SAM依赖型甲基转移酶结构域.因此推测ctcK基因可能是负责催化金霉素C-6位甲基化酶的基因.
2.3 重组质粒pJTK2的构建
以J13的染色体DNA为模板,用两对引物K1/K2和K3/K4分别扩增上游交换臂KB1(2 033 bp)和下游交换臂KB2(2 051 bp).PCR样品经电泳检测后,回收目标条带并进行TA克隆,得到中间质粒pTK1和pTK2.质粒pTK1和pTK2分别经XbaⅠ/EcoRⅤ和EcoRⅤ/EcoRⅠ双酶切后,回收KB1和KB2片段;质粒pJTU412经XbaⅠ/EcoRⅠ双酶切,回收7 879 bp的片段并与KB1和KB2片段进行酶连,构建质粒pJTK1;最后,用EcoR Ⅰ对质粒pJTK1和puc30-apr分别进行单酶切,分别回收11 951 bp和1 168 bp的片段,再次酶连,经筛选得到最终质粒pJTK2(pJTU412∶∶KB1∶∶KB2∶∶apr),其酶切验证见图2-B.该质粒以KpnⅠ/BglⅡ双酶切,得到5 234,3 766,2 978和1 141 bp四条带;用EcoR Ⅰ/XbaⅠ双酶切,得到7 879,4 072,1 141和27 bp四条带;用EcoR Ⅴ/HindⅢ双酶切,得到9 289,2 855和975 bp三条带;pJTK2经以上3种方式酶切,电泳条带大小均与理论预测一致,克隆系列经测序与预测吻合.由此,重组质粒pJTK2构建完毕.

图2 质粒pJTK2的物理图谱(A)及其酶切鉴定图(B)
Fig.2 Schematic diagram of plasmid pJTK2 (A),and validation of pJTK2 by endonuclease (B)
2.4 金色链霉菌SK12重组菌株的构建
接合转移得到的突变株SK11,用引物K5/K6扩增到1 559 bp和2 300 bp片段,PCR产物电泳检测结果与理论预测大小一致,初步确定为单交换菌株,电泳结果见图3-B泳道2.
影印筛选得到的突变株SK12,用引物K5/K6和K7/K8分别扩增到1 559 bp和2 454 bp片段,与亲株相比均缺失了741 bp片段,电泳结果见图3-B泳道3和6.经测序分析,证明SK12确实为ctcK基因框内缺失工程菌.
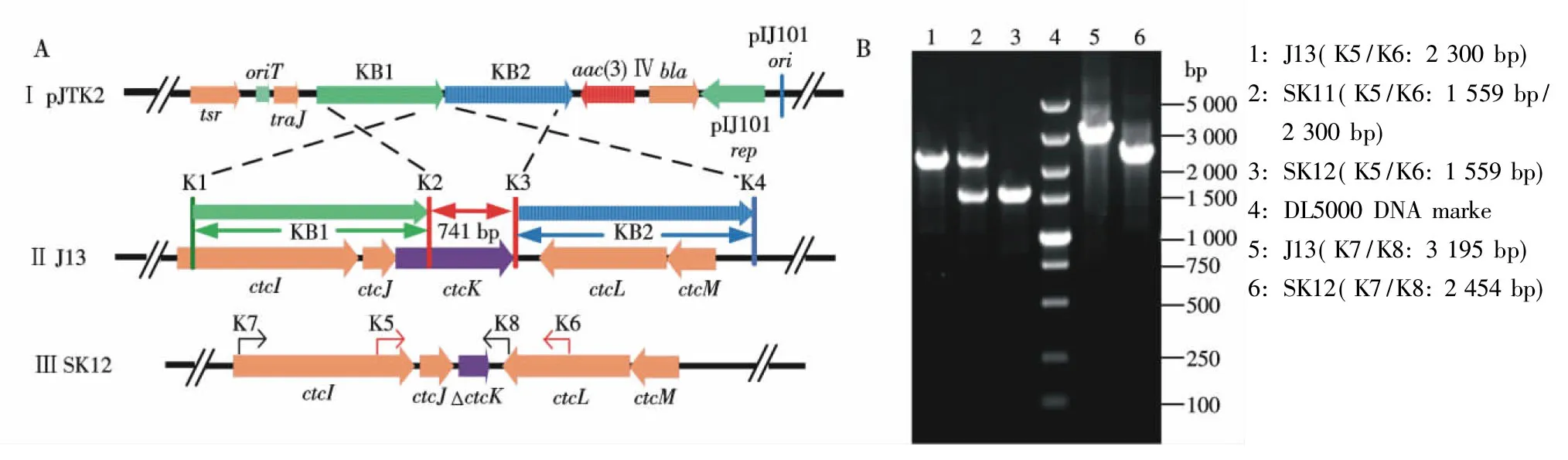
图3 pJTK2质粒与J13染色体DNA同源重组示意图(A)及其突变株PCR鉴定电泳图(B)
Fig.3 Diagram showing the homologous recombination of plasmid pJTK2 and J13 chromosomal DNA (A),and PCR assay for the verification of the mutants (B)
2.5 工程菌SK12的菌落形态及代谢产物分析
ctcK基因缺失工程菌SK12的基内菌丝体为棕红色,而亲株J13为棕黄色.除此之外,工程菌SK12与亲株J13的孢子颜色均为棕灰色,且生长周期相同,这与程惠芳所报道的去甲基金霉素突变株的菌落形态相符[18].继续用传代方法将SK12传5代后,其菌落形态依旧保持稳定.将SK12和J13按1.2.5方法进行发酵及代谢产物组分分析,经高效液相色谱检测,结果如图4.J13样品(图4,c)与金霉素标准品(图4,a)主峰保留时间基本相近,分别为31.193 min和32.184 min,因此认为31.193 min的峰为金霉素峰.SK12样品(图4,d)与去甲基金霉素标准品(图4,b)主峰保留时间也基本相近,分别为20.260 min和19.712 min,因此认为20.260 min的峰为去甲基金霉素峰.据此可知,与亲株J13(图4,c)相比,工程菌SK12(图4,d)不再合成金霉素,而主产去甲基金霉素,说明ctcK基因的缺失阻断了金霉素的合成,使金霉素合成代谢积累在去甲基金霉素,显示ctcK基因参与C-6位甲基化.

(a) 0.5 g/L金霉素标准品; (b) 0.5 g/L去甲基金霉素标准品; (c) 出发菌J13样品; (d) 工程菌SK12样品图4 J13和SK12代谢产物高效液相色谱分析图Fig.4 HPLC analysis of metabolites from J13 and SK12
由于金霉素及去甲基金霉素含有氯原子,因此有典型的[A+2]同位素峰,且[A]∶[A+2]≈3∶1.而四环素不含氯原子,所以没有[A+2]同位素峰.质谱检测结果显示,出发菌J13代谢产物中检测到金霉素m/z=479.12 [M+H]+的准分子离子峰及其[A+2]的同位素峰m/z=481.12 [M+H]+,且两者丰度比约为3∶1,与理论相符,检测结果见图5.此外,J13代谢产物中还检测到四环素的准分子离子峰m/z=445.16 [M+H]+,但未检测到去甲基金霉素的离子峰,这可能是由于去甲基金霉素相对含量较低,因此未能检测出来.另外,质谱图中的离子峰m/z=146.08 [M+H]+,m/z=161.09 [M+H]+,m/z=282.28 [M+H]+,m/z=338.34 [M+H]+,m/z=381.08 [M+H]+,m/z=527.16 [M+H]+可能是碎片峰或杂质峰,因为在金霉素生物合成途径中均没有相应质量数的中间代谢产物.与亲株J13相反,工程菌SK12代谢产物中检测到了去甲基金霉素m/z=465.10 [M+H]+的准分子离子峰及其[A+2]的同位素峰m/z=467.10 [M+H]+,但未检测到金霉素和四环素的离子峰.质谱结果进一步说明ctcK基因的缺失阻断了金霉素的合成,使金霉素合成代谢积累在去甲基金霉素,初步阐明了ctcK基因负责参与催化C-6位甲基化.此外,SK12代谢产物中检测到m/z=365.10 [M+H]+(6-Pretetramid)的离子峰,但未检测到m/z=351 [M+H]+(Pretetramid)的离子峰,这可能是因为ctcK基因的缺失不能完全阻断Pretetramid到6-Pretetramid 的代谢流.当然,也有可能是因为m/z=365.10 [M+H]+不是6-Pretetramid的离子峰,而是碎片峰或杂质峰.
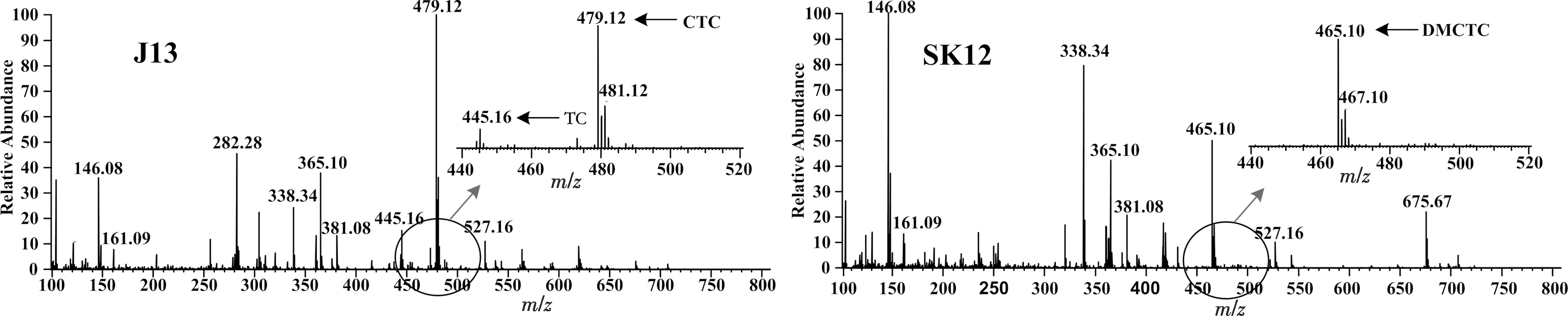
图5 J13和SK12代谢产物质谱分析图Fig.5 MS analysis of metabolites from J13 and SK12
2.6ctcK基因回补实验
以金色链霉菌J13的基因组DNA为模板,通过K1/K4引物PCR扩增KB3片段(4 811 bp),将其克隆到pMD19-T载体,得到阳性克隆子,提取其质粒,并命名为质粒pKB11.质粒pKB11和质粒pKC1139分别用XbaⅠ/EcoRⅠ双酶切,再经回收、酶连、转化、筛选阳性克隆子,获得ctcK基因回补同源重组质粒pKB12(pKC1139∶∶KB3),其酶切验证见图6-B.将pKB12转入ET12567(pUZ8002),并通过接合转移方法将其导入工程菌SK12中,筛选获得一株pKB12质粒整合到SK12染色体上的重组菌株,命名为金色链霉菌SK13.由于该重组菌株存在同源片段,容易发生二次重组.因此可通过影印筛选获得ctcK基因回复突变株SK14(简称SK14),PCR电泳检测结果见图7-B.将SK14按照1.2.5中的方法进行摇瓶发酵并用高效液相色谱对其代谢产物进行分析.结果表明,SK14(图8,b)重新主产金霉素,与亲株J13(图8,a)相比没有明显差异,进而再次证明ctcK基因是负责参与催化C-6位甲基化的基因.

图6 质粒pKB12的物理图谱(A)及其酶切鉴定图(B)
Fig.6 Schematic diagram of plasmid pKB12 (A),and validation of pKB12 by endonuclease (B)

图7 pKB12质粒与SK12染色体DNA同源重组示意图(A)及其回复突变株PCR鉴定图(B)
Fig.7 Diagram showing the homologous recombination of plasmid pKB12 and SK12 chromosomal DNA (A),and PCR assay for the verification of the reverse mutant (B)

图8 J13(a)和SK14(b)代谢产物高效液相色谱分析图Fig.8 HPLC analysis of metabolites from J13(a) and SK14(b)
3 结论与讨论
四环类抗生素生物合成过程中,C-6甲基化酶基因一直是研究热点,但至今仍未完全阐明.2007年,Zhang等将龟裂链霉菌(Streptomycesrimosus)oxyF基因进行异源表达,证实了OxyF为土霉素C-6位甲基化酶,负责pretetramid 到6-methylpretetramid的生物转化过程,且表明OxyF对pretetramid底物具有高度特异性[19].本研究在此基础上,通过序列比对发现ctcK基因与oxyF基因序列同源性高达74.4%,且经生物信息学分析再次发现CtcK蛋白中亦存在SAM依赖型甲基转移酶结构域,因此推测ctcK基因可能参与金霉素C-6位甲基化.据此,本研究利用基因敲除技术灭活ctcK基因,获得ctcK基因失活突变菌SK12(ΔctcK).经HPLC及MS分析显示,工程菌SK12不再合成金霉素,主要积累去甲基金霉素,与出发菌J13主要积累金霉素明显不同,说明ctcK基因的失活阻断了金霉素的生物合成代谢流,使工程菌积累去甲基金霉素,初步阐明了ctcK基因参与C-6位甲基化.此外,ctcK基因的缺失并没有使代谢积累pretetramid,而是继续合成去甲基金霉素,这可能是由于后续的下游修饰酶对底物的特异性要求不高,使得pretetramid可以进行后续的一系列氧化、卤化、转氨及氨二甲基化等修饰作用,最终合成去甲基金霉素.
通过基因回补实验,将ctcK基因重新导入工程菌SK12(ΔctcK)中,获得回复突变株SK14,其代谢产物主要积累金霉素,与出发菌J13相同.这与Ryan等将ctc09基因(与ctcK基因序列同源性高达99.4%)克隆至pLP212281表达载体,并导入产6-去甲基四环素的金色链霉菌A377中,得到突变株主产四环素的研究结果相符[9].这两个研究结果不仅表明ctcK基因可能是金霉素C-6位甲基化酶基因,还显示CtcK可以催化四环类抗生素pretetramid到6-methylpretetramid的甲基化反应,催化途径如图9.然而,基因功能的最终确定还须对该基因进行体外表达等一系列研究工作.
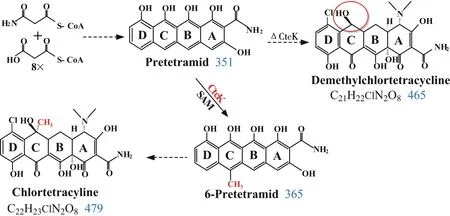
图9 金霉素生物合成过程中ctcK基因催化途径图Fig.9 Catalytic pathway of the ctcK in chlortetracycline biosynthesis
[1] NGUYEN F,STAROST A L,ARENZ S,etal.Tetracycline antibiotics and resistance mechanisms[J].Biol Chem,2014,395(5):559-575.
[2] NELSON K L,BROZEL V S,GIBSON S A,etal.Influence of manure from pigs fed chlortetracycline as growth promotant on soil microbial community structure[J].World J Microb Biot,2011,27(3):659-668.
[3] WEN B,LIU Y,WANG P,etal.Toxic effects of chlortetracycline on maize growth,reactive oxygen species generation and the antioxidant response[J].J Environ Sci China,2012,24(6):1099-1105.
[4] CHOPRA I,ROBERTS M.Tetracycline antibiotics:mode of action,applications,molecular biology,and epidemiology of bacterial resistance[J].Microbiol Mol Biol R,2001,65(2):232-260.
[5] PAUTKE C,VOGT S,KREUTZER K,etal.Characterization of eight different tetracyclines:advances in fluorescence bone labeling[J].J Anat,2010,217(1):76-82.
[6] 余彦国,张 瑾.四环素类药物的非抗菌作用机制与非抗感染临床应用[J].中国兽药杂志,2012,46(1):54-56.
[7] 裴立忠,王勇平,张 鹏,等.四环素类抗生素生产状况与市场发展前景[J].中国兽药杂志,2015,49(1):64-68.
[8] MCCORMICK J R,JENSEN E R.Biosynthesis of the Tetracyclines.VIII.1 Characterization of 4-hydroxy-6-methylpretetramid[J].J Am Chem Soc,1965,87(8):1794-1795.
[9] RYAN M J.Strain for the production of 6-dimethyltetracycline,method for producing the strain and vector for use in the method:US,5989903[P],1999-11-23[2015-12-26].http://www.dwz.cz/32xi.
[10] NAKANO T,MIYAKE K,ENDO H,etal.Identification and cloning of the gene involved in the final step of chlortetracycline biosynthesis inStreptomycesaureofaciens[J].Biosci Biotech Bioch,2004,68(6):1345-1352.
[11] ZHU T,DENG Z X,YOU D L,etal.Deciphering and engineering of the final step halogenase for improved chlortetracycline biosynthesis in industrialStreptomycesaureofaciens[J].Metab Eng,2013,19:69-78.
[12] 张南燕,洪文荣,林玉双,等.打靶载体pIJ792的构建[J].海峡药学,2010,20(4):164-167.
[13] 方志锴,洪文荣,严凌斌,等.金色链霉菌接合转移体系的构建[J].福建农林大学学报(自然科学版),2011,40(5):521-524.
[14] 陈梁军.金霉素发酵工艺研究[J].海峡药学,2010,22(6):23-25.
[15] 刘 慰,秦 浩,刘 霜,等.一株枯草芽胞杆菌的分离鉴定及其杀虫活性的研究[J].湖南师范大学自然科学学报,2014,37(5):14-20.
[16] TOBIAS K,BIBB M,MARK J B,etal.Practicalstreptomycesgenetics[M].Norwich:The John Innes Foundation,2000.
[17] SAMBROOK J F,RUSSELL D W.Molecular Cloning:A Laboratory Manual[M].New York:Cold Spring Harbor Laboratory Press,2001.
[18] 程惠芳,刘金玲,啜淑英.产去甲基金霉素突变株的选育Ⅱ.金霉素链霉菌635突变株的选育[J].微生物学报,1974,14(1):74-76.
[19] ZHANG W J,WATANABE K,CLAY C,etal.Investigation of early tailoring reaction in the oxytetracycline biosynthetic pathway[J].J Biol Chem,2007,282(35):25717-25725.
(编辑 WJ)
Study ofctcKin Chlortetracycline Biosynthesis Gene Cluster
LINLong-zhen,WANYun-feng,HONGWen-rong*
(College of Biological Science and Technology,Fuzhou University,Fuzhou 350108,China)
In order to detect the function ofctcK,thectcKdeletion mutantS.aureofaciensSK12 (ΔctcK) was constructed inS.aureofaciensJ13 by genetic engineering.Changes of its secondary metabolites were analyzed.The molecular ion peak of demethylchlortetracycline (m/z=465.10 [M+H]+) instead of chlortetracycline (m/z=479.12 [M+H]+) was detected in the metabolites of mutant strain SK12 by MS analyses.This is in contrast to the detection result of metabolites of parent strain J13.These results indicate that the inactivation ofctcKinterdicts chlortetracycline biosynthesis flow and lead to the main accumulation of demethylchlortetracycline in mutant strain SK12,revealing the successful methylation of C-6 of chlortetracycline withctcKinvolved.In this study,the function of thectcKwas preliminarily elucidated.An engineered bacteria that mainly produces monocomponent demethylchlortetracycline has been simultaneously obtained.
ctcK; DMCTC; methylation; biosynthesis;S.aureofaciens
10.7612/j.issn.1000-2537.2017.01.006
2016-03-02
国家自然科学基金资助项目(31070093);国家“重大新药创制”科技重大专项资助项目(2012ZX09201101-008)
* 通讯作者,E-mail:hongwr56@163.com
Q935
A
1000-2537(2017)01-0037-07
