β-榄香烯血药浓度测定方法的建立及其药动学研究Δ
2017-02-23周鑫莉黄若凡葛蒙晰梁晓华复旦大学附属华山医院肿瘤科上海200040
詹 琼,周鑫莉,黄若凡,林 浩,葛蒙晰,梁晓华(复旦大学附属华山医院肿瘤科,上海 200040)
·临床药学与研究·
β-榄香烯血药浓度测定方法的建立及其药动学研究Δ
詹 琼*,周鑫莉,黄若凡,林 浩,葛蒙晰,梁晓华#(复旦大学附属华山医院肿瘤科,上海 200040)
目的:建立测定人血浆中β-榄香烯浓度的方法,并用于药动学研究。方法:血浆样品经液-液萃取后,以萘为内标,采用气质联用法测定。色谱柱为Rxi-5ms毛细管柱,柱温为150℃,载气为氦气,流速为1.0 mL/min,分流比为0.5∶1,程序升温,进样量为1 μL;采用电子轰击离子源,以单离子监测方式进行正离子扫描,选择监测的离子为m/z 93(β-榄香烯)和m/z 128(内标)。选择8例肿瘤患者,单次给予榄香烯注射液10 mg/kg后,采用该法测定给药前后β-榄香烯的血药浓度,采用WinNonlin 6.0软件计算其药动学参数。结果:β-榄香烯血药浓度在0.163 8~40 μg/mL范围内线性关系良好(r=0.999 8,n=5),定量下限为0.163 8 μg/mL;日内、日间RSD<10%;平均加样回收率为92.82%~97.75%,平均提取回收率为91.30%~93.31%。8例恶性肿瘤患者单次静脉滴注榄香烯注射液10 mg/kg后,其平均药-时曲线符合权重系数为1/c2的二室模型,cmax为(1.47±0.59)μg/mL,tmax为(2.43±0.78)h,AUC0-12h为(3.52±0.69)μg·h/mL,分布相半衰期为(0.36±0.04)h,消除相半衰期为(1.43±0.80)h,消除速率常数为(0.39±0.06)L-1,转运速率常数(k12、k21)分别为(3.21±0.72)和(1.43±0.21)L-1。结论:该方法样品前处理简单,且准确度高、专属性强,适用于β-榄香烯血药浓度的测定及人体药动学的研究。β-榄香烯在人体内吸收快、消除快。
β-榄香烯;气质联用法;血药浓度;药动学
β-榄香烯(β-Elemene)属于萜烯类化合物,可从姜科植物温郁金(Curcuma wenyujin Y.H.Chen et C.Ling)中提取得到[1]。榄香烯注射液是由我国自主研发的抗癌新药,以β-榄香烯为主要成分[2-5]。该药为非细胞毒性抗肿瘤药,可抑制肿瘤细胞核酸合成或诱导肿瘤细胞凋亡、分化,从而有效抑制多种肿瘤细胞的生长增殖[6-9]。但目前关于β-榄香烯人体药动学的报道较少。为了解其在人体内的药动学特征,为临床合理用药提供理论依据,笔者采用气质联用(Gas chromatography-mass spectrometry,GC-MS)法测定人血浆中β-榄香烯的浓度,并用于药动学研究,现报道如下。
1 材料
1.1 仪器
GC-MS-QP2010型单四极杆气质联用仪,配有AOC-20i自动进样器、电子轰击离子源(Electron ionization,EI)和Compound Composer数据库软件(日本Shimadzu公司);AB135-S型十万分之一天平(瑞士Mettler Toledo公司);XW-80A型涡旋混合器(上海沪西分析仪器厂);TGL16M型冷冻离心机(长沙英泰仪器有限公司)。
1.2 药品与试剂
β-榄香烯对照品(中国食品药品检定研究院,批号:100268-201402,纯度:99.4%);萘对照品(内标,国药集团化学试剂有限公司,批号:40035562,纯度:≥99.5%);榄香烯注射液(大连华立金港药业有限公司,批准文号:国药准字H10960114,批号:1210301,规格:20 mL∶0.1 g);氯化钠注射液(江苏通用药业有限公司,批准文号:国药准字H20043842,批号:10130916,规格:500 mL∶4.5 g);正乙烷为色谱纯,其余试剂均为分析纯。空白血浆由复旦大学附属华山医院健康志愿者提供。
2 方法与结果
2.1 色谱与MS条件
色谱柱:Rxi-5ms毛细管柱(30.0 m×0.25 mm,0.25 μm);进样口温度:200℃;接口温度:150℃;柱温:150℃;载气:高纯度氦气(>99%);流速:1.0 mL/min;分流比:0.5∶1;程序升温(初始150℃,保持3 min;以40℃/min的速度升温至220℃,保持1 min);进样量:1 μL。
采用EI,以单离子监测(Single ion monitoring,SIM)模式扫描,正离子方式检测。电子轰击能量:70 eV;离子源温度:200℃;四极杆温度:100℃;检测器电压:调谐电压;扫描范围:m/z 50~300,选择监测的离子为m/z 93(β-榄香烯)和m/z 128(内标)。
2.2 溶液的制备
精密称取β-榄香烯对照品20 mg,置于10 mL量瓶中,用甲醇溶解并定容,摇匀,得质量浓度为2.0 mg/mL的β-榄香烯对照品贮备液,置于-40℃冰箱中保存,备用。
精密称取内标对照品20 mg,置于10 mL量瓶中,用正己烷溶解并定容,摇匀,得质量浓度为2.0 mg/mL的内标贮备液,置于-40℃冰箱中保存。临用前用正己烷稀释,得质量浓度为20 μg/mL的内标溶液,备用。
2.3 血浆样品的处理
取空白血浆适量,加入内标溶液(20 μg/mL)50 μL,涡旋混匀30 s,常温下加入饱和氯化钠溶液(浓度为6 mol/L)2滴,静置15 min,加入萃取剂(正己烷)500 μL,涡旋振荡10 min,4℃下高速离心(4 000×g)10 min,取上清液200 μL至加有内衬管的进样瓶中,待测。
2.4 方法学考察
2.4.1 专属性考察 在“2.1”项色谱与质谱条件下,β-榄香烯和内标的保留时间分别约为4.4和2.6 min,两者分离良好,内源性物质无干扰。典型色谱图见图1。
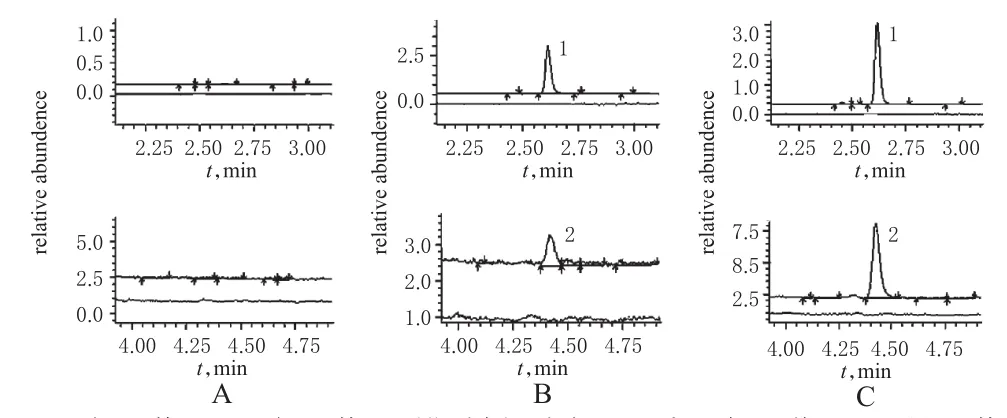
图1 典型色谱图Fig 1 Typical chromatograms
2.4.2 标准曲线的绘制和定量下限的考察 取β-榄香烯对照品贮备液适量,用正己烷稀释,得质量浓度分别为200、80、32、12.8、5.12、2.048、0.819 2 μg/mL的系列标准工作液;分别精密吸取上述标准工作液各50 μL,置于2 mL聚乙烯管中,精密加入空白血浆200 μL,涡旋混匀30 s,得相当于β-榄香烯质量浓度分别为40、16、6.4、2.56、1.024、0.409 6、0.163 8 μg/mL的系列标准血浆样品,按“2.3”项下方法处理后,进样分析,记录色谱图。以待测物质量浓度(x)为横坐标、待测物与内标的峰面积比值(y)为纵坐标进行线性回归,得回归方程为y=0.030 778x+0.000 432(r=0.999 8,n=5)。结果显示,β-榄香烯血药浓度在0.163 8~40 μg/mL范围内线性关系良好,定量下限为0.163 8 μg/mL(RSD<20%)。
2.4.3 精密度试验 分别配制β-榄香烯低、中、高质量浓度(0.409 6、2.56、32 μg/mL)的血浆样品,按“2.3”项下方法处理后,进样分析。各质量浓度血浆样品平行测定5次,连续测定5 d,根据当日标准曲线计算各样品中β-榄香烯的实测质量浓度,考察方法的精密度。结果显示,日内、日间RSD<10%,表明该方法精密度良好。精密度试验结果见表1。
表1 精密度试验结果(,n=5)Tab 1 Results of precision test(,n=5)
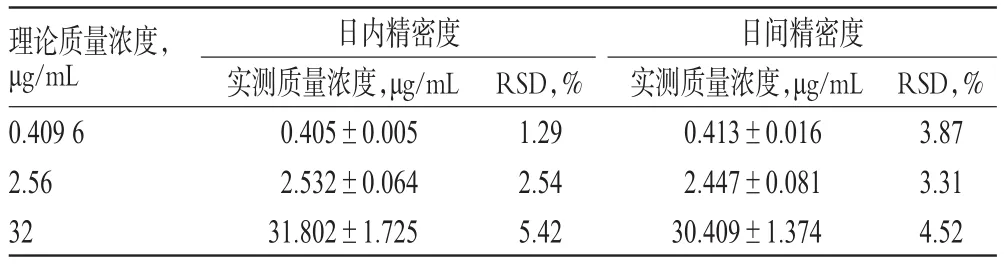
表1 精密度试验结果(,n=5)Tab 1 Results of precision test(,n=5)
理论质量浓度,μg/mL 0.409 6 2.56 32日内精密度实测质量浓度,μg/mL 0.405±0.005 2.532±0.064 31.802±1.725 RSD,% 1.29 2.54 5.42日间精密度实测质量浓度,μg/mL 0.413±0.016 2.447±0.081 30.409±1.374 RSD,% 3.87 3.31 4.52
2.4.4 加样回收率试验 分别配制β-榄香烯低、中、高质量浓度(0.409 6、2.56、32 μg/mL)的血浆样品各3份,分别精密加入相应质量浓度的对照品溶液,摇匀,按“2.3”项下方法处理后,得血浆样品9份,进样分析,根据当日标准曲线计算加样回收率及RSD值。结果显示,平均回收率为92.82%~97.75%,RSD<5%。加样回收率试验结果见表2。
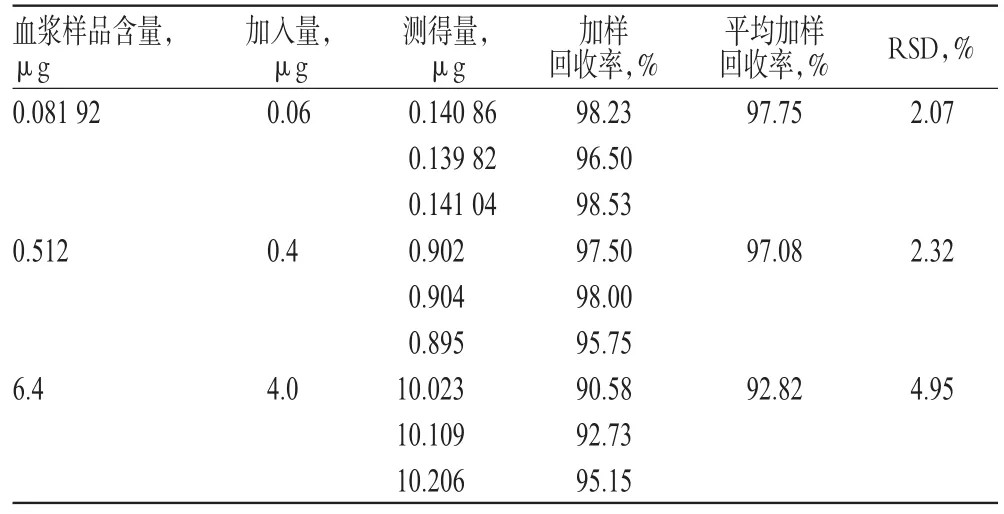
表2 加样回收率试验结果(n=3)Tab 2 Results of sample recovery tests(n=3)
2.4.5 提取回收率试验 分别配制β-榄香烯低、中、高质量浓度(0.409 6、2.56、32 μg/mL)的血浆样品,按“2.3”项下方法处理后,进样分析,得β-榄香烯色谱峰面积(A1)和内标色谱峰面积(A2)。取对照品贮备液和内标溶液各适量,配制成与前者质量浓度相对应的β-榄香烯标准溶液,进样分析,得β-榄香烯色谱峰面积(B1)和内标色谱峰面积(B2)。β-榄香烯的提取回收率=A1/B1×100%,内标的提取回收率=A2/B2×100%。结果显示,各质量浓度血浆样品β-榄香烯的平均提取回收率分别为93.31%、91.30%和92.65%,RSD分别为3.42%、2.85%和2.97%(n=5);内标的平均提取回收率分别为90.53%、91.26%和92.71%,RSD分别为2.66%、2.74%和3.81%(n=5),符合生物样品定量分析方法指导原则的有关规定[10]。
2.4.6 稳定性试验 分别配制β-榄香烯低、中、高质量浓度(0.409 6、2.56、32 μg/mL)的血浆样品,按“2.3”项下方法处理后,室温放置,分别于配制后0、2、4、6、8、12 h精密吸取1 μL,进样分析。结果显示,各质量浓度血浆样品在12 h内稳定性良好,β-榄香烯的RSD分别为4.56%、3.95%和2.63%(n=6)。
2.5 药动学研究
本研究为单中心、开放性的β-榄香烯药动学临床研究(临床研究注册号:NCT01679847),研究方案经医院医学伦理委员会审查批准(审查号:2010-180),所有受试者均知情同意并签署知情同意书。
2.5.1 纳入与排除标准 纳入标准:经细胞学或组织病理检查确诊的肿瘤患者;预计生存期>3个月;试验前1个月未使用过榄香烯注射液治疗;血常规、肝肾功能、心电图均正常。排除严重心功能不全、肝肾功能障碍、神志不清、患有精神疾病、不能完成研究、近3个月内参加过其他临床试验的患者。本研究共纳入2015年2-8月我院肿瘤科恶性肿瘤患者8例,年龄43~60岁,平均年龄(51.6±7.3)岁。其中,男性6例、女性2例,卡氏(KPS)评分均>80分。患者的一般情况见表3。

表3 患者的一般情况Tab 3 General condition of subjects
2.5.2 试验方案 所有患者于受试前1天清淡饮食后,禁食10 h,不禁水。予次日上午单次给予榄香烯注射液10 mg/kg(用氯化钠注射液稀释至500 mL),ivgtt,用输液泵控制滴速,3 h内匀速滴注完毕。试验期间避免剧烈运动,禁服茶、咖啡及其他含咖啡和醇类饮料。所有受试者均于前臂屈侧埋置肝素化套管针,分别于给药前及开始滴注后0.25、0.5、1、1.5、2、3、3.5、4、6、8、12 h静脉采血3 mL,经乙二胺四乙酸(EDTA)抗凝后,以400×g离心10 min。取上清液于-80℃下保存。血浆样品按“2.3”项下方法处理后,进样分析,测定β-榄香烯的血药浓度,绘制平均药-时曲线(见图3)。采用WinNonlin 6.0药动学软件进行房室模型拟合处理。结果显示,β-榄香烯的平均药-时曲线符合权重系数为1/c2的二室模型,其主要药动学参数见表4。
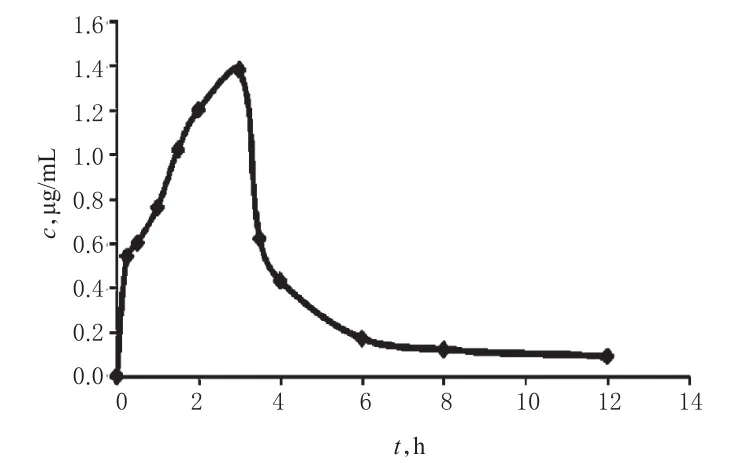
图3 β-榄香烯的平均药-时曲线(n=8)Fig 3 Average plasma concentration-time curve of β-elemene(n=8)
表4 主要药动学参数(s,n=8)Tab 4 Main pharmacokinetic parameters(s,n=8)
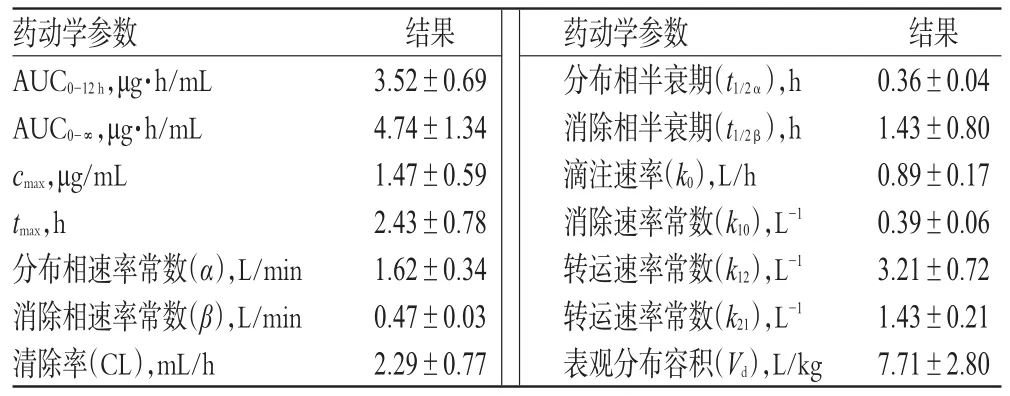
表4 主要药动学参数(s,n=8)Tab 4 Main pharmacokinetic parameters(s,n=8)
药动学参数AUC0-12h,μg·h/mL AUC0-∞,μg·h/mL cmax,μg/mL tmax,h分布相速率常数(α),L/min消除相速率常数(β),L/min清除率(CL),mL/h结果3.52±0.69 4.74±1.34 1.47±0.59 2.43±0.78 1.62±0.34 0.47±0.03 2.29±0.77药动学参数分布相半衰期(t1/2α),h消除相半衰期(t1/2β),h滴注速率(k0),L/h消除速率常数(k10),L-1转运速率常数(k12),L-1转运速率常数(k21),L-1表观分布容积(Vd),L/kg结果0.36±0.04 1.43±0.80 0.89±0.17 0.39±0.06 3.21±0.72 1.43±0.21 7.71±2.80
3 讨论
恶性肿瘤通常称为癌症,是严重威胁人类健康的慢性疾病之一。目前,治疗恶性肿瘤的方法主要有外科手术治疗、药物治疗以及放射治疗。药物治疗在肿瘤的综合治疗中具有极为重要的作用。随着肿瘤医学的不断发展,临床应用的抗肿瘤药物也逐渐增多,特别是以天然抗癌活性成分为先导化合物的抗癌药物的研发已有了较大的成果。榄香烯注射液由我国自主研发,主要成分为β-榄香烯,是从植物温郁金中提取的天然抗癌活性成分,已广泛应用于胸腹腔积液、肺癌、胃癌、骨转移癌、胰腺癌等多种实体瘤的综合治疗[11-13]。研究表明,β-榄香烯能增强肿瘤细胞的免疫原性,抑制肿瘤转移,改善和提高荷瘤机体的细胞免疫功能,具有高效、安全、副作用小和不易耐受等优点[11-12]。
榄香烯属于半萜类化合物,只可溶于有机溶剂,而血浆中含有多种有机酸类等物质,可能对β-榄香烯的测定产生干扰。本研究采用液-液萃取法,考察了乙醚、异丙醇、正己烷、氯仿等有机溶剂对血浆样品中β-榄香烯和内标的萃取效果。结果显示,乙醚易挥发,可致结果产生偏差;异丙醇处理后,内源性物质的干扰较大;氯仿则易产生乳化。故最终选择正乙烷为提取和稀释溶剂。试验结果显示,正己烷对β-榄香烯和内标的提取回收率较高,且萃取液中几乎不含可影响测定的内源性干扰物。
GC-MS是分析化学中最成熟的一类联用技术。该方法既具有GC法的高分离性能,又具有MS法准确鉴定化合物结构的特点,二者联用,取长补短,可达到同时定性、定量检测的目的。本研究所建立的GC-MS法样品前处理简单,日内、日间RSD<10%,β-榄香烯的平均加样回收率和提取回收率均>90%,方法的准确度高、专属性强,可适用于临床血液样品中β-榄香烯浓度的测定。
在药动学研究中,为提高参数计算的准确性,取样点的设计应兼顾到吸收、分布和消除相。经过大量血浆样品的分析试验,将采血时间确定为给药前及开始滴注后的0.25、0.5、1、1.5、2、3、3.5、4、6、8、12 h,不仅兼顾了吸收、分布和消除相,又在达峰时间附近设置了较为密集的采血点,得到了较为完整的试验数据。本研究根据榄香烯注射液药品说明书,将给药剂量设定为10 mg/kg,采用前文建立的GC-MS法测定单次静脉滴注榄香烯注射液后肿瘤患者体内β-榄香烯的血药浓度,采用WinNonlin 6.0药动学软件处理数据,考察其药动学特征。结果显示,β-榄香烯的平均药-时曲线符合权重系数为1/c2的二室模型,cmax为(1.47±0.59)μg/mL,tmax为(2.43±0.78)h,t1/2α为(0.36±0.04)h,t1/2β为(1.43±0.80)h,提示补液结束后血药浓度迅速下降,表明β-榄香烯在人体内吸收快、消除快。体外研究显示,1 μg/mL为β-榄香烯的最低有效血药浓度[14],故尽可能延长榄香烯注射液静脉给药时间或持续给药,可能有助于延长β-榄香烯的作用时间,提高其临床抗肿瘤疗效。
本研究首次进行了榄香烯注射液的人体药动学研究,由于仅检测了单次、单剂量静脉滴注榄香烯注射液后人体内β-榄香烯的血药浓度,药动学数据较为局限。为进一步验证其结果的准确性,本研究将在后续试验中进一步考察多次、多剂量给药后β-榄香烯的体内药动学特征,并加大样本量,为临床应用榄香烯注射液、提高抗肿瘤疗效提供更准确的依据。
[1] 余佳文,程斌.榄香烯诱导肿瘤细胞凋亡分子机制研究进展[J].中国药房,2013,24(35):3348-3350.
[2] 王颖,郭兰萍,黄璐琦,等.姜黄、莪术、郁金的化学成分与药理作用研究进展[J].中国药房,2013,24(35):3338-3341.
[3] 沈洪,倪菲菲.β-榄香烯抗肿瘤免疫效应的研究进展[J].分子诊断与治疗杂志,2014,6(1):57-61.
[4] 李雪,周赟,陈蕾.β-榄香烯主要抗肿瘤机制及在非肿瘤疾病中的研究进展[J].安徽医药,2015,19(8):1429-1432.
[5] 阙晓.β-榄香烯抗肿瘤分子机制研究进展[J].中药与临床,2015,6(6):61-64.
[6] 欧阳俊,沈洪,刘军楼,等.β-榄香烯抗肝癌的促凋亡机制研究[J].世界科学技术:中医药现代化,2014,16(4):738-742.
[7] Liu JS,He SC,Zhang ZL,et al.Anticancer effects of β-elemene in gastric cancer cells and its potential underlying proteins:a proteomic study[J].Oncol Rep,2014,32(6):2635-2647.
[8] Yao CC,Tu YR,Jiang J,et al.β-elemene reverses the drug resistance of lung cancer A549/DDP cells via the mitochondrial apoptosis pathway[J].Oncol Rep,2014,31(5):2131-2138.
[9] Liu M,Mao L,Daoud A,et al.β-elemene inhibits monocyte-endothelial cells interactions via reactive oxygen species/MAPK/NF-κB signaling pathway in vitro[J].Eur J Pharmacol,2015,doi:10.1016/j.ejphar.2015.09.032.
[10] 钟大放,李高,刘昌孝.生物样品定量分析方法指导原则:草案[J].药物评价研究,2011,34(6):409-415.
[11] Guan C,Liu W,Yue Y,et al.Inhibitory effect of β-elemene on human breast cancer cells[J].Int J Clin Exp Pathol,2014,7(7):3948-3956.
[12] Zhang GN,Ashby CR Jr,Zhang YK,et al.The reversal of antineoplastic drug resistance in cancer cells by β-elemene[J].Chin J Cancer,2015,34(11):488-495.
[13] 谢恬,李铖璐,徐淑媛,等.金港榄香烯与榄香烯脂质体注射液的指纹图谱研究[J].天津中医药,2014,31(5):301-305.
[14] 徐莉英,杜惠莲,张美慧,等.β-榄香烯衍生物的抗肿瘤活性及构效关系研究进展[C]//2013年中国药学大会暨第十三届中国药师周论文集.南宁:中国药学会,2013:833-842.
Establishment of Determination Method for Plasma Concentration of β-Elemene and Its Pharmacokinetic Study in Human
ZHAN Qiong,ZHOU Xinli,HUANG Ruofan,LIN Hao,GE Mengxi,LIANG Xiaohua(Dept.of Oncology,Huashan Affiliated Hospital of Fudan University,Shanghai 200040,China)
OBJECTIVE:To establish a method for the concentration determination of β-elemene in human plasma,and to study its pharmacokinetics.METHODS:After liquid-liquid extraction,using naphtalin as internal standard,plasma sample was determined by GC-MS.The determination was performed on Rxi-5ms capillary column with column temperature of 150℃.The carrier gas was helium at flow rate of 1.0 mL/min with split ratio of 0.5∶1 by temperature programming,and sample size was 1 μL.EI and single ion monitoring pattern were used for positive ion scanning with m/z 93(β-elemene)and m/z 128(internal standard).8 tumor patients were selected,and were given Elemene injection 10 mg/kg.Plasma concentration of β-elemene were determined before and after medication.The pharmacokinetic parameters were calculated by WinNonlin 6.3 software.RESULTS:The linear range of β-elemene were 0.163 8-40 μg/mL(r=0.999 8,n=5)with quantification limit of 0.163 8 μg/mL;RSDs of intra-day and inter-day were lower than 10%;average sample recoveries ranged 92.82%-97.75%;average extraction recoveries ranged 91.30%-93.31%.After 8 malignant tumor patients were given single intravenous dripping of Elemene injection 10 mg/kg,mean plasma concentration-time curves were in line with two-compartment model with weight coefficient of 1/c2.Pharmacokinetic parameters were as follows:cmaxwas(1.47±0.59)μg/mL,tmaxwas(2.43±0.78)h,AUC0-12hwas(3.52±0.69)μg·h/mL,distribution phase half-life was(0.36±0.04)h,and clearance phase half-life was(1.43±0.80)h,elimination rate constant was(0.39±0.06)h-1,and transport rate constant(k12,k21)were(3.21±0.72)and(1.43±0.21)h-1.CONCLUSIONS:The sample preparation method is simple,and the determination method is accurate and specific,and is suitable for plasma concentration and pharmacokinetic study of β-elemene.β-elemene is absorbed and eliminated fast in human.
β-elemene;GC-MS;Plasma concentration;Pharmacokinetics
R969.1
A
1001-0408(2017)02-0173-05
2016-05-16
2016-11-16)
(编辑:张元媛)
国家自然科学基金资助项目(No.81302010、81101551);上海市科学技术委员会自然科学基金资助项目(No.13ZR1405000、16ZR1404300)
*主治医师,硕士。研究方向:恶性肿瘤的综合治疗。电话:021-66895120。E-mail:mdf7534@163.com
#通信作者:主任医师,博士。研究方向:恶性肿瘤的综合治疗。电话:021-66895120。E-mail:Xhliang66@sina.com
DOI10.6039/j.issn.1001-0408.2017.02.08
