灌浆期夜间高温胁迫下耐热和热敏感水稻籽粒的比较蛋白质组分析
2017-02-20黄小平张宏玉雷刚王志美章智贺超廖江林黄英金
黄小平张宏玉雷刚王志美章智贺超廖江林,,∗黄英金,,∗
(1江西农业大学作物生理生态与遗传育种教育部重点实验室,南昌330045;2江西农业大学农业应对气候变化南昌市重点实验室,南昌330045;∗通讯联系人,E-mail:jlliao514815@163.com,yjhuang_cn@126.com)
灌浆期夜间高温胁迫下耐热和热敏感水稻籽粒的比较蛋白质组分析
黄小平1张宏玉2雷刚1王志美1章智1贺超1廖江林1,2,∗黄英金1,2,∗
(1江西农业大学作物生理生态与遗传育种教育部重点实验室,南昌330045;2江西农业大学农业应对气候变化南昌市重点实验室,南昌330045;∗通讯联系人,E-mail:jlliao514815@163.com,yjhuang_cn@126.com)
【目的】为了阐明水稻灌浆期耐夜间高温的分子机制,提高水稻耐热性,鉴定了水稻近等基因系耐热纯系XN0437T与热敏感纯系XN0437S在灌浆期夜间高温胁迫下的差异表达蛋白质。【方法】采用桶栽方法培育水稻,于开花期标记同一天扬花的颖花以保障所取颖花样品的生育进程一致;于水稻灌浆初期(花后第8天)进行夜间高温处理。高温处理结束后剪取带标记的颖花提取水稻籽粒总蛋白质,采用8-plex i TRAQ试剂盒进行蛋白质样品的差异显色标记,标记样品采用高效液相系统进行质谱鉴定及定量分析。【结果】鉴定并定量了3130个蛋白质,耐热与热敏感水稻纯系间存在36个差异表达蛋白质。蛋白质功能注释结果显示,鉴定的36个差异表达蛋白质中仅14个蛋白质(占38.9%)注释了功能,12个蛋白质(占33.3%)为推测性功能注释,10个(占27.8%)为功能未知的蛋白质。已注释功能的14个蛋白质中,5个蛋白质参与能量代谢,3个蛋白质参与物质转运与代谢,2个蛋白质参与光合作用,3个蛋白质为响应逆境的锌指蛋白质,1个蛋白质为响应逆境的热激蛋白质。【结论】灌浆期夜间高温影响水稻籽粒细胞内参与能量代谢、物质转运与代谢、光合作用等相关蛋白质的表达模式。水稻籽粒细胞中锌指蛋白质Q67 TK9、Q10N88上调表达,锌指蛋白质Q5YLY5下调表达,有利于提高水稻灌浆期对夜间高温的耐热性。
水稻;灌浆期;夜间高温;蛋白质组学;iTRAQ技术
全球气候变暖,尤其是夏季频繁高温对水稻等作物产量和品质的不利影响,已受到广泛关注[1,2]。在全球气温升高的大趋势下,夜间气温的升高幅度显著大于白天。而且夜间平均气温每升高1℃可导致水稻减产10%,而白天气温的升高与水稻产量间无显著相关性[3],表明夜间高温是直接导致水稻减产的主要原因[4]。在我国,夏季高温热害主要发生在长江中下游地区,尤其在7月份,该区域受西太平洋副热带高压控制,天气晴朗、太阳辐射强烈,极易出现高温酷热天气[5,6]。该区域是我国双季稻的主产区,而且该区域双季早稻的灌浆初期正值7月上、中旬。水稻灌浆初期(扬花后第8~14天)是籽粒胚乳细胞形成和充实的关键时期,期间遇高温热害会加快胚乳细胞的分化而增加畸形胚乳细胞的比例,结果不利于同化物向胚乳细胞的运输和积累从而导致水稻籽粒的充实度下降、粒重降低[7]。同时,高温影响水稻籽粒细胞内的酶活性,不利于籽粒储藏物质的转化和积累进而导致稻米品质变劣[8,9]。长江中下游地区的双季早稻是其他作物难以替代的优势粮食作物,我国稻谷总产量的几次大波动都与双季早稻的减产密切相关。因此,研究水稻灌浆期耐夜间高温的分子机制,加快选育对夜温升高钝感的优良水稻新品种以保证我国稻谷产量和品质的稳定,进而对保障国家的口粮安全具有重要意义。水稻灌浆期的耐热性受多基因调控,其分子调控机制相对复杂[10,11]。明确哪些基因及其编码的蛋白质参与调控水稻灌浆期耐热性是解析其分子机制的先决内容。已有研究表明,灌浆期高温抑制淀粉支解酶Ⅱb(BEⅡb)活性、增加直链淀粉支链长度而减少直链淀粉的长链数量[12];灌浆期高温提高水稻胚乳细胞中焦磷酸化酶(AGPase)、可溶性淀粉合成酶(SSS)和淀粉分支酶(SBE)等与淀粉合成有关的酶活性[13]。在基因表达方面,灌浆期高温抑制颗粒淀粉合成酶Ⅰ(GBSSⅠ)、颗粒淀粉合成酶Ⅱb(BEⅡb)、ADP-葡萄糖焦磷酸化酶(包括AGPS2b, AGPS1和AGPL2)、ADP-葡萄糖转运体等与淀粉合成相关基因以及丙酮酸磷酸双激酶(PPDK)基因的表达[14,15];灌浆期高温诱导α-淀粉酶(amylase)基因(包括Amy1A,Amy1C,Amy3 A,Amy3D和Amy3E)表达,加剧胚乳细胞内淀粉的水解而增大籽粒垩白面积[16]。在蛋白质表达方面,灌浆期高温诱导18.1 k D和17.9 k D热激蛋白质(HSP)、醇溶谷蛋白质(Prolamin)和谷蛋白质(Glutelin)表达,抑制颗粒淀粉合成酶(granule-boundstarch synthase)、类过敏原蛋白质(allergen-like protein)和延长因子1β(elongation factor 1β)的表达[14,17]。在调控途径方面,灌浆期夜间高温诱导线粒体跨膜电子传递相关基因上调表达[18],影响三羧酸循环(TCA)、氨基酸和多胺的生物合成途径[19]。这些基因和蛋白质的鉴定及其表达模式的明确为进一步阐明水稻灌浆期耐热的分子机制奠定了研究基础。然而,水稻在遭遇灌浆期夜间高温胁迫时,到底哪些基因和蛋白质的表达及其呈现何种表达模式,其有利于提高水稻对灌浆期夜间高温的耐性,尚鲜见报道[18]。本研究以近等基因系的耐热水稻纯系XN0437T和热敏感纯系XN0437S为供试材料,利用i TRAQ(同位素标记相对和绝对定量,isobaric tags for relative and absolute quantitation)技术和高效液相质谱检测技术鉴定耐热和热敏感水稻纯系在应答灌浆期夜间高温过程中的差异表达蛋白质,明确哪些蛋白质的上调表达或下调表达有利于提高水稻灌浆期对夜间高温的耐热性,为进一步阐明水稻灌浆期耐夜间高温的分子机制奠定研究基础。
1 材料与方法
1.1 供试水稻材料
供试水稻材料为江西农业大学早稻灌浆期耐热抗早衰育种技术研究课题组选育的一对近等基因系,即耐热纯系XN0437T和热敏感纯系XN0437S。此对近等基因系源于协青早B/N22//协青早B的回交重组自交系,在江西南昌作为双季早稻在常规栽培条件下种植,耐热纯系XN0437T和热敏感纯系XN0437S的株高分别为81.3 cm和81.0 cm,穗长分别为18.4 cm和18.1 cm,每穗总粒数分别为94.3粒和95.0粒,全生育期均为106 d。SSR分子标记检测结果显示此对近等基因系的基因组多态性仅为1.8%。两水稻纯系于水稻开花后第8天开始进行48 h(38.0±0.5)℃高温处理后,在常温条件(25.0±0.5)℃下恢复生长至成熟并调查其籽粒充实度。结果显示耐热水稻纯系XN0437T(原名703T)的籽粒充实度为92.4%,热敏感纯系XN0437S(原名704S)的籽粒充实度为43.6%,籽粒充实度差异达到极显著水平[20]。
1.2 供试水稻材料的培育、高温处理及取样
供试水稻材料的培育、高温处理及取样参照Liao等的方法进行[18]。水稻的培育采用桶栽的方法,水稻抽穗期、扬花期标记同一天抽穗且同一天开花的颖花以保证所取样品的生长发育进程一致。水稻扬花后第8天开始在人工气候室内进行高温处理,夜间温度设为38.0℃±0.5℃(高温处理)和25.0℃±0.5℃(对照),处理和对照的白天温度均设为(26.0±0.5)℃。暗期时长10 h、光期时长14 h,连续处理48 h。设置3次生物学重复。高温处理结束时,取处理与对照的带标记颖花各约5 g,采用锡箔纸包裹,置于液氮中速冻,并于-80℃下保存备用。
1.3 水稻籽粒总蛋白质提取及质量检测
取水稻籽粒样品3 g,经液氮研磨成粉末后,转移到15 m L离心管中,加入蛋白质提取缓冲液(8 mol/L尿素,0.1%SDS,1 mmol/L PMSF,1 mmol/L DTT)于自动涡旋混合器上室温振荡提取3 h后,4℃、14 000 r/min下离心15 min,取上清液转移至新的15 m L离心管中,加入6倍体积的预冷丙酮,-20℃下沉淀过夜。沉淀过夜样品于4℃、14 000 r/min下离心15 min,去上清液,将沉淀于4℃真空干燥后获得总蛋白质干粉,-80℃下保存备用。
取蛋白质干粉50 mg,经裂解液(含8 mol/L尿素,2 mol/L硫脲,质量分数4%CHAPS,p H3~10体积分数0.5%两性电解质,50 mmol/L DTT和1.0 mmol/L PMSF)超声溶解后,于4℃、14 000 r/ min下离心15 min后,上清液(总蛋白质溶液)转移至1.5 m L离心管。采用SDS-PAGE电泳和考马斯亮蓝染色法检测总蛋白质的完整性,SDS-PAGE电泳参数与方法参照Liao等[21]。以牛血清白蛋白质为标准品,采用Bradford法测定蛋白质样品浓度。
1.4 蛋白质酶解及iTRAQ标记
蛋白质样品先经还原和烷基化后,采用胰蛋白质酶酶解。每个样品取100μg蛋白质,经10 mmol/L二硫苏糖醇(DTT)于37℃温浴1 h、55 mmol/L碘乙酰胺于室温烷化1 h后,加入3.3μg胰蛋白质酶于37℃下消化12 h,消化结束时加入体积分数1%的蚁酸100μL终止酶解反应,真空抽干获得蛋白质肽段干粉。蛋白质肽段干粉复溶于8 mol/L尿素(含0.1%SDS)和500 mmol/L三乙基碳酸氢铵的水溶液后,采用AB Sciex公司的8-plex i TRAQ试剂盒进行差异显色标记。将试剂盒中8管标记试剂(113、114、115、116、117、118、119和121)经50μL异丙醇稀释后分别与相应的蛋白质肽段干粉复溶样品混合,室温放置1 h,各管中加入100μL去离子水使标记物失活,混合8组样品,冻干备用。
随机取3次高温处理重复中的2次重复进行i TRAQ分析。耐热水稻纯系的2个对照重复分别命名为TC1和TC2,2个夜间高温胁迫重复分别命名为TT1和TT2,并用iTRAQ试剂113、114、115、116依次进行标记;热敏感水稻纯系的2个对照重复分别命名为SC1和SC2,2个夜间高温胁迫重复分别命名为ST1和ST2,并用iTRAQ试剂117、118、119、121依次进行标记。
1.5 iTRAQ标记样品的强阳离子交换柱分级及质谱检测
iTRAQ标记的8个样品等量混合后采用C18强阳离子柱进行样品分级。经强阳离子色谱柱平衡缓冲液A(含p H 2.55、5 mmol/L KH2PO4,体积比为20%的乙腈、H3PO4)平衡25 min后,取标记样品混合物300μL,用强阳离子色谱柱平衡缓冲液B (含p H 2.75、5 mmol/L KH2PO4,体积比为20%的乙腈,600 mmol/L KCl,H3PO4)稀释7倍,正磷酸调p H值至2.5,离心取上清液进行梯度洗脱,每1 min收集1管样品洗脱液,洗脱液流速为0.2 ml/ min。线性洗脱程序如下:0-3 min,缓冲液B的体积分数由0%升至5%;3-21 min,缓冲液B的体积分数由5%升至20%;21-27 min,缓冲液B的体积分数由20%升至30%;27-33min,缓冲液B的体积分数由30%升至100%。梯度洗脱结束后,根据色谱图的峰形和时间合并连续的多肽含量较少的样品,共形成20个组分用于肽段的质谱检测。
质谱检测采用Thermo Scientific公司生产的Q Exactive质谱仪,高效液相系统为戴安NCS3500系统。液相色谱A相为体积分数为99.9%的dd H2O和0.1%的甲酸,B相为体积分数为99.9%的乙腈、0.1%的甲酸。液相色谱洗脱液流速为300 n L/min,液相色谱线性梯度洗脱程序如下:0-5 min,B相体积分数保持3%不变;5-6 min,B相体积分数由3%升至5%;6-36 min,B相体积分数由5%升至20%;36-46 min,B相体积分数由20%升至30%;46-50 min,B相体积分数由30%升至80%,并在之后5 min内B相体积分数保持不变;55 -55.5 min,B相体积分数由80%降至3%,并在之后19.5 min内B相体积百分数保持3%不变。检测质谱全扫描范围m/z=350~1800,全扫描中选择离子强度前20位的母离子用标准碰撞能为30 eV的HCD模式碎裂后,进行二级质谱序列测定,以报告离子的比例进行定量。
1.6 蛋白质定量及功能注释
将质谱鉴定结果导入Proteome Discoverer软件,筛选选择肽段可信度高(Peptide Confidence=high)的肽段,并由软件根据同一特异肽段(Unique Peptide)在各样本中的报告离子峰的面积比值计算蛋白质的表达量。利用Proteome Discoverer软件搜索Uniport数据库(http://ww w.uniprot.org/),注释蛋白质的功能。
1.7 蛋白质编码基因的GO功能和KEGG通路的显著富集分析
质谱数据经Proteome Discoverer软件搜索Uniport数据库鉴定蛋白质后,按照蛋白质编码基因ID、利用KOBAS软件搜索在线GO(Gene ontology)数据库(http://geneontology.org/),采用Qvalue方法进行FDR校正,从而注释蛋白质编码基因产物属性和蛋白质编码基因参与的通路并统计显著富集的通路。
1.8 差异表达蛋白质分析
根据软件Proteome Discoverer计数获得的蛋白质表达量,分2步进行差异表达蛋白质分析。首先,依据蛋白质表达量分析耐热纯系与热敏感纯系各自的夜间高温胁迫与对照的差异表达蛋白质(组内分析)。若蛋白质在夜间高温胁迫中的表达量与其在对照中的表达量的比值大于1.5倍,则定义为组内上调1.5倍的表达蛋白质;上述比值小于0.667(1/1.5),则定义为组内下调1.5倍的表达蛋白质。然后,利用组内分析结果比较耐热和热敏感纯系之间差异表达蛋白质(组间分析)。以下两种情况均定义为耐热纯系与热敏感纯系间的差异表达蛋白质:1)相同表达模式的差异蛋白质:在2个水稻纯系中均呈现相同的上调或下调表达模式,且耐热纯系与热敏感纯系之间的上调或下调表达量的比值大于1.5倍或小于0.667(1/1.5)倍的蛋白质;2)不同表达模式的差异蛋白质,在2个水稻纯系中呈现不同的表达模式,即在耐热纯系中上调表达而在热敏感纯系中下调表达的蛋白质,或在耐热纯系中下调表达而在热敏感纯系中上调表达的蛋白质。
1.9 蛋白质编码基因的mRNA表达量验证
为了验证iTRAQ数据的可靠性,在不同功能分类中选择了7个有代表性的差异表达蛋白质,根据其编码基因在Gen Bank的EST数据库(w ww.ncbi.nlm.nih.gov/dbEST)中mRNA序列,利用NCBI在线设计软件primer-BLAST设计引物,采用荧光定量PCR方法检测差异表达蛋白质编码基因在水稻应答灌浆期夜间高温的表达量变化。
荧光定量PCR的水稻籽粒样品来自“1.2供试水稻材料的培育、高温处理及取样”的3次夜间高温处理重复,样品的总RNA提取和RNA反转录合成cDNA第一链、qPCR和表达量计算参照文献[18]和[22]的方法进行。
2 结果与分析
2.1 蛋白质的鉴定及定量
利用i TRAQ标记技术和液相色谱串联质谱检测技术,供试的8个样品共检测到肽段次数为83 254次。通过软件Proteome Discoverer过滤,得到了16 437条高可信度(Peptide Confidence=high)的肽段,其中可用于蛋白质定量的特异肽段为12 911条。可信肽段和特异肽段经Uniport数据库搜索,最终鉴定并定量了3130个蛋白质。
蛋白质的表达量的差异分析结果显示,耐热水稻纯系中上调1.5倍的蛋白质有61个,下调1.5倍的蛋白质有20个(图1)。热敏感水稻纯系中上调1.5倍的蛋白质有38个,下调1.5倍的蛋白质有18个。其中,在耐热纯系和热敏感纯系中均上调表达的蛋白质有17个,均下调表达的蛋白质有8个。
2.2 GO功能和KEGG通路的显著富集结果

图1 耐热纯系与热敏感纯系的应答夜间高温的蛋白质数量Fig.1.Protein amount from the heat-tolerant line and heat-sensitive line responding to high night temperature.
蛋白质编码基因的GO功能(A)和KEGG通路(B)的显著富集结果如图2所示。蛋白质编码基因的GO显著富集结果显示(图2-A),质谱鉴定蛋白质的GO功能产物属性显著富集(-logP值≥1.5)在生物学过程(Biological process)的萜类化合物生物合成过程(GO ID=0016114:Terpenoid biosynthetic process)、类异戊二烯生物合成过程(GO ID=0008299:Isoprenoid biosynthetic process)、单羧酸生物合成过程(GO ID=0072330和0032787: Monocarboxylic acid biosynthetic process)、有机含羟基化合物生物合成过程(GO ID=1901617和1901615:Organic hydroxy compound biosynthetic process)、有机酸生物合成过程(GO ID=0016053: Organic acid biosynthetic process)、羧酸生物合成过程(GO ID=0046394:Carboxylic acid biosyntheticprocess)、单一有机体生物合成过程(GOID=0044711:Single-organism biosynthetic process)、脂质生物合成过程(GO ID=0008610:Lipid biosynthetic process)和小分子生物合成过程(GO ID=0044283:Small molecule biosynthetic process);其次,GO功能产物属性显著富集(-logP值≥1.5)在细胞组分(Cellular component)的酶抑制剂活性(GO ID=0004857:Enzyme inhibitor activity)、肽链内切酶抑制剂活性(GO ID=004866:Endopeptidase inhibitor activity)、肽酶调节因子活性(GO ID=0061134:Peptidase regulator activity)、肽酶抑制因子活性(GO ID=0030414:Peptidase inhibitor activity)、肽链内切酶调节因子活性(GO ID=0061135:Endopeptidase regulator activity)、丝氨酸蛋白质酶抑制剂活性(GO ID=0004867:Serinetype endopeptidase inhibitor activity)、分子功能调节因子(GO ID=0098772:Molecular function regulator)和酶调节因子活性(GO ID=0030234:Enzyme regulator activity)。蛋白质编码基因的KEGG通路显著富集结果显示(图2-B),质谱鉴定蛋白质的KEGG通路显著富集(-logP值≥4)在内质网蛋白质加工通路上(KEGG ID=Osa04141: Protein processing in endoplasmic reticulum)。
2.3 差异表达蛋白质的功能注释及其分类
依据1.7的差异表达蛋白质判定方法,耐热水稻纯系与热敏感水稻纯系之间存在36个差异表达蛋白质。这些差异表达蛋白质经Uniport数据库搜索,发现只有14个蛋白质(占38.9%)有功能注释、还有12个蛋白质(占33.3%)具有推测性功能注释,另有10个(占27.8%)为功能未知蛋白质。14个有功能注释的蛋白质中(表1),有5个蛋白质(Q9FU69、Q7Y179、Q0IPF8、Q2R1N0和Q84T00)参与能量代谢;有3个蛋白质(Q8GTK2、Q7Y007和Q10BU2)参与物质转运与代谢;有2个蛋白质(Q2R237和Q658I1)参与光合作用;另外4个蛋白质(Q67TK9、Q10N88、Q84Q72和Q5YLY5)为应答逆境的18.1 k D热激蛋白质和锌指蛋白质。
仅有推测性功能注释及功能未知的22个差异表达蛋白质中,在2水稻纯系中均呈现上调表达1.2倍以上的蛋白质有10个(Q6I587、Q7XI37、Q69MT6、Q338P8、Q7XI22、Q8 H8U1、Q94GQ6、Q0E3F2、Q6YUH8、Q6ES31),均呈现下调表达1.2倍以上的蛋白质有2个(Q7XQ85、Q0E225);在耐热水稻纯系中上调表达1.2倍以上而在热敏感水稻纯系中下调表达1.2倍以上的蛋白质有8个(Q6ZJ47、Q6ZCC9、Q6ZCP8、Q53M16、Q9LWS6、C7JA46、Q0E0B4、Q7XVN6),在耐热水稻纯系中下调表达1.2倍以上而在热敏感水稻纯系中上调表达1.2倍以上的蛋白质有2个(Q0DTK3、Q5N9C8)。
2.4 差异表达蛋白质的mRNA表达模式验证
有代表性的7个差异表达蛋白质及其编码基因的m RNA表达模式如图3所示。通过iTRAQ差异标记结合蛋白质谱分析获得的蛋白质表达模式与荧光定量PCR中的m RNA表达模式的趋势基本一致,表明通过i TRAQ差异标记结合高效液相色谱技术鉴定并定量的蛋白质组其结果可靠。
3 讨论

图2 差异表达蛋白质编码基因的GO功能(A)和KEGG通路(B)显著富集结果Fig.2.Significant enrichment results of Gene Ontology(A)and Kyoto Encyclopedia of Genes(B).
iTRAQ差异标记具有在同一个体系中同时标记多个(4或6或8个)样品的优点,不仅可以增加后续质谱分析的样品通量,而且可以减少蛋白质色谱分析过程中的定量误差[23]。本研究通过iTRAQ差异标记和液相质谱技术鉴定并定量了耐热与热敏感水稻近等基因系籽粒中的3130个蛋白质。这些蛋白质中,在耐热与热敏感水稻纯系中相对表达量超过1.5倍的蛋白质分别有81个和56个;进一步比较这些蛋白质在2个水稻纯系之间的表达模式差异,结果发现耐热与热敏感水稻纯系之间存在36个差异表达蛋白质。这些差异表达蛋白质经数据库搜索,发现仅14个蛋白质已注释功能,其余蛋白质只注释了推测性功能或功能未知。这14个已注释功能的蛋白质中(表1),有5个蛋白质参与能量代谢, 3个蛋白质参与物质转运与代谢,2个蛋白质参与光合作用,4个为逆境应答蛋白质(18.1 k D热激蛋白质和锌指蛋白质)。
锌指蛋白质是一类转录调控因子蛋白质,通过蛋白质的锌、铁中心与DNA结合从而调控基因的表达[24]。它们不仅在植物生长发育中起着重要的基因表达调控功能[25,26],而且在植物应答生物胁迫和非生物胁迫过程中扮演着非常重要的调控基因表达的角色[27-31]。Chen等[25]的研究报道锌指蛋白质OsGZF1在水稻种胚发育过程中具有调控籽粒中谷蛋白质形成功能。Cao等分析了水稻的Cys2-His2(C2H2)锌指蛋白质家族,发现其中的20个锌指蛋白质参与调控水稻的生长发育,28个参与调控水稻的授粉受精,22个参与调控水稻的抗病性,而且锌指蛋白质VRF1是水稻抗病的不可或缺的调控因子[32]。Huang等发现CHY锌指蛋白质具有通过调控水稻叶片气孔的开闭从而提高水稻抗旱性和耐盐性的功能[27,32]。本研究通过比较耐热与热敏感水稻近等基因系的蛋白质组的表达模式,发现锌指蛋白质Q67TK9(Zinc knuckle containing proteinlike)和Q10N88(ARF GAP-like zinc finger-containing protein ZIGA2)在耐热水稻纯系中上调表达2.3倍以上,而在热敏感水稻纯系中无明显表达变化(<1.5倍);锌指蛋白质Q5YLY5在耐热与热敏感水稻纯系中均呈现下调表达,但是该蛋白质在耐热水稻纯系中下调表达了4.167倍,而在热敏感水稻纯系中仅下调表达1.56倍。表明锌指蛋白质Q67TK9、Q10N88的上调表达,以及锌指蛋白质Q 5 YLY 5的下调表达有利于提高水稻灌浆期对夜间高温的耐热性。

表1 耐热纯系与热敏感纯系的差异表达蛋白质的表达模式及其功能注释Table 1.Expression model and functional illustration of the differentially expressed proteins between the heat-tolerant and the heat-sensitive lines.
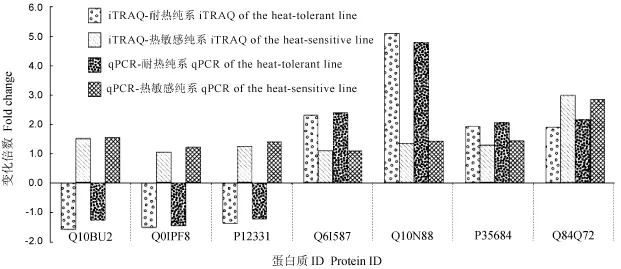
图3 差异表达蛋白质及其编码基因的表达模式Fig.3.Expression pattern of the differentially expressed protein and its coding gene.
研究表明,籽粒ATP酶促进外源营养物质经质外体和共质体的协同作用向淀粉胚乳的运输,同时ATP酶还为胚乳细胞吸收并积累蛋白质,进一步发育成蛋白体提供动力[33,34]。本研究发现,在耐热和热敏感水稻应答夜间高温过程中,籽粒中与ATP合成过程相关的ATP合成酶亚基β(Q0IPF8、LOC_Os12g10570)和ATP酶家族蛋白质(Q84T00、LOC_Os03g58800)以及与物质运转过程相关的羧肽酶(Q8GTK2、LOC_Os07g46350)、GDSL脂肪酶或酰基水解酶家族蛋白质(Q7Y007、LOC_Os03g47940)和种子萌发蛋白质3-7 (Q10BU2、LOC_Os03g58980)均呈现差异表达模式。表明夜间高温影响了ATP酶活性,进而阻碍了营养物质向淀粉胚乳的运转和积累。
热激蛋白质普遍存在于动植物细胞内,它们通过控制蛋白质的折叠和积累从而调控蛋白质表达的分子或分子伴侣[35]。据报道,干旱、高盐和高温等环境条件均可诱导热激蛋白质表达[36-40]。前期研究中,我们通过蛋白质双向电泳技术检测了水稻应答灌浆期(白天+夜间)高温的蛋白质组[17],发现18.1 kD热激蛋白质和17.9 kD热激蛋白质在耐热与热敏感水稻纯系中均呈现上调表达,而且在热敏感水稻纯系中的上调表达倍数高于其在耐热水稻纯系中的上调表达倍数。本研究利用i TRAQ差异标记和液相质谱技术比较耐热与热敏感水稻近等基因系应答夜间高温胁迫的蛋白质组差异,也检测到了18.1 kD热激蛋白质在夜间高温胁迫与对照、耐热与热敏水稻纯系中呈现差异表达,而且该蛋白质在热敏感水稻纯系中的上调表达倍数(2.975倍)高于其在耐热纯系中的上调表达倍数(1.906倍)。此外,本研究中还检测到17.9 k D热激蛋白质(Q84Q77)在耐热水稻纯系及热敏感水稻纯系中均上调表达,在耐热水稻纯系中上调了1.829倍、在热敏感水稻纯系中上调了2.292倍,但该蛋白质在2个水稻纯系间的表达倍数差异小于1.5倍。据此认为18.1 kD热激蛋白质的表达丰度似可以作为水稻对灌浆期夜间高温耐热性的评判指标。
4 结论
灌浆期夜间高温影响水稻籽粒细胞内参与能量代谢、物质转运与代谢、光合作用等相关蛋白质的表达模式。水稻籽粒细胞中锌指蛋白质Q67TK9、Q10N88的上调表达,以及锌指蛋白质Q5YLY5的下调表达,有利于提高水稻灌浆期对夜间高温的耐热性。
[1] Wheeler T,von Braun J.Climate change impacts on global food security.Science,2013,341(6145):508-513.
[2] Ray D K,Gerber J S,Macdonald G K,West P C.Climate variation explains a third of global crop yield variability.Nat Com mun,2015,6:5989.
[3] Peng S,Huang J,Sheehy J E,Laza R C,Visperas R M, Zhong X,Centeno G S,Khush G S,Cassman K G.Rice yields decline with higher night temperature from global war-ming.Proc Natl Acad Sci USA,2004,101(27):9971-9975.
[4] Shi W J,Yin X Y,Struik P C,Xie F M,Schmidt R C,Jagadish K S V.Grain yield and quality responses of tropical hybrid rice to high night-time temperature.Field Crop Res,2016, 190:18-25.
[5] 谢晓金,李秉柏,王琳,戴秦如,申双和.长江中下游地区高温时空分布及水稻花期的避害对策.中国农业气象,2010,31 (1):144-150.Xie X J,Li B B,Wang L,Dai Q R,Shen S H.Spatial and temporal distribution of high temperatureand strategies to rice florescence harm in the lower-middle reaches of Yangtze River.Chi J Agrometeorol,2010,31(1):144-150.(in Chinese with English abstract)
[6] 张校玮.我国极端气候时空特征及风险分析.上海:上海师范大学,2012.Zhang J W.Spatial and temporal characteristics of extreme climate and risks analysis in China.Shanghai:Shanghai Normal University,2012.(in Chinese with English abstract)
[7] Morita S,Yonemaru J,Takanashi J.Grain growth and endosperm cell size under high night temperatures in rice(Oryza sativa L.).Ann Bot,2005,95(4):695-701.
[8] Lin C J,Li C Y,Lin S K,Yang F H,Huang J J,Liu Y H, Lur H S.Influence of high temperature during grain filling on the accumulation of storage proteins and grain quality in rice (Oryza sativa L.).J Agric Food Chem,2010,58(19): 10545-10552.
[9] Ahmed N,Tetlow I J,Nawaz S,Iqbal A,Mubin M,Nawaz U R M S,Butt A,Lightfoot D A,Maekawa M.Effect of high temperature on grain filling period,yield,amylose content and activity of starch biosynthesis enzymes in endosperm of basmati rice.J Sci Food Agric,2015,95(11):2237-2243.
[10]Jagadish S V K,Murty M V R,Quick W P.Rice responses to rising temperatures-challenges,perspectives and future directions.Plant,Cell Environ,2015,38:1686-1698.
[11]Liu J,Feng L,Li J,He Z.Genetic and epigenetic control of plant heat responses.Front Plant Sci,2015,6:267.
[12]Jiang H,Dian W,Wu P.Effect of high temperature on fine structure of amylopectin in rice endosperm by reducing the activity of the starch branching enzyme.Phytochemistry,2003, 63(1):53-59.
[13]张桂莲,廖斌,武小金,肖应辉,肖浪涛,陈立云.高温对水稻胚乳淀粉合成关键酶活性及内源激素含量的影响.植物生理学报,2014,50(12):1840-1844.Zhang G L,Liao B,Wu X J,Xiao Y H,Xiao L T,Chen L Y.Effect of high temperature on activities of enzymes associated with starch synthesis and hormones contents in endosperm of rice.J Plant Physiol,2014,50(12):1840-1844.(in Chinese with English abstract)
[14]Yamakawa H,Hirose T,Kuroda M,Yamaguchi T.Comprehensive expression profiling of rice grain filling-related genes under high temperature using DNA microarray.Plant Physiol,2007,144(1):258-277.
[15]Mitsui T,Shiraya T,Kaneko K,Wada K.Proteomics of rice grain under high temperature stress.Front Plant Sci,2013, 4:36.
[16]Hakata M,Kuroda M,Miyashita T,Yamaguchi T,Kojima M,Sakakibara H,Mitsui T,Yamakawa H.Suppression of alpha-amylase genes improves quality of rice grain ripened under high temperature.Plant Biotechnol J,2012,10(9): 1110-1117.
[17]廖江林,宋宇,钟平安,周会汶,张宏玉,黄英金.耐热和热敏感水稻应答灌浆初期高温胁迫过程中的差异表达蛋白质鉴定.中国农业科学,2014,47(16):3121-3131.Liao J L,Song Y,Zhong P A,Zhou H W,Zhang H Y, Huang Y J.Identification of the differentially expressed proteins between heat-tolerant and heat-sensitive rice responding to high-temperature stress at the early milky stage.Sci Agric Sin,2014,47(16):3121-3131.(in Chinese with English abstract)
[18]Liao J L,Zhou H W,Peng Q,Zhong P A,Zhang H Y,He C,Huang Y J.Transcriptome changes in rice(Oryza sativa L.)in response to high night temperature stress at the early milky stage.BMC Genom,2015,16:18.
[19]Yamakawa H,Hakata M.Atlas of rice grain filling-related metabolism under high temperature:Joint analysis of metabolome and transcriptome demonstrated inhibition of starch accumulation and induction of amino acid accumulation.Plant Cell Physiol,2010,51(5):795-809.
[20]Liao J L,Zhang H Y,Shao X L,Zhong P A,Huang Y J.I-dentification for heat tolerance in backcross recombinant lines and screening of backcross introgression lines with heat tolerance at milky stage in rice.Rice Sci,2011,18(4):279-286.
[21]Liao J L,Huang Y J.Evaluation of protocols used in 2-D electrophoresis for proteome analysis of young rice caryopsis.GPB,2011,9(6):229-237.
[22]Liao J L,Zhang H Y,Liu J B,Zhong P A,Huang Y J.Identification of candidate genes related to rice grain weight under high-temperature stress.Plant Sci,2012,196:32-43.
[23]Frost D C,Greer T,Xiang F,Liang Z,Li L.Development and characterization of novel 8-plex Di Leu isobaric labels for quantitative proteomics and peptidomics.Rapid Com mun Mass Spectrom,2015,29(12):1115-1124.
[24]Klug A.The discovery of zinc fingers and their applications in gene regulation and genome manipulation.Annu Rev Biochem,2010,79:213-231.
[25]Chen Y,Sun A,Wang M,Zhu Z,Ouwerkerk P B.Functions of the CCCH type zinc finger protein OsGZF1 in regulation of the seed storage protein GluB-1 from rice.Plant Mol Biol, 2014,84(6):621-634.
[26]Sekhar S,Gharat S A,Panda B B,Mohaptra T,Das K,Kariali E,Mohapatra P K,Shaw B P.Identification and characterization of differentially expressed genes in inferior and superiorspikelets of rice cultivars with contrasting panicle-compactness and grain-filling properties.PLOS One,2015,10(12): e145749.
[27]Huang X Y,Chao D Y,Gao J P,Zhu M Z,Shi M,Lin H X.A previously unknown zinc finger protein,DST,regulates drought and salt tolerance in rice via stomatal aperture control.Gene Dev,2009,23(15):1805-1817.
[28]Tyagi H,Jha S,Sharma M,Giri J,Tyagi A K.Rice saps are responsive to multiple biotic stresses and overexpression of OsSAP1,an A20/AN1 zinc-finger protein,enhances the basal resistance against pathogen infection in tobacco.Plant Sci, 2014,225:68-76.
[29]Wang F,Tong W,Zhu H,Kong W,Peng R,Liu Q,Yao Q.A novel Cys2/His2 zinc finger protein gene from sweetpotato, IbZFP1,is involved in salt and drought tolerance in transgenic Arabidopsis.Planta,2016,243(3):783-797.
[30]Yue X,Que Y,Xu L,Deng S,Peng Y,Talbot N J,Wang Z.ZNF1 encodes a putative C2 H2 zinc-finger protein essential for appressorium differentiation by the rice blast fungus Magnaporthe oryzae.Mol Plant Microbe Interact,2016,29(1):22-35.
[31]Zhang Y,Lan H,Shao Q,Wang R,Chen H,Tang H,Zhang H,Huang J.An A20/AN1-type zinc finger protein modulates gibberellins and abscisic acid contents and increases sensitivity to abiotic stress in rice(Oryza sativa L.).J Exp Bot,2016, 67(1):315-326.
[32]Cao H,Huang P,Zhang L,Shi Y,Sun D,Yan Y,Liu X, Dong B,Chen G,Snyder J H,Lin F,Lu J.Characterization of 47 Cys2-His2 zinc finger proteins required for the development and pathogenicity of the rice blast fungus Magnaporthe oryzae.New Phytol,2016,doi:10.1111/nph.13948.
[33]Wei C X,Lan S Y,Xu Z X.Ultracytochemical localization and functional analysis of ATPase during the endosperm development in rice(Oryza sativa L.).Sci Agric Sin,2003,36 (3):259-262.
[34]Zhou Z Q,Lan S Y,Xu Z X,Yang Z M.Dynamic change of ATPase activity on amyloplasts and protein bodies during the endosperm development in rice(Oryza sativa L.).Acta Biol Ex p Sin,2005,38(1):7-15.
[35]Al-Whaibi M H.Plant heat-shock proteins:A mini review.J King Saud Univ-Sci,2011,23(2):139-150.
[36]Gonzalez-Schain N,Dreni L,Lawas L M,Galbiati M,Colombo L,Heuer S,Jagadish K S,Kater M M.Genome-wide transcriptome analysis during anthesis reveals new insights into the molecular basis of heat stress responses in tolerant and sensitive rice varieties.Plant Cell Physiol,2016,57(1):57-68.
[37]Das S,Krishnan P,Mishra V,Kumar R,Ramakrishnan B, Sinqh N K.Proteomic changes in rice leaves grown under open field high temperature stress conditions.Mol Biol Rep,2015, 42(11):1545-1558.
[38]Xiang J H,Ran J,Zou J,Zhou X,Liu A,Zhang X,Peng Y, Tang N,Luo G,Chen X.Heat shock factor Os Hsf B2b negatively regulates drought and salt tolerance in rice.Plant Cell Rep,2013,32(11):1795-1806.
[39]Liu A L,Zou J,Liu C F,Zhou X Y,Zhang X W,Luo G Y, Chen X B.Over-expression of Os Hsf A7 enhanced salt and drought tolerance in transgenic rice.BMB Rep,2013,46(1): 31-36.
[40]Zou J,Liu C,Liu A,Zou D,Chen X.Overexpression of Os Hsp17.0 and Os Hsp23.7 enhances drought and salt tolerance in rice.J Plant Physiol,2012,169(6):628-635.
Analysis on Comparative Proteomics of Rice Grain Between Heat-tolerant and Heat-sensitive Lines Under High Night Temperature Stress at Filling Stage
HUANG Xiaoping1,ZHANG Hongyu2,LEI Gang1,WANG Zhimei1,ZHANG Zhi1,HE Chao1, LIAO Jianglin1,2,∗,HUANG Yingjin1,2,∗
(1Key Laboratory of Crop Physiology,Ecology and Genetic Breeding,Ministry of Education,Jiangxi Agricultural University, Nanchang 330045;2 Key Laboratory of Agriculture Responding to Climate Change,Jiangxi Agricultural University,Nanchang 330045;∗Corresponding author,E-mail:jlliao514815@163.com;yjhuang_cn@126.com)
【Objective】To understand molecular mechanism of rice tolerance to high night temperature at filling stage, we identify the differentially expressed proteins(DEPs)and screen the proteins involving in regulating the heat-tolerance in rice.【Method】The heat-tolerant rice line XN0437T and the heat-sensitive rice line XN0437S originated from a near-genetic lines were used as plant materials.Rice was pot-cultivated under traditional management.To ensure that only grain samples with uniform growth were used for proteomes analysis,rice panicle bloomed on the same date were labeled with same markers and spikelets flowering on the same date on the labeled panicle were further labeled.On the 8th day after flowering,rice plants with same label were transferred to chambers for high night temperature treatment.Rice grains with same label were harvested and total proteins of the grain samples were extracted after high temperature treatment.The 8-plex iTRAQ kits combined with the LC-MS/MS technology were used to analyze the DEPs between the heat-tolerant and heat-sensitive lines.【Result】After protein’s databases searching and differentially expressed proteins analysis,3130 proteins were finally identified and 36 proteins showed differential expression levels between the heat-tolerant and heat-sensitive line.For the 36 DEPs,14 proteins(38.9%) had functional annotation,12(33.3%)had putative function,and 10(33.3%)were functional unknown proteins.The 14 function-known proteins were involved in energy metabolism(five proteins),transport and metabolism(three proteins),photosynthesis(two proteins)and defense response(four proteins).【Conclusion】High night temperature impacts the expressed patterns of the proteins involved in energy metabolism,matter transport and metabolism, photosynthesis and defense response in rice at filling stage.We suggested that up-regulated expression of the zinc finger proteins(Q67TK9 and Q10N88),and down-regulated expression of the zinc finger protein(Q5YLY5)in rice grain could enhance the heat-tolerance in rice.
rice;filling stage;high night temperature;proteomics;iTRAQ technique
Q948.112+.2;S511.01
A
1001-7216(2017)01-0013-10
2016-06-24;修改稿收到日期:2016-09-17。
江西省青年科学基金重点资助项目(20133 ACB21004);国家自然科学基金资助项目(31260315,31471467)。
