清蛋白及前清蛋白水平与小细胞肺癌患者预后的关系研究
2017-02-17张苗苗鲁培
张苗苗 鲁培
(郑州大学第一附属医院 肿瘤科 河南 郑州 450000)
清蛋白及前清蛋白水平与小细胞肺癌患者预后的关系研究
张苗苗 鲁培
(郑州大学第一附属医院 肿瘤科 河南 郑州 450000)
目的 研究小细胞肺癌(small cell lung cancer,SCLC)患者血清清蛋白(albumin,ALB)及前清蛋白(prealbumin,PA)水平与其预后的关系。方法 回顾性分析2012年5月至2015年5月郑州大学第一附属医院经病理学证实的84例SCLC患者,在初次化疗前采用溴甲酚绿法检测其血清ALB和PA水平。根据ALB水平将患者分为正常组(ALB≥35 g/L) 69例与异常组(ALB<35 g/L) 15例;根据PA水平将患者分为正常组(180 mg/L≤PA≤400 mg/L)61例及异常组(PA<180 mg/L)23例。卡方检验比较ALB及PA与各临床指标的相关性,生存率的计算采用Kaplan-Meier法,Log-Rank法进行生存率的显著性检验;COX比例风险模型矫正各混杂因素的影响。结果 血清ALB水平正常组患者的总生存期为(18.27±1.45)个月,中位生存期为(15.21±1.04)个月;血清ALB水平异常组患者的总生存期为(9.65±2.61)个月,中位生存期为(6.83±2.73)个月,两组患者总生存期及中位生存期比较,差异均有统计学意义 (P<0.05);血清PA水平正常组患者的总生存期为(19.68±2.02)个月,中位生存期为(18.43±3.50)个月;血清PA水平异常组患者的总生存期为(12.86±1.86)个月,中位生存期为(12.65±3.07)个月。两组患者总生存期及中位生存期比较,差异均有统计学意义 (P<0.05)。结论 ALB及PA是SCLC的独立预后因素。
小细胞肺癌;清蛋白;前清蛋白;预后
肺癌是全球癌症相关死亡的首要原因[1],我国国家癌症中心2015年发布的数据显示,2006年至2011年我国肺癌5 a患病率是130.2(1/10万)。其中男性84.6(1/10万),居恶性肿瘤第2位。女性45.6(1/10万),居恶性肿瘤第4位[2]。肺癌主要包括肺鳞癌、肺腺癌及小细胞肺癌等,其中小细胞肺癌约占15%~20%。SCLC恶性程度高、进展迅速、肿瘤倍增时间短、发病初期极易出现远处转移、对化疗和放疗敏感但其预后差。即使经过正规的系统治疗,局限期SCLC患者的中位生存期约为15~34个月,广泛期SCLC患者的中位生存期仅为7~11个月。目前,评估SCLC患者预后的指标较多,常见的有神经特异性烯醇化酶(NSE)、肿瘤分期、行为状态评分(KPS评分)、C 反应蛋白水平(CRP)、乳酸脱氢酶水平(LDH)、纤维蛋白原水平等[3-6]。大量研究表明,化疗前患者的营养状况可显著影响其预后,血清ALB及PA水平均可用于判断患者的营养状况。既往研究表明,ALB及PA水平是结肠癌[7]、食管癌[8]、卵巢癌[9]、ALL及AML[10]患者治疗效果的有效预测指标。但是,ALB及PA对SCLC患者的疗效及预后关系尚未见报道。本研究主要通过回顾性分析84例SCLC患者的临床资料,观察初次化疗前血清ALB及PA水平与其预后的关系。
1 资料与方法
1.1 纳入标准 ①经细胞学或病理组织学检查确诊为SCLC;②年龄>18岁;③既往未行化疗、放疗及手术治疗;④行为状态评分(KPS评分)>60分;⑤病历资料完整。排除标准:①既往患有其他恶性肿瘤;②患有自身免疫性疾病;③患有慢性肾病及肝脏疾病;④糖尿病患者;⑤甲状腺功能障碍患者。所有患者均接受标准的EP(依托泊苷+顺铂)化疗方案,3周为1个周期,共6个周期。
1.2 临床资料 回顾性分析2012年5月至2015年5月于郑州大学第一附属医院肿瘤内科就诊的符合入选标准的患者88例,其中2例患者失访,1例患者死于醉酒,1例患者死于心力衰竭,失访率为1.14%。余84例患者中,男64例,女20例,男女比为3.2∶1;中位年龄为60岁(33~85岁);局限期(limited disease, LD)小细胞肺癌34例,广泛期(extensive disease, ED)小细胞肺癌50例。分别根据治疗前血清ALB水平及PA水平将患者分为ALB正常组(ALB≥35 g/L)69例与异常组(ALB<35 g/L) 15例;PA正常组(180 mg/L≤PA≤400 mg/L)61例及异常组(PA<180 mg/L)23 例。
1.3 检测方法 入院时采集空腹静脉血5 ml, 3 000 r/min离心,分离血清,采用溴甲酚绿法检测血清ALB及PA水平,检测仪器为雅培公司生产的 C8000 型,操作按照说明书执行。血清ALB正常参考值为35~55 g/L,PA正常参考值为180~400 mg/L。
1.4 观察指标及随访 收集84例患者的性别,年龄,肿瘤分期,初诊时血清LDH、CRP、NSE、ALB及PA水平等资料并对其进行随访。观察终点事件的定义:总生存期定义为确诊SCLC之日开始至任何原因死亡的时间;对于死亡之前已经失访的患者,将末次随访时间计算为死亡时间。所有患者在治疗后每3个月随访1次,直至死亡。末次随访时间为2015年12月7日。
1.5 统计学分析 采用SPSS 21.0统计学软件进行统计分析,定性资料以率(%)表示,分类变量间的差异采用χ2检验或校正的χ2检验。生存率的计算采用 Kaplan-Meier法,显著性检验采用Log-Rank法,以P<0.05为差异具有统计学意义。采用Cox比例风险模型进行多因素分析,以双侧检验,P<0.05为具有统计学意义。
2 结果
2.1 一般情况 符合入组的SCLC患者共84例,治疗前血清ALB正常组及异常组患者的一般临床特征见表1;血清PA正常组及异常组患者的一般临床特征见表2;组间比较,差异均无统计学意义(P>0.05)。
2.2 血清ALB与生存期的关系 血清ALB<35 g/L组患者的总生存期为(9.65±2.61)个月,中位生存期为(6.83±2.73)个月;血清ALB≥35 g/L组患者的总生存期为(18.27±1.45)个月,中位生存期为(15.21±1.04)个月。两组患者总生存期、中位生存期比较,差异均有统计学意义(P<0.05)。见图1。
2.3 血清PA与生存期的关系 血清PA<180 mg/L组患者的总生存期为(12.86±1.86)个月,中位生存期为(12.65±3.07)个月;180 mg/L≤血清PA≤400 mg/L组患者的总生存期为(19.68±2.02)个月,中位生存期为(18.43±3.50)个月。两组患者总生存期、中位生存期比较,差异均有统计学意义(P<0.05)。见图2。
2.4 单因素及COX模型回归多因素分析 肿瘤分期、ALB、PA、LDH、CRP和NSE是SCLC患者预后的独立危险因素(P<0.05)。见表3、4。
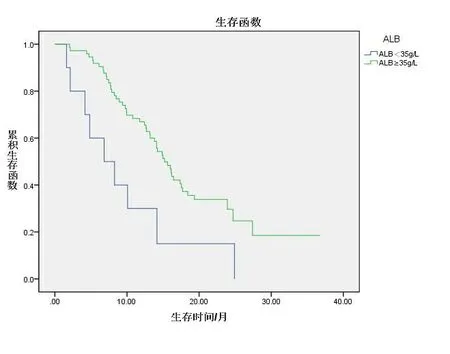
图1 血清ALB正常组和异常组患者的生存曲线

图2 血清PA正常组和异常组患者的生存曲线
3 讨论
SCLC是一种侵袭力较强的恶性肿瘤,往往大部分患者在诊断时已经发生远处转移,因此患者的生存期及预后往往不容乐观。目前,尽管随着新药的出现及治疗方法的不断改进,SCLC患者的生存得到了很大改善,但是其预后差仍然是临床肿瘤医师需要进一步解决的问题。由于SCLC患者个体的临床预后存在较大差异,因此通过探讨影响SCLC患者预后的因素以客观评价患者因素、肿瘤因素及治疗因素对患者预后的影响,有助于指导临床治疗,为提高疗效提供科学依据。血清ALB是由585个氨基酸组成的单链蛋白质,其半衰期约为19 d。具有结合和运输内源性及外源性物质,维持血液胶体渗透压、清除自由基、抑制血小板聚集和抗凝等生理功能。血清PA分子量为54 000 D,其半衰期较ALB短,约为0.5 d,可作为肝功能损害的早期指标以及提示一些疾病的变化及预后。血浆ALB及PA水平均可用于反映肝脏的合成及储备功能,可以帮助判断患者的营养状况。而营养状况可影响患者的生存及预后,营养不良是恶性肿瘤的常见并发症。有研究表明,肿瘤患者营养不良发生率高达26.35%,而营养风险更是达到45.56%。营养风险是手术或化疗患者预后的不良因素。具有营养不良及营养风险的患者化疗不良事件发生率明显高于无营养不良及营养风险患者。化疗住院时间也明显长于无营养风险者。因此,在临床工作中应重视恶性肿瘤患者的营养状况。研究已表明PA水平与直肠癌[7]和食管癌[8]患者的总生存期相关,另一项研究表明PA与非小细胞肺癌[11]及卵巢癌[12]患者的治疗效果相关。此外,该项研究还表明低PA水平是影响癌症患者生存的独立影响因素。

表1 血清ALB正常组及异常组的临床病理特征

表2 血清PA正常组及异常组的临床病理特征
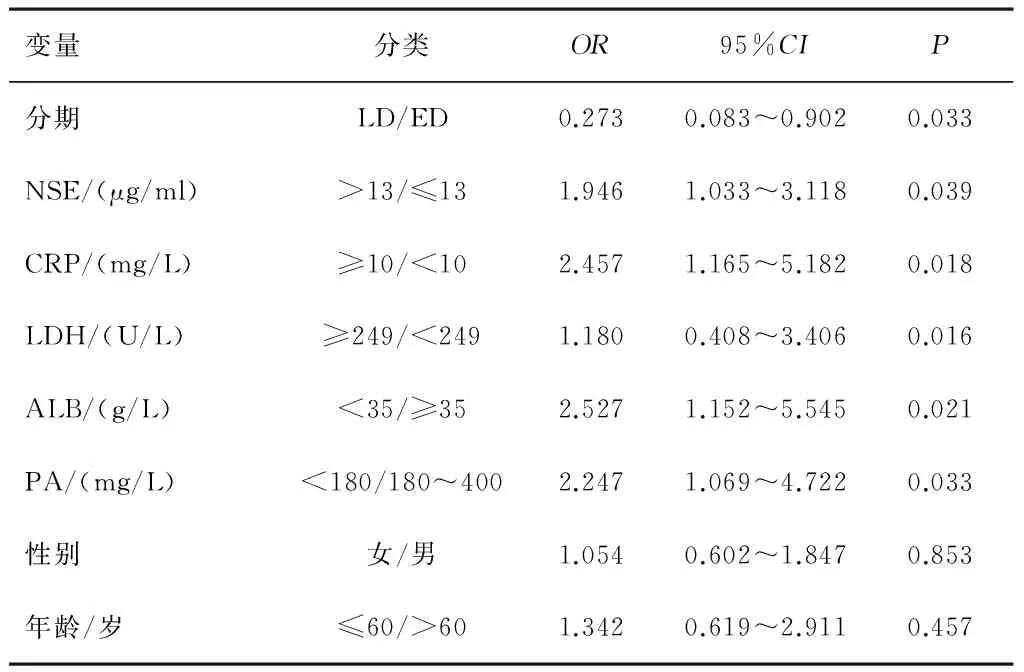
表3 84例SCLC单因素回归分析结果
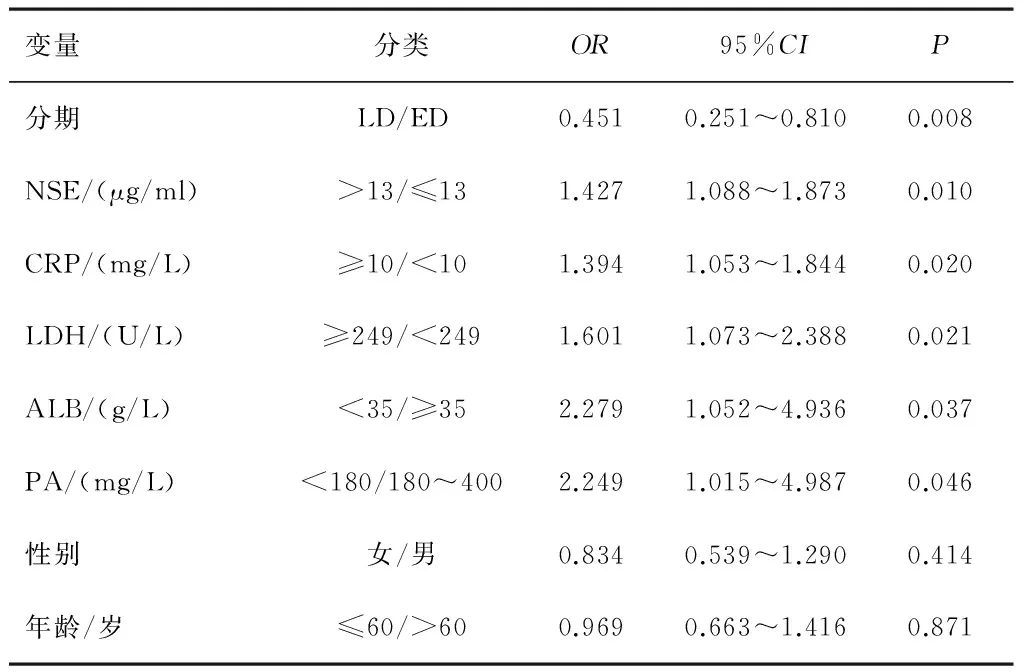
表4 84例SCLC Cox多因素回归分析结果
本研究结果显示,血清ALB及PA水平可能是影响SCLC患者预后的独立危险因素。然而,样本量小是该研究的不足之处,该结论有待于大样本多中心的研究进一步证实;除此之外,PA的半衰期仅为0.5 d,而ALB的半衰期约为19 d,故PA较ALB而言是否对评估SCLC患者的生存及预后更具有敏感性也有待于进一步研究。
[1] Jemal A,Bray F,Center M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] Zheng R,Zeng H,Zhang S,et al.National estimates of cancer prevalence in China,2011[J].Cancer Lett,2016,370(1):33-38.
[3] Liu S,Zhang G L,Li C H,et al.Prognostic factors and survival of patients with small cell lung cancer in a northeastern Chinese population[J].Thoracic Cancer,2013,4(2):143-152
[4] 贾垂明.血浆纤维蛋白原、D- 二聚体与非小细胞肺癌预后的相关性研究[J].临床医学,2011,24(3):64.
[5] Wheatley-Price P,Ma C,Ashcroft L F,et al.The strength of female sex as a prognostic factor in small-cell lung cancer:apooled analysis of chemotherapy trials from the Manchester Lung GroupandMedical Research CouncilClinical Trials Unit[J].Ann Oncol,2010,21(2):232-237.
[6] 李承慧,段爱雄,汪志求.非小细胞肺癌患者血小板增多与预后关系的临床研究[J].现代肿瘤医学,2014,22(2):329-331.
[7] Bystrom P,Berglund A,Nygren P,et al.Evaluation of predictive markers for patients with advanced colorectal cancer[J].Acta Oncol,2012,51(7):849-859.
[8] Kelly P,Paulin F,Lamont D,et al.Pre-treatment plasma proteomic markers associated with survival in oesophageal cancer[J].Bri J Cancer,2012,106(5):955-961.
[9] Mahlck G,Granvist K.Plasma prealbumin in women with epithelial ovarian carcinoma[J].Gynecol Obstet Invest,1994,37(2):135-140
[10]Esfahani A,Ghoreishi Z,AbediMiran,M et al.Nutritional assessment of patients with acute leukemia during induction chemotherapy:association with hospital outcomes[J].Leuk Lymphoma,2014,55(8):1743-1750
[11]Kawai H,Ota H.Low perioperative serum prealbumin predicts early recurrence after curative pulmonary resection for non-small-cell lung cancer[J].World J Surg,2012,36(12):2853-2857.
[12]Ho S Y,Guo H R,Chen H A,et al.Nutritional predictors of survival in terminally ill cancer patients[J].J Formos Med Assoc,2003,102(8):544-550.
Relationship between serum albumin and prealbumin levels and prognosis of patients with small cell lung cancer
Zhang Miaomiao,Lu Pei
(DepartmentofOncology,theFirstAffiliatedHospitalofZhengzhouUniversity,ZhengZhou450000,China)
Objective To evaluate the relationship between serum albumin(ALB)and prealbumin(PA) levels and prognosis of patients with small cell lung cancer. Methods A retrospective analysis of 84 SCLC patients confirmed by pathology in the First Affiliated Hoapital of Zhengzhou University from May of 2012 to May of 2015. The serum ALB and PA levels were adopted by bromocresol green method before primary chemotherapy. The patients were divided into ALB normal group (ALB≥35 g/L,n=69) and abnormal group(ALB<35 g/L,n=15), PA normal group(180 mg/L≤PA ≤400 mg/L,n=61) and abnormal group (PA<180 mg/L,n=23) according to the ALB and PA levels respectively. The Chi square test was used to evaluate the association of ALB and PA levels with the clinical indexes. The survival rates were calculated using the Kaplan Meier method and Log-Rank method was use for significance test of survival. COX proportional hazards model was used to correct the confounding factors. Results The overall survival and median survival time were (18.27±1.45) and (15.21±1.04) months in the ALB lever normal group, which were (9.65±2.61) and (6.83±2.73) months in the abnormal group,and there was a significant difference in the survival time between two groups (P<0.05). The overall survival and median survival time were (19.68±2.02) and (18.43±3.50) months in the PA lever normal group, which were (12.86±1.86) and (12.65±3.07) months in the abnormal group, and there was a significant difference in the survival time between two groups (P<0.05). Conclusion ALB and PA are independent prognostic factors for SCLC.
small cell lung cancer; albumin; prealbumin; prognosis
R 734.2
10.3969/j.issn.1004-437X.2017.02.004
2016-05-22)
