人源肿瘤异种移植模型在精准肿瘤医学中的研究进展
2017-02-15李克娟
李克娟,黄 昊,高 苒
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,北京 100021)
人源肿瘤异种移植模型在精准肿瘤医学中的研究进展
李克娟,黄 昊,高 苒*
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,北京 100021)
癌症是由于物理、化学、病毒等致癌因子导致的原癌基因和抑癌基因突变从而引发的一系列异质性疾病的统称。尽管近年来高通量测序技术与靶向治疗取得了突破性的进展,但是临床转化研究的高失败率使得抗肿瘤药物的创新发展十分有限。人源肿瘤异种移植模型(patient-derived xenograft model,PDX模型)是指直接将病人的新鲜肿瘤组织移植到免疫缺陷小鼠上,依靠小鼠提供的环境生长的一种异种移植模型。这种模型保留了原代肿瘤的基质异质性、组织学特性、分子多样性以及微环境,为临床前药效的个性化筛选评估以及生物标志物的鉴定提供了有效的研发资源。PDX模型结合临床数据,基因组图谱以及药效数据可以增加药物特异性,应用于肿瘤患者个体化治疗,提高临床治疗成功率。本文就PDX模型研究进展进行综述,包括其在肿瘤新疗法中的应用、挑战性与局限性、以及在精准肿瘤医学中的应用前景。
人源性肿瘤异种移植;PDX模型;个性化治疗;精准医学
癌症是由于多种致癌因素激活原癌基因或(和)灭活肿瘤抑制因子,使细胞发生转化并无限增殖,且与肿瘤基因信号通路相关的一类基因组疾病的统称[1]。高通量测序技术的最新进展已经阐明了多种癌症的突变过程并提供了一个全面的癌症基因目录[2-6]。此外,癌症基因组分析也表明癌症通常是一种高度异质性的疾病,即使是基因突变水平以及肿瘤组织病理结果一致的同种类型的癌症也存在异质性。这种普遍存在的异质性可以在某种程度上解释为什么同一种癌症类型的患者对某种特定的治疗表现出不同的疗效。随着基因组测序技术以及生物信息与大数据科学的交叉应用,新型医学概念与医疗模式逐渐发展。美国医学界在2011年首次提出精准医学的概念,2015年美国总统奥巴马又在国情咨文中提出“精准医学计划”,希望精准医学可以引领一个医学新时代。精准医学的本质是通过精确基因组分析,将患者分为小亚群,通过个体或亚群的精确分类来实现个体化精准治疗。
大量的基因组分析已经鉴定出了多种肿瘤相关基因,同时也发现了许多潜在的靶向治疗位点,目前有很多临床药物就是根据这些潜在的靶向位点而设计的,其中包括伊马替尼(imatinib),该药物通过靶向BCR-ABL1融合蛋白治疗慢性粒细胞白血病[7];曲妥珠单抗(transtuzumab)是通过靶向HER2治疗乳腺癌与胃癌[8];吉非替尼(gifitinib)和厄洛替尼(erlotinib)是通过靶向EGFR突变治疗肺癌[9];克唑替尼(crizotinib)则是通过靶向EML4-ALK融合蛋白治疗肺癌[10]。除了将这些药物转化到临床,靶向治疗的快速发展也促进了人们对根据个体化肿瘤的分子分型而制定的个体化治疗方案理念的认同[11]。目前基因组分析和靶向治疗的结合已经应用到几乎所有类型的肿瘤治疗。
抗肿瘤药物的创新发展常因为临床试验的高失败率而受到制约。目前抗肿瘤药物的临床试验成功率低于15%,针对实体瘤的成功率则更低[12]。尽管靶向治疗具有巨大的潜力,但是在实际操作过程中有相当多的肿瘤都难以被靶向药物识别。这是因为在一个特定的肿瘤中,基因组的不稳定性导致了多种肿瘤相关的原癌基因或抑癌基因发生改变进而增加了肿瘤细胞表型的复杂性。此外,肿瘤本身就是一个异质细胞的集合体,其中包括肿瘤细胞,成纤维细胞,血管内皮细胞以及免疫细胞,甚至来自同一患者的肿瘤细胞在基因组和转录组中均可表现出多样化的特征,这些都可以体现肿瘤的异质性。因此,在多数情况下,药物疗效预测并不能通过简单的基因组分析来进行全面的预期评估。
为了克服这些局限性,针对肿瘤的基因组改变,医学研究者们迫切需求更加精准更加全面的分析以及药物疗效预测评估的方法。人源肿瘤移植模型(patient derived xenograft model,PDX模型)是指将病人的新鲜肿瘤组织移植到免疫缺陷小鼠上,依靠小鼠提供的环境生长的一种异种移植模型。这种模型为临床前药效筛选及评估提供了有效的研发资源。本文就PDX模型研究进展以及在精准肿瘤医学中的应用进行综述。
1 人源肿瘤移植模型(PDX模型)
传统的的体内药敏测试方法是将鼠源或人源细胞在体外筛选,经过传代培养,建立稳定细胞株,然后移植到小鼠体内建立肿瘤模型,这种模型的建立在肿瘤研究中的应用已有半个世纪[13],但是这种模型存在一定的缺陷,因为连续传代的肿瘤细胞株适应了外界培养皿的环境,丢失了肿瘤异质性,因此不能客观反应原代肿瘤的情况。PDX模型是一种直接将病人的新鲜肿瘤细胞或组织通过原位或者是异位(多为皮下或肾包膜)等方式移植到免疫缺陷小鼠上,依靠小鼠提供的环境生长的一种动物模型。其最重要的优势就是可以高度保留患者肿瘤的组织学特性,遗传学特征以及肿瘤特异性,同时也包含了原代肿瘤的微环境,包括细胞外基质,免疫细胞以及肿瘤微环境因子[14]。PDX模型是目前为止最接近临床研究的相关肿瘤模型,这种模拟人肿瘤特异性的模型对肿瘤临床前期评估、治疗和预后具有重要的转化意义,有望为肿瘤患者个体化治疗带来新突破。
PDX模型的建立方法是将新鲜外科手术肿瘤组织或活检组织通过皮下[15]或原位种植到免疫缺陷小鼠身上,也有将肿瘤种植到血供更为丰富的肾包膜下[16]。接种到小鼠身上的肿瘤需要被剪切成2~4 mm大的碎片然后重新种植到新的小鼠身上进行传代。用于建立PDX模型的小鼠根据免疫缺陷程度可以分为BALB/c Nude,SCID,NOD SCID,NSG 小鼠以及NOG小鼠。其中NSG小鼠(NOG小鼠)不但缺乏T细胞、B细胞和NK细胞,而且细胞因子信号传递能力缺失,对人源细胞和组织几乎没有排斥反应,是目前国际公认的免疫缺陷程度最高、最适合人源细胞或组织移植的工具小鼠。
一般来说,PDX移植瘤的成瘤时间在2~4个月[15],在药物敏感性测试实验中,移植瘤小鼠应在早期世代进行传代扩增。PDX建模的成功率(以获得可以传代的PDX肿瘤为标准)在23%~75%之间[17],与肿瘤类型密切相关(表1)。据报道,结直肠癌(64~89%)与胰腺癌(62%)具有较高的移植率,但是乳腺癌(13%~27%)的成功率则较低[18,19]。此外,肿瘤标本的恶性程度以及分化程度对移植的成功率影响也较大,恶性程度高、分化程度低的肿瘤移植成功率较高[20]。移植位点也是影响移植瘤生长的一个重要影响因素。皮下移植因其操作简单、容易观察、方便定期测量和适合传代等优点被广泛使用,但成功率相对较低,约为40%~60%[21]。在皮下异种移植模型中,其肿瘤一般局限于皮下成团生长,很少出现转移扩散和转移瘤。肾包膜下移植因其血供比较丰富,成功率能达到95%以上[22]。但是肾包膜下移植也有它的局限性,包括肾包膜脆弱操作困难、对受体小鼠的损伤较大、且易导致感染等。与其他两种移植位点相比,原位移植更加贴近肿瘤微环境,尤其是在研究癌症转移方面,原位移植模型最为理想[25]。但是由于原位移植对移植者的技术要求较高,建模比较困难,也阻止了其广泛应用。此外,移植成功率还被报道与激素补充剂有关,在乳腺癌中,给雌鼠补充雌二醇颗粒可以将成功率从2.6%提高到21.4%[26],而在前列腺癌中,给NOD SCID雄鼠补充睾丸素可将成功率提高至38.9%[23]。因此,肿瘤类型、肿瘤恶性程度、移植方式以及激素补充剂等是影响肿瘤异种移植成功率的重要因素。
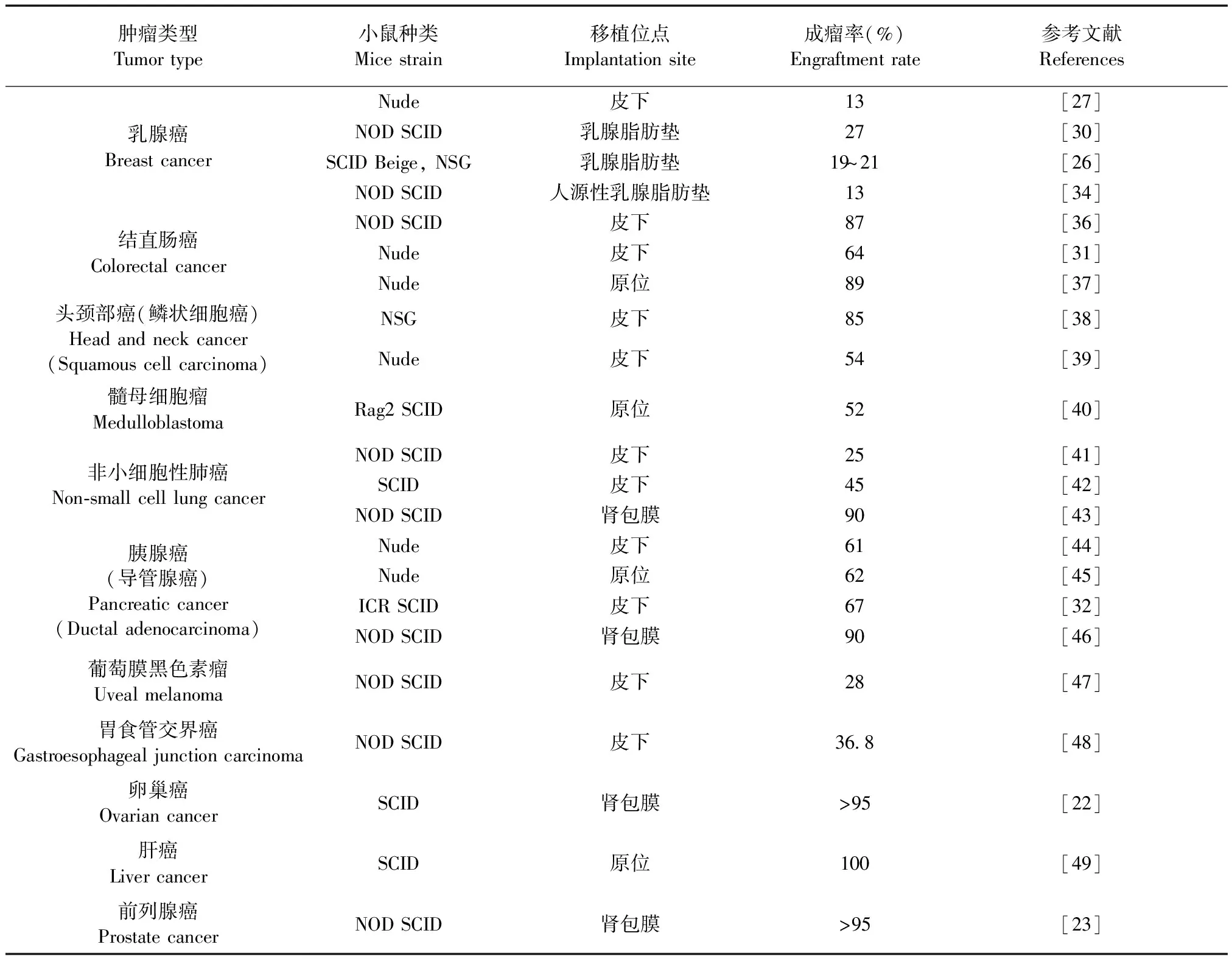
表1 PDX模型成瘤率总结
大量的研究表明,PDX模型高度保真并保留了原代肿瘤的组织病理学、遗传学特征以及肿瘤异质性[27]。此外,全面的基因表达谱数据分析表明PDX肿瘤在很大程度上保留了原代肿瘤中大多数的关键基因与信号通路活性[28,29]。在乳腺癌PDX模型中也会在临床相关位点发生自发性转移,包括胸腺、肺、骨及腹膜[30]。在一些传代实验中,反复种植同一个肿瘤可以相对高度地保留基因组偏差,这在结直肠癌、乳腺癌以及胰腺癌中均有报道[28, 31,32]。但是也有些报道发现了PDX特有的核苷酸突变,这有可能是由肿瘤对新环境的适应性或在原代肿瘤中低于可检测极限的亚克隆过度生长所导致的[33,34]。
2 PDX模型应用
PDX模型已被证实是一个很有意义的在多种肿瘤类型临床前药物测试的研究工具。研究发现结直肠癌、胰腺癌患者与相应的PDX模型对西妥昔单抗和吉西他滨均表现出相同的反应性[31, 36, 44]。贝伐单抗在胶质母细胞瘤(GBM)患者与PDX模型中均没有改善生存期,且使肿瘤变得更具侵略性和侵袭性[49]。白蛋白结合型紫杉醇和吉西他滨的联合疗法通过PDX实验证实对胰腺癌具有效果[51],该疗法随后被报道在一个随机III期临床研究中成功地为晚期胰腺癌患者提供了生存获益[52]。PDX模型在临床前的靶向药物研究中具有独特的优势,这是因为在评估了PDX模型的基因组特性之后,一个具有相同基因组特征的PDX模型子集可以被用来评估靶向治疗的效果。例如,pan-RAF和SRC家族激酶双重抑制剂的作用就是先前已知的BRAF抑制剂敏感和耐受的黑素瘤PDX模型中评估的[53]。此外,靶向药物和细胞毒性药物组合治疗,也可以在之前特定的PDX模型中得到测试,如Park团队[54]最近利用胃癌PDX模型验证了BCL2L1抑制剂和伊立替康联合治疗的功效。
将PDX模型更加系统地应用到肿瘤药物研发资源开发上面,需要建立生物库或PDX肿瘤生物样本库,尤其是基因组高度特异性的PDX库是发展高级诊断和癌症治疗的宝贵资源[55]。最近国际上已经有一些研究团队建立了PDX资源库,并且现在已经开始尝试建立合作网络化PDX生物银行。比如,EurO PDX就是由16个欧洲机构联合组成的PDX模型库,旨在发展建立临床相关和标注的PDX网络库,据称已经拥有1500个PDX模型[35];美国国家癌症研究所(NCI)的初期目标是建立1000个PDX模型,目前数量已经完成约三分之一;美国的杰克逊实验室已经拥有超过450个PDX模型;以诺华公司为代表的制药公司于2015年发布的药物筛选工具便使用了1000多个PDX模型。这些模型将帮助医学研究者们更好的研究癌症的遗传复杂性。
随着基因组高度明确的PDX模型收集以及药物敏感性和耐药性相关的生物标志物逐渐被识别,癌症的精准医疗将变成可能。科学家们已经利用PDX模型重现了多种已知的癌症敏感性生物标志物,如野生型KRAS的结直肠癌对西妥昔单抗敏感[31, 36]和野生型KRAS的肺癌对厄洛替尼敏感[56]。通过分别对药物敏感和药物耐受的大肠癌PDX模型进行比较,HER2的扩增被确定为西妥昔单抗治疗的耐药标志物[36]。同时,通过对PDX模型反复给予某种特定药物可以建立新型耐药肿瘤模型。与体外肿瘤细胞培养系统相比,这些耐药肿瘤更具有临床相关性,可以用于耐药机制的研究和耐药标志物的鉴定。例如,对BRAF阳性的黑色素瘤PDX模型使用BRAF抑制剂vemurafenib的连续给药,可以诱导伴有BRAF突变并且对vemurafenib耐受的黑色素瘤模型的产生,BRAF突变蛋白水平升高已经被报道为连续vemurafenib药物治疗中的判断耐药性的一个关键因素[57]。
PDX模型的预测能力已被应用到新型抗癌药物开发的联合临床试验中。一般来讲,Ⅰ、Ⅱ期临床试验至少需要5年才可以完成,在这些试验中,实时分析、数据整合、及对药物呈现不同反应的人群进行分层十分有限。为了克服这一障碍,小鼠肿瘤模型的药物治疗实验与临床试验共同进行的联合临床试验可以被实施,这样临床前数据和临床数据可以同时得到整合[58]。联合临床试验的概念最初是为转基因小鼠模型提出的,现在这一观念也可以应用于基因组明确的PDX模型[35]。使用PDX模型的联合临床试验方法将有利于将患者快速分层、药物组合优化、耐药机制的研究及生物标志物的鉴定[58]。
PDX模型还可以作为“替身”模型用于个体化抗癌药物筛选。“替身”模型是将小鼠作为特定的人类患者的替代品来测试与筛选抗癌药物。在一项前瞻性研究中,14名患者的替身小鼠模型被用来研究筛选含63种药物的232个治疗方案中的有效的治疗方案,然后将针对移植瘤模型的最有效的治疗方案中的17个方案对11名患者进行了治疗,其中的15个治疗方案对患者成功地起到了持久性的部分缓解疗效[18]。在另一项研究中,PDX临床试验(PCT)被证实可通过靶向药物在PDX模型上的反应评估靶向药物对患者的反应,研究发现67%的BRAF突变黑色素瘤PDX模型对encorafenib敏感,这与II期临床试验中选择性的BRAF抑制剂对患者的反应率是一致的;而对encorafenib不敏感的BRAF突变黑色素瘤PDX模型对BRAF抑制剂与MEK抑制剂联合治疗显示反应,这也与I/II期临床试验中联合治疗BRAF突变的黑色素瘤患者的结果相符[59]。因此,临床医生可以根据个体化的PDX模型对药物的反应,指导并确定最佳治疗方案,并根据疗效反应及时对治疗方案进行优化。
PDX模型也可以用于研究肿瘤免疫治疗的效果。例如,同时移植了患者来源的胃癌组织以及外周血单核细胞的小鼠对anti-hcd137和anti-hpd1抗体的联合疗法表现出肿瘤生长抑制[60]。然而,目前构建PDX模型使用的小鼠皆为免疫缺陷小鼠,仍不能完全模拟人类体内肿瘤及免疫环境,因此具有患者来源的肿瘤及包含所有人类免疫细胞的人源化的PDX模型则是适合研究肿瘤免疫最佳的临床前模型。
3 PDX模型研究面临的挑战
虽然PDX模型保留了原代肿瘤的组织病理学、基因组结构以及药敏反应,但在肿瘤移植到免疫缺陷小鼠身上的同时,PDX肿瘤的克隆型分布与患者原始肿瘤相比依然不同。在PDX肿瘤中的连续传代过程中,全基因组等位基因变异频率表明克隆选择在初期的移植步骤中比在传代扩增步骤中发生的更加频繁,而具体的克隆选择在同一类型肿瘤不同肿瘤样本中表现不同[61]。PDX模型的克隆动力学可能是由预先存在的克隆而非新生成的克隆选择行为而产生的[62]。作为克隆选择的结果,PDX肿瘤中更具侵略性的肿瘤克隆很可能成为主导,并且在某些情况下,根据基因组和转录组分析结果表明PDX模型的确显示了更具转移性和复发性的迹象[63]。这些更具侵略性的克隆就很可能成为肿瘤治疗极为重要的目标。
在使用PDX模型进行临床前药物筛选过程中,植入失败以及PDX建立花费的时间(约4~8个月)也是肿瘤治疗所面临的限制因素。此外,人体基质和免疫细胞在移植肿瘤传代过程中的损耗对后期世代肿瘤微环境和转移的研究是PDX模型的一个主要限制。肿瘤相关细胞,如血管内皮细胞、成纤维细胞、炎症细胞及肿瘤细胞之间的的相互作用在肿瘤生物学中起到一个重要的作用。近期研究表明,肿瘤微环境也与药物反应有关[64]。此外,免疫调节剂如anti-PD1抗体应用到PDX模型具有局限性,因为用于建立PDX模型的免疫缺陷小鼠缺乏免疫系统的重要组成部分[35]。将免疫功能低下小鼠体内移植人类造血干细胞和祖细胞,即建立人源化的小鼠,则有望克服这一障碍。一些研究表明,通过输入人类造血干细胞可以在移植瘤中分化出不同谱系的人源功能性免疫细胞,包括人类的免疫细胞和间质细胞[65,66]。
PDX模型的另一个主要问题是小鼠体内的人源肿瘤淋巴瘤,这种现象已在多种组织来源的PDX模型中被报道,其中包括非小细胞肺癌、肝癌、前列腺癌和胃癌[67-70]。这些淋巴瘤大多数是表达CD45标记的人源淋巴瘤,与B细胞淋巴瘤相一致[67,70]。患者肿瘤组织的炎症增加了罹患人源性淋巴瘤PDX模型的风险,与结直肠癌相比,胃癌PDX模型具有更高比例的淋巴瘤,部分可能是由于基线炎症率较高导致的[70]。关于淋巴瘤的形成机理有一种说法是,免疫缺陷小鼠体内缺乏免疫监视,EBV感染使B淋巴细胞转换成增殖状态,导致B细胞淋巴瘤的产生[70]。因此,在PDX模型构建过程中需要运用组织病理学及CD34等标记物排除淋巴瘤的形成[70]。
4 结论
癌症治疗的精准医学需要来自基因组分析和药物反应的大数据整合,高通量测序技术的最新进展使患者个人的癌症基因组分析变成可能。PDX模型保留了原代肿瘤的组织病理、基因组特性、及药物敏感性,并且可以作为患者“替身”来研究药物反应。这些PDX模型为多样化的药物开发、生物标记物的发现、临床前的药物测试、联合临床实验以及个体化药物筛选提供了一个较为理想的平台,此外,结合基因组序列及PDX模型药物筛选,可以指导临床用药及提高疗效,为精准癌症医学提供新的机会。最后,结合测序数据以及替身实验的定向突变PDX模型将会给优化治疗,提高临床疗效,以及精准癌症医学提供新的机会。
[1] Garraway LA, Verweij J, Ballman KV. Precision oncology: an overview [J]. J Clin Oncol, 2013, 31(15):1803-1805.
[2] Bell D, Berchuck A, Birrer M,etal. Integrated genomic analyses of ovarian carcinoma [J]. Nature, 2011, 474(7353):609-615.
[3] Koboldt DC, Fulton RS, McLellan MD,etal. Comprehensive molecular portraits of human breast tumours [J]. Nature, 2012, 490:61-70.
[4] Muzny DM, Bainbridge MN, Chang K,etal. Comprehensive molecular characterization of human colon and rectal cancer [J]. Nature, 2012, 487(7407):330-337.
[5] Verhaak RGW, Hoadley KA, Purdom E,etal. Integrated genomic analysis identifies clinically relevant subtypes of glioblastoma characterized by abnormalities in PDGFRA, IDH1, EGFR, and NF1 [J]. Cancer Cell, 2010, 17(1):98-110.
[6] Weinstein JN, Collisson EA, Mills GB,etal. The cancer genome atlas pan-cancer analysis project [J]. Nat Genet, 2013, 45(10):1113-1120.
[7] Quintas-Cardama A, Cortes J. Molecular biology of bcr-abl1-positive chronic myeloid leukemia [J]. Blood, 2009, 113(8):1619-1630.
[8] Slamon D, Eiermann W, Robert N,etal. Adjuvant trastuzumab in HER2-positive breast cancer [J]. N Engl J Med, 2011, 365:1273-1283.
[9] Pao W, Miller V, Zakowski M,etal. EGF receptor gene mutations are common in lung cancers from “never smokers” and are associated with sensitivity of tumors to gefitinib and erlotinib [J]. Proc Natl Acad Sci USA, 2004, 101(36):13306-13311.
[10] Shaw AT, Yeap BY, Solomon BJ,etal. Effect of crizotinib on overall survival in patients with advanced non-small-cell lung cancer harbouring ALK gene rearrangement: a retrospective analysis [J]. Lancet Oncol, 2011, 12(11):1004-1012.
[11] Macconaill LE, Garraway LA. Clinical implications of the cancer genome [J]. J Clin Oncol, 2010, 28, 28(35):5219-5228.
[12] DiMasi JA, Reichert JM, Feldman L,etal. Clinical approval success rates for investigational cancer drugs [J]. Clin Pharmacol Ther, 2013, 94(3):329-335.
[13] Dulbecco R. Production of Plaques in Monolayer Tissue Cultures by Single Particles of an Animal Virus [J].Proc Natl Acad USA, 1952, 38(8):747-752.
[14] Kopetz S, Lemos R, Powis G. The promise of patient- derived xenografts: the best laid plans of mice and men [J]. Clin Cancer Res, 2012, 18(19):5160-5162.
[15] Morton CL, Houghton PJ. Establishment of human tumor xenografts in immunodeficient mice [J]. Nat Protoc, 2007, 2(2):247-250.
[16] Wang Y, Sudilovsky D, Zhang B,etal. A human prostatic prostatic epithelial model of hormonal carcinogenesis [J]. Cancer Res, 2001, 61(16): 6064-6072.
[17] Siolas D, Hannon, GJ. Patient-derived tumor xenografts: transforming clinical samples into mouse models [J]. Cancer Res, 2013, 73(17):5315-5319.
[18] Hidalgo M, Bruckheimer E, Rajeshkumar NV,etal. A pilot clinical study of treatment guided by personalized tumorgrafts in patients with advanced cancer [J]. Mol Cancer Ther, 2011, 10(8):1311-1316.
[19] Williams SA, Anderson WC, Santaguida MT,etal. Patient-derived xenografts, the cancer stem cell paradigm, and cancer pathobiology in the 21st century [J]. Lab Invest, 2013, 93(3):970-982.
[20] van Kempen LC, Ruiter DJ, van Muijen GN,etal. The tumor microenvironment: a critical determinant of neoplastic evolution [J]. Eur J Cell Bio, 2003, 82(11):539-548.
[21] Jin K, Teng L, Shen Y,etal. Patient-derived human tumour tissue xenografts in immunodeficient mice: asystematic review [J]. Clin Transl Oncol, 2010, 12(7):473-480.
[22] Lee CH, Xue H, Sutcliffe M,etal. Establishment of subrenal capsule xenografts of primary human ovarian tumors in SCID mice: potential models [J]. Gynecol Oncol, 2005, 96(1):48-55.
[23] Lin D, Wyatt AW, Xue H,etal. High Fidelity Patient-Derived Xenografts for Accelerating Prostate Cancer Discovery and Drug Development [J]. Cancer Res, 2014, 74(4):1272-83.
[24] Scott CL, Becker MA, Haluska P,etal. Patient- derived xenograft models to improve targeted therapy in epithelial ovarian cancer treatment [J]. Front Oncol, 2013, 3:295.
[25] Hoffman RM. Patient-derived orthotopic xenografts: better mimic of metastasis than subcutaneous xenografts [J]. Nat Rev Cancer, 2015, 15(8):451-452.
[26] Zhang XM, Claerhout S, Prat A,etal. A Renewable tissue resource of phenotypically stable, biologically and ethnically diverse, patient-derived human breast cancer xenograft models [J]. Cancer Res, 2013, 73(15):4885-4897.
[27] Marangoni E, Vincent-Salomon A, Auger N,etal. A new model of patient tumor derived breast cancer xenografts for preclinical assays [J]. Clin Cancer Res, 2007, 13(13):3989-3998.
[28] Reyal F, Guyader C, Decraene C,etal. Molecular profiling of patient-derived breast cancer xenografts [J]. Breast Cancer Res, 2012, 14(1):R11.
[29] Tentler JJ, Tan AC, Weekes CD,etal. Patient-derived tumour xenografts as models for oncology drug development [J]. Nat Rev Clin Oncol, 2012, 9(6):338-350.
[30] DeRose YS, Wang GY, Lin YC,etal. Tumor grafts derived from women with breast cancer authentically reflect tumor pathology, growth, metastasis and disease outcomes [J]. Nat Med, 2011, 17(11):1514-1520.
[31] Julien S, Merino-Trigo A, Lacroix L,etal. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer [J]. Clin Cancer Res, 2012, 18(19):5314-5328.
[32] Mattie M, Christensen A, Chang MS,etal. Molecular characterization of patient-derived human pancreatic tumor xenograft models for preclinical and translational development of cancer therapeutics [J]. Neoplasia, 2013, 15(10):1124-1136.
[33] Ding L, Ellis MJ, Li SQ,etal. Genome remodelling in a basal-like breast cancer metastasis and xenograft [J]. Nature, 2010, 464(7291):999-1005.
[34] Li S, Shen D, Shao JY,etal. Endocrine-therapy resistant ESR1 variants revealed by genomic characterization of breast-cancer-derived xenografts [J]. Cell Rep, 2013, 4(1):1116-1130.
[35] Hidalgo M, Amant F, Biankin AV,etal. Patient-derived xenograft models: an emerging platform for translational cancer research [J]. Cancer Discov, 2014, 4(9):998-1013.
[36] Bertotti A, Migliardi G, Galimi F,etal. A molecularly annotated platform of patient-derived xenografts (“xenopatients”) identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer [J]. Cancer Discov, 2011, 1(6):508-523.
[37] Aytes A, Molleví DG, Martinez-Iniesta M,etal. Stromal interaction molecule 2 (STIM2) is frequently overexpressed in colorectal tumors and confers a tumor cell growth suppressor phenotype [J]. Mol Carcinog, 2012, 51(9):746-753.
[38] Kimple RJ, Harari PM, Torres AD,etal. Development and characterization of HPV-positive and HPV-negative head and neck squamous cell carcinoma tumorgrafts [J]. Clin Cancer Res, 2013, 19(4):855-864.
[39] Keysar SB, Astling DP, Anderson RT,etal. A patient tumor transplant model of squamous cell cancer identifies PI3K inhibitors as candidate therapeutics in defined molecular bins [J]. Mol Oncol, 2013, 7(4):776-790.
[40] Zhao XM, Liu ZG, Yu LT,etal. Global gene expression profiling confirms the molecular fidelity of primary tumor-based orthotopic xenograft mouse models of medulloblastoma [J]. Neuro Oncol, 2012, 14(5):574-583.
[41] Fichtner I, Rolff J, Soong R,etal. Establishment of patient derived non-small cell lung cancer xenografts as models for the identification of predictive biomarkers [J]. Clin Cancer Res, 2008, 14(20):6456-6468.
[42] Zhang XC, Zhang J, Li M,etal. Establishment of patient-derived non-small cell lung cancer xenograft models with genetic aberrations within EGFR, KRAS and FGFR1: useful tools for preclinical studies of targeted therapies [J]. J Transl Med, 2013, 11:168.
[43] Dong X, Guan J, English JC,etal. Patient derived first generation xenografts of non-small cell lung cancers: promising tools for predicting drug responses for personalized chemotherapy [J]. Clin Cancer Res, 2010, 16(5):1442-1451.
[44] Garrido-Laguna I, Uson M, Rajeshkumar NV,etal. Tumor engraftment in nude mice and enrichment in stroma-related gene pathways predict poor survival and resistance to gemcitabine in patients with pancreatic cancer [J]. Clin Cancer Res, 2011, 17(17):5793-5800.
[45] Reyes G, Villanueva A, García C,etal. Orthotopic xenografts of human pancreatic carcinomas acquire genetic aberrations during dissemination in nude mice [J]. Cancer Res, 1996, 56(24):5713-5719.
[46] Xue A, Julovi SM, Hugh TJ,etal. A patient-derived subrenal capsule xenograft model can predict response to adjuvant therapy for cancers in the head of the pancreas [J]. Pancreatology, 2015, 15(4):397-404.
[47] Némati F, Sastre-Garau X, Laurent C,etal. Establishment and characterization of a panel of human uveal melanoma xenografts derived from primary and/or metastatic tumors [J]. Clin Cancer Res, 2010, 16(8):2352-2362.
[48] Dodbiba L, Teichman J, Fleet A,etal. Primary esophageal and gastro-esophageal junction cancer xenograft models: clinicopathological features and engraftment [J]. Lab Invest, 2013, 93(4):397-407.
[49] Huynh H, Ong R, Soo KC. Foretinib demonstrates anti-tumor activity and improves overall survival in preclinical models of hepatocellular carcinoma [J]. Angiogenesis, 2012, 15(1):59-70.
[50] Joo KM, Kim J, Jin J,etal. Patient-specific orthotopic glioblastoma xenograft models recapitulate the histopathology and biology of human glioblastomas in situ [J]. Cell Rep, 2013, 3(1):260-273.
[51] Von Hoff DD, Ramanathan RK, Borad MJ,etal. Gemcitabine plus nab-paclitaxel is an active regimen in patients with advanced pancreatic cancer: a phase I/II trial [J]. J Clin Oncol, 2011, 29(34):4548-4554.
[52] Von Hoff DD, Ervin T, Arena FP,etal. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine [J]. N Engl J Med, 2013, 369(18):1691-1703.
[53] Girotti MR, Lopes F, Preece N,etal. Paradox-breaking RAF inhibitors that also target SRC are effective in drug-resistant BRAF mutant melanoma [J]. Cancer Cell, 2015, 27(1):85-96.
[54] Park H, Cho SY, Kim H,etal. Genomic alterations in BCL2L1 and DLC1 contribute to drug sensitivity in gastric cancer [J]. Proc Natl Acad Sci USA, 2015, 112(40):12492-12497.
[55] Dowst H, Pew B, Watkins C,etal. Acquire: an open-source comprehensive cancer biobanking system [J]. Bioinformatics, 2015, 31(10):1655-1662.
[56] Fichtner I, Rolff J, Soong R,etal. Establishment of patient derived non-small cell lung cancer xenografts as models for the identification of predictive biomarkers [J]. Clin Cancer Res, 2008, 14(20):6456-6468.
[57] Das Thakur M, Salangsang F, Landman AS,etal. Modelling vemurafenib resistance in melanoma reveals a strategy to forestall drug resistance [J]. Nature, 2013, 494(7436):251-255.
[58] Nardella C, Lunardi A, Patnaik A,etal. The APL paradigm and the "co-clinical trial" project [J]. Cancer Discov, 2011, 1(2):108-116.
[59] Gao H, Korn JM, Ferretti S,etal. High-throughput screening using patient-derived tumor xenografts to predict clinical trial drug response [J]. Nat Med, 2015, 21(11):1318-1325.
[60] Fernandez de Sanmamamed M, Lopez Rodriguez I, Schalper KA,etal. Nivolumab and urelumab enhance antitumor activity of human T lymphocytes engrafted in Rag2-/-IL2Rγnull immunodeficient mice [J]. Cancer Res, 2015, 75(17):3466-3478.
[61] Eirew P, Steif A, Khattra J, Ha G,etal. Dynamics of genomic clones in breast cancer patient xenografts at single-cell resolution [J]. Nature, 2015, 518(7539):422-426.
[62] Aparicio S, Hidalgo M, Kung AL. Examining the utility of patient-derived xenograft mouse models [J]. Nat Rev Cancer, 2015, 15(5):311-316.
[63] Rosfjord E, Lucas J, Li G,etal. Advances in patient-derived tumor xenografts: From target identification to predicting clinical response rates in oncology [J]. Biochem Pharmacol, 2014, 91(2):135-143.
[64] Ostman A. The tumor microenvironment controls drug sensitivity [J]. Nat Med, 2012, 18(9):1332-1334.
[65] Morton JJ, Bird G, Keysar SB,etal. Xact Mice: humanizing mouse bone marrow enables microenvironment reconstitution in a patient-derived xenograft model of head and neck cancer [J]. Oncogene, 2016, 35(3):290-300.
[66] Rongvaux A, Willinger T, Martinek J,etal. Development and function of human innate immune cells in a humanized mouse model [J]. Nat Biotechnol, 2014, 32(4):364-372.
[67] Chen K, Ahmed S, Adeyi O,etal. Human solid tumor xenografts in immunodeficient mice are vulnerable to lymphomagenesis associated with Epstein-Barr virus [J]. PLoS One, 2012, 7(6):e39294.
[68] John T, Yanagawa N, Kohler D,etal. Characterization of lymphomas developing in immunodeficient mice implanted with primary human non-small cell lung cancer [J]. J Thorac Oncol, 2012, 7(7):1101-1108.
[69] Wetterauer C, Vlajnic T, Schuler J,etal. Early development of human lymphomas in a prostate cancer xenograft program using triple knock-out immunocompromised mice [J]. Prostate, 2015, 75(6):585-592.
[70] Zhang LH, Liu YQ, Wang XH,etal. The extent of inflammatory infiltration in primary cancer tissues is associated with lymphomagenesis in immunodeficient mice [J]. Sci Rep, 2015, 5:9447.
Research progress of patient-derived xenografts in precision cancer medicine
LI Ke-juan, HUANG Hao, GAO Ran*
(Institute of laboratory animal sciences, CAMS & PUMC, Beijing 100021, China)
Cancer is a group of heterogeneous disease caused by diverse genomic alterations in oncogenes and tumor suppressor genes. Despite recent advances in high-throughput sequencing technologies and development of targeted therapies, novel cancer drug development is limited due to the high attrition rate from clinical studies. Patient-derived xenografts (PDX) models are generated by implanting sectioned patient tumor fragments into immunodeficient mice. PDX models retain many of the key characteristics of patients’ tumors including histology, genomic signature, cellular heterogeneity, and drug responsiveness. These models cannot only serve as a platform for co-clinical trials by enabling the integration of clinical data, genomic profiles, and drug responsiveness data to determine precisely targeted therapies, but also be applied to the development of biomarkers for drug responsiveness and personalized drug selection. This review summarizes our current knowledge of this field, including methodologic aspects, applications in drug development, challenges and limitations, and utilization for precision cancer medicine.
Patient-derived xenografts; PDX models; Individual treatment; Precision medicine
北京市优秀人才培养资助项目(2015000020124G073)。
李克娟(1987-),女,博士,研究方向:肿瘤模型建立。E-mail:likejuan@cnilas.org
高苒(1980-),女,副研究员,研究方向:肿瘤模型建立。E-mail:gaoran26@hotmail.com
研究进展
R-332
A
1671-7856(2017) 01-0091-08
10.3969.j.issn.1671-7856.2017.01.018
2016-06-29
