UV—B辐射增强对紫花苜蓿光合特性及膜脂过氧化的影响
2017-02-05王伟赵艺欣郭书嫄赵天宏岳
王伟++赵艺欣++郭书嫄++赵天宏++岳姝妤

doi:10.15889/j.issn.1002-1302.2016.10.094
摘要:随着臭氧层变薄,到达地表的紫外辐射不断增多,对地表生物产生一系列的影响,研究UV-B辐射对紫花苜蓿光合及膜脂过氧化特性的影响,有助于阐明紫花苜蓿生理习性对UV-B辐射增强的响应。以紫花苜蓿(金皇后)为试验材料,设正常光照(CK)、UV-B辐射增强均5%(T1)和UV-B辐射增强约10%(T2) 3个处理,研究 UV-B辐射增强对紫花苜蓿整个生育期光合特性及膜脂过氧化特性的影响。结果表明:在整个生育期,叶绿素a含量、叶绿素b含量、叶绿素 a+b 含量和叶绿素a/b值均呈先升后降趋势;光合指标净光合速率(Pn)、蒸腾速率(Tr)及气孔导度(Gs)均表现为先升后降,而胞间CO2浓度(Ci)为先降后升;丙二醛含量和相对电导率均呈上升的趋势;地上生物量在每个时期与对照相比都下降;每个指标在盛花期差异基本达到显著水平(P<005)。此外,与CK相比,T2处理的变化趋势比T1处理明显,说明UV-B辐射对紫花苜蓿的光合作用和膜脂特性有一定的伤害作用,随着UV-B辐射剂量的增加,伤害作用增强。
关键词:UV-B;紫花苜蓿;叶绿素;光合特性;膜脂过氧化
中图分类号: S541+.101文献标志码: A文章编号:1002-1302(2016)10-0324-04
收稿日期:2015-10-15
基金项目:国家自然科学基金(编号:30970448);沈阳农业大学大学生科技创新项目(编号:2015211)。
作者简介:王伟(1988—),男,山西忻州人,硕士研究生,研究方向为植物生理生态。E-mail:578355833@qq.com。
通信作者:赵天宏,博士,教授,博士生导师,研究方向为全球变化及植物生理生态。E-mail:zth1999@163.com。地球大气平流层存在着被誉为“地球保护伞”的臭氧层,它能强烈吸收太阳紫外辐射(ultraviolet radiation,简称UVR),使地球上的生物免受伤害。近年来由于人类不合理的活动,导致平流层的臭氧层变薄,使得到达地面的紫外辐射量增加,进而对地球上的生物活动产生相应的影响[1]。植物光合作用是植物生长的基础,是在一定的天气条件下,各种生理生态因子综合效应的最终反映,是构成植物生产力的最主要因素,植物的生长发育与光合能力密切相关。丙二醛(MDA)是一种植物体内产生的氧化应激标志物,其浓度的高低可以用来表示植物细胞内部膜系统的过氧化程度和受伤害程度,所以通常被作为研究逆境生理的重要指标。紫花苜蓿(Medicago sativa)作为多年生的优良豆科牧草,在我国西部半干旱地区具有十分重要的价值和地位,素有“牧草之王”之称。近年来,有关紫花苜蓿光合特性的研究主要集中在盐碱胁迫[2]、重金属胁迫[3]、温度水分胁迫[4-5]、刈割[6]、增施外源[7]、复合作用[8]等方面,且多以日变化研究为主,而关于在整个生育期UV-B辐射增强对紫花苜蓿光合特性影响的研究较少。本研究通过观测紫花苜蓿在UV-B辐射增强条件下光合特性及膜脂过氧化的变化,揭示紫花苜蓿光合特性及膜脂受伤害程度与UV-B辐射增强的关系,有助于了解增强 UV-B辐射下紫花苜蓿光合响应机制,为紫花苜蓿品种的选育和高产栽培提供相关的理论依据与参考。
1材料与方法
1.1材料与器材
选用紫花苜蓿品种金皇后(Golden Empress),种子购于辽宁东亚富友种业有限公司;紫外灯管,为北京北方利辉试验仪器设备有限公司生产,峰值为308 nm。
1.2试验设计
试验地设在沈阳农业大学农学院实验基地,2014年4月10日播种,采用样方法条播的方式进行紫花苜蓿栽种,行距25 cm,播深1 cm左右,每个小区模拟大田出苗后间苗至50株。设3个处理:CK(对照:在自然光照下生长,完全模拟大田栽培),T1[UV-B辐射强度增加9.3 kJ/(m2·d),相当于晴空条件下平均UV-B辐射强度的5.0%~5.2%,其他各项生态因子完全模拟大田栽培],T2[UV-B辐射强度增加18.6 kJ/(m2·d),相当于晴空条件下平均UV-B辐射强度的10.00%~10.15%,其他各项生态因子完全模拟大田栽培]。共设6个重复,18个小区随机排列。UV-B强度处理采用高度可调的灯架置于紫花苜蓿植株上方30 cm处,产生的UV-B辐射经0.08 mm乙酸纤维素膜过滤后照射紫花苜蓿植株。从紫花苜蓿分枝期进行紫外照射,每天08:00—16:00 共8 h,阴雨天停止照射,直到成熟。在处理期间,不断调整灯管与植株顶端的距离以保证植物接受恒定剂量的 UV-B辐射;对照组(CK)上方也悬挂灯架,但不安装灯管。此外,按正常的田间管理进行紫花苜蓿的水肥和除草除虫管理。以紫花苜蓿叶片为试验材料,分别在分枝期、初花期、盛花期及成熟期取样并测定相关指标。
1.3测定内容与方法
1.3.1叶绿素含量的测定[9]叶绿素含量的测定采用丙酮法,根据以下公式计算叶绿素的浓度,再根据稀释倍数分别计算叶片中叶绿素的含量。相关公式:
叶绿素a(Chla)含量=12.72×D663 nm-2.59×D645 nm;
叶绿素b(Chlb)含量=22.88×D645 nm-4.67×D663 nm;
叶绿素总量[Chl(a+b)]含量=8.05×D663 nm+20.29×D645 nm;
叶绿素a/b值(Chla/b值)=Chla/Chlb。
1.3.2光合指标的测定利用LI-6400便携式光合仪(美国),在紫花苜蓿4个生育期阳光充足的晴天从09:00—11:30,随机选取充分受光、叶位一致、生长健康、代表性强的植株,测其离地面2/3高度处叶片的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)。每个处理每次取3个重复,以平均值作为该测量结果。测定光量子通量密度为 500 μmol/(m2·s),温度为28 ℃,CO2浓度为 400 μmol/mol。
1.3.3膜脂过氧化指标测定相对电导率的测定采用外渗电导法;丙二醛含量的测定采用硫代巴比妥酸法[9]。
1.3.4地上生物量采用烘干法,刈割后取10株置于烘箱中,105 ℃杀青20 min,然后在85 ℃下烘干至恒质量,测得地上部干质量,以单株质量表示地上生物量。
1.4数据处理与分析
用Excel 2003软件进行制图,利用SPSS 22.0分析差异性,P<0.05表示差异显著。
2结果与分析
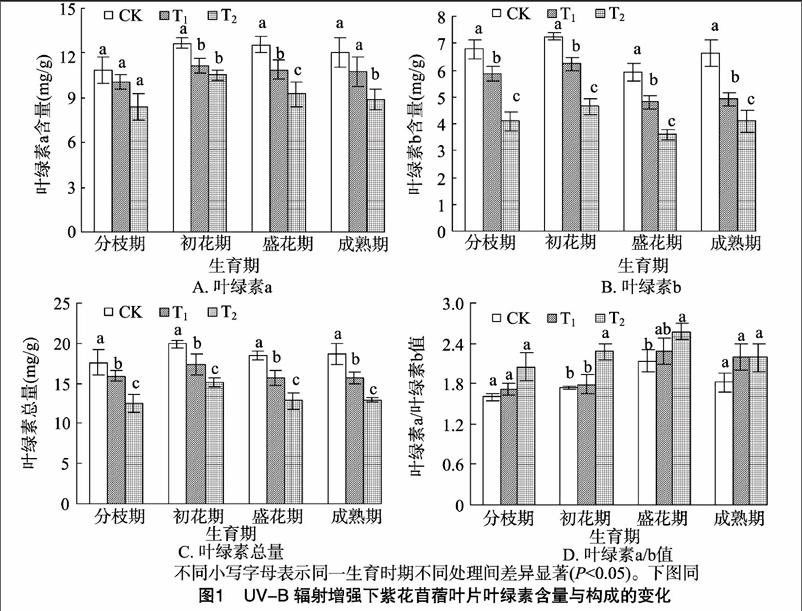
2.1UV-B辐射增强对紫花苜蓿光合色素的影响
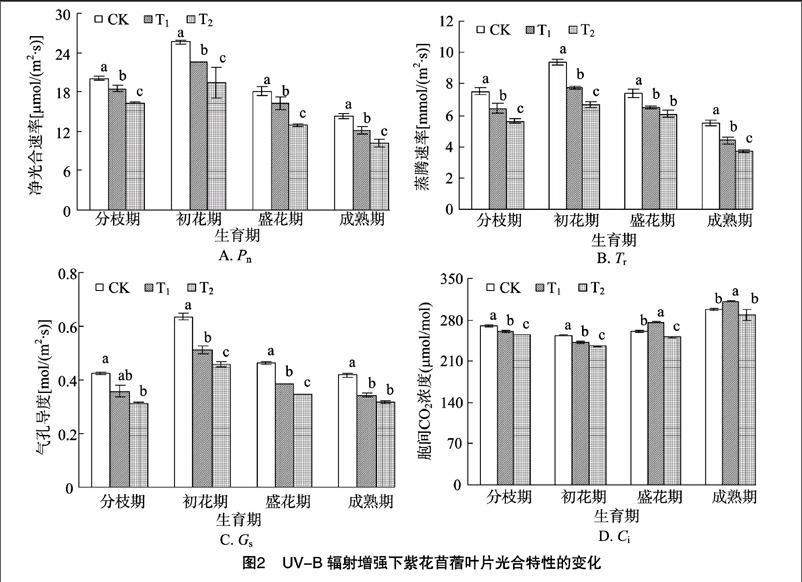
如图1所示,在整个生育期,紫花苜蓿Chla含量、Chlb含量、Chl(a+b)含量及Chla/b值均呈先升高后降低的趋势,且Chlb、Chl(a+b)含量在各处理之间差异均达到显著水平(P<0.05),以盛花期的变化最为明显;在各个生育期中,Chla、Chlb及Chl(a+b)含量都表现出CK>T1>T2,而Chla/b值与之相反,为CK 2.2UV-B辐射增强对紫花苜蓿光合特性的影响 从图2-A可以看出,在整个生育期Pn在初花期达到最高值,之后开始下降,最终低于分枝期;与分枝期相比,在成熟期Pn下降速度最快,降幅达28.53%~37.56%;在各个生育期,各处理Pn排序都为CK>T1>T2,与CK相比,随着UV-B辐射的增强,T1处理在初花期Pn的降幅最大,为14.73%;T2处理Pn在成熟期降幅最大,为28.93%,并且各处理间差异显著(P<0.05)。 从图2-B可以看出,在整个生育期Tr在初花期达到最高值,之后开始下降,最终低于分枝期;与分枝期相比,Tr在成熟期下降速度最快,降幅达26.52%~34.25%;在各个生育期,各处理Tr排序都为CK>T1>T2,随着 UV-B辐射的增强,T1、T2处理下的Tr在成熟期降幅最大,分别为3281%、2045%;除盛花期之外,各处理间差异显著(P<005)。 从图2-C可以看出,在整个生育期Gs在初花期达到最高值,之后开始下降,最终低于分枝期;与分枝期相比,Gs在成熟期下降速度最快,降幅达1.14%~3.80%,且T1的下降幅度比T2明显;在各个生育期,各处理Gs排序都为CK>T1>T2,与CK相比,随着UV-B辐射的增强,T1、T2处理下的Gs在初花期的降幅最大,分别为19.41%、28.03%;除分枝期、成熟期之外,各处理间差异显著(P<0.05)。 从图2-D可以看出,在整个生育期Ci变化幅度较小,在初花期达到最低值,之后开始上升,最终高于分枝期;与分枝期相比,Ci在成熟期上升速度最快,增幅达10.58%~1965%;在各个生育期,与CK相比,随着UV-B辐射的增强,在T1处理下,Ci在分枝期、初花期低于CK,在盛花期、成熟期明显高于CK;T2处理下Ci都明显低于CK;各处理间差异显著(P<0.05)。 2.3UV-B辐射增强对紫花苜蓿膜脂过氧化的影响 2.3.1对相对电导率的影响从图3可以看出,在不同生育期,与CK相比,随着UV-B辐射的增强,紫花苜蓿各处理间的膜透性显著增加,都表现为CK 2.3.2对丙二醛含量的影响从图4可以看出,在不同生育期中,与CK相比,随着UV-B辐射的增强,紫花苜蓿各处理间MDA含量呈上升趋势,都表现为CK 2.4UV-B辐射增强对紫花苜蓿地上部分生物量的影响 由表1可知,在紫花苜蓿分枝期和初花期,UV-B辐射对紫花苜蓿的地上部生物量影响与对照相比差异不显著,而在盛花期和成熟期差异显著(P<0.05),在整个生育期都表现为CK>T1>T2,与CK相比,T1处理的降幅为1.59%~3616%,T2处理的降幅为4.33%~64.13%,且T1处理降幅小于T2处理。 3讨论 3.1UV-B辐射增强对光合特性的影响 光合作用是植物体最重要的物质生产基础和生理过程,植物的生长发育与光合能力密切相关,影响植物光合速率的因素有气孔因素和非气孔因素。在本试验中,从整个生育期来看,紫花苜蓿叶片的净光合速率、气孔导度和蒸腾速率均出现下降趋势,而胞间CO2浓度呈上升趋势,这说明造成紫花 表1UV-B辐射增强下紫花苜蓿单株地上部质量的变化 处理地上部质量(g/株)分枝期初花期盛花期成熟期CK2.77±0.35a6.93±1.18a14.13±2.23a31.03±7.02aT12.71±0.55a6.82±2.13a12.63±1.27a19.81±3.65bT22.47±0.92a6.63±1.89a7.53±1.98c11.13±3.46c注:表中数据为“平均值±标准差”;同一时期同列数据后不同小写字母代表差异显著(P<0.05)。 苜蓿光合速率降低的主要原因是由非气孔因素限制所引发的,即长期的UV-B辐射,紫花苜蓿叶片叶绿体色素合成酶活性降低,叶绿体合成受阻,破坏了叶肉细胞,使得叶绿体形态结构受损,叶肉细胞的光合活性受到限制,进而对光合作用产生一定抑制作用。本试验中,初花期与分枝期相比,UV-B辐射对紫花苜蓿的光合作用有明显的促进作用,而就整个生育期而言,UV-B辐射对紫花苜蓿的光合作用起一定的抑制作用,这可能与长期UV-B辐射的累积效应有关,即在紫花苜蓿生长初期,由于积累了少量的UV-B辐射,对紫花苜蓿的生长起到一定促进作用,而到生长后期,随着长时间的 UV-B辐射,对紫花苜蓿叶片微结构的伤害才逐渐显现出来。此外,与CK相比,高剂量的UV-B辐射(T2处理)对紫花苜蓿光合特性的伤害程度高于低剂量(T1处理)。Allen等认为UV-B辐射造成光合速率下降的原因是由于气孔阻力增大,增加气孔对外界环境特别是大气湿度的敏感性,CO2的传导率降低,引起胞间CO2浓度下降,从而影响CO2的同化效率[10]。Farquhar等发现,光合速率的下降,取决于气孔导度和胞间CO2浓度,当净光合速率下降,气孔导度和胞间CO2浓度同时也下降时,则可认为光合速率的下降是由气孔因素引起的;而当净光合速率和气孔导度下降,胞间CO2浓度上升时,则可认为光合速率的下降是由非气孔因素引发的[11]。郑有飞等对大豆的研究发现,在UV-B处理下,大豆净光合速率和气孔导度下降,而胞间CO2浓度上升,认为引起大豆光合速率降低的主要原因并不是叶绿素含量的减少,而可能是叶片单位面积活性变化、气孔导度降低以及叶绿素含量减少等非气孔因素共同作用的结果[12],这与本试验的研究结果类似。
3.2UV-B辐射增强对膜脂过氧化的影响
MDA和相对电导率是植物体内产生的氧化应激标志物,MDA是植物膜脂过氧化作用的最终产物,相对电导率的变化可以反映细胞膜在逆境条件下受损情况,植物在遭受逆境伤害时,MDA含量和相对电导率会增加,进而会对植物膜系统产生一定的破坏作用,所以通常被作为研究逆境生理的重要指标。本试验中,在整个生育期,随着UV-B辐射增强处理,相对电导率和MDA含量都明显增加,在各个生育期,与CK相比也明显增加,这可能是由于紫花苜蓿长期处于UV-B辐射增强的照射下,细胞膜受到不同程度的伤害,使细胞膜透性增加,细胞膜系统发生紊乱,植物的氧化损伤加剧,引起相对电导率和MDA含量增加,与赵天宏等对大豆叶片的研究中发现UV-B处理下的大豆叶片相对电导率和MDA含量均高于对照的研究结果[13]类似。Low等研究发现,UV-B辐射对植物膜系统的伤害主要表现在使极性脂丢失,不饱和脂肪酸指数降低,从而降低膜的流动性,发生细胞膜脂过氧化作用[14]。而吴兵等认为,长期经UV-B辐射的矮蒿草和钉柱委陵菜叶片丙二醛含量不同程度地下降可能是由于其他抗氧化物质的作用减轻了其膜脂的过氧化程度,降低了伤害作用[15],与本试验UV-B辐射增强使丙二醛含量和相对电导率增加的结论不一致。
4结论
在同一生育期,随着UV-B辐射的增强,紫花苜蓿的Chla、Chlb、Chl(a+b)含量表现为下降趋势,Chla/b为上升趋势,Pn、Tr、Gs和Ci基本表现为下降趋势,相对电导率和MDA含量为上升趋势,植株地上生物量则表现为下降趋势,并且各处理间差异明显;而随着生育时期的不同,光合色素和光合指标大致呈下降趋势,相反,相对电导率、MDA含量和地上生物量均呈上升趋势。说明随着UV-B辐射增强,对紫花苜蓿的伤害作用逐渐突显,且高剂量(T2处理)的UV-B辐射对紫花苜蓿的伤害程度高于低剂量(T1处理)。
参考文献:
[1]Frederick J E,Slusser J R,Bigelow D S. Annual and interannual behavior of solar ultraviolet irradiance revealed by broadband measurements[J]. Photochemistry and Photobiology,2000,72(4):488-496.
[2]范方,张玉霞,姜健,等. 盐胁迫对紫花苜蓿生长及光合生理特性的影响[J]. 中国农学通报,2013,29(17):14-18.
[3]王瑞刚,唐世荣,郭军康. 铜胁迫对髙丹草和紫花苜蓿生长和光合特性的影响[J]. 生态环境学报,2010,19(12):2922-2928.
[4]韩瑞宏,卢欣石,高桂娟,等. 紫花苜蓿(Medicago sativa)对干旱胁迫的光合生理响应[J]. 生态学报,2007,27(12):5229-5237.
[5]牟兰,何承刚,姜华,等. 干热胁迫对紫花苜蓿光合特性的影响[J]. 草地学报,2014,22(3):550-555.
[6]代红军,谢应忠,胡艳莉. 不同刈割程度对紫花苜蓿生长、净光合速率和可溶性糖含量的影响[J]. 植物生理学通讯,2009,45(11):1061-1064.
[7]李雪芬. 氮添加对紫花苜蓿生长特性及光合生理特性的影响[J]. 北方园艺:土壤与肥料,2015(2):158-164.
[8]樊良新,刘国彬,薛萐,等. CO2浓度倍增及干旱胁迫对紫花苜蓿光合生理特性的协同影响[J]. 草地学报,2014,22(1):85-93.
[9]张治安,陈展宇. 植物生理学实验技术[M]. 长春:吉林大学出版社,2008.
[10]Allen D J,Nogués S,Baker N R. Ozone depletion and increased UV-B radiation:is there a real threat to photosynthesis?[J]. Journal of Experimental Botany,1998,49(328):1775-1788.
[11]Farquhar G D,Sharkey T D. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology,1982,33(1):317-345.
[12]郑有飞,徐卫民,吴荣军,等. 地表臭氧浓度增加和UV-B辐射增加及其复合处理对对大豆光合特性的影响[J]. 生态学报,2012,32(8):2515-2524.
[13]赵天宏,刘轶鸥,王岩,等. O3浓度升高和UV-B辐射增强对大豆叶片叶绿素含量和活性氧代谢的影响[J]. 应用生态学报,2013,24(5):1277-1283.
[14]Low P S,Merida J R. The oxidative burst in plant defense:function and signal transduction[J]. Physiologia Plantarum,1996,96(3):533-542.
[15]吴兵,韩发,岳相国,等. 长期增强UV-B辐射对高寒草甸植物光合速率和抗氧化系统的影响[J]. 西北植物学报,2005,25(10):2010-2016.
