生物酶法拆分手性药物的研究进展
2016-12-30柯彩霞徐德蛟闫云君徐莉
柯彩霞,徐德蛟,闫云君*,徐莉*
1.华中科技大学生命科学与技术学院,湖北武汉430074;2.湖北省孝感市邹岗中心卫生院,湖北孝感432100
生物酶法拆分手性药物的研究进展
柯彩霞1,徐德蛟2,闫云君1*,徐莉1*
1.华中科技大学生命科学与技术学院,湖北武汉430074;2.湖北省孝感市邹岗中心卫生院,湖北孝感432100
在现有手性药物的制备过程中,通常使用化学催化、气相或液相色谱分离纯化的方法,而耗能大、花费高、副产物多等是其主要缺点.近年来,生物酶法拆分手性药物的研究逐渐增多,多类生物酶已被报道具有催化手性拆分的能力,其对不同类底物的应用是目前研究的重点之一.在生物酶法拆分手性药物的过程中,反应溶剂与酰基供体是影响对映选择拆分效率的主要因素;另外,合理应用酶的固定化技术能有效的提高拆分效率,使其具有工业应用的可能.生物酶法拆分手性药物因具有副产物少、操作简便、环境友好等优点而备受关注,有望补充或替换化学法在手性药物制备中的作用.随着结构生物学、现代分子生物学的发展与酶法拆分手性药物研究的不断深入,通过对酶分子空间结构与催化机理的分析研究,人工合成具有特定催化功能的酶成为可能,生物酶法拆分手性药物技术的应用有望得到较大的突破.
酶法拆分;手性药物;对映选择性;异构体
1 引言
在自然环境中,大部分化合物具有同分子式、相互呈镜象但不能重叠的两种结构形式,如同人的左右手一样,这类化合物称为对映体或旋光异构体,含有手性因素的药物即为手性药物.手性药物的不同对映异构体在药理活性、代谢过程、代谢速率及毒性等方面往往存在着显著的差异.多数手性药物中只有一种对映体具有实际治疗作用,而另一种对映体不仅没有药效,而且可能抵消部分有效对映体的作用,甚至产生严重不良反应或毒性[1].因此,美国食品与药物管理局(FDA)发布了手性药物的指导原则,要求所有在美国上市的消旋体药物必须说明其中所含对映体各自的药理作用、毒性和临床效果,并对新上市的手性药物提供5年专卖权,以保证和鼓励相关药物的研发[2].近年来,中国、日本、欧盟等均发布过相应的政策规范手性药物的生产和应用,这些政府行为和人们对单一手性医药的需求共同促进了光学纯单一手性药物的发展,使得手性药物占有的市场份额逐年增加,世界手性药物销售以每年15%以上的速度增长.光学纯药品的年增长速率(155%)远远高于非光学纯药品的年增长速率(8%),手性药物市场巨大[3].
手性药物的制备经常先进行不对称合成或拆分化学合成路线中某个手性中间体,再合成单一手性药物.外消旋体拆分、手性催化合成和底物诱导的手性合成是获得手性药物的三种策略[4],其中外消旋体拆分技术是医药领域研究的重点和热点之一,化学拆分、色谱拆分、生物酶拆分等是外消旋体拆分技术研究中的常用关键技术.而生物酶法与其他方法相比具有催化效率高、规模易放大、条件温和、工艺简单、选择性好、环境友好等优势[5],且能获得化学合成难以得到的产物,克服或弥补相应的困难和不足,具有很好的发展前景.
2 生物酶法手性药物拆分的研究现状
酶作为一种天然催化剂,在许多应用研究中占据着不可忽视的重要性,酶的应用范围也在逐步扩大,随着研究的不断深入,不论是在生物体系还是非生物体系内,水相或非水相反应当中,酶促反应的应用都有着一定的发展.而在手性药物的拆分中,由于大部分药物的低水溶性,酶的非水相反应效率十分关键.在现有的研究当中,已知多种水解酶类,酯酶、脂肪酶、酰胺酶、腈水合酶、酰化酶等均能用于外消旋体的拆分,部分相应研究如表1所示,其中脂肪酶(lipase,EC 3.1.1.3)应用较多、效果较好[6].脂肪酶属于三酰甘油酰基水解酶,来源丰富,尤其在微生物中可获得多种脂肪酶.脂肪酶在水相与非水相中的应用广泛,且具有反应温度广、pH耐受性好以及底物专一性等特点,商业化脂肪酶绝大多数都是微生物脂肪酶[7].
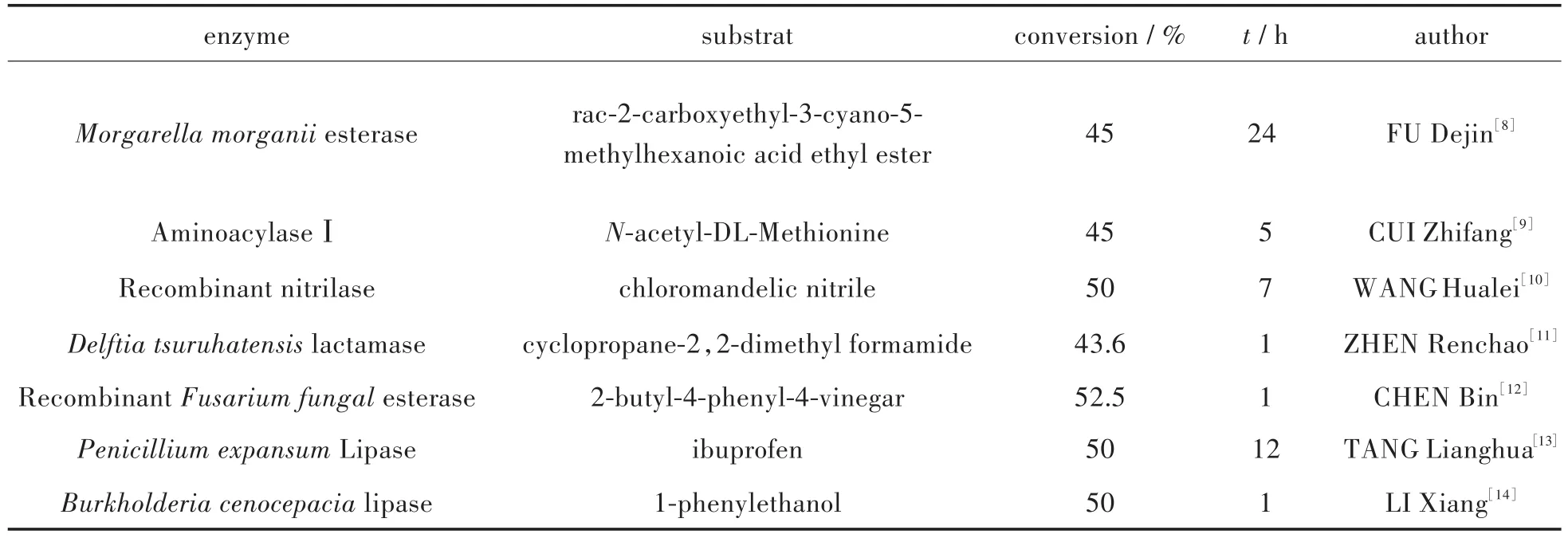
表1 不同种类生物酶在外消旋体拆分中的应用Tab.1Applications of different types of enzyme in racemic resolution
由于脂肪酶催化反应多样、环境友好、副产物少等特点,脂肪酶在手性药物拆分的应用日益广泛,在伯醇、仲醇、叔醇、二元醇、芳香醇等底物的拆分上均有一定的应用[15].例如Fujimoto等[16]于1986年第一次成功将生物酶法用于非轴对称的手性化合物拆分,在有机相中,(R)-,(S)-联萘二丁酸酯的对映选择ee值分别为96%、94%,整体反应转化率达50%,近年来,洋葱伯克霍尔德菌、荧光假单胞菌属的脂肪酶也被广泛应用于非轴对称手性拆分中.而迄今为止,拆分叔醇的应用较少,研究人员认为脂肪酶的活性位点与叔醇结构结合相对困难,导致这一类应用较难开展.Krishna等报道了利用南极假丝酵母Candida antarctica lipase A(CAL-A)以乙酸乙烯酯为酰基供体对应性拆分叔醇88、89、90、91的工作[17-19],取得了一定的进展.
3 影响酶法拆分手性药物效率的主要因素
研究表明,除了选择适合的生物酶进行手性药物拆分之外,在反应体系中选择合适的反应溶剂与酰基供体,是获得高对映选择拆分效率的重要因素.
3.1 反应溶剂的影响
反应溶剂的选择对一个反应的进行有着至关重要的作用,它对底物的溶解度和酶促反应的效率都有着极大的影响,因而在研究当中,不同反应溶剂的比较选择实验是最基础必备的环节.岳珂[20]在利用解假丝酵母(Candida lipolytica)拆分一苯乙醇的研究中,筛选到二氯甲烷为最适溶剂,将E值从9.5提高到了34.5.李相等[21]用洋葱伯克霍尔德菌脂肪酶拆分一苯乙醇,通过对13中常用溶剂进行筛选,通过酶活与对映选择性的综合考量,选择正庚烷最为最适的反应溶剂.除此之外,离子液体作为反应溶剂的应用也受到了广泛研究,Antonia P.等[22]用南极假丝酵母C.antarctica lipase B(CAL-B),以离子液体为反应溶剂拆分一苯乙醇,在最佳反应条件下,经过12 h,反应ee值可达到92%~99%.
3.2 酰基供体的影响
在手性拆分的反应过程中,酶与底物的结合效率至关重要,通常认为酶分子先要与酰基供体形成酰基-酶复合物,进而发生转酯反应,以达到拆分效果.因此,不同的酶在拆分同一反应时,通常所需选择的最适酰基供体也不同.例如,在异辛烷为溶剂的体系中拆分外消旋布洛芬,黄霜霜等[23]选用皱褶假丝酵母脂肪酶(C.rugosa lipase,CRL),以11种伯醇,3种仲醇,3种叔醇和1种二醇为底物与外消旋布洛芬反应进行了最适酰基供体筛选,发现当使用异辛醇为酰基供体时,拆分效率最好,ee值超过90%;在使用甲醇、乙醇、正丙醇、异丙醇作为供体时,拆分效率较差,ee值均不到20%.而在郭华颖的研究当中[24],使用扩展青霉菌TS414拆分布洛芬的过程中,使用正丙醇为供体时拆分效率反而最高,异丙醇最低.一般认为这是由于不同酶的活性中心结构域的空间结构不同,导致不同底物与之结合的能力和效率不一,故在进行生物酶法手性药物的拆分时,酰基供体的筛选非常重要.
4 酶的固定化技术对拆分效率的影响
酶的固定化技术是指通过物理和(或)化学的作用,使酶蛋白附着或结合在一定的载体基质上,或限定在有限的空间内.许多酶蛋白在经过固定化后会失活或活性降低,而有一部分酶蛋白仍然具有催化活性,这一类固定化酶通常具有比游离酶更好的稳定性,且易于分离与重复使用,能降低工业成本,在工业应用上有极大的潜力.利用固定化技术可提高非水相酶促反应的效率,解决游离酶拆分手性药物效率低、反应时间长的缺陷,为生物酶拆分手性药物的实际应用奠定了基础[25-27].魏晓飞[28]用溶胶-凝胶固定化的枯草杆菌脂肪酶催化拆分2-甲基-1-丁醇,在最佳实验条件下,立体对性选择性E值达到13.05,剩余2-甲基-1-醇光学纯度可达到97%以上.崔彦君[29]利用磁性高分子材料固定化玫瑰假丝酵母脂肪酶催化酮洛芬酯类,相较于游离酶,该固定化脂肪酶的拆分效率具有显著的提升,在重复利用5次之内能保持较好的拆分效率.闫云君团队先后利用大孔树脂、碳纳米管固定化洋葱伯克霍尔德菌脂肪酶,将其游离酶完全拆分1-苯乙醇所需的时间从48 h分别缩短至了30 min和10 min取得了极为有效的成果[30-31].酶的固定化技术对酶催化效率的积极影响,使其在生物酶拆分手性药物研究领域内具有不可忽视的重要性,极大的发展潜力.
5 展望
手性药物的制备具有极大的市场潜力,现今市面上的单一对映体手性药物多通过化学手段制备而成,其中气相色谱和高效液相色谱法的化学分离法是对应产业中采用的主要手段,但手性柱费用高、产物易污染、容易产生副产物是其主要的缺陷.相比于化学拆分技术,酶法拆分技术在生产的资本投入方面有较明显的优势,酶法操作简便且不易污染,近年来固定化技术在酶的非水相反应效率提升中取得了较显著的研究进展,如闫云君团队在手性拆分1-苯乙醇的反应中,制备了一种高催化效率的固定化酶,将非水相转酯反应时间从几天缩短到十几分钟[30],展示了脂肪酶在手性拆分反应中的潜力,简便的反应条件和大大缩短的时间成本使得酶法拆分的产业化应用具有极大的工业潜力.近年来,随着分子生物学与生物信息学研究手段的发展,酶分子的空间结构与催化机理研究逐步深入,人工合成具有特定催化功能的酶是未来酶促反应研究领域内最具发展潜力的研究方向之一.相信在不久的将来,随着微生物资源的开发利用,能够寻找、开发得到更多适用于多种基质、具有高度选择性的酶,使得酶法拆分手性药物的制备中具有更为广阔的应用和更加巨大的工业利用价值.
[1]CANER H,GRONER E,LEVY L,et al.Trends in the development of chiral drugs[J].Drug discovery today,2004,9(3):105-110.
[2]THERAPONTOS C,ERSKINE L,GARDNER E R,et al. Thalidomideinduceslimbdefectsbypreventing angiogenic outgrowth during early limb formation[J]. Proceedings of the national academy of sciences,2009,106(21):8573-8578.
[3]SHAFAATI A.Chiral drugs:current status of the industry and the market[J].Iranian journal of pharmaceutical research,2007,6(2):73-74.
[4]GHANEM A,ABOUL-ENEIN M N,EL-AZZOUNY A,etal.Lipase-mediatedenantioselectivekinetic resolution of racemic acidic drugs in non-standard organic solvents:direct chiral liquid chromatography monitoring and accurate determination ofthe enantiomeric excesses[J].Journal of chromatography A,2010,1217(7):1063-1074.
[5]GIACOMINID,GALLETTIP,PARADISIF. Environmentally-friendlysynthesisofprofens[J]. Chem Inform,2009,40(31):i.
[6]SCHOEMAKER H E,MINK D,WUBBOLTS M G. Dispelling the myths-biocatalysis in industrial synthesis[J].Science,2003,299(5613):1694-1697.
[7]黄璜,李宗军,王远亮,等.各类微生物脂肪酶酶学性质及应用的研究进展[J].粮油食品科技,2014,22(1):109-118.
HUANG H,LI Z J,WANG Y L,et al.Progress in enzymaticpropertiesofmicrobiallipaseand applications[J].Science and technology of cereals,oils and foods,2014,22(1):109-118.
[8]傅德进,郑仁朝,郑裕国.摩氏摩根菌产酯酶条件优化及在普瑞巴林手性中间体合成中的应用[J].生物加工过程,2012,10(6):12-17.
FU D J,ZHEN R C,ZHEN Y G.Optimization of Morgarellamorganiiesteraseproductionandits applicationinsynthesisofchiralintermediateof Pregabalin[J].Chinesejournalofbioprocess engineering,2012,10(6):12-17.
[9]崔志芳,李春露,姚善泾.氨基酰化酶拆分制备手性蛋氨酸工艺条件研究[J].化学反应工程与工艺,2006,22(1):88-92.
CUI Z F,LI C L,YAO S J.The research on process conditions for the chiral resolution of l-methioine by aminoacylase[J].Chemical reaction engineering and technology,2006,22(1):88-92.
[10]王华磊.新型腈水解酶基因的高效挖掘及其在合成光学纯α-羟基酸中的应用研究[D].上海:华东理工大学,2013.
[11]郑仁朝.立体选择性酰胺酶的筛选及其动力学拆分制备(S)-(+)-2,2-二甲基环丙烷甲酰胺的研究[D].杭州:浙江工业大学,2007.
[12]陈兵.重组镰孢霉菌内酯水解酶在手性合成中的新应用[D].上海:华东理工大学,2010.
[13]唐良华.脂肪酶的生产及其在布洛芬手性拆分中的应用基础研究[D].杭州:浙江大学,2007.
[14]LI X,HUANG S,XU L,et al.Improving activity and enantioselectivityoflipaseviaimmobilizationon macroporousresinforresolutionofracemic 1-phenylethanol in non-aqueous medium[J].BMC biotechnology,2013,13(1):1.
[15]GHANEM A,ABOUL-ENEIN H Y.Lipase-mediated chiral resolution of racemates in organic solvents[J]. Tetrahedron-asymmetry,2004,15(21):3331-3351.
[16]FUJIMOTOY,IWADATEH,IKEKAWAN. Preparationofopticallyactive2,2'-dihydroxy-1,1'-binaphthylviamicrobialresolutionofthe corresponding racemic diester[J].Journal of the chemical society,chemical communications,1985(19):1333-1334.
[17]KRISHNA S H,PERSSON M,BORNSCHEUER U T. Enantioselective transesterification of a tertiary alcohol bylipaseAfromCandidaAntarctica[J]. Tetrahedron:asymmetry,2002,13(24):2693-2696.
[18]BRACKENRIDGE I,MCCAGUE R M,ROBERTS S M,et al.Enzymic resolution of oxalate of a tertiary alcohol using porcine pancreatic lipase[J].Journal of the chemical society,transactions,1993(1):10.
[19]CHEN S,FANG J.Preparation of optically active tertiary alcohols by enzymatic methods.Application to the synthesis of drugs and natural products[J].The journaloforganicchemistry,1997,62(13):4349-4357.
[20]岳珂.解脂假丝酵母脂肪酶在苯乙醇手性拆分中的应用及菌种产酶发酵条件,酶学性质的研究[D].杭州:浙江工业大学,2008.
[21]LI X,XU L,WANG G,et al.Conformation studies on Burkholderiacenocepacialipaseviaresolutionof racemic 1-phenylethanol in non-aqueous medium andits process optimization[J].Process biochemistry,2013,48(12):1905-1913.
[22]ANTONIA P,VAN RANTWIJK F,SHELDON R A. Effective resolution of 1-phenyl ethanol by Candida antarctica lipase B catalysed acylation with vinyl acetate in protic ionic liquids(PILs)[J].Green chemistry,2012,14(6):1584-1588.
[23]HUANG S,LIX,XU L,etal.Protein-coated microcrystals fromCandidarugosalipase:itsimmobilization,characterization,andapplicationinresolutionof racemic ibuprofen[J].Applied biochemistry and biotechnology,2015,177(1):36-47.
[24]郭华颖.外消旋布洛芬酶法拆分的研究[D].福州:福建师范大学,2008.
[25]李小冬,吴嘉,贾东晨,等.固定化酶的研究方法概述[J].中国酿造,2011(11):5-9.
LI X D,WU J,JIA D C,et al.Review of research methodsofenzymesimmobilization[J].China brewing,2011(11):5-9.
[26]徐莉,侯红萍.酶的固定化方法的研究进展[J].酿酒科技,2010(1):86-89.
XUL,HOUHP.Researchprogressinthe immobilization of enzymes[J].Liquor-making science and technology,2010(1):86-89.
[27]游金坤,余旭亚,赵鹏.吸附法固定化酶的研究进展[J].化学工程,2012(4):1-5.
YOU J K,YU X Y,ZHAO P.Progress and trend of adsorption-based enzyme immobilization[J].Chemical engineering(China),2012(4):1-5.
[28]魏晓飞.溶胶—凝胶法固定化枯草杆菌脂肪酶及拆分手性醇的研究[D].长春:吉林大学,2011.
[29]崔彦君.新型磁性高分子载体的制备,固定化脂肪酶及其催化酮洛芬手性拆分的研究[D].兰州:兰州大学,2012.
[30]KE C,LI X,HUANG S,et al.Enhancing enzyme activity and enantioselectivity of Burkholderia cepacia lipase via immobilization on modified multi-walled carbon nanotubes[J].RSC advances,2014,4(101):57810-57818.
[31]LI X,HUANG S,XU L,et al.Improving activity and enantioselectivityoflipaseviaimmobilizationon macroporousresinforresolutionofracemic 1-phenylethanol in non-aqueous medium[J].BMC biotechnology,2013,13:92.
本文编辑:张瑞
Advance in Enzymatic Resolution of Chiral Drugs
KE Caixia1,XU Dejiao2,YAN Yunjun1*,XU Li1*
1.School of Life Science and Technology,Huazhong University of Science and Technology,Wuhan 430074,China;2.Zougang People's Hospital,Xiaogan 432100,China
Chemical catalysis,gas or liquid chromatography separation and purification are the main technologies in chiral drug preparation,which result in high energy consumption,high cost,and multi-byproducts and so on.Enzymatic resolution in chiral drugs preparation was attracted increasing attention in recent years.Many kinds of enzyme were investigated on their resolution ability towards different substrates,and their application has become a topic subject.It was found that the reaction solvent and acyl donor are the most important factors to enantio selective efficiency.A proper immobilization technology can significantly enhance the enzyme activity and pave the way to industrialization.The enzymatic resolution of chiral drugs could play a key role in chiral pharmacy production with less byproducts,simple operation and environmental frendliness.Based on the rapid progress in structure biology,especially deep understand of enzyme structure and catalytic mechanism,the enzymatic chiral resolution is expected to be made great advances with the development of modern techniques of molecular biology and chiral drug.
enzymatic chiral resolution;chiral drug;enantioselective;isomer
Q93-335
A
10.3969/j.issn.1674-2869.2016.06.001
1674-2869(2016)06-0517-04
2016-08-06
国家自然科学基金项目(31170078);国家863课题(2014AA093510)
柯彩霞,硕士研究生.E-mail:kecaixia@hust.edu.cn
*通讯作者:徐莉,博士,副教授.E-mail:xuli@hust.edu.cn
闫云君,博士,教授.E-mail:yanyunjun@hust.edu.cn
