吹扫捕集—气相色谱法同时测定海水中的氟氯烃和六氟化硫
2016-12-08蔡明刚邓恒祥黄鹏柯宏伟郑雪红李
蔡明刚+邓恒祥+黄鹏+柯宏伟+郑雪红+李文权
摘要 氟氯烃(CFCs)和六氟化硫(SF6)都是人工合成的卤代化合物,在海洋科学考察中是非常重要的基础观测参数,在示踪海/气交换、水团交换等一系列重要海洋学过程研究中均有特殊的应用价值;同时,也可以用于估算表观耗氧速率(Apparent oxygen utilization rate, AOUR)以及人为碳(Anthropogenic CO2, Cant)等一些重要的物理及生物地球化学过程参量。CFCs,SF6在海水中的浓度非常低,测量难度大,而CFCs和SF6的联合使用对海洋学过程研究具有重大意义。本研究建立了一套吹扫捕集系统以分析海水中CFC12和SF6,对吹扫捕集系统测定条件进行了优化,最佳的实验条件为:捕集温度70℃,吹扫时间8 min,吹扫压力310 kPa,脱附时间30 s,脱附温度90℃。本方法测定简单、灵敏度高,CFC12和SF6的检出限分别为0.02 pmol/kg和0.03 fmol/kg, CFC12和SF6的测定精密度分别为±1.2%和±0.5%。标准工作曲线的线性相关系数均大于0.9995。本方法成功应用于2014年中国第六次北极科学考察航次中采集的海水样品的测定。
关键词 六氟化硫; 氟氯烃; 吹扫捕集; 气相色谱; 海水
2016-02-02收稿;2016-03-25接受
本文系国家自然科学基金项目(Nos. 40976113, 41076133, 91228202)、南北极环境综合考察与评估专项(Nos. CHINARE2014-03-04-03,CHINARE2015-03-04-03)、国家海洋局海洋-大气化学与全球变化重点实验室开放基金课题(No. gcmac1404)、福建省"新世纪优秀人才支持计划"及厦门大学校长基金资助
E-mail: mgcai@xmu.edu.cn
1 引 言
氟氯烃(Chlorofluorocarbons, CFCs)是人工合成的卤代烷烃类物质,几乎无天然来源[1]。六氟化硫(Sulfur hexafluoride, SF6)也是人工合成的化合物,SF6气体以其良好的绝缘性能和灭弧性能,自20世纪60年代开始就已应用于电子工业领域。SF6还因其化学惰性、无毒、不燃及无腐蚀性,被广泛应用于金属冶炼。
CFCs和SF6主要通过海气交换过程进入海洋,化学活性较弱,在海水中具有保守性,其在海水中的含量变化除了同大气源变化有关外,仅同水体运动等物理过程相关。因此,CFCs和SF6成为优良的瞬态示踪物(Transient tracers),应用于诸多海洋学过程研究[2]。其时间尺度信息还可用于计算一些重要的物理和生物地球化学参量,例如表观耗氧速率(Apparent oxygen utilization rate, AOUR)[3~7]和人为碳(Anthropogenic CO2, Cant)等[8~12]。
海水中CFCs和SF6的浓度非常低,分别为pmol/kg和fmol/kg量级。因此,测定大洋水体中的CFCs,尤其是SF6的难度较大,采样过程极易受到大气中CFCs和SF6的沾污[13]。经过不断改进,Vollmer等建立了一种同时测定CFCs和SF6的方法[14]。Bullister等[15]以此为基础,发展了一套同时快速分析SF6和CFC-11、CFC-12的系统。目前,CFCs的分析测定可靠性已经可以达到溶解氧、营养盐等常规参数测定的水准[13],而SF6鉴于其较低的浓度和溶解度,分析技术尚有提升空间。
国内海水中痕量CFCs/SF6的分析方法学研究尚处于起步阶段,主要以CFCs的分析为主[16~18]。经过不断改进,本研究组提出了一种可同时分析多种CFCs的方法[18],显著提高了分析精度。然而,国内对海水SF6的测定方法研究仍是空白。因此,有必要开发海水中痕量CFCs/SF6的分析方法,弥补国内CFCs/SF6分析方法学研究的不足。
由于CFC-11和CFC-12的分布特征极为相似[19,20],因此本研究只同时测定海水中的CFC-12和SF6,建立了一套吹扫捕集-气相色谱装置,利用标准气体进行定量分析,采用填充柱对样品进行分离,对捕集材料、捕集温度、进样时间、吹扫时间、吹扫效率等实验条件进行了优化,考察了方法的重复性、检出限等,并将此方法应用于中国第六次北极科学考察航次的CFC-12和SF6海水样品的分析,仪器的稳定性、精密度以及测定结果均达到国外同类仪器同等水平。
2 实验部分
2.1 仪器与试剂
配有电子捕获检测器(Electric capture detector, ECD)的Varian CP3800气相色谱仪(天美(控股)有限公司);吹扫捕集装置(自行搭建);填充色谱柱主柱(180 cm Carbograph 1AC + 20 cm Molsieve 5A);填充色谱柱预柱(30 cm Porasil C + 60 cm Molsieve 5A);捕集管(50 cm Porapak T);LZB-3气体流量计(余姚市银环流量仪表有限公司);HDM型电热套(江苏省金坛市金城国胜实验仪器厂)。
干冰(厦门弘华气体有限公司);高纯氮气(纯度99.999%,福州新航气体有限公司);无水乙醇(分析纯,汕头市濠达精细化学品有限公司);CFC-12、SF6标准气体(2.62 μg/m3 CFC-12, 0.048 μg/m3 CF6, 美国国家海洋和大气管理局);多位阀、三通阀、四通阀及六通阀(美国VICI公司);稳压阀(美国Parker Hannifin公司);定量环(体积分别为0.1, 0.25, 0.5, 1.0, 2.0和5.0 mL,美国VICI公司)。
2.2 实验方法
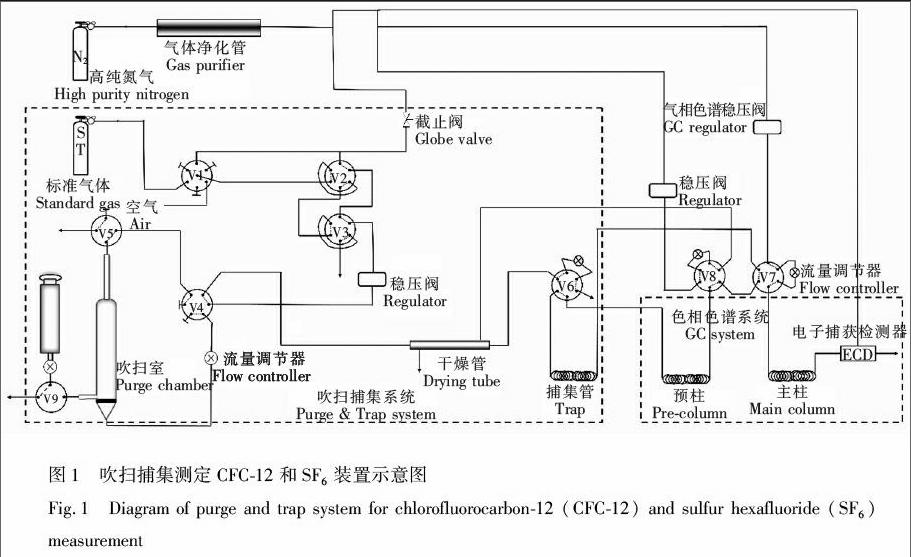
吹扫捕集法具有取样量少、检测灵敏度高等优点,是目前水体中易挥发物质富集的主要方法[21,22]。本研究使用自行搭建的吹扫捕集装置,以不同体积的定量环控制标准气体的进样量。仪器装置见图1,其中,V1阀是一个多通阀,用于选择输入气体(标准气体、氮气空白或者空气),V2和V3为六通阀用于组合不同体积的定量环,V4为六通阀用于控制吹扫室与系统的连接或者断开,V5为四通阀用于进样时排空吹扫室的顶空气体,V6六通阀用于准备状态或者加热状态时隔离捕集管,V7六通阀用于将预柱与主柱连通或者隔离,V8六通阀用于切换捕集管是否与预柱相连。标准气体从定量环进样,水样由进样口进样,样品首先流经捕集管,目标物被低温捕集后,加热脱附进入气相色谱,采用填充色谱柱对样品进行分离,最后通过ECD同时测定CFC-12和SF6。
2.3 分析流程
本研究的测定方法与文献[14,15]的方法相近。 不同之处在于,本研究对方法进行了简化,只用一个ECD即可同时测出CFC-12和SF6。本方法简单、灵敏,较大的提高了测定样品的效率。将120 mL水样注入吹扫室,吹扫气体为高纯氮气,吹扫压力为310 kPa,吹扫时间8 min,捕集温度 70℃,目标物在捕集管中富集,捕集结束后,移出冷浴,90℃水浴迅速加热捕集管,目标物释放后,随载气进入预柱进行预先分离,以去除CFC-12后的杂质,随后目标物进入主柱分离,最后在ECD中检测。色谱柱载气压力为207 kPa;色谱柱箱温度90℃,检测器温度为340℃,检测器尾吹流量为10 mL/min。
2.4 样品采集的质量控制
在航次中,为了防止水样被沾污,CFCs、SF6样品需要优先于其它样品采集,确保水样不会被大气污染。同时,每隔5个站位采集平行样。采水所需的Niskin采水瓶及其配件使用前均用弱溶剂异丙醇荡洗3次后,在氮气气氛下烘烤,去除装置表面吸附的杂质。水样使用玻璃钳口瓶从Niskin瓶采集,采样前,玻璃钳口瓶与连接的管路先用约100 mL水样润洗,再将不锈钢采样管放入钳口瓶瓶底,装满并溢流约200 mL后,压盖密封水样,确保瓶内无气泡,否则重新采样。
2.5 标准曲线及检出限的测定
以吹扫1 h的水样作为空白水样。采用标准气体进行定量,利用定量环确定进样体积,通过不同体积定量环的组合,气体的进样体积分别为0.25, 0.5, 1.0, 1.5, 2.0, 4.0, 5.0, 7.0, 10, 15, 20, 25和30 mL。标准气体通过多位阀V1进样,分析流程与水样分析流程一致,绘制峰面积-进样量的工作曲线。SF6、CFC-12标准气体进样体积为0.25 mL,平行测定10次,计算标准偏差,以标准偏差的3倍数值计算检出限。
3 结果与讨论
3.1 实验条件的优化
3.1.1 捕集填料,捕集温度及脱附温度 文献报道的用于捕集CFCs、SF6的填料主要有Carboxen 1000[23], Carboxen 1004[15], Porasil C[14], Porapak Q[15,24,25], Porapak T[14]和HeySep D[26]等,捕集温度通常低于 30℃。本研究基于实验室之前积累的经验以及文献报道的结果,选择Porapak T作为捕集填料,而SF6在Porapak T中的保留时间特别的短,温度若不够低则无法有效捕集,因此本实验以干冰/乙醇浴作为制冷液,捕集管温度可达到 70℃,用90℃水浴对捕集管进行脱附,结果表明,在此温度下目标物可完全脱附。
3.1.2 切换时间 本研究组采用吹扫捕集气相色谱法测定了海水中的CFCs[18],以单一的毛细管色谱柱对目标物进行分离,由于没有加入预柱,杂质干扰CFC-12及其它目标物的分离。本研究采用气体分析分离常用的填充色谱柱替代毛细管色谱柱,对目标物进行分离,填充柱比毛细管柱具有更好的选择性,同时在系统中增加了一段预柱,用于延阻CFC-12之后出峰的杂质,去除对目标物的干扰,提高SF6与CFC-12的分离效果。
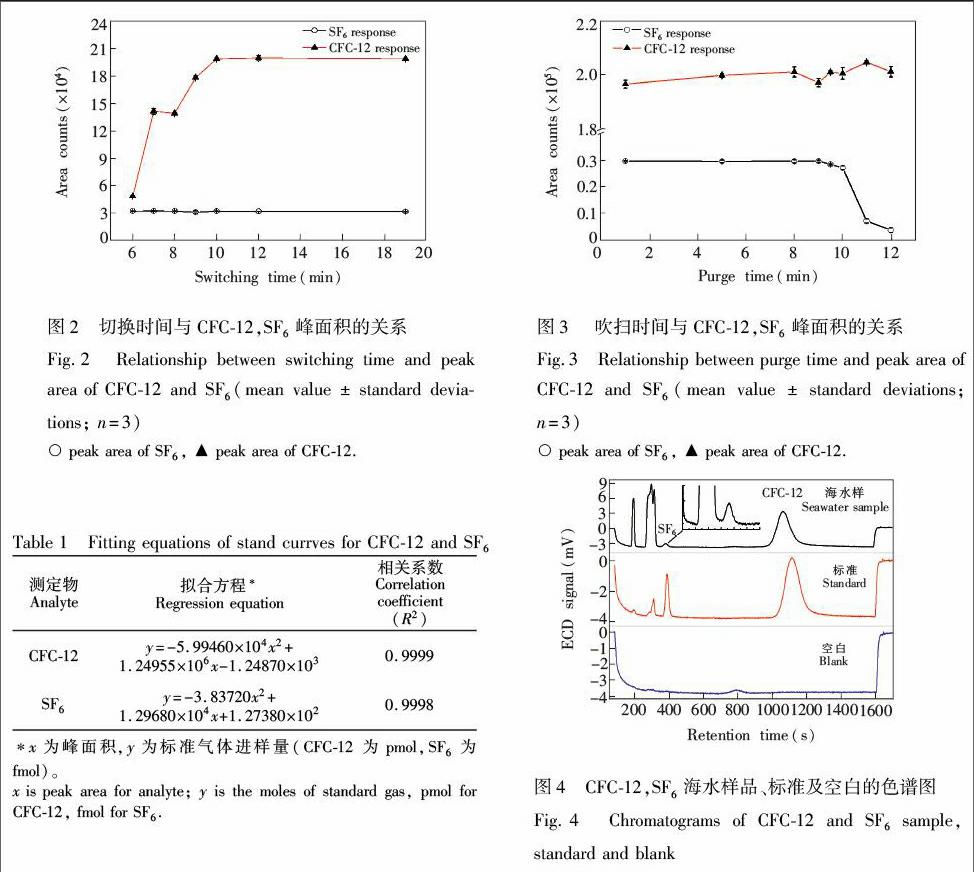
本实验需要确定色谱预柱与主柱之间的切换时间。CFC-12、SF6标准气体进样体积为5 mL,进样时间分别为6, 7, 8, 9, 10, 12和19 min,考察进样时间对目标物相应的影响。结果表明(图2),缩短切换时间至6 min,CFC-12的谱峰峰面积降低,这说明大部分CFC-12并没有完全进入主柱,从而导致CFC-12的响应降低; 而SF6的响应则基本没有变化, 表明SF6完全进入主柱。 如图2所示,在6 min处,CFC-12的峰面积出现明显降低,而12 min后,各目标物有较好的响应值且较为稳定,考虑到样品分析时间需尽量缩短,所以在不影响目标物响应的情况下选取12 min作为切换时间。
3.1.3 吹扫压力 标准气体的进样体积为5 mL,调节吹扫入口压力,吹扫时间为1 min,在样品吹扫捕集状态下测定出口流量,考察不同吹扫压力对目标物响应的影响。实验表明,吹扫压力达到310 kPa后,SF6和CFC-12的响应没有显著变化,表明此吹扫压力对目标物的响应没有影响。测定出口流量,在310 kPa入口压力下,吹扫流量为120 mL/min。
3.1.4 吹扫时间 捕集管实际上相当于是处于低温状态下的色谱柱,因此目标物在捕集管当中的富集主要取决于其保留时间的长短。如果目标物保留时间过短,则会出现穿透的情况。固定吹扫压力为310 kPa,标准气体进样体积为5 mL,吹扫时间分别为1, 5, 8, 9, 9.5, 10, 11及12 min,考察目标物响应变化情况(见图3)。结果表明,在1~12 min 范围内,CFC-12的响应值基本没有变化,说明在此吹扫时间内, CFC-12在捕集管内未发生穿透而损失;相比而言,SF6在9.5 min处出现衰减趋势,说明SF6在捕集管内发生穿透。综合以上实验结果,确定水样的吹扫时间为8 min。
3.1.5 吹扫效率 确定了8 min作为水样的吹扫时间之后,同一份样品,采用相同的流程多次吹扫并测定样品中的目标物, 直到水样中没有目标物为止。以六次北极科学考察获取的表层海水样品做吹扫效率实验,同一份水样在相同条件下吹扫若干次,各次吹扫得到的CFC-12峰面积依次为A1,A2…An,则吹扫效率PE(%) =A1/(A1+A2+...An)×100。由于SF6在水样中的溶解度较低,因此吹扫一次后就认为达到100%的吹扫效率,CFC-12水体浓度和溶解度相对SF6较大,因此吹扫效率为99%。
3.2 工作曲线、精密度和检出限
标准气体进样体积为0.25 mL,重复测定10次,SF6和CFC-12峰面积的相对标准偏差分别为0.5%和1.2%,因此SF6的测定精密度为±0.5%,CFC-12为±1.2%。由于本实验采用了国际上通用的气体标准进行定量和校正[13~15],并利用填充色谱柱进行分离,避免了液体标准配制和使用过程中受空气的沾污和溶剂挥发的影响,方法具有很好的重现性。以标准偏差的3倍数值计算检出限,得到CFC-12和SF6的检出限分别为0.02 pmol/kg和0.03 fmol/kg。对于SF6而言,其水体浓度比CFC-12低了1000倍,因而ECD中SF6的响应灵敏度低于CFC-12,其检出限相对CFC-12而言偏差较大。
由于ECD对于CFCs和SF6的响应是非线性的[15],因此采用多项式回归法对峰面积和标准气体进样量进行拟合[27],各物质的标准曲线拟合方程见表1。
3.3 海水中CFC-12与SF6的测定
在上述优化条件下,测定海水样品,典型色谱图如图4所示。应用本方法测定北极航次采集的北冰洋与白令海样品各6次,结果表明,表层海水CFC-12浓度范围为0.145~2.80 pmol/kg; SF6浓度范围为0.13~0.20 fmol/kg,测定结果与文献[15]相近。
致 谢 感谢国家海洋局极地考察办公室对本课题现场实施的协调工作和“雪龙”号极地科考船在采样过程中给予的支持和帮助。感谢德国基尔GEOMER海洋研究所Toste Tanhua博士和Boie Bogner工程师对本方法的搭建及数据处理提供的技术支持。感谢曹建平工程师在本实验中给予的指导。本研究实验设备由厦门大学海洋化学公共实验平台提供。
References
1 Jordan A, Harnisch J, Borchers R, Le Guern F N, Shinohara H. Environ. Sci. Technol., 2000, 34(6): 1122-1124
2 Fine R A. Annu. Rev. Mar. Sci., 2011, 3: 173-195
3 Sonnerup R E, Quay P D, Bullister J L. Deep-Sea Res. PT I, 1999, 46(5): 777-805
4 Feely R A, Sabine C L, Schlitzer R, Bullister J L, Mecking S, Greeley D. J. Oceanogr., 2004, 60(1): 45-52
5 Karstensen J, Stramma L, Visbeck M. Prog. Oceanogr., 2008, 77(4): 331-350
6 Sonnerup R E, Mecking S, Bullister J L. Deep-Sea Res. PT I, 2013, 72: 61-71
7 Sonnerup R E, Mecking S, Bullister J L, Warner M J. J. Geophys. Res., 2015, 120(5): 3761-3776
8 Sabine C L, Feely R A, Gruber N, Key R M, Lee K, Bullister J L, Wanninkhof R, Wong C S, Wallace D W R, Tilbrook B, Millero F J, Peng T H, Kozyr A, Ono T, Rios A F. Science, 2004, 305(5682): 367-371
9 Waugh D W, Haine T W N, Hall T M. Deep-Sea Res. PT I, 2004, 51(11): 1475-1491
10 Waugh D W, Hall T M, McNeil B I, Key R, Matear R J. Tellus B., 2006, 58(5): 376-389
11 Tanhua T, Jones E P, Jeansson E, Jutterstrom S, Smethie W M, Wallace D W R, Anderson L G. J. Geophys. Res., 2009: 114(C1): C01002
12 Schneider A, Tanhua T, Kortzinger A, Wallace D W R. Deep-Sea Res. PT I, 2012, 67: 85-97
13 Bullister J, Tanhua T. Paris: GO-SHIP IOCCP Report, 2010: 1-11
14 Vollmer M K, Weiss R F. Mar. Chem., 2002, 78(2-3): 137-148
15 Bullister J L, Wisegarver D P. Deep-Sea Res. PT I, 2008, 55(8): 1063-1074
16 YE Xin-Rong, ZHANG Hai-Sheng, PAN Jian-Ming. Marine Environment Science, 2004, (2): 69-71
叶新荣, 张海生, 潘建明. 海洋环境科学, 2004, (2): 69-71
17 SUN Na, LI Wen-Quan, DENG Yong-Zhi, CHEN Zu-Feng. Journal of Xiamen University(Natural Science), 2006, (6): 816-818
孙 娜, 李文权, 邓永智, 陈祖峰. 厦门大学学报(自然科学版), 2006, (6): 816-818
18 CAI Ming-Gang, HUANG Peng, ZHANG Mi-Ming, LI Wen-Quan. Chinese J. Anal. Chem., 2013, 41(2): 268-272
蔡明刚, 黄 鹏, 张麋鸣, 李文权. 分析化学, 2013, 41(2): 268-272
19 Tanhua T, Waugh D W, Bullister J L. Geophys. Res. Lett., 2013, 40(5): 927-932
20 Watanabe Y W, Shimamoto A, Ono T. J. Oceanogr., 2003, 59(5): 719-729
21 LIN Qi, LI Jun-Rong, LIN Jian, LIN Guo-Bin. Chinese J. Anal. Chem., 2014, 42(5): 678-682
林 麒, 李俊荣, 林 坚, 林国斌. 分析化学, 2014, 42(5): 678-682
22 ZHANG Hong-Hai, LI Jian-Long, YANG Gui-Peng, SONG Yu-Chen, JIN Na. Chinese J. Anal. Chem., 2015, 43(3): 333-337
张洪海, 李建龙, 杨桂朋, 宋雨辰, 靳 娜. 分析化学, 2015, 43(3): 333-337
23 Tanhua T, Olsson K A, Fogelqvist E. Deep-Sea Res. PT II, 2004, 51(22-24): 2683-2699
24 Law C S, Watson A J, Liddicoat M I. Mar. Chem., 1994, 48(1): 57-69
25 Busenberg E, Plummer L N. Water Resour. Res., 2000, 36(10): 3011-3030
26 Stoven T, Tanhua T. Ocean Sci., 2014, 10(3): 439-457
27 Grasshoff K, Kremling K, Ehrhardt M (Eds.). Methods of Seawater Analysis, John Wiley & Sons, 1999
Abstract Chlorofluorocarbons (CFCs) and sulfur hexafluoride (SF6) are kinds of anthropogenic halogenated compounds. They are very important for the ocean processes including air-sea exchange, water mass exchange etc. Meanwhile, they can be used to calculate some key physical and biogeochemical parameters such as AOUR (apparent oxygen utilization rate) and Cant (anthropogenic CO2). In comparison with CFCs, it is quite difficult to measure SF6 in the seawater due to its low solubility. However, it is useful to study the oceanic processes based on both the CFCs and SF6. In this study, a purge and trap gas chromatographic system was developed to measure the CFC-12 and SF6 simultaneously in seawater. The optimum conditions were as follows: trap temperature of 70℃, purge time of 8 min, purge gas pressure of 310 kPa, desorption time of 30 s, and desorption temperature of 90℃. The detection limit of CFC-12 and SF6 were 0.02 pmol/kg and 0.03 fmol/kg, respectively. The analytical precisions of CFC-12 and SF6 were ±1.2% and ±0.5%, respectively. The correlation coefficients (R2) of all the calibration curves were greater than 0.9995. This method was successfully used in the analysis of the samples collected from 6th Chinese Arctic Research Expedition.
Keywords Sulfur Hexafluoride; Chlorofluorocarbons; Purge and trap; Gas chromatography; Seawater
